白藜芦醇通过miRNA-122调节神经酰胺水平而治疗非酒精性脂肪肝
2017-09-03杨庆宇
杨庆宇, 郜 娜
(1郑州人民医院药剂科, 2郑州大学附属肿瘤医院/河南省肿瘤医院药剂科,河南 郑州 450053)
白藜芦醇通过miRNA-122调节神经酰胺水平而治疗非酒精性脂肪肝
杨庆宇1△, 郜 娜2
(1郑州人民医院药剂科,2郑州大学附属肿瘤医院/河南省肿瘤医院药剂科,河南 郑州 450053)
目的: 探讨白藜芦醇通过微小RNA(miRNA)-122调节神经酰胺水平从而治疗非酒精性脂肪肝的作用机制。方法:高脂高胆固醇饲料喂养C57BL/6J小鼠建立非酒精性脂肪肝模型,实验分为正常对照(control)组、模型(model)组及白藜芦醇80 mg/kg和160 mg/kg给药组,给药4周后检测血清中总胆固醇(TC)和甘油三酯(TG)含量,收集肝脏,行HE染色观察肝脏脂质浸润情况,检测肝组织神经酰胺水平,real-time PCR检测miRNA-122含量,Western blot检测肝组织中丝氨酸棕榈酰转移酶(SPT)水平。人肝癌HepG2细胞含10%小牛血清的RPMI-1640培养基培养,实验分为正常对照组、模型(油酸诱导)组、模型+白藜芦醇给药组、miRNA-122 siRNA组及白藜芦醇和miRNA-122 siRNA联合给药组,除正常对照组外,各组细胞均同时给予油酸刺激或药物持续孵育24 h,检测细胞匀浆中TC和TG含量、miRNA-122及神经酰胺水平,Western blot法检测各组肝细胞中SPT水平。结果:白藜芦醇低、高剂量组均能显著降低非酒精性脂肪肝小鼠血清TC和TG水平,改善肝组织细胞中脂质浸润情况,减少miRNA-122表达,同时降低肝组织神经酰胺水平及SPT蛋白表达。细胞实验结果显示,与正常对照组相比,油酸诱导脂质沉积模型组及miRNA-122 siRNA组细胞内TC和TG含量均显著增加,神经酰胺及SPT水平亦显著上升;白藜芦醇给药干预能降低油酸诱导模型组细胞中TC和TG含量、神经酰胺水平及SPT蛋白表达;与miRNA-122 siRNA组相比,白藜芦醇与miRNA-122 siRNA共孵育组TC和TG含量、神经酰胺水平及SPT蛋白水平有所降低,但作用有限。结论:白藜芦醇能够显著减少整体及细胞水平非酒精性脂肪肝模型肝细胞中脂质堆积,其机制可能是白藜芦醇通过上调miRNA-122水平、下调SPT蛋白水平而减少肝细胞中神经酰胺水平,从而达到治疗非酒精性脂肪肝的作用。
白藜芦醇; 非酒精性脂肪肝; 微小RNA-122; 神经酰胺; 丝氨酸棕榈酰转移酶
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是一种慢性损害性肝病,主要特征是肝脏脂质沉积达到肝脏总重的5%以上,可由单纯性脂肪肝进一步发展到非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)甚至肝硬化、肝癌。NAFLD这一疾病在过去的15年里迅速增长,西方发达国家的发病率高达20%~40%,亚洲国家的发病率为9%~40%[1]。同时,NAFLD亦可促进高血脂和冠状动脉疾病的发生和发展[2]。
近年来,有研究发现高脂肪饲料喂养大鼠的肝内神经酰胺含量明显增加,提示肝细胞脂质沉积与神经酰胺的生成可能存在一定的关系[3]。胡杨等[4]研究发现神经酰胺参与了NAFLD大鼠肝细胞内的脂质沉积过程,抑制神经酰胺的合成则有助于减轻肝细胞内的脂质沉积。
微小RNA(microRNA,miRNA)是一类长约19~22个核苷酸的内源性非编码小分子RNA,对动物、植物及人类生理活动具有重要的调节作用。在肝细胞中最丰富的miRNA是miRNA-122。大量研究表明,miRNA-122在肝细胞生长、脂质代谢及病毒感染等多种生物学过程方面起调控作用,其中miRNA-122与脂肪性肝炎的相关性近年来也得到了重视。在反义寡聚核苷酸阻断miRNA-122表达的实验中证实了miRNA-122 在脂肪和胆固醇代谢中的活性[5-6].
白藜芦醇(resveratrol,RES)已被证实可降低高蔗糖饲喂的NAFLD大鼠血脂和肝脏脂肪,增加机体抗氧化作用[7],同时可以改善胰岛素抵抗,降低糖尿病小鼠血糖和血脂。本研究采用整体和细胞实验研究白藜芦醇是否通过调节肝组织miRNA-122,进而影响肝组织神经酰胺水平,最终减少肝脏脂质沉积。
材 料 和 方 法
1 实验动物、细胞、试剂和仪器
40只C57BL/6J小鼠,4周龄,购自北京维通利华实验动物技术有限公司[合格证编号为SCXK(京)2012-0001],体重18~22 g;高脂高胆固醇饲料购自Research Diet,货号D12336,其中碳水化合物46%,脂肪16%,胆固醇1.25%;HepG2细胞系购自南京凯基生物科技发展有限公司。
白藜芦醇购自Sigma; C16、C17、C18和 C24神经酰胺标准品购自 Avanti;RPMI-1640培养基、小牛血清和0.25%胰蛋白酶购自Gibco;BCA蛋白浓度测定试剂盒购自Beyotime;抗丝氨酸棕榈酰转移酶(serine palmitoyltransferase,SPT)和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体购自Abcam;miRNA-122 siRNA购自上海吉玛生物股份有限公司;RT-qPCR试剂盒购自TaKaRa;总胆固醇(total cholesterol,TC)和甘油三酯(triglyceride,TG)测定试剂盒购自南京建成生物工程研究所。
低温超速离心机及酶标仪(Thermo);光学显微镜(OLYMPUS);分析天平及电子秤(METTLER TOLEDO);细胞培养箱(SANYO);蛋白印迹电泳系统(Bio-Rad);凝胶成像系统(Tanon);超净工作台(SIEMENS);流式细胞仪(Beckman Coulter)。液相色谱条件:分析柱 Zorbax SB C8(2.1 mm×150.0 mm,3.5 μm);柱温 35 ℃;流动相为甲醇和2 mmol/L醋酸铵(0.1% 甲酸)。质谱条件:ESI 离子源,负离子模式。离子源参数如下:气体温度325 ℃;气体流速 5 L/min;雾化器压力 45 Psi;鞘气温度 350 ℃;鞘气流速 11 L/min;毛细管电压 3 500 V (+)。
2 方法
2.1 动物造模、分组及给药 所有40只小鼠饲养于清洁级环境中,温度25 ℃,湿度55%~65%,维持12/12 h明暗交替。适应性喂养1周后,取30只小鼠给予高脂高胆固醇饲料饲喂建立非酒精性脂肪肝模型,4周后根据血脂水平分为3组,每组10只:模型(model)组给予等量溶媒;白藜芦醇低、高剂量(low-dose and high-dose RES, RES-L and RES-H)组分别给予80 mg/kg和160 mg/kg白藜芦醇溶液。另10只小鼠始终饲喂正常饲料,并给予等量溶媒。持续给药4周后,眼底静脉窦采血,3 500 r/min离心15 min,取上清保存于-80 ℃冰箱中待用。分离肝脏,一部分保存于-80 ℃冰箱,一部分固定于10%的甲醛溶液中待用。
2.2 生化指标的测定 分组给药前和实验终点时,各组小鼠禁食不禁水12 h,眼底静脉窦采血,分离血清,根据试剂盒方法检测血清中TC和TG含量。
2.3 HE染色 将固定于10%甲醛溶液中的肝组织脱水后常规石蜡包埋、切片。切片经二甲苯脱蜡,梯度乙醇水化,伊红染色,苏木精复染,梯度脱水,二甲苯透明,树脂封片,光镜下观察,进行病理学分析。
2.4 Real-time PCR 检测肝组织中miRNA-122水平 采用Trizol两步法抽提小鼠肝组织总RNA,按照逆转录试剂盒说明书进行逆转录操作。20 μL反应体系如下:total RNA 50 ng~5 μg, 2×TS Reaction Mix 10 μL, GSP(RT-Primer) 2 μL (1 pmol), Transcript RT/RI Enzyme Mix 1 μL, 加RNase-free water 至20 μL。反应条件为42 ℃ 30 min, 85 ℃ 5 min。所得cDNA于-20 ℃中保存待用。
采用real-time PCR 检测小鼠肝组织中 miRNA-122含量,以U6作为内参照。 miRNA-122 的上游引物序列为5’-CCAAACACCATTGTCACACTCCAG-3’, 下游引物序列为5’-CTAGCTGGAGTGTGACAATGGTGTTTGGAGCT-3’;U6的上游引物序列为5’-CTCGCTTCGGCAGCACATA-3’,下游引物序列为5’-AACGCTTCACGAATTGCG-3’。反应体系(20 μL)如下:RT-Product 2 μL, SYBR Green Mix 9 μL, ddH2O 7.4 μL, 正义引物0.8 μL (200 nmol/L), 反义引物0.8 μL (200 nmol/L)。计算公式为2-ΔΔCt。
2.5 细胞培养及分组 HepG2细胞采用含 100 mg/L链霉素和100 kU/L 青霉素的RPMI-1640培养基加10%小牛血清培养,置于37 ℃、5% CO2的细胞培养箱中,每2~3 d换液,待细胞生长至对数生长期后进行实验,实验分为正常对照(control)组、油酸(0.25 mmol/L)诱导模型(model)组、油酸诱导模型给予5 μmol/L白藜芦醇给药(model+RES)组、miRNA-122 siRNA组及miRNA-122 siRNA与白藜芦醇共孵育(miRNA-122 siRNA+RES)组,各组刺激及给药处理同时进行,持续12 h。
2.6 miRNA-122 siRNA转染效率的检测 将对数期的HepG2细胞接种于6孔板中,采用无双抗培养基培养。24 h后按照Lipofectamine 2000转染说明,采用瞬时转染法将1 μg miRNA-122 siRNA和阴性对照转染至HepG2细胞中,6 h后去除转染试剂,荧光显微镜下观察转染效率。
2.7 脂质含量的测定 称取200 mg左右肝脏组织并记录重量或取6孔板培养细胞,加2 mL氯仿/甲醇(2∶1)混合液,使用匀浆机充分分散。3 500 r/min离心10 min。将上清相转移到新的离心管中,并加0.2倍体积的生理盐水,涡旋10 min。3 500 r/min离心5 min,静置分层。分离下层含油脂的液相,充分挥干。用1 mL异丙醇溶解油脂。用试剂盒测定溶液中TC、TG的浓度,并根据称取的组织重量计算肝脏TC和TG含量。
2.8 神经酰胺含量的测定 采用胡杨等[4]方法进行检测。将2 mL 甲醇分别加入C16、C17、C18 和C24 神经酰胺标准品中,振荡混匀后使其彻底溶解,置于-20 ℃冰箱备用,使用时根据不同的浓度稀释。各个不同浓度的神经酰胺标准品溶液进样,并绘制各个神经酰胺的标准曲线,计算线性回归方程和相关系数。
称量50 mg湿润肝组织或取6孔板培养细胞于EP 管中,加1 mL 氯仿和甲醇(2∶1)的混合液,用BCA 法测定蛋白浓度;然后加入1 μg C17神经酰胺标准品作为内参照;收集下层氯仿层,冷冻干燥后加入1 mL 甲醇,涡旋震荡混匀后置于-20 ℃冰箱保存待测。检测时先设定液相色谱条件和质谱条件,然后将不同组别的脂类提取1.5 μL 进样,记录色谱图的峰值起止时间、保留时间、峰值面积、峰值高度等数据。最后按照线性回归方程计算出不同实验组肝组织内的神经酰胺含量。
2.9 Western blot法检测凋亡相关蛋白的表达 提取肝组织和细胞总蛋白,用BCA蛋白浓度试剂盒测定样品蛋白含量,配制5%浓缩胶和15%分离胶,上样,电泳,之后将凝胶上的蛋白转移到PVDF膜上,并于5%脱脂奶粉封闭液中室温下封闭2 h,洗膜,加抗SPT抗体(1∶1 000)和GAPDH抗体(1∶5 000),4 ℃孵育过夜,洗膜,加 II 抗(1∶10 000)室温孵育2 h,洗膜,采用ECL化学发光法显色,使用Quantity One软件对结果进行处理分析。
3 统计学处理
使用SPSS 17.0软件进行统计分析。计量资料以均数±标准误(mean±SEM)表示,多组间比较采用单因素方差(one-way ANOVA)分析,两两比较采用SNK-q检验,以P<0.05为差异具有统计学显著性。
结 果
1 白藜芦醇对各组小鼠血脂水平的影响
与control组相比较,model组TC及TG水平均显著增加;与model组相比,白藜芦醇80 mg/kg和160 mg/kg均可显著降低高脂高胆固醇饮食诱导的非酒精性脂肪肝模型小鼠血清TC和TG的水平,并呈现一定的剂量依赖性,见图1。
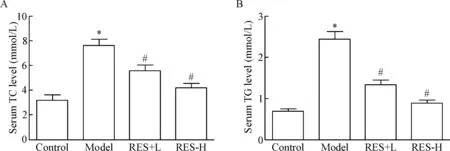
Figure 1.The serum levels of TC and TG in each group after 4-week treatment with RES at doses of 80 mg/kg and 160 mg/kg. Mean±SEM.n=10.*P<0.05vscontrol group;#P<0.05vsmodel group.
图1 灌胃给予白藜芦醇4周后各组小鼠血清TC和TG水平的变化
2 白藜芦醇对小鼠肝组织脂肪含量的影响
各组小鼠肝组织形态学检查如图2A所示,正常对照组肝脏组织形态学正常,结构完整,细胞索以中央静脉为中心向四周呈放射状整齐排列,肝小叶轮廓清晰,肝细胞呈多边形,细胞分界清,核圆而清晰,位于细胞中央;model组肝细胞索紊乱,肝细胞肿胀呈气球样变,胞质疏松,胞质内可见大量大小不等、数量不一的脂肪空泡和水样变性;白藜芦醇低、高剂量组均可见肝组织脂肪沉积减少,高剂量组脂肪沉积显著少于低剂量组。
由图2B、C可以看出,小鼠经高脂高胆固醇饲喂诱导建模后,肝组织TC及TG含量均显著升高,而白藜芦醇可剂量依赖性地降低模型小鼠肝组织中TC及TG含量,与肝组织病理学检查结果一致。
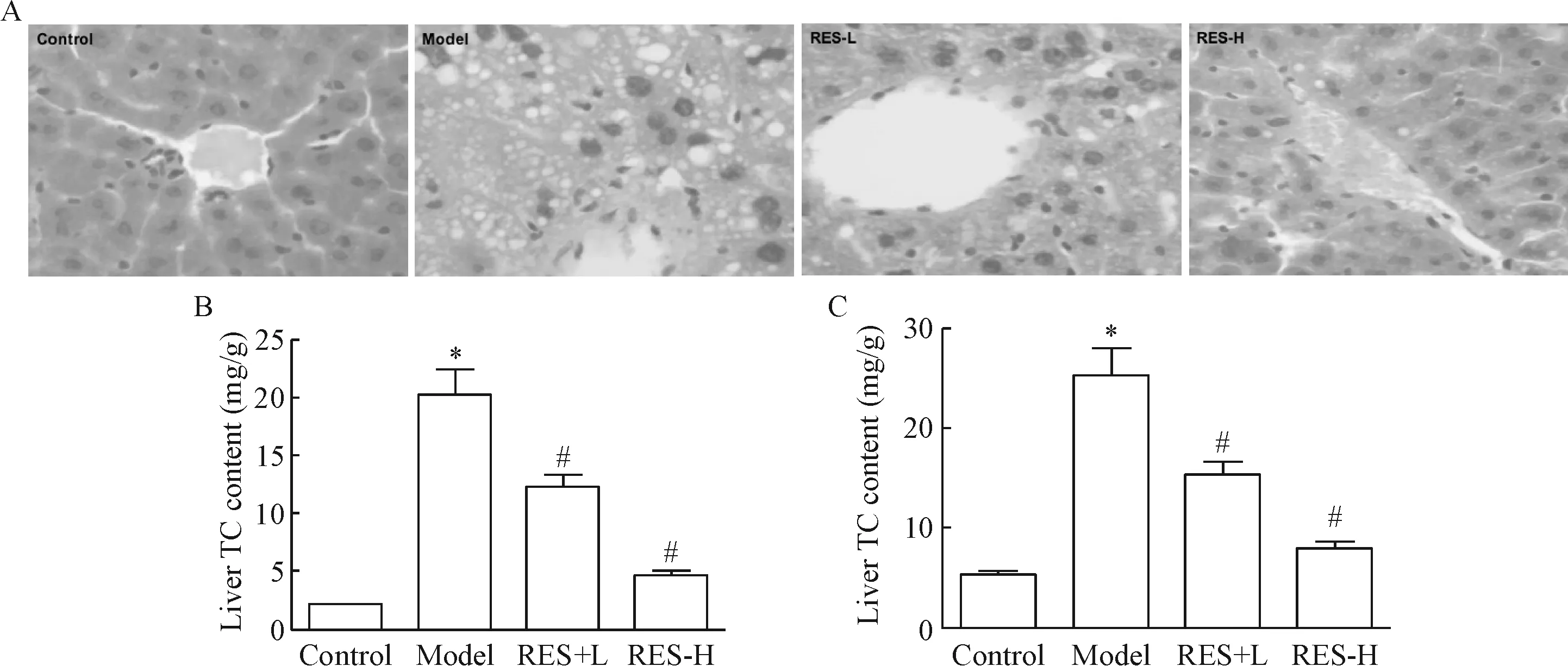
Figure 2.The histopathological examination of liver (A; HE staining,×200), and liver content of TC (B) and TG (C) in each group after 4-week treatment with RES at doses of 80 mg/kg and 160 mg/kg. Mean±SEM.n=10.*P<0.05vscontrol group;#P<0.05vsmodel group.
图2 灌胃给予白藜芦醇4周后各组小鼠肝组织病理学检查及肝组织TC和TG含量的变化
3 白藜芦醇对小鼠肝组织神经酰胺水平的影响
根据胡杨等[4]报道显示,本实验中主要检测C16:0及C24:0神经酰胺水平。与正常对照组相比,模型组小鼠经高脂高胆固醇饲料饲喂诱导后肝组织2种神经酰胺水平显著升高;与模型组相比,给药干预4周后,白藜芦醇低、高剂量组小鼠肝组织2种神经酰胺水平均显著降低,并呈一定剂量依赖性,见图3。
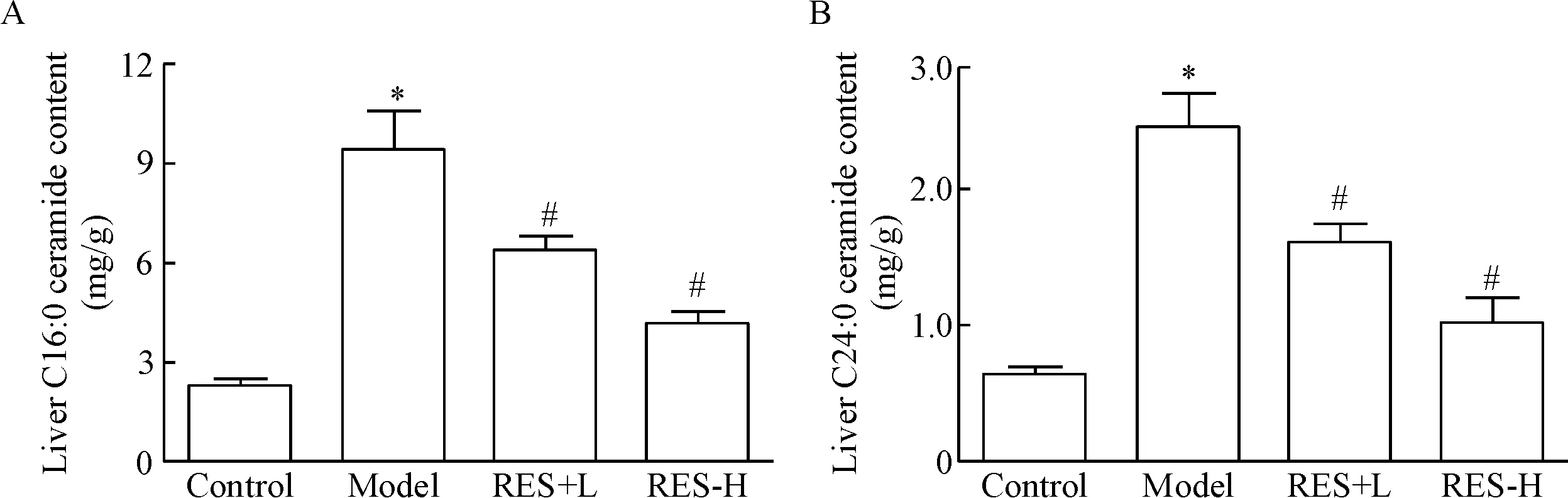
Figure 3.The liver C16:0 and C24:0 ceramide content in each group after 4-week treatment with RES at doses of 80 mg/kg and 160 mg/kg. Mean±SEM.n=6.*P<0.05vscontrol group;#P<0.05vsmodel group.
图3 灌胃给予白藜芦醇4周后各组小鼠肝组织C16:0和C24:0神经酰胺含量的变化
4 白藜芦醇对小鼠肝组织SPT蛋白水平的影响
与正常对照组相比,模型组小鼠肝组织SPT蛋白水平显著上调;与模型组相比,白藜芦醇低、高剂量组模型小鼠经灌胃干预4周后,肝组织SPT蛋白水平显著增加,并呈一定剂量依赖性,见图4。
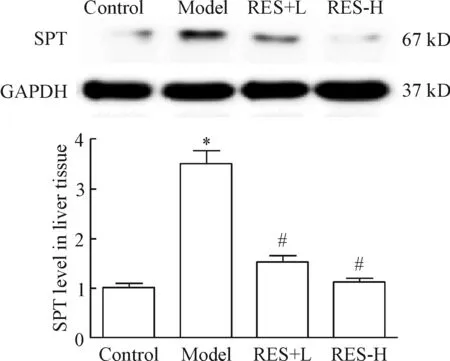
Figure 4.The relative liver protein level of SPT in each group after 4-week treatment with RES at doses of 80 mg/kg and 160 mg/kg. Mean±SEM.n=6.*P<0.05vscontrol group;#P<0.05vsmodel group.
图4 灌胃给予白藜芦醇4周后各组小鼠肝组织SPT蛋白水平的变化
5 白藜芦醇对小鼠肝组织miRNA-122水平的影响
与正常对照组相比,模型组小鼠肝组织miRNA-122的表达水平显著降低;与模型组相比,灌胃分别给予非酒精性脂肪肝小鼠白藜芦醇80 mg/kg和160 mg/kg 4周可显著上调模型小鼠肝组织中miRNA-122的表达水平,且给药组呈现一定剂量依赖性,见图5。
6 HepG2细胞中miRNA-122 siRNA转染效率的检测
采用瞬时转染法转染miRNA-122 siRNA于HepG2细胞24 h后在荧光显微镜下观察miRNA-122 siRNA的转染效率,约有60%以上的细胞表达绿色荧光蛋白。与此同时,real-time PCR实验结果也显示转染miRNA-122 siRNA 24 h后, 细胞中miRNA-122 siRNA的表达明显增加,说明可用于后续实验,见图6。

Figure 5.The relative liver miRNA-122 levels in each group after 4-week treatment with RES at doses of 80 mg/kg and 160 mg/kg. Mean±SEM.n=6.*P<0.05vscontrol group;#P<0.05vsmodel group.
图5 灌胃给予白藜芦醇4周后各组小鼠肝组织miRNA-122表达水平的变化
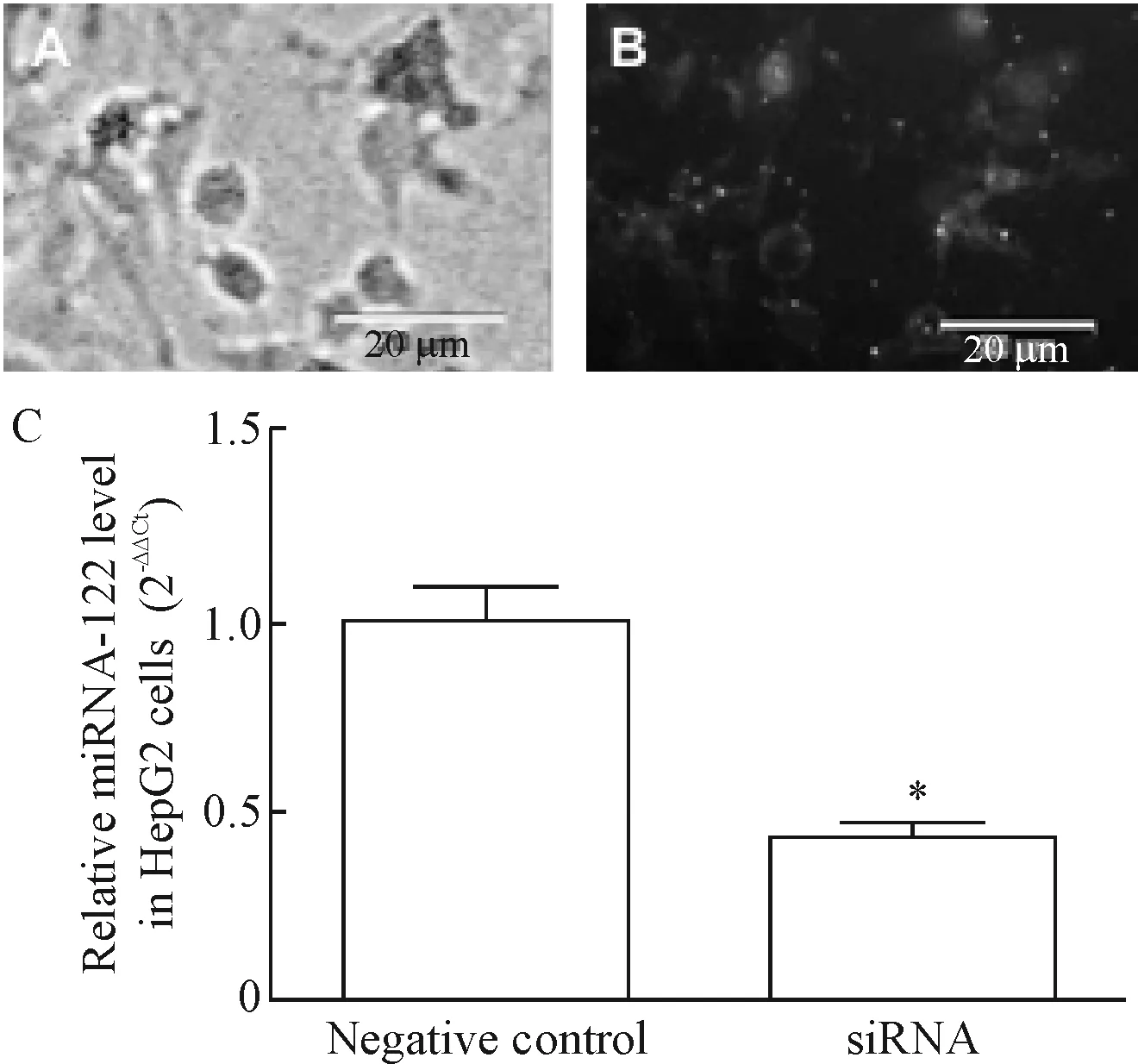
Figure 6.The efficiency of miRNA-122 siRNA transfection in HepG2 cells observed by fluorescence microscence (A, B) and detected by real-time PCR (C). Mean±SEM.n=3.*P<0.05vsnegative control group.
图6 HepG2细胞中miRNA-122 siRNA转染效率的检测
7 白藜芦醇对HepG2细胞内脂质含量的影响
细胞实验中,除正常对照组之外,刺激(油酸或miRNA-122 siRNA)或给药干预(白藜芦醇)均单独或共同孵育24 h。由结果可以看出,与正常对照组相比,模型组HepG2细胞经油酸刺激24 h后,细胞中TC和TG含量显著增加;与模型组相比,白藜芦醇给药组细胞中TC及TG含量显著降低,与小鼠实验结果一致;miRNA-122 siRNA组细胞中TC及TG含量显著高于正常对照组,但低于模型组;miRNA-122 siRNA和白藜芦醇联合给药组与miRNA-122 siRNA单独给药组相比,略有降低,但差异无统计学显著性,见图7。
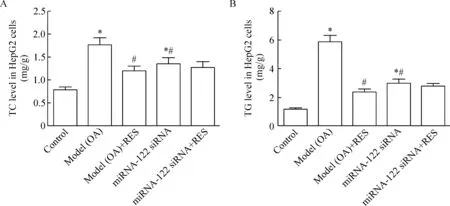
Figure 7.TC (A) and TG (B) levels in the HepG2 cells. Mean±SEM.n=3.*P<0.05vscontrol group;#P<0.05vsmodel (OA) group.
图7 各组HepG2细胞中TC和TG含量的变化
8 白藜芦醇对HepG2细胞内神经酰胺含量的影响
与正常对照组相比,模型组HepG2细胞经油酸刺激24 h后,细胞中神经酰胺含量显著增加;与模型组相比,白藜芦醇给药组细胞中神经酰胺含量显著降低;miRNA-122 siRNA给药组细胞中神经酰胺含量显著高于正常对照组,但低于油酸诱导模型组;与miRNA-122 siRNA单独给药组相比,miRNA-122 si-RNA和白藜芦醇联合给药组细胞中神经酰胺含量有所降低,但差异无统计学显著性,见图8。
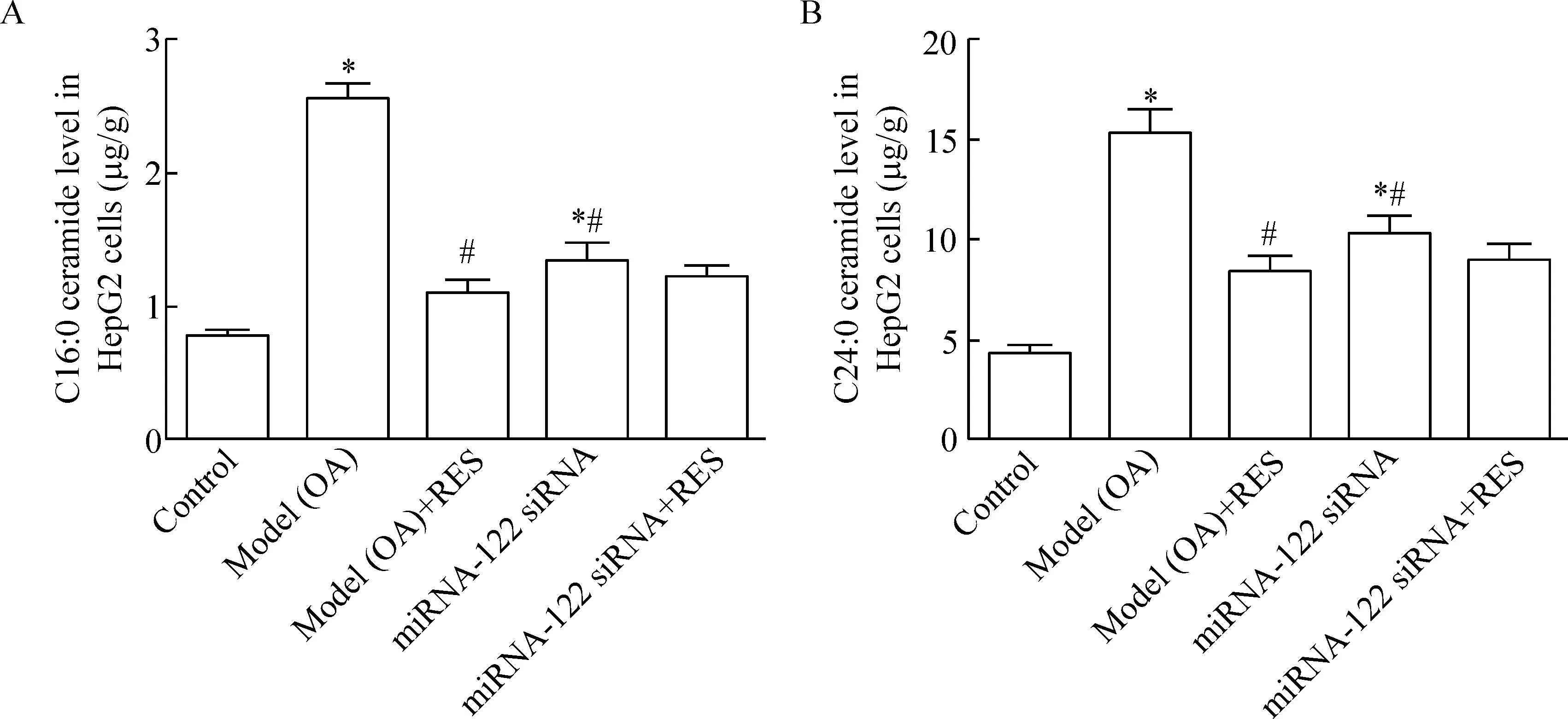
Figure 8.C16:0 (A) and C24:0 (B) ceramide levels in the HepG2 cells. Mean±SEM.n=3.*P<0.05vscontrol group;#P<0.05vsmodel (OA) group.
图8 各组HepG2细胞中C16:0和C24:0神经酰胺含量的变化
9 白藜芦醇对HepG2细胞内SPT蛋白水平的影响
与正常对照组相比,模型组HepG2细胞经油酸刺激24 h后,细胞中SPT表达水平显著上调;与模型组相比,白藜芦醇给药组细胞中SPT水平显著降低;miRNA-122 siRNA给药组细胞中SPT蛋白水平含量显著高于正常对照组,但低于油酸诱导模型组;与miRNA-122 siRNA单独给药组相比,miRNA-122 siRNA和白藜芦醇联合给药组细胞中SPT蛋白水平有所降低,但差异无统计学显著性,见图9。
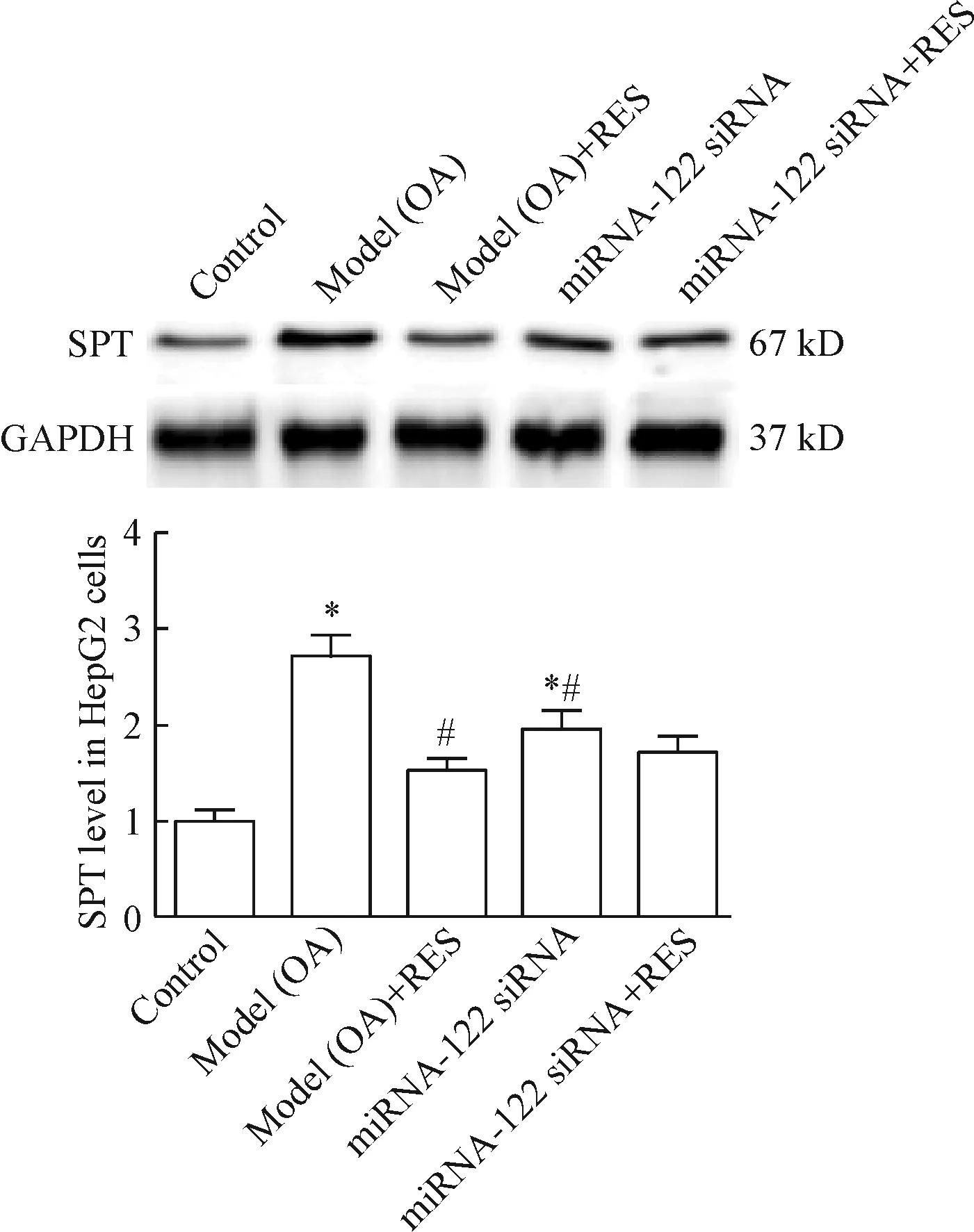
Figure 9.The relative protein levels of SPT in the HepG2 cells. Mean±SEM.n=3.*P<0.05vscontrol group;#P<0.05vsmodel (OA) group.
图9 各组HepG2细胞中SPT蛋白水平
讨 论
神经酰胺是细胞膜的组成成分,主要由长链脂肪酸和鞘氨醇组成。此外,神经酰胺作为第二信使参与细胞增殖、分化和凋亡等生命活动,发挥着重要的生理学作用。近来大量研究表明,神经酰胺对NAFLD的形成和发展具有重要的调节作用。Chocian等[8]采用高脂饲料喂养大鼠建立NAFLD模型,发现其肝细胞内神经酰胺含量明显增加;而采用多球壳菌素阻断神经酰胺的从头合成途径, 能减轻高脂喂养小鼠肝内的脂肪沉积[9]。机体神经酰胺产生的途径主要有从头合成途径、 鞘磷脂循环途径和鞘氨醇合成途径3种。 从头合成途径是神经酰胺产生的主要途径,该途径主要发生在内质网或线粒体中,丝氨酸与棕榈酰CoA在SPT 催化下形成3-酮-二氢鞘氨醇,再依次转化为二氢鞘氨醇、二氢神经酰胺,最后形成神经酰胺,其中SPT是从头合成途径的限速酶[10-11]。本研究在NAFLD小鼠模型及肝细胞脂质沉积模型上均可见神经酰胺及其从头合成途径关键酶SPT显著升高,而给予白藜芦醇可呈剂量依赖性地降低神经酰胺和SPT水平,可见白藜芦醇对NAFLD的治疗作用可能部分是通过对神经酰胺的调节实现的。
miRNA-122是在脊椎动物肝组织中表达丰富且高度保守的miRNA,可见其对肝脏的重要作用。miRNA-122由22个核苷酸组成,通过调节多种不同肝功能涉及到的相关靶mRNA,起到维持肝脏稳态的作用。 通过药理学和遗传学手段抑制miRNA-122可以导致全身和肝脏脂质代谢、铁稳态及肝细胞分化的紊乱[12]。临床研究表明,在早期NASH患者中,miRNA-122水平显著下调,这些患者在采取上调miRNA-122治疗措施后肝脏功能得到恢复,肝脏脂质沉积、炎症及纤维化程度显著降低,该结果在miRNA-122基因敲除小鼠模型上也得到证实。本实验中,采用高脂高胆固醇饮食建立的NAFLD模型小鼠可见肝组织miRNA-122水平显著降低,而神经酰胺及SPT水平显著升高,同时模型小鼠肝组织脂质大量沉积,而给予白藜芦醇治疗后,肝组织脂质沉积显著减少,同时伴随肝组织miRNA水平升高、神经酰胺及SPT表达水平的降低,因此我们推测白藜芦醇可能通过调节miRNA-122和神经酰胺水平达到治疗NAFLD作用的。本实验通过细胞实验进一步验证我们的假说,在油酸诱导的HepG2细胞脂质沉积模型中,与动物模型结果一致,miRNA-122水平显著下降,伴随神经酰胺水平升高;同时miRNA-122 siRNA组细胞脂质含量亦高于正常对照组,且伴随神经酰胺及SPT上调;与该组相比miRNA-122 siRNA联合白藜芦醇共同培养组脂质含量、神经酰胺水平及SPT表达均显著降低。
综上所述,本实验从整体及细胞水平均证实白藜芦醇可通过上调miRNA-122水平,进而抑制SPT,降低神经酰胺水平,达到改善肝组织脂质沉积、治疗NAFLD的作用。
[1] Fan L, Strasser-Weippl K, Li JJ, et al. Breast cancer in China[J]. Lancet Oncol, 2014, 15(7):e279-e289.
[2] Cuperus FJ, Halilbasic E, Trauner M. Fibrate treatment for primary biliary cirrhosis[J]. Curr Opin Gastroenterol, 2014, 30(3):279-286.
[3] Chocian G, Chabowski A, Zendzian-Piotrowska M, et al. High fat diet induces ceramide and sphingomyelin formation in rat’s liver nuclei[J]. Mol Cell Biochem, 2010, 340(1-2):125-131.
[4] 胡 杨, 刘朝霞, 傅 念, 等. 神经酰胺在非酒精性脂肪肝大鼠肝细胞脂质沉积中的作用[J]. 世界华人消化杂志, 2015, 23(32):5196-5200.
[5] 栾 天, 佟 雷, 徐 威, 等.miR-122促进原发性肝细胞癌Huh-7细胞凋亡[J]. 实用肿瘤学杂志, 2012, 26(5):428-431.
[6] Esau C, Davis S, Murray SF, et al. miR-122 regulation of lipid metabolism revealed byinvivoantisense targeting[J]. Cell Metab, 2006, 3(2):87-98.
[7] Pektas MB, Yücel G, Koca HB, et al. Dietary fructose-induced hepatic injury in male and female rats: influence of resveratrol[J]. Drug Res (Stuttg), 2017, 67(2):103-110.
[8] Chocian G, Chabowski A, Zendzian-Piotrowska M, et al. High fat diet induces ceramide and sphingomyelin formation in rat′s liver nuclei[J]. Mol Cell Biochem, 2010, 340(1-2):125-131.
[9] Yang G, Badeanlou L, Bielawski J, et al. Central role of ceramide biosynthesis in body weight regulation, energy metabolism, and the metabolic syndrome[J]. Am J Phy-siol Endocrinol Metab, 2009, 297(1):E211-E224.
[10]Vinodh R, Hannun YA. Sphingolipid metabolism and signaling as a target for cancer treatment[J]. Cell Death Dis, 2013, 28(4):205-229.
[11]Venable ME. Elevation of ceramide in senescence: role of sphingolipid metabolism[J]. Tumor Dormancy, 2014, 32(2):81-88.
[12]吴瑞珊, 苏运钦, 余广超, 等. Taqman探针实时荧光定量PCR检测肝脏疾病患者血清中miR-122的表达水平及其临床意义[J]. 中国病理生理杂志, 2013, 29(2):348-353.
(责任编辑: 林白霜, 罗 森)
p53通过诱导miR199a-3p抑制SOCS7,从而抑制UUO中的STAT3活化和肾纤维化
近来p53在肾纤维化中的作用被研究较多,但其功能仍然存在争议,其潜在的机制尚不清楚。Yang等的研究显示,在药理学和基因上阻断p53可减轻单侧输尿管梗阻(unilateral urethral obstruction, UUO)小鼠的肾间质性纤维化、凋亡和炎症。有趣的是,p53的阻断与miR-215-5p、miR-199a-5p&3p 和STAT3的抑制有关。在培养的人肾小管上皮细胞(HK-2)中,TGF-β1处理导致纤维化改变,包括胶原蛋白I(collagen I)和波形蛋白(vimentin)表达,且与p53积聚、p53 Ser15磷酸化和miR-199a-3p表达相关。用pifithrin-α阻断p53可抑制TGF-β1处理过程中STAT3的活化及miR-199a-3p、胶原蛋白I和波形蛋白的表达。过表达miR-199a-3p可增加TGF-β1诱导的胶原蛋白I和波形蛋白表达,并恢复SOCS7表达。此外,SOCS7被鉴定为miR-199a-3p的一个靶基因,并且SOCS7沉默可促进STAT3活化。ChIP分析表明,p53可与miR-199a-3p的启动子区域结合。来自IgA肾病和糖尿病肾病患者的肾活检标本显示,p53和STAT3均明显活化,SOCS7表达减少,促纤维化蛋白和miR-199a-3p表达增加。这些结果一起证明了肾间质纤维化中存在一条新的p53/miR-199a-3p/SOCS7/STAT3通路。
Sci Rep, 2017, 7:43409(李肖肖)
Effects of resveratrol on levels of ceramide via regulating miRNA-122 in treating non-alcoholic fatty liver disease
YANG Qing-yu1, GAO Na2
(1DepartmentofPharmacy,People’sHospitalofZhengzhou,2DepartmentofPharmacy,AffiliatedTumorHospitalofZhengzhouUniversity&HenanCancerHospital,Zhengzhou450053,China.E-mail:yangqingyude@126.com)
AIM: To observe the therapeutical effects of resveratrol on non-alcoholic fatty liver disease and its potential mechanism. METHODS: Male C57BL/6J mice were fed with high-fat and high-cholesterol diet to established non alcoholic fatty liver disease model, and were administrated with resveratrol at doses of 80 mg/kg and 160 mg/kg. After 4-week treatment, the blood sample was collected for determination of total cholesterol (TC) and triglyceride (TG). The liver tissues were harvested for measuring the liver lipid content. The histopathological examination were conducted with hematoxylin and eosin staining. The ceramide levels in the liver tissues were detected by HPLC-MS. The microRNA (mi-RNA)-122 levels in the liver tissues were detected by real-time PCR. The protein levels of serine palmitoyltransferase (SPT) were determined by Western blot. The HepG2 cells were cultured and divided into 5 groups: control group, model group (induced by 0.25 mmol/L oleic acid), model+resveratrol group (treated with 5 μmol/L resveratrol), miRNA-122 siRNA group and resveratrol+miRNA-122 siRNA group. Except control group, the cells in other groups were stimulated with oleic acid and incubated with respective drugs simultaneously for 24 h. The levels of TC, TG and ceramide in the cells of each group were measured. The protein levels of SPT in each group were determined by Western blot. RESULTS: In non-alcoholic fatty liver disease mice, resveratrol dose-dependently reduced the serum TC and TG levels, decreased the lipid deposition, the ceramide level and the SPT protein level, and increased the level of miRNA-122 in the liver tissues. In theinvitrostudy, compared with model group, resveratrol reduced the serum TC and TG levels, decreased the ceramide level, reduced the SPT protein level. Compared with control group, the levels of TC, TG and ceramide, and the protein expression of SPT were increased in miRNA-122 siRNA group. Compared with miRNA-122 siRNA group, no statistical difference of TC, TG, ceramide and protein expression of SPT in resveratrol combined miRNA-122 siRNA group was observed. CONCLUSION: Resveratrol significantly reduces lipid accumulation by reduction of miRNA-122 and ceramide levels, and decrease in SPT protein levels in the liver.
Resveratrol; Non-alcoholic fatty liver disease; MicroRNA-122; Ceramide; Serine palmitoyltransferase
1000- 4718(2017)08- 1506- 08
2017- 04- 10
2017- 07- 07
R965;R575.5
A
10.3969/j.issn.1000- 4718.2017.08.026
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0371-67077232; E-mail: yangqingyude@126.com
