人参皂苷Rh4诱导肝癌细胞HepG2的凋亡及分子机制*
2017-09-03吕晓艳胡俊男蔡恩博刘双利张连学
王 梓, 吕晓艳, 胡俊男, 赵 岩, 蔡恩博, 刘双利, 李 伟△, 张连学△
(1吉林农业大学中药材学院, 吉林 长春 130118; 2吉林大学白求恩第二医院检验科, 吉林 长春 130041)
人参皂苷Rh4诱导肝癌细胞HepG2的凋亡及分子机制*
王 梓1, 吕晓艳2, 胡俊男1, 赵 岩1, 蔡恩博1, 刘双利1, 李 伟1△, 张连学1△
(1吉林农业大学中药材学院, 吉林 长春 130118;2吉林大学白求恩第二医院检验科, 吉林 长春 130041)
目的: 探讨人参皂苷Rh4对人肝癌HepG2细胞凋亡的作用及机制。方法: 采用MTT比色法测定不同浓度(10、20和40 μmol/L)人参皂苷Rh4对人肝癌HepG2细胞活力的抑制作用;用流式细胞术检测定细胞凋亡率;通过Hoechst 33258和TUNEL染色观察人参皂苷Rh4诱导人肝癌HepG2细胞凋亡的形态学变化;Western blot法检测凋亡相关蛋白Bax、Bcl-2、caspase-3和caspase-9的表达情况。结果: 人参皂苷Rh4能够明显促进人肝癌HepG2细胞的凋亡,且呈剂量依赖性;TUNEL和Hoechst 33258染色实验结果表明,人参皂苷Rh4作用24 h后,细胞呈现明显皱缩、肿胀、破裂等凋亡形态;Western blot分析结果表明,随着人参皂苷Rh4给药浓度的增加,抗凋亡蛋白Bcl-2 表达量逐渐下降,而促凋亡蛋白Bax、cleaved caspase-3和caspase-9的表达逐渐升高。结论: 人参皂苷Rh4可诱导人肝癌HepG2细胞凋亡,其作用机制可能与下调Bcl-2以及上调Bax、cleaved caspase-3 和caspase-9蛋白表达有关。
人参皂苷Rh4; 肝细胞癌; HepG2 细胞; 细胞凋亡
肝癌(hepatocellular carcinoma,HCC)是世界上最常见的恶性肿瘤之一,易于在肝内及向身体其它部位转移[1]。中国有十分之一的人携带肝炎病毒,肝炎病毒是致癌的高危因素,而肝癌的发病率正在逐年增加[2-3]。尽管对肝癌的诊断和治疗已经取得很大进步,但肝癌仍是癌症相关死亡的全球第三大原因。当前,化疗虽然是肿瘤治疗的主要方法,但严重的副作用限制了其的广泛使用[4]。由于中药在治疗肿瘤上具有安全性和有效性[5],因此也越来越受到国内外学者的广泛关注。
人参作为一种传统中药,具有抗肿瘤、抗衰老、抗辐射、增强免疫力等多种生物学活性[6]。人参皂苷是人参中的主要活性成分并具有多种药理功效,尤其在预防和抑制肿瘤等方面起着重要的作用。研究结果表明人参皂苷能够促进肿瘤细胞的凋亡和分化, 并能提高肿瘤细胞对化疗药物的敏感性以及提高机体抗肿瘤的免疫力[7]。人参皂苷Rh4(ginse-noside Rh4,Rh4)作为人参三醇型皂苷的高温热裂解产物,在免疫调节[8]、抗肿瘤[9]、抑制血小板聚集[10]等方面表现出多种生物活性,现已广泛受到国内外专家的关注和重视。
本文利用人参总皂苷及各单体化合物能够促进肿瘤细胞凋亡的机制,将人参皂苷Rh4作用于人肝癌HepG2细胞,并进一步探讨了其诱导细胞凋亡的分子机制,为临床肝癌的治疗提供了实验基础。
材 料 和 方 法
1 材料与仪器
1.1 细胞 人肝癌HepG2细胞购自南京凯基生物科技发展有限公司。
1.2 样品与试剂 人参皂苷Rh4由本实验室分离制备,经HPLC检测,纯度>98.0%。DMEM高糖培养基(Gbico);小牛血清白蛋白(北京鼎国生物有限公司);MTT(Sigma Aldrich);二甲基亚砜(北京化学试剂厂); TUNEL细胞凋亡检测试剂盒(三箭生物工程有限公司);Bradford蛋白定量试剂盒(碧云天公司);ECL试剂盒(宝泰克生物有限公司);兔抗鼠Bax、Bcl-2、caspase-3、caspase-9、β-actin抗体和羊抗兔HRP抗体购自Cell Signaling Technology;甘氨酸、Tris碱、SDS、丙烯酰氨、甲基丙烯酰氨、过硫酸氨、TEMED和脱脂奶粉购自鼎国生物有限公司;甲醇、氯仿为北京化学试剂厂生产。
1.3 仪器 FACSVerse流式细胞仪(BD);组织匀浆机(麒麟贝尔公司);凝胶成像系统(上海天能有限技术公司);低温超高速离心机(Thermo);蛋白印迹电泳系统(Bio-Rad);超净工作台(苏州净化设备厂);水平式离心机(上海医疗器械厂);倒置显微镜(Olympus)。
2 方法
2.1 细胞培养 人肝癌HepG2细胞在37 °C、5% CO2条件下,培养于含10%新生牛血清、1×105U/L青霉素,100 mg/L链霉素的DMEM培养基中。以0.25%胰蛋白酶和0.02%乙二胺四乙酸消化,每隔3 d传代1次。
2.2 MTT比色法检测Rh4对HepG2细胞活力的抑制作用 取对数生长期的HepG2肝癌细胞,按每孔5×104个细胞接种于96孔板中,于37 °C、5% CO2的孵箱中培养24 h,细胞贴壁后加入含人参皂苷Rh4的培养液使其终浓度分别为10、20和40 μmol/L,并设置对照孔,每个浓度各时点设置3重复孔。继续培养12、24、48、72 h后每孔加入MTT溶液(5 g/L)20 μL,继续孵育4 h后终止培养。弃掉孔内培养上清液,每孔加150 μL 二甲基亚砜,使结晶物充分溶解。选择570 nm波长,在酶标仪上测定每孔吸光度(A)值。计算细胞抑制率(%)= (对照组A值-给药组A值)/对照组A值×100%。
2.3 Annexin V-FITC/PI双染法定量检测细胞凋亡 为检测人参皂苷Rh4对HepG2细胞凋亡率的影响,取对数生长期的细胞用不同剂量人参皂苷Rh4(0、10、20和40 μmol/L)处理24 h后,收集细胞,采用Annexin V-FITC/PI双染细胞凋亡检测试剂盒进行检测。
将HepG2细胞用不含乙二胺四乙酸的0.25%胰酶进行消化,并收集1×105个细胞于1.5 mL离心管中,4 ℃、2 000 r/min 离心5 min,取沉淀用4 ℃预冷的PBS洗涤细胞2次,加入500 μL的binding buffer使细胞悬浮,再加入5 μL Annexin V-FITC,轻轻混匀,4 ℃避光反应30 min后,加入5 μL PI,轻轻混匀,室温避光反应5 min。上样时,细胞悬液用300目铜网过滤,流式细胞仪检测,激发波长488 nm,发射波长530 nm。
2.4 TUNEL法检测细胞凋亡 将对数生长期的HepG2细胞种6孔板中,不同浓度(0、10、20和40 μmol/L)的Rh4处理24 h后消化收集细胞。PBS洗涤1次,加入l.0 mL免疫染色固定液室温(15~25 ℃)水平摇床上缓慢摇动固定40 min。PBS洗涤后,加入l.0 mL含0.1% Triton X-100的PBS,冰浴孵育2 min,PBS洗涤2次后,每个样品上加入50 μL TUNEL检测液,37 ℃避光孵育60 min,将收集到的样品过300目铜网,上机检测,488 nm激发波长,以未处理细胞设定检测阈值。
2.5 荧光显微镜观察 将对数生长期的细胞传代于放有盖玻片的6孔板中,培养24 h,不同浓度(0、10、20和40 μmol/L)的人参皂苷Rh4培养液处理细胞24 h。将各处理孔中的培养基更换为1 mL新鲜配制的染色液,置37 ℃避光孵育20 min。PBS洗2次后,取出盖玻片置荧光显微镜下观察细胞形态的变化。凋亡细胞的细胞核有明亮的蓝色荧光,染色致密,无网状结构,呈现新月形或分节等凋亡核形态;相同区域用蓝光激发,观察并拍摄细胞红色图像,坏死细胞因被PI着色而呈红色荧光,极晚期凋亡细胞也会呈红色,而正常细胞的红色荧光很浅。
2.6 蛋白提取及定量 收集药物处理后的细胞,PBS洗涤3次,加入细胞裂解液,用细胞刮刀收集,收集后的混悬液置于4 ℃冰箱放置,于漩涡振荡器上每隔30 min混匀1次,裂解2 h。然后3 000×g离心15 min,收集上清。继续12 000×g离心15 min收集上清即为全细胞蛋白裂解液。蛋白浓度通过Bradford方法检测,组织样本稀释至1 600 μL,用不同浓度 BSA(2.5、5、7.5、10 mg/L)作为标准曲线,加入显色剂400 μL,室温放置15 min,可见光分光光度计595 nm处读取吸光度值,计算样本中的蛋白浓度。
2.7 Western blot分析凋亡蛋白 配置5%的浓缩胶和15% SDS-聚丙烯酰胺凝胶后,每孔加入30 μg蛋白样品并在Marker加样孔中加入10 μL的预染Marker液进行电泳。电泳完成后于4 ℃、100 V转膜2 h。转膜后用5%脱脂奶粉振荡,室温封闭1 h,封闭后,加入用抗体稀释液1∶1 000稀释的 I 抗,摇床混匀后4 ℃过夜。次日,用辣根过氧化物酶标记的第 II 抗体进行孵育1 h后,按ECL试剂盒说明书进行操作显色,凝胶成像仪上成像,Quantity One软件分析蛋白条带灰度。
3 统计学处理
用SPSS 18.0进行统计学处理。计量数据均用均数±标准差(mean±SD)表示,组间差异比较用单因素方差分析方法进行检验,结果数据图表用GraphPad Prism 6.0制作。以P<0.05为差异有统计学意义。
结 果
1 人参皂苷Rh4对HepG2细胞生长的抑制作用
MTT实验结果表明,人参皂苷Rh4作用HepG2细胞12 h、24 h和48 h后,随着药物剂量的增加和作用时间的延长,人参皂苷Rh4对HepG2细胞生长的抑制程度不断增加,呈明显的剂量和时间依赖性。人参皂苷Rh4浓度从10 μmol/L增加到40 μmol/L,24 h的生长抑制率由22.1%增加到32.3%,见图1。
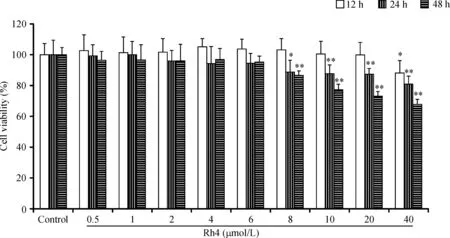
Figure 1.The effect of ginsenoside Rh4 on the viability of HepG2 cells with different times. HepG2 cells were treated with ginsenoside Rh4 for 12, 24, and 48 h. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group.
图1 人参皂苷Rh4对HepG2细胞存活力的影响
2 人参皂苷Rh4对HepG2肝癌细胞的促凋亡作用
结果如图2所示,不同浓度的人参皂苷Rh4作用HepG2细胞24 h后,细胞凋亡率随药物浓度的增加而增加。10、20和40 μmol/L的人参皂苷Rh4处理24 h,细胞凋亡率分别为11.47%、15.29%和21.33%,说明Rh4所致HepG2细胞凋亡率的变化呈现一定的剂量依赖性,高浓度的人参皂苷Rh4可以引起细胞坏死。

Figure 2.Quantification of apoptotic percentage in the HepG2 cells treated with ginsenoside Rh4 after 24 h. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group.
图2 不同剂量的人参皂苷Rh4所致HepG2细胞凋亡率的变化
3 Hoechst 33258染色
不同浓度的人参皂苷Rh4(10~40 μmol/L)作用HepG2细胞24 h后,利用Hoechst 33258染色在荧光显微镜下观察细胞状态,结果如图3所示。Rh4处理24 h后,对照组细胞核弥散,呈网织状,染色较淡,几乎观察不到致密浓染,表明细胞状态良好,无凋亡发生;常规镜下观察,可以看到随着人参皂苷Rh4给药浓度的增加,细胞体积变小,出现细胞核固缩、碎裂和凋亡小体形成等凋亡状态。在40 μmol/L浓度的人参皂苷Rh4作用24 h后,可以明显观察到HepG2细胞核皱缩明显,呈致密浓染,表现出典型的细胞凋亡特点。利用光密度软件分析,随着人参皂苷Rh4给药剂量的增加,细胞核发生浓缩,变小,凋亡的细胞比例逐渐增加,呈剂量依赖性。由此可见人参皂苷Rh4可以诱导HepG2细胞凋亡,其结果佐证了MTT实验结果.
4 TUNEL染色
对照组HepG2细胞几乎无可见凋亡细胞特征,细胞完整,边缘清晰;随着人参皂苷Rh4给药浓度的增加,细胞出现不同程度的皱缩,边缘化,核膜裂解,细胞核呈现致密深染,表明人参皂苷Rh4可以诱导HepG2细胞凋亡,且呈现一定的剂量依赖关系,见图4。
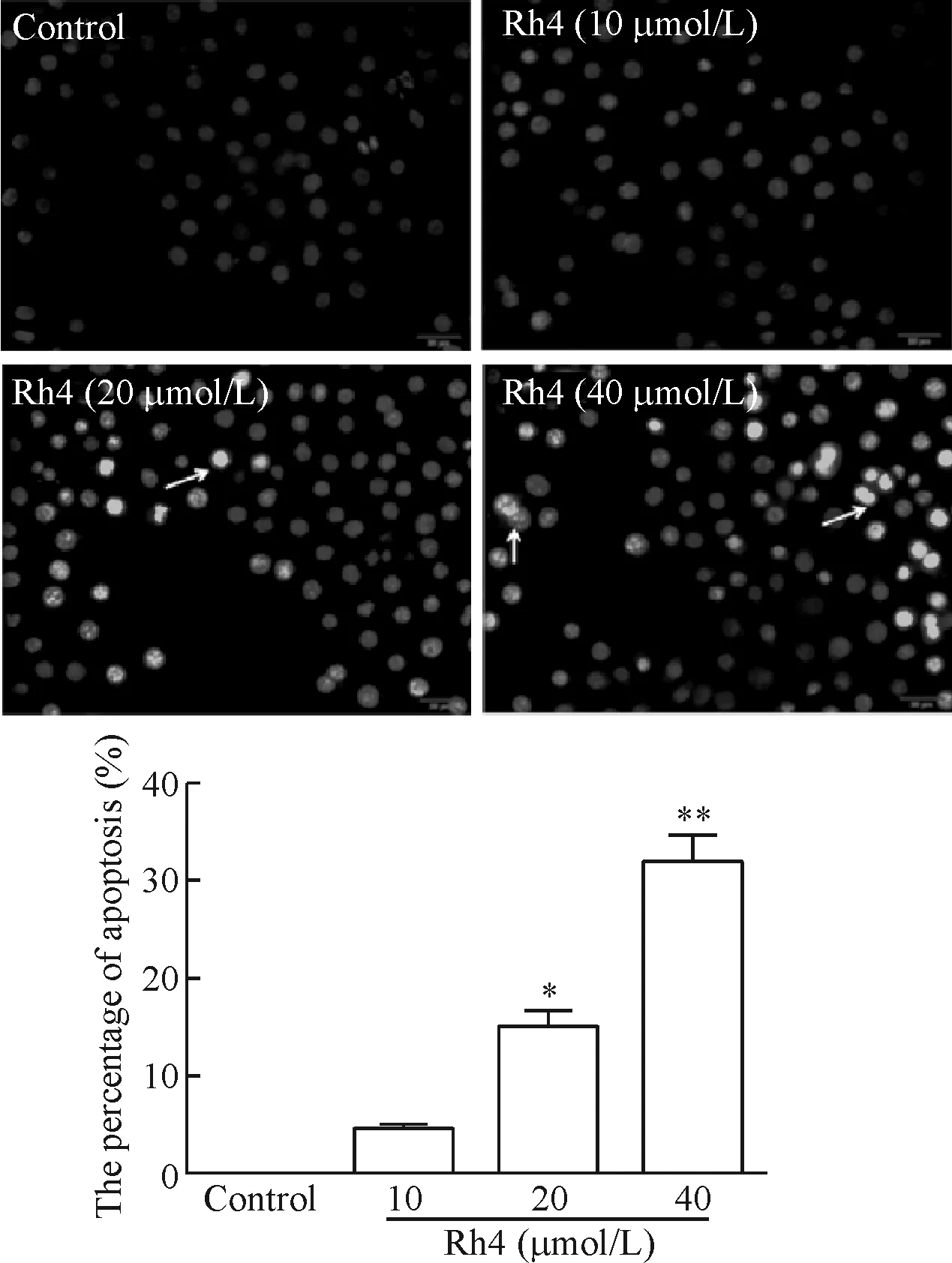
Figure 3.The morphological observation of the HepG2 cells exposed to ginsenoside Rh4 with Hoechst 33258 staining (×200). Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group.
图3 Hoechst 33258检测人参皂苷Rh4所致HepG2细胞凋亡形态的变化
5 人参皂苷Rh4对HepG2细胞Bcl-2和Bax凋亡蛋白表达水平的影响
与对照组相比,3个剂量浓度的人参皂苷Rh4均能够促进HepG2细胞中Bax蛋白表达(P<0.05),其中20和40 μmol/L剂量组能有效抑制Bcl-2蛋白表达水平(P<0.05);随着人参皂苷Rh4给药浓度的增加,Bax/Bcl-2比值上调,呈现出一定的剂量依赖性(P<0.05),见图5。
6 人参皂苷Rh4对HepG2细胞caspase-3和caspase-9凋亡蛋白表达水平的影响
将0~40 μmol/L的人参皂苷Rh4作用HepG2细胞24 h后,收集细胞进行Western blot检测。与对照组相比,3个剂量浓度的人参皂苷Rh4均能够增高HepG2细胞中cleaved caspase-3的蛋白水平(P<0.05),其中20和40 μmol/L剂量组能够有效上调caspase-9蛋白表达水平(P<0.05);随着人参皂苷Rh4给药浓度的增加,其对cleaved caspase-3和caspase-9的上调呈现出一定的剂量依赖性(P<0.05),见图5。

Figure 4.The microscopic observation of TUNEL assay for determining the effects of ginsenoside Rh4 on apoptosis of HepG2 cells. HepG2 cells were treated with ginsenoside Rh4 for 24 h. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group.
图4 人参皂苷Rh4作用HepG2细胞24 h后的TUNEL染色结果

Figure 5.The protein levels of apoptosis-related proteins in the HepG2 cells treated with ginsenoside Rh4 for 24 h. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group.
图5 人参皂苷Rh4对HepG2细胞中凋亡相关蛋白表达水平的影响
讨 论
近年来,在抗癌领域的研究中,天然产物取得了显著的成就,临床使用的抗癌药物中60%以上来源于天然产物,天然产物已成为抗癌新药开发的重要途径之一[11-12]。本文以热裂解人参皂苷Rh4为研究对象,重点阐释其诱导HepG2细胞凋亡的分子机制,结果表明人参皂苷Rh4能够呈剂量依赖性地显著抑制HepG2细胞的增殖。利用TUNEL和Hoechst 33258染色观察,高剂量人参皂苷Rh4处理24 h后,HepG2细胞呈现皱缩,破裂,具有典型的凋亡等特征。由此可见,人参皂苷Rh4可明显抑制人肝癌HepG2细胞的生长,其抑制作用主要通过促进细胞凋亡来实现的。
为进一步探讨人参皂苷Rh4诱导HepG2细胞凋亡的分子机制,本实验还利用了Western blot技术对以上实验结果加以佐证。细胞凋亡是受基因控制的一种程序性死亡,即细胞为维持内环境稳定,在生理或病理状态下自主发生的一种死亡形式[13-14]。凋亡发生时细胞首先接收和识别生理性或病理性凋亡刺激信号,然后启动凋亡相关基因并合成一系列具有致死效应的蛋白质,从而引起细胞的解体和死亡[15]。肿瘤细胞凋亡信号转导通路中,Bcl-2家族成员的构成比例是凋亡调控的关键因素,发挥着重要的作用,研究者认为Bax/Bcl-2比值是启动肿瘤细胞凋亡的“分子开关”[16-17]。本实验结果表明:人参皂苷Rh4能够激活Bax促凋亡蛋白的表达水平,同时抑制抗凋亡蛋白Bcl-2的表达水平,人参皂苷Rh4作用HepG2细胞24 h后,Bax/Bcl-2二者比值增加。此外,人参皂苷Rh4能够显著激活caspase-3和caspase-9的蛋白表达水平,进一步促进细胞凋亡。
综上所述,人参皂苷Rh4 能剂量依赖性地诱导HepG2细胞凋亡,且这一作用是部分通过降低抗凋亡蛋白Bcl-2,并增加促凋亡蛋白Bax、cleaved caspase-3和caspase-9的表达来发挥的,其具体分子作用机制尚待进一步研究。
[1] Myzak MC, Karplus PA, Chung FL, et al. A novel me-chanism of chemoprotection by sulforaphane: inhibition of histone deacetylase [J]. Cancer Res, 2004, 64(16): 5767-5774.
[2] Tanase AM, Dumitrascu T, Dima S, et al. Influence of hepatitis viruses on clinicopathological profiles and long-term outcome in patients undergoing surgery for hepatocellular carcinoma [J]. Hepatobiliary Pancreat Dis Int, 2014, 13(2): 162-172.
[3] Nishikawa H, Arimoto A, Wakasa T, et al. Comparison of clinical characteristics and survival after surgery in patients with non-B and non-C hepatocellular carcinoma and hepatitis virus-related hepatocellular carcinoma [J]. J Cancer, 2013, 4(6): 502-513.
[4] Bain GH, Collie-Duguid E, Murray GI, et al. Tumor expression of leptin is associated with chemotherapy resis-tance and therapy-independent prognosis in gastro-oeso-phageal adenocarcinomas [J]. Br J Cancer, 2014, 110(6): 1525-1534.
[5] 罗惠娟, 徐建平, 黎 清, 等. 4种中药多糖及胸腺肽对U14宫颈癌荷瘤鼠脾脏和瘤内免疫影响的比较[J]. 中国病理生理杂志, 2012, 28(10):1895-1900.
[6] 刘艳红, 章秀丽, 陈少文, 等. 人参皂苷Rh2诱导人肝癌HepG2细胞凋亡的研究[J]. 中国实验诊断学, 2011, 15(12):2011-2013.
[7] 李 杰, 宋淑霞, 吕占军. 人参皂苷抗肿瘤作用的研究进展[J]. 中国肿瘤生物治疗杂志, 2004, 11(1):61-63.
[8] Sun H, Ye Y, Pan Y. Immunological-adjuvant saponins from the roots ofPanaxnotoginseng[J]. Chem Biodivers, 2005, 2(4): 510-515.
[9] Baek NI, Kim DS, Lee YH, et al. Ginsenoside Rh4, a genuine dammarane glycoside from Korean red ginseng [J]. Planta Med, 1996, 62(1): 86-87.
[10]郝 颖, 于珊珊, 戴雨霖, 等. RRLC-Q-TOF MS/MS法分析生晒参和大力参中的皂苷类成分[J]. 质谱学报, 2014, 35(4):311-316.
[11]周彩虹, 林洪生, 黄启福, 等. 中药金安粉针剂对小鼠Lewis肺癌的抑制作用及其机制探讨[J]. 中国病理生理杂志, 2003, 19(5):672-675.
[12]Butler MS. Natural products to drugs: natural product-derived compounds in clinical trials [J]. Nat Prod Rep, 2008, 25(3): 475-516.
[13]李朝慧, 任本洪, 孙雪娇, 等. 顺铂耐药对食管癌细胞增殖、凋亡、迁移和血管生成的影响[J]. 中国病理生理杂志, 2017, 33(1):1-6.
[14]Zhang H, Lin Y, Maas A, et al. BaxΔ2 promotes apoptosis through caspase-8 activation in microsatellite-unstable colon cancer [J]. Mol Cancer Res, 2014, 12(9): 1225-1232.
[15]Kuboki M, Simizu S, Umezawa K. Activation of apoptosis by caspase-3-dependent specific RelB cleavage in anticancer agent-treated cancer cells: involvement of positive feedback mechanism [J]. Biochem Biophys Res Commun, 2015, 456(3): 810-814.
[16]Faião-Flores F, Coelho PR, Toledo Arruda-Neto JD, et al. Apoptosis through Bcl-2/Bax and cleaved caspase up-regulation in melanoma treated by boron neutron capture therapy [J]. PLoS One, 2013, 8(3):e59639.
[17]孙栋勋, 黄栋栋, 金巧智, 等. miRNA-7介导Bax和Bcl-2表达对人鼻咽癌CNE-1细胞凋亡的影响[J]. 中国病理生理杂志, 2016, 32(5):933-937.
(责任编辑: 林白霜, 罗 森)
Ginsenoside Rh4 induces apoptosis of human hepatocellular carcinoma HepG2 cells
WANG Zi1, LÜ Xiao-yan2, HU Jun-nan1, ZHAO Yan1, CAI En-bo1, LIU Shuang-li1, LI Wei1, ZHANG Lian-xue1
(1CollegeofChineseMedicinalMaterials,JilinAgriculturalUniversity,Changchun130118,China;2ClinicalLaboratory,TheSecondHospitalofJilinUniversity,Changchun130041,China.E-mail:liwei7727@126.com;zlxbooksea@163.com)
AIM: To investigate the apoptosis and molecular mechanism of human hepatocellular carcinoma HepG2 cells induced by ginsenoside Rh4. METHODS: Human hepatocellular carcinoma HepG2 cells were treated with ginsenoside Rh4 at doses of 10, 20 and 40 μmol/L, and the inhibitory effect of ginsenoside Rh4 on HepG2 cell viability was measured by MTT assay. The apoptotic rate of HepG2 cells was analyzed by flow cytometry. The morphological changes of the HepG2 cells were observed by Hoechst 33258 and TUNEL staining. The expression of apoptosis-related proteins Bax, Bcl-2, caspase-3 and caspase-9 was determined by Western blot. RESULTS: Ginsenoside Rh4 promoted apoptosis of HepG2 cells in a dose-dependent manner. TUNEL and Hoechst 33258 staining showed that the cells appeared obvious shrinking, swelling and rupture after treated with ginsenoside Rh4 for 24 h. The results of Western blot showed that with the increasing concentrations of ginsenoside Rh4, the expression of pro-apoptotic proteins Bax, cleaved caspase-3 and caspase-9 increased, while anti-apoptotic protein Bcl-2 decreased gradually. CONCLUSION: Ginsenoside Rh4 induces apoptosis of human hepatocellular carcinoma HepG2 cells, and the main mechanism may be related to down-regulation of Bcl-2 and up-regulation of Bax, cleaved caspase-3, and caspase-9.
Ginsenoside Rh4; Hepatocellular carcinoma; HepG2 cells; Apoptosis
1000- 4718(2017)08- 1399- 06
2016- 12- 05
2017- 04- 27
国家自然科学基金资助项目(No. 31201331);人参产业技术体系(No. 201303111);吉林省留学回国人员科研启动基金;吉林农业大学首批青年拔尖创新人才支持计划(2016);吉林大学白求恩计划项目(No. 2015401)
R965; R730.23
A
10.3969/j.issn.1000- 4718.2017.08.009
杂志网址: http://www.cjpp.net
△通讯作者 李 伟 Tel: 0431-84533304; E-mail: liwei7727@126.com; 张连学 Tel: 0431-84533304; E-mail: zlxbooksea@163.com
