骨髓炎兔胫骨动物模型的建立与评价
2017-09-03滕加文梁学振李梁
滕加文 梁学振 李梁
骨髓炎兔胫骨动物模型的建立与评价
滕加文 梁学振 李梁
目的 探讨胫骨骨髓炎动物模型建立与评估。方法 30只普通级别成年新西兰大白兔,按随机数表法分为对照组与实验组, 每组15只。实验组麻醉成功后于右侧胫骨髌下内侧纵行切口, 显露胫骨干骺端后, 注入5%鱼肝油酸钠0.3 ml, 静置5 min后, 注入制备好的金黄色葡萄球菌菌液0.1 ml;对照组注入0.9%生理盐水0.1 ml, 余操纵步骤同实验组。14、28 d时分别观察两组大体情况、影像学、白细胞、细菌培养及组织学等动物模型制备情况。结果 共30只兔完成实验, 实验组14只兔成功建立骨髓炎模型, 成功率为93%。术后3 d两组兔均萎靡不振, 食欲减退, 跛行;14 d后实验组14只兔出现右小腿部红肿, 皮肤隆起;均可挤出黄白色脓液, 细菌培养后均为金黄色葡萄球菌;28 d时实验组10只兔全部出现窦道并可挤出黄白色脓液;对照组未发现明显发热、皮肤红肿、脓液溢出等症状。实验组术后7、14、28 d时体温均高于对照组, 差异均具有统计学意义(P<0.05);实验组术后14、28 d体重均低于对照组, 差异均具有统计学意义(P<0.05)。术后14 d, X线提示实验组14只兔均出现不同程度的骨密度降低, 皮质变薄, 溶解, 个别见死骨;术后28 d, 10只实验兔均可见死骨、骨缺损及新骨形成, 程度较术后14 d时明显加深。术后14、28 d时, 实验组Norden骨髓炎评分均高于对照组, 差异均具有统计学意义(P<0.05)。术后1、7、14、28 d实验组白细胞计数均高于对照组, 差异均具有统计学意义(P<0.05)。术后14 d时取实验组窦道分泌物及髓腔内组织, 经细菌培养后14只兔为金黄色葡萄球菌, 术后28 d时培养均为金黄色葡萄球菌;对照组未培养出细菌。实验组病理学结果为骨髓炎活动性改变。结论 运用金黄色葡萄球菌液直接注入骨髓腔的方法可以稳定制成动物骨髓炎模型, 且在14 d时就基本符合骨髓炎诊断标准, 28 d时为稳定状态可开展进一步研究。
动物骨髓炎模型;金黄色葡萄球菌;Norden骨髓炎评分
骨髓炎是骨科临床上较为常见的难治性疾病, 是一种伴随着骨质破坏和进行性炎症的感染状态[1-3]。有报道显示, 在开放性骨折后的3个月内, 发生严重感染的几率高达27%[4,5],建立良好的动物模型来筛选和优化治疗方案就显得尤为重要。
1 材料与方法
1.1 实验动物 普通级别成年新西兰大白兔30只, 性别不限, 体重2.0~2.5kg, 中位体重2.35kg, 由济南西岭角养殖繁育中心单位提供, 实验动物许可证号:SCXK(鲁)20150001。 30只兔按随机数表法分为对照组与实验组, 每组15只。各组14 d后处死5只, 28 d后处死全部。
1.2 实验药物、试剂及仪器 本次实验中用到的实验药物、试剂及仪器具体见表1。

表1 实验药物、试剂及仪器的生产厂家信息
1.3 造模方法 适应性饲养1周的新西兰大白兔, 称重后以水合氯醛(300mg/k g)腹腔麻醉, 待麻醉成功后, 固定于兔手术台上。实验组:于右侧胫骨上端内侧剪毛备皮, 碘伏溶液消毒, 行右胫骨髌下内侧纵行切口, 长约1 c m, 分离软组织后显露胫骨干骺端, 用1mm克氏钻头钻入髓腔, 从钻孔处抽出0.5ml骨髓, 后注入5%鱼肝油酸钠0.3ml, 静置5min后,注入制备好的金黄色葡萄球菌菌液0.1ml, 骨蜡封闭钻孔, 以防止菌液溢出, 冲洗后逐层缝合。对照组:注入0.9%氯化钠溶液0.1ml, 余操作步骤同实验组。术后动物隔离分笼饲养,患肢不制动, 标准进食, 不应用任何抗生素及其他药物, 术后7 d内隔日用碘伏溶液消毒伤口。
1.4 统计学方法 采用SPSS 19.0统计学软件处理数据。计量资料以均数±标准差()表示, 采用t检验。P<0.05表示差异具有统计学意义。
2 结果
30只兔中1只麻醉过量死亡, 补齐后共30只兔完成实验。14 d时实验组共有14只兔制作骨髓炎模型成功, 成功率为93%。
2.1 大体观察 术后3 d两组兔均萎靡不振, 食欲减退, 跛行。14 d后实验组14只兔出现右小腿部红肿, 皮肤隆起;均可挤出黄白色脓液(图1), 细菌培养后均为金黄色葡萄球菌;28 d时实验组10只兔全部出现窦道并可挤出黄白色脓液(图2)。对照组未发现明显发热、皮肤红肿、脓液溢出等症状。两组造模前体温比较差异无统计学意义(P>0.05);两组均在术后1 d体温升高, 但组间对比差异无统计学意义(P>0.05), 考虑术后发热;实验组所有兔手术7 d时均不同程度发热, 与对照组比较差异具有统计学意义(P<0.05), 术后14 d时实验组兔体温较术后7 d时降低, 但仍高于对照组, 组间比较差异具有统计学意义(P<0.05);术后28 d实验组兔体温与术后14 d持平, 对比差异无统计学意义(P>0.05), 术后28 d实验组兔体温与对照组比较差异无统计学意义(P<0.05)。见表2。两组造模前体重比较差异无统计学意义(P>0.05);实验组术后14 d体重明显减轻, 术后28 d较术后14 d无明显改变, 对照组体重无明显改变;实验组术后14、28 d体重均低于对照组, 差异均具有统计学意义(P<0.05)。见表3。
2.2 影像学观察 术后14 d, X线提示实验组14只兔均出现不同程度的骨密度降低, 皮质变薄, 溶解, 个别见死骨(图3)。术后28 d, 10只实验兔均可见死骨、骨缺损及新骨形成, 程度较术后14 d时明显加深。术后14、28 d时, 实验组N o r d e n骨髓炎评分均高于对照组, 差异均具有统计学意义(P<0.05);相较于术后14 d时, 实验组术后28 d时骨髓炎程度加重, 死骨及骨质缺损明显增加, N o r d e n骨髓炎评分明显升高, 差异具有统计学意义(P<0.05)。实验中对照组持续表现为骨连续性好, 皮质光滑完整, 无死骨及骨缺损, 术后28 d与术后14 d N o r d e n骨髓炎评分比较差异无统计学意义(P>0.05)。见表4。
2.3 血细胞观察 两组造模前白细胞计数比较差异无统计学意义(P>0.05);术后1、7 d, 实验组15只兔较对照组均出现不同程度的白细胞计数升高, 组间差异均具有统计学意义(P<0.05);术后14 d实验组较对照组白细胞计数升高, 差异具有统计学意义(P<0.05), 但相对于术后7 d降低, 差异具有统计学意义(P<0.05)。术后28 d, 实验组白细胞计数较对照组升高, 差异具有统计学意义(P<0.05), 但与术后14 d时比较差异无统计学意义(P>0.05)。对照组实验周期内白细胞计数无明显变动, 比较差异无统计学意义(P>0.05)。见表5。
2.4 细菌学观察 术后14 d时取实验组窦道分泌物及髓腔内组织, 经细菌培养后14只兔为金黄色葡萄球菌, 术后28 d时培养均为金黄色葡萄球菌(图4)。对照组未培养出细菌。
2.5 组织学观察 光镜病理切片显示, 实验组14 d时送检标本自骨组织至骨髓内, 可见不同程度中性嗜酸性粒细胞呈弥散性浸润, 髓腔内部分髓细胞广泛性坏死, 分区域脓肿形成伴部分机化。病理诊断为创伤后骨髓炎活动性改变。28 d时送检标本可见广泛中性嗜酸性粒细胞呈弥散性浸润, 髓腔内大部分髓细胞广泛性坏死, 分区域脓肿形成伴机化。病理诊断同14 d时。对照组未见中性嗜酸性粒细胞浸润, 髓腔内细胞正常, 未发现脓肿细胞。
表2 两组体温变化对比(, ℃)

表2 两组体温变化对比(, ℃)
注:与对照组对比,aP<0.05
组别只数造模前术后1 d术后7 d术后14 d术后28 d实验组1538.60±0.5939.02±1.3439.56±1.24a39.32±0.64a39.35±1.04a对照组1538.50±0.5638.91±1.3438.28±1.2238.46±0.4238.35±0.51 t 0.4760.2252.8504.3513.344 P >0.05>0.05<0.05<0.05<0.05
表3 两组体重对比(, g)

表3 两组体重对比(, g)
注:与对照组对比,aP<0.05
组别只数造模前术后14 d术后28 d实验组152300.000±303.7182007.000±198.944a1980.000±133.250a对照组152386.000±272.4992262.000±190.7762151.000±139.956 t 0.8163.5833.427 P >0.05<0.05<0.05
表4 两组N o r d e n骨髓炎评分对比(, 分)
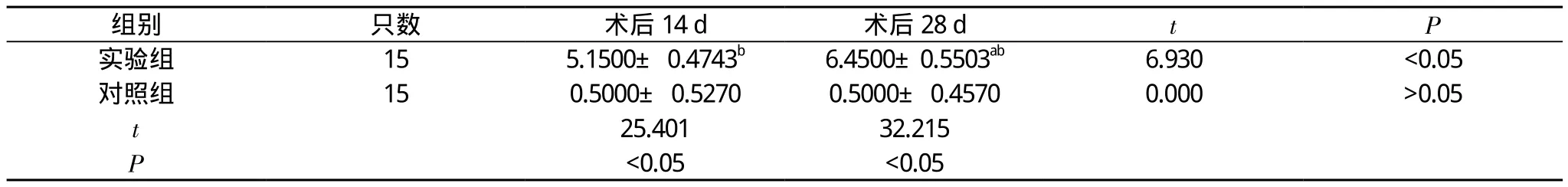
表4 两组N o r d e n骨髓炎评分对比(, 分)
注:与本组术后14 d对比,aP<0.05;与对照组对比,bP<0.05
组别只数术后14 d术后28 dtP实验组155.1500± 0.4743b6.4500±0.5503ab6.930<0.05对照组150.5000± 0.52700.5000± 0.45700.000>0.05 t 25.40132.215 P <0.05<0.05
表5 两组白细胞计数对比(, ×109/L)

表5 两组白细胞计数对比(, ×109/L)
注:与本组术后7 d对比,aP<0.05;与对照组对比,bP<0.05
组别只数造模前术后1 d术后7 d术后14 d术后28 d对照组152.80±0.732.92±0.782.82±0.652.89±0.493.04±0.77实验组152.94±0.5314.24±0.74b12.04±0.73b8.53±0.73ab8.76±0.58bt 0.60140.77736.53324.84522.981 P >0.05<0.05<0.05<0.05<0.05

图1 14d后实验组黄白色脓液照片
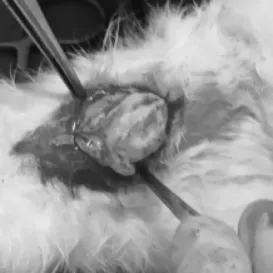
图2 28d时实验组大白兔黄白色脓液照片

图3 术后14 d时实验组X线片

图4 术后28 d时实验组细菌培养
3 讨论
骨髓炎一直是医疗领域中一个亟待解决的问题, 其多为慢性骨髓炎, 特点是低度感染, 病菌长期存在, 死骨形成, 窦道存在, 病程往往迁延几个月甚至几年[6-9]。而对于创伤性骨髓炎的明确分类与治疗始终困扰着临床医生[10,11]。因此,寻找到一个有效的方法彻底根治骨髓炎迫在眉睫, 而合适的骨髓炎动物模型的建立, 为进一步探索骨髓炎的治疗方法,奠定良好的基础[12]。
总之, 在骨髓炎实验模型的建立中, 通过合适的方法及适当的菌种植入, 可以有效的建立动物模型。在术后14 d时实验动物可基本达到骨髓炎的诊断标准。28 d时骨髓炎的症状表现会更加明显, 实验动物的状态也基本稳定。这为以后开展相关实验研究提供了更为宽泛的选择, 也为以后创伤性骨髓炎的分类诊疗提供参考。
[1] 龙光桥.慢性骨髓炎诊断与治疗.中国继续医学教育, 2016, 8(18):128-130.
[2] 彭冰, 宋才渊, 金红婷, 等.慢性骨髓炎的临床诊断与治疗.中国骨伤, 2015, 28(9):870-873.
[3] 冯晨晨.慢性骨髓炎的诊断及治疗方法进展.河北医科大学, 2016.
[4] 史永安, 杜全红, 马秉珺, 等.创伤性骨髓炎的分型及治疗经验.中国矫形外科杂志, 2016, 24(11):1048-1050.
[5] 陈金水, 廖肇山, 林松庆, 等.兔股骨慢性骨髓炎模型的制作.中国组织工程研究, 2015, 19(49):7885-7889.
[6] 褚立涛, 郭国栋, 刘刚, 等.兔胫骨创伤后骨髓炎动物模型的建立.医学研究生学报, 2012, 25(11):1160-1162.
[7] 吕豪, 刘书明, 杨华山, 等.慢性骨髓炎患者感染病原菌分布及药物敏感性研究.中华医院感染学杂志, 2016, 26(22):5179-5181.
[8] 刘伯让, 毕晓洁, 王勤, 等.慢性化脓性骨髓炎伤口分泌物细菌学特征与耐药性分析.中华医院感染学杂志, 2016, 26(2): 382-384.
[9] 卢旻鹏.载银纳米抗菌复合骨填充材料治疗兔胫骨慢性骨髓炎的实验研究.重庆医科大学, 2010.
[10] 李亮亮.兔慢性骨髓炎模型的建立及效果评价.安徽医药, 2015, 19(12):2299-2301.
[11] 杨国跃.载溶葡萄球菌酶羟基磷灰石/壳聚糖复合缓释材料治疗兔胫骨骨髓炎的实验研究.天津医科大学, 2012.
[12] 袁承杰, 翁蔚宗, 周启荣, 等.骨髓炎骨缺损动物模型构建研究进展.中华骨与关节外科杂志, 2016, 9(1):87-90.
Establishment and evaluation of rabbit tibial osteomyelitis model
TENG Jia-wen, LIANG Xue-zhen, LI Liang.Department of Micro Orthopedics, Affiliated Hospital of Shandong University of Traditional Chinese Medicine, Jinan 250014, China
Objective To investigate the establishment and evaluation of tibial osteomyelitis animal model.Methods A total of 30 regular adult New Zealand white rabbits were divided by random number table method into control group and experimental group, with 15 rabbits in each group.In the experimental group, a longitudinal incision was performed on inside of the right tibial patella after successful anesthesia.After the tibial metaphysis was revealed, 5% sodium morrhuate 0.3 ml were injected, and 0.1 ml staphylococcus aureus liquid was injected after 5 min standing.In the control group, 0.9% physiological saline 0.1 ml was injected, and the other operating steps were was the same with the experimental group.Observation were made on general situation, imaging, white blood cells, bacterial culture and histology and other animal model preparations at 14 and 28 d in two groups.Results A total of 30 rabbits completed the experiment, and there were 14 rabbits in the experimental group with successfully established osteomyelitis model, with success rate as 93%.In postoperative3 d, malaise, loss of appetite and limping occurred in two groups.At 14 d, there were 14 rabbits in the experimental group with right lower leg redness and skin uplift.Yellow white pus could be extruded, and staphylococcus aureus was cultured after bacterial culture.At 28 d, sinus showed in 10 rabbits of the experimental group, and yellow white pus could be extruded.The control group showed no obvious fever, skin swelling and pus overflow symptoms.The experimental group had higher temperature in postoperative 7, 14 and 28 d than the control group, and the difference had statistical significance (P<0.05).The experimental group had lower weight in postoperative 14 and 28 d than the control group, and the difference had statistical significance (P<0.05).In postoperative 14 d, X-ray showed that there were 14 rabbits in experimental group with varying degrees of bone mineral density decline, cortical thinning, dissolution, and dead bones can be seen in some rabbit.In postoperative 28 d, the dead bone, bone defect and new bone were observed in 10 rabbits of the experimental group, and the degreeof bone formation was obviously worse than postoperative 14 d.In postoperative 14 and 28 d, the experimental group had higher Norden osteomyelitis score than the control group, and the difference had statistical significance (P<0.05).In postoperative 1, 7, 14 and 28 d, the experimental group had higher white blood cell count than the control group, and the difference had statistical significance (P<0.05).In postoperative 14 d, sinus secretions and medullary cavity tissue were collected for bacterial culture.There were 14 rabbits of the experimental group with staphylococcus aureus, and all rabbits with staphylococcus aureus in postoperative 28 d.No bacteria showed in the control group after culture.The pathological results of the experimental group were active changes in osteomyelitis.Conclusion The method of staphylococcus aureus injection into the bone marrow cavity is easy for stable preparation of animal osteomyelitis model.It is basically in line with the diagnostic criteria for osteomyelitis at 14 d, and the state is stable for further study at 28 d.
Animal osteomyelitis model; Staphylococcus aureus; Norden osteomyelitis score
10.14164/j.cnki.cn11-5581/r.2017.16.114
2017-07-04]
250014 山东中医药大学附属医院显微骨科(滕加文);山东中医药大学(梁学振 李梁)
