重度创伤后锌和脑干NMDA受体与MODS死亡机制关系
2017-09-03周永翠王广欢于晓军吕俊耀
周永翠,王广欢,王 典,于晓军,吕俊耀,汤 畅
(汕头大学医学院 1.第一附属医院;2.第二附属医院;3.法医学教研室,广东 汕头515041)
*通讯作者
重度创伤后锌和脑干NMDA受体与MODS死亡机制关系
周永翠1,王广欢2*,王 典3,于晓军3,吕俊耀3,汤 畅3
(汕头大学医学院 1.第一附属医院;2.第二附属医院;3.法医学教研室,广东 汕头515041)
目的 探讨重度创伤引发的微量元素锌急性缺乏与多器官功能障碍综合征(MODS)及其死亡机制的关系。方法 建立重度创伤兔模型,检测脑干NMDA受体、血生化、血清和脑锌。结果 伤后12 h,脑和脑干中锌增高,但血锌浓度下降明显。在脑干背侧区,NR1在伤后6 h内增高随后下降,NR2A在伤后12 h降至最低点。脑干NR2B水平在死亡组最低。血锌离子与脑干腹侧区,背侧区以及网状结构的NR2A、NR2B呈正相关(P<0.05)。脑干锌与只与腹侧,背侧与网状结构NR2A变化呈负相关(P<0.05)。结论 重伤可致血锌急性降低,氧化应激增强,引起NMDA受体的改变导致神经细胞的神经毒性,这可能是重度创伤MODS发生的机制之一。
多器官功能衰竭;NMDA;锌
(ChinJLabDiagn,2017,21:1412)
严重的创伤会导致全身性病理生理反应,严重的可以引起全身炎症反应综合征(SIRS) 、 休克和多器官功能障碍综合征(MODS)包括死亡。外伤引起的继发MODS或死亡机制并不完全清楚。微量元素与抗氧化相关酶的急剧变化,是多器官功能衰竭(MOF)甚至死亡的重要机制[1]。目前,氧化应激和/或兴奋性毒性被认为是神经毒素损伤[2]的最后共同通路。作为特异性兴奋性氨基酸受体NMDA受体是兴奋性毒性的主要神经通路。它在各种急、慢性脑损伤中起重要作用,尤其在脑干,因为它包含了许多重要的生命中枢核。因此,我们应用创伤后MODS模型探讨锌和脑干NMDA受体变化,了解创伤后MODS及其死亡的可能机制。
1 材料与实验方法
1.1 动物模型建立及分组
1.1.1 创伤模型建立 新西兰家兔40只,体重2-2.5 kg。每只兔子每天喂40 g浓缩饲料,每千克饲料含40 g锌。创伤程度采用创伤定级和创伤严重度分级(AIS-ISS)。将家兔固定后:①反复过度拧绞右膝关节,完全性撕碎膝关节后十字韧带,膝关节脱位瘫软(AIS 840406.3);②左肘关节上1.5 cm处钳夹致肱骨闭合性粉碎骨折(AIS 752804.3);③左侧股骨下段膝关节上1.5 cm处钳夹致股骨下段闭合性粉碎骨折(AIS 8518143.3)。损伤总评分ISS=32+32+32=27。
1.1.2 实验分组 ①正常对照组8只;②重伤6 h组8只;③重伤12 h组8只;④重伤3 d组8只;⑤伤后超过24 h死亡的家兔为死亡组8只。
1.2 取材和检测方法
兔深麻醉(戊巴比妥钠腹腔注射,100 mg/kg)。兔颈动脉急性出血处死。各组家兔按创伤后6 h、12 h和3 d定时并颈静脉采血。重伤组家兔分别随机于伤后6 h、12 h、3 d,颈动脉放血快速处死,各时间点8只,立即取脑干组织,用于组织切片。
应用原子吸收光谱法检测家兔血清、大脑及脑干组织微量元素Zn含量。血常规及生化检测:全自动生化分析仪检测血清白蛋白、球蛋白、BUN、Cr。免疫组织化学检测脑干NR1、NR2A、NR2B表达,Image-Pro Plus 6.0 测定受体的含量。
1.3 统计学分析

2 结果
2.1 血生化检测
创伤各组的生化指标较对照组有显著性改变。实验组血清ALB、GLB水平伤后明显降低(P<0.05);BUN、Cr水平伤后明显增加,并在死亡组中达到峰值(P<0.05;表1)。
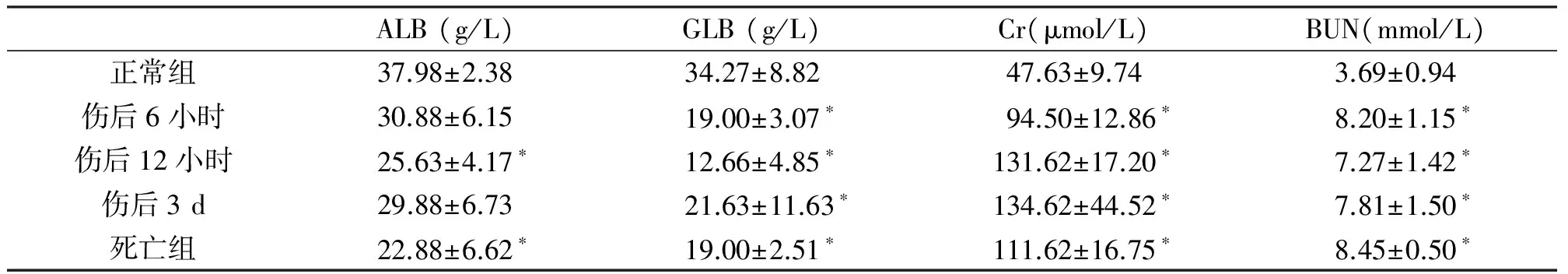
表1 各组中ALB,GLB,Cr 和 BUN测定
*与正常组相比P<0.05
2.2 脑干NR1、NR2A、NR2B免疫组化检测
在脑干背侧损伤后6 h,NR1水平均高于对照组,但在伤后12 h,NR1较伤后6 h明显下降,伤后3天接近基础水平。死亡组中NR1水平比正常组低。重伤组和死亡组中NR2A水平较低,且低于正常组,死亡组水平最低。重伤组NR2B水平低于对照组;但重伤各组差异不明显,重伤组水平显著高于死亡组(图1)。
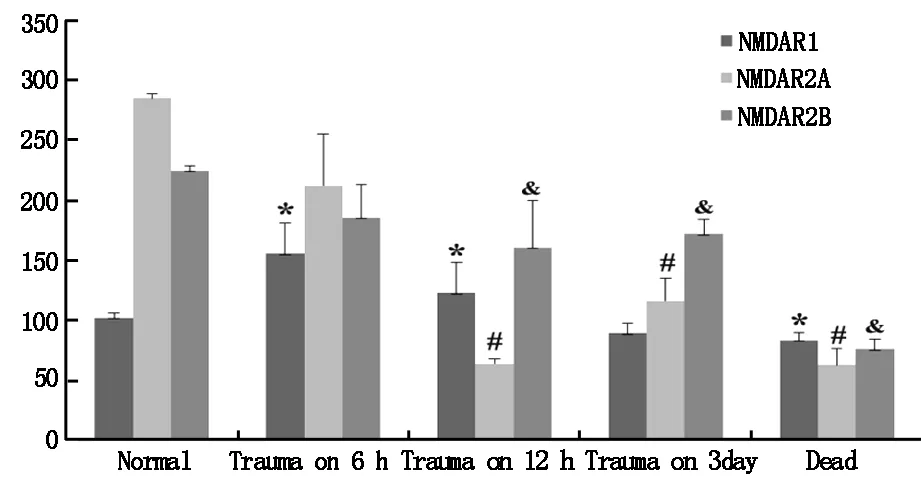
图1 各实验组中脑干NR1,NR2A和NR2B的变化。资料采用均数±标准差;n=8,与对照组相比 (*,#,& ,P<0.05).
2.3 血清,脑和脑干锌
与正常组相比,伤后6 h血清锌水平下降,伤后12 h继续下降,然而伤后3天增加。脑和脑干中锌含量在伤后6 h增加,伤后3天持续增加(图2)。
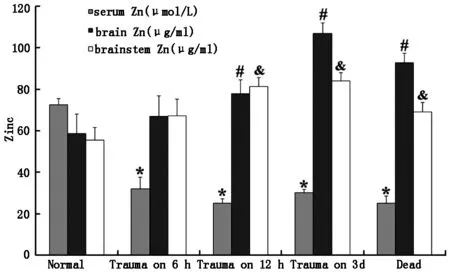
图2 重度创伤后血清、脑和脑干锌的变化。资料采用均数±标准差;n=8,与对照组相比 (*,#,& ,P<0.05).
2.4 锌和脑干NR1,NR2A和NR2B的表达水平之间的相关性
血清锌与脑干背侧NR2A(r=0.629,P<0.05)和NR2B(r= 0.696,P<0.05)的变化呈正相关。脑锌与脑干背侧NR2A表达呈负相关(r=-0.702,P<0.05)。脑锌与脑干背侧NR2B的表达呈负相关(r=-0.568,P<0.05)。脑干锌水平与脑干背侧NR2A表达呈负相关(r=-0.616,P<0.05)。
3 讨论
3.1 锌与创伤后氧化应激反应的相关性
严重创伤可导致炎症介质和炎性细胞因子的释放,引起SIRS和氧化应激。氧化应激理论在神经毒性机制研究中具有重要地位,它可以解释神经损伤和延迟效应的积累。本实验中,血清锌明显下降,伤后12 h后继续下降。在重伤和死亡组锌在损伤后3天持续在较低水平,表明严重的创伤可能会导致血清锌急性下降[3]。在严重创伤后脑、脑干组织中锌含量逐渐增加,显著高于死亡组,但低于存活组。锌在抗氧化系统中起着重要的作用,脑组织在一定程度上可以继续重新分配锌,可提高抗氧化能力[4]。
3.2 严重创伤后与兴奋性毒性密切相关NMDA受体的变化和意义
在神经损伤中,除氧化应激外,还有兴奋性神经毒性。兴奋性毒性是由各种氧自由基和炎症介质刺激谷氨酸引起的。其中,NMDA受体是主要的受体。临床上,在脑缺血、创伤性脑损伤发生时与NMDA受体密切相关。
NR1是离子型谷氨酸受体家族的重要成员,其作用受谷氨酸介导;生理条件下NR1起重要的作用[5]。本实验,在脑干背侧伤后6 h NR1的含量较高,伤后3天恢复。表明,伤后机体通过代偿机制操纵NMDA受体亚单位,造成这时期中枢兴奋性氨基酸毒性增强[6]。本结果与神经元缺血缺氧通过NMDA受体的激活导致大脑受损的最终结果是一致的。
另外,伤后NR2有显著的变化。NR2A和2B是2种调节蛋白亚基。推测,在创伤后调节亚基的减少,减少了对受体活性的结合位点的抑制作用,抑制结合可能会减少,导致最终抑制减少。已证实,在大鼠脑内NR2A和NR2B的表达之间的差异,为NMDA受体表达在脑组织不同的时间和不同的地点的表达提供了分子基础[7]。我们发现,NR2A和2B与血清锌水平变化高度相关表明,作为调节蛋白成分,它们对环境更敏感,特别是外周创伤后等强的刺激[8]。
血液锌与脑干中NR1水平不相关,最有可能是由于血锌丢失增加,摄入减少和再分配。此外,NR1是一个含量大的功能单元,特别是在代偿期更容易受到大的影响。基于脑和脑干锌与NR2A和2B的表达相关,我们推测,严重创伤后NR2不需要抑制就能达到明显的抑制效果。脑锌的急剧增加满足了这一要求。锌和脑干NR2A和2B的相关性表明锌在大脑中抑制NR2A具有较好的亲和力。
严重创伤后急性锌缺乏,抗氧化活性降低,NMDA受体活性改变,导致兴奋性神经毒性增强,导致脑干实质性损害,可能是重度创伤MODS发生的机制之一。
[1]王 典,王海鹏,于 文,等.重伤家兔体内Cu及代谢酶变化与MOF及死亡关系[J].中国法医学杂志,2011,26(4):261.
[2]祝卫国,陈学敏.氧化应激、兴奋性毒性与神经毒性[J].国外医学,卫生学分册,1999,26(5):296.
[3]Wang BH,Yu XJ,Wang D et al.Alterations of trace elements (Zn,Se,Cu,Fe) and related metalloenzymes in rabbit blood after severe trauma[J].J Trace Elem Med Biol,2007,21(2):102.
[4]孙亚蒙,陈 莺,林 岩,等.卒中和短暂性缺血发作患者的卒中预防指南:美国心脏协会/美国卒中协会指南[J].神经病学与神经康复学杂志,2014,11(2):61.
[5]白 晖,张 明,张 炜.谷氨酸受体辅助亚单位的研究进展[J].神经药理学报,2015,5(2):24.
[6]Ling W,Chang L,Song Y,et al.Immunolocalization of NR1,NR2A,and PSD-95 in rat hippocampal subregions during postnatal development[J].Acta Histochem,2012,114(3):285.
[7]杨一萍,骆 媛,王永安,等.脑缺血再灌注损伤大鼠大脑皮质 NR2A 及 NR2B 受体表达变化[J].中国药理学与毒理学杂志,2012,26(2):157.
[8]张秦喆,王 瑞,董振宇,等.谷氨酸受体调控树突棘形态可塑性的研究进展[J].现代生物医学进展,2016,16(10):1984.
Relationship between zinc and brain stem NMDA receptor activity and death mechanism of MODS after severe trauma
ZHOUYong-cui1,WANGGuang-huan2*,WANGDian3,etal.
(1.TheFirstAffiliatedHospitalofShantouUniversityMedicalCollege,Shantou515041,China;2.TheSecondAffiliatedHospitalofShantouUniversityMedicalCollege.3.DepartmentofForensicMedicine,ShantouUniversityMedicalCollege)
Objective To investigate the relationship between acute zinc deficiency caused by severe trauma and multiple organ dysfunction syndromes (MODS) and its mechanism.Methods A severe traumatic rabbit model was established.Zinc and serum biochemical profiles were determined.Results Immunohistochemistry was used to detect brainstem NR1,NR2A,and NR2B in severe trauma.Brain and brainstem Zn increased at 12 h,but serum Zn decreased dramatically after trauma.NR1 in the dorsal brainstem increased at 6 h after injury and then decreased.NR2A in the dorsal regions decreased to a plateau at 12 h after trauma.NR2B were lowest in the death group in the brainstem.Serum zinc was positively correlated with NR2A and 2B and negatively correlated with zinc in the brain (P<0.05).Correlations were also found between the brainstem NR2A and that of the dorsal brainstem,as well as between brainstem NR2A and changes in NR2B.There was a negative correlation between zinc and NR2A (P<0.05).Conclusion Severe trauma led to an acute reduction of zinc enhancing oxidative stress and the changes of NMDAR causing the neurotoxicity of the nerve cells.This may be a mechanism for the occurrence of MODS or death after trauma.
Multiple Organ Failure;N-Methyl-D-Aspartate,Zinc
1007-4287(2017)08-1412-03
R651.1
A
周永翠(1979-),女,博士,副主任技师,研究方向:病理与病理生理。
2016-09-20)
