CD3+CD4+、CD3+CD8+T细胞在IgA肾病患者外周血的表达及临床意义
2017-09-03李琳,陈志,孙韬,吴昊
李 琳,陈 志,孙 韬,吴 昊
(吉林大学第一医院 肾病科,吉林 长春130021)
CD3+CD4+、CD3+CD8+T细胞在IgA肾病患者外周血的表达及临床意义
李 琳,陈 志,孙 韬,吴 昊*
(吉林大学第一医院 肾病科,吉林 长春130021)
IgA肾病(immunoglobin A nephropathy)是最常见的原发性肾小球肾炎[1],也是导致终末期肾衰竭最常见的原因之一[2]。IgA肾病的病因未明,被认为多种免疫细胞及相关因子参与了其发病机制[3]。
T细胞亚群主要包括CD3+CD8+的细胞毒性T 细胞(cytotoxic T cells,Tc)和CD3+CD4+的辅助性T 细胞(helper T cells,Th)等[4],CD4+T细胞和CD8+T细胞在调节宿主免疫中发挥了重要作用[5,6]。本文拟通过检测IgA肾病患者外周血CD3+CD4+T细胞、CD3+CD8+T细胞的水平以及CD4+/CD8+的比值,来反映IgA肾病患者的细胞免疫状态。
1 材料与方法
1.1 材料
1.1.1 研究对象 研究对象为2015年3月到2017年3月吉林大学第一医院收治IgA肾病患者26例。所有患者经肾穿刺经病理明确诊断。所有病例排除了合并有严重感染和自身免疫性疾病,以及既往有恶性肿瘤病史的患者。所有入组病例3个月内未用过激素及免疫抑制剂。 随机选择20 例年龄与性别匹配的健康正常者,均排除心、肝、肾等疾病为对照组。
1.1.2 试剂和仪器 试剂:CD3 anti-human PE cy7,CD4 anti-human FITC,CD8 anti-human pacific blue均购自美国BD公司,淋巴细胞分离液Ficoll-Histopaque 1.077购自美国Sigma公司。仪器:FACS Fortessa 流式细胞仪(美国BD公司)。
1.2 方法
1.2.1 标本收集 取IgA肾病患者组及健康对照组清晨空腹静脉人乙二胺四乙酸(ethylene diamietetraacetic acid,EDTA)抗凝血5 mI,立即轻摇混匀,室温保存,3 h内测定。
1.2.2 外周血单个核细胞(PBMC)的提取 超净台中,将采到的抗凝血加PBS1∶1混匀。取离心管,每管加5 ml淋巴细胞分离液。将稀释的抗凝血沿管壁缓慢匀速加到分离液的上面。将离心管置于水平离心机,室温下2 000 rpm,离心20 min。离心结束后,用毛细吸管轻轻穿过血浆层至白膜层,沿离心管周缘吸出白膜层细胞,置于新离心管中。加PBS液,吸管吹打细胞均匀,室温1 200 rpm,离心5 min,洗涤2次。用含0.1%BSA的PBS重悬提取的PBMC细胞。
1.2.3 荧光标记细胞外抗原染色 流式管中每管细胞数为5×105,1 650 rpm,离心5 min,弃上清。加入100 μl流式洗液,并加入细胞表面抗原hCD3 PE-cy7/hCD4 FITC/hCD8 pacific blue各10 μl。混匀后置4℃避光孵育20 min。冷流式FACS洗液洗涤细胞2次。弃上清,重悬至500 μl流式洗液中。
1.2.4 流式分析 应用流式细胞仪检测IgA肾病患者组和健康对照组外周血中CD3+CD4+T细胞和CD3+CD8+T细胞的表达情况。
1.2.5 统计学处理 采用GraphPad Prism 5.0作图,流式数据采用Flowjo分析数据并作图,组别间差异比较采用配对t检验,P<0.05有统计学意义。
2 结果
2.1 流式分析IgA肾病患者组与健康对照组CD3+CD4+T细胞的比例
结果表明IgA肾病患者外周血CD3+CD4+T细胞的比例低于健康对照组,差异有统计学意义(P<0.001)。结果见表1及图1。
2.2 流式分析IgA肾病患者组与健康对照组CD3+CD8+T细胞的比例
结果表明IgA肾病患者外周血CD3+CD8+T细胞的比例高于健康对照组,差异有统计学意义(P<0.01)。结果见表1及图1。
2.3 测定IgA肾病患者组与健康对照组CD4+/CD8+比值
结果提示IgA肾病患者外周血CD4+/CD8+比值低于健康对照组,差异有统计学意义(P<0.001),结果见表1。
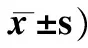
表1 IgA肾病患者外周血T 细胞亚群检测结果比较(%,
Note:**,P<0.01;***,P<0.001
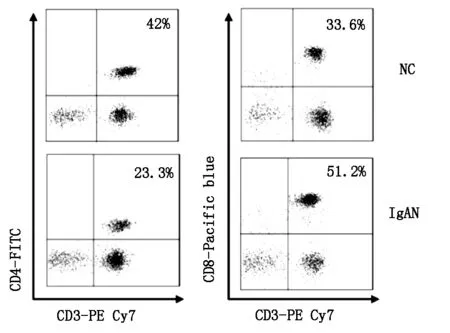
图1 健康对照组、IgA肾病患者组CD3+CD4+T细胞、CD3+CD8+T细胞及CD4+/CD8+比值的比较**,P<0.01;***,P<0.001
3 讨论
IgA肾病为最常见的原发性肾小球疾病[7],据统计,IgA肾病发生率占全部原发性肾小球疾病的45%-50%[8]。IgA肾病发病机制不明,目前认为与免疫因素、基因异常及上呼吸道感染有关。尽管IgA肾病的发病机制尚未阐明,但IgA肾病肾组织中明确有IgA免疫球蛋白沉积,提示与免疫炎症性反应相关[9]。多种免疫细胞和相关细胞因子参与IgA肾病发病机制[10]。
T细胞亚群是目前临床上较常用的反映免疫功能状态的指标,T细胞的免疫调节作用主要由CD4+T细胞、CD8+T细胞完成[11]。其中,CD4+T细胞可协调B细胞分化产生抗体,CD8+T细胞可抑制抗体的合成及T细胞增殖,两者的稳态维持着机体正常的免疫应答[12]。我们检测了IgA肾病患者的这两种T淋巴细胞亚群,发现与对照组相比,IgA肾病患者CD4+T细胞数量及CD4+/CD8+比值均降低,差异有统计学意义,显示患病机体T淋巴细胞数量异常,免疫功能低下。此外这也提示了IgA肾病患者容易并发感染。
综上,我们认为IgA肾病患者外周血的CD4+T细胞减少而CD8+T细胞增多,这种T细胞亚群改变也反映了IgA肾病中免疫功能的紊乱及容易并发感染。
[1]FloegeJ,Moura IC,Daha MR,New insights into the pathogenesis of IgA nephropathy[J].Semin Immunopathol,2014,36(4):431.
[2]Liu P,Lassén E,Nair V,et al.Transcriptomic and Proteomic Profiling Provides Insight into Mesangial Cell Function in IgA Nephropathy[J].J Am Soc Nephrol,June 23,2017.doi:10.1681/ASN.2016101103.
[3]Al Hussain T,Hussein MH,Al Mana H,et al,Pathophysiology of IgA Nephropathy[J].Adv Anat Pathol,2017,24(1): 56.
[4]Caby F.Writing committee of the CD4/CD8 ratio restoration in long-term treated HIV-1-infected individuals: Incidence and determinants[J].AIDS,2017,31(12):1685.
[5]Gerner W,Kaser T,Saalmuller A.Porcine T lymphocytes and NK cells--an update[J].Dev Comp Immunol,2009,33(3):310.
[6]Sallustio F,Serino G,Cox SN,et al.Aberrantly methylated DNA regions lead to low activation of CD4+T-cells in IgA nephropathy[J].Clin Sci (Lond),2016,130(9):733.
[7]Ledbetter JA,Deans JPruffo A,et al.CD4,CD8 and the role of CD45 in T-cell activation[J].Curr Opin Immunol,1993.5(3): 334.
[8]聂东红.IgA肾病肾间质纤维化患者血清胶原蛋白I、血小板衍生生长因子、转化生长因子-P1水平变化及意义[J].中国临床医生杂志,2017,45(2):63.
[9]于 航.IgA肾病发病机制的研究进展[J].内蒙古医科大学学报,2017,39 (1):90.
[10]程小莉,吕治安,杨艳艳,等.巨噬细胞在IgA肾病患者肾脏中的浸润及其与肾纤维化的关系[J].西 安 交 通 大 学 学 报 ,2017,38 (1):66.
[11]谭 政,龚非力.T 细胞功能亚群[J].生命科学,2010,22(6):499.
[12]吴姗姗,严 峰,邓玉玲,等.小细胞和非小细胞肺癌晚期患者CD3+CD4+及CD3+CD8+T 淋巴细胞亚群的差异[J].中国免疫学杂志,2015,31(1):114.
本研究受国家自然科学基金(81641064),吉林省省级产业创新专项资金项目(2016C041-2),吉林省教育厅“十三五”科学技术研究规划项目(JJKH20170841KJ),吉林省发改委产业技术研究开发专项(2015Y036-1)资助
1007-4287(2017)08-1305-02
2017-06-15)
*通讯作者
