不同剂量右美托咪定在慢性阻塞性肺疾病患者机械通气中的应用及对肺功能的影响
2017-09-03罗耀文石伟
罗耀文 石伟
·论著·
不同剂量右美托咪定在慢性阻塞性肺疾病患者机械通气中的应用及对肺功能的影响
罗耀文 石伟
目的探讨不同剂量右美托咪定在慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)患者机械通气中的应用及对肺功能的影响。方法选择2014年11月至2016年11月于深圳市人民医院就诊的102例COPD患者,参照抽签法分为对照组与实验组,每组51例,对照组予以静脉滴注1.0 μg(kg·h)右美托咪定治疗,实验组予以静脉滴注0.6 μg(kg·h)右美托咪定治疗,观察两组患者用药前后血流动力学、肺功能、炎性因子和安全性。结果用药前,比较两组血流动力学、肺功能、炎性因子无差异(P>0.05)。用药后,实验组血流动力学改变及炎性因子降低优于对照组(P<0.05)。实验组肺有效顺应性、动脉血氧分压高于对照组[(56.54±7.06vs. 52.96±6.42)ml/H2O、(98.34±12.16vs. 93.12±11.88)mmHg],实验组呼吸指数、肺泡-动脉氧分压低于对照组[(0.23±0.02vs. 0.25±0.03)、(21.20±2.65vs. 23.32±2.92)mmHg(P<0.05)]。实验组不良反应率低于对照组(P<0.05)。结论小剂量右美托咪定对COPD机械通气患者血流动力学的影响较小,能够保护肺功能,缓解炎症反应。
肺疾病,慢性阻塞性; 右美托咪定; 机械通气; 肺功能
慢性阻塞性肺病(chronic obstructive pulmonary disease, COPD)作为一种肺部的破坏性疾病,气流受限且不完全可逆是其特征,并多呈进行性的发展,随病情程度的进展可加重咳嗽及呼吸急促,增加咳痰量[1-2]。同时COPD可诱导肺部换气机通气功能产生严重异常,诱发二氧化碳潴留,导致呼吸功能减弱,多需通过机械通气以辅助呼吸[3]。但机械通气作为一种有创疗法,多存在不同程度的疼痛,可引起喉部不适,且可诱发多种应激反应。有研究指出合理的镇静模式可缓解人机对抗,提高患者对气管插管的耐受程度[4]。右美托咪定作为一种新颖、高选择性α2肾上腺素受体激动剂,可起到抗焦虑、镇痛及镇静等效果[5]。目前临床上关于其使用剂量尚未有统一标准,本研究旨在探讨不同剂量右美托咪定在COPD患者机械通气中的应用及对肺功能的影响。
资料与方法
一、一般资料
102例COPD患者参照抽签法分组,本研究家属及患者均签署知情同意书,同时经过医院伦理委员会批准。患者纳入标准:①与COPD相关诊断标准相符[6]:肺部X线胸片提示有肺部紊乱、增粗等变化,气流存在受限、无法全部逆转,慢性咳痰、咳嗽比气流受限出现的时间早;②机械通气指征明确;③未合并其他呼吸系统疾病;④近期未使用镇静或者镇痛药物。排除自身免疫及血液系统异常;心肝肾等功能不全;近期伴急性感染或者创伤;恶性肿瘤。对照组男28例,女23例;年龄53~72岁,平均(62.85±2.85)岁;身高150~180 cm,平均(168.24±3.74)cm;体质量45~79kg,平均(69.73±2.87)kg。实验组男25例,女26例;年龄52~74岁,平均(63.27±2.98)岁;身高150~183 cm,平均(169.75±3.92)cm;体质量46~81 kg,平均(70.21±2.99)kg。两组患者基线资料比较无差异(P>0.05),具有可比较性。
二、研究方法
两组患者均建立静脉通路,接通心电监护仪,常规监测血压、心电图、血氧饱和度等,并创建机械通气。对照组予以静脉滴注负荷剂量1.0 μg(kg·h)、维持剂量0.4 μg(kg·h)右美托咪定治疗,实验组予以静脉滴注负荷剂量0.6 μg(kg·h)、维持剂量0.2 μg(kg·h)右美托咪定治疗,待患者气管导管拔除后停止滴注。记录两组患者用药前及用药24 h舒张压、收缩压、心率及呼吸指数。于用药前及用药后24 h抽取患者空腹动静脉血2 ml,常规处理后保存待检。采用血气分析仪检测动脉血氧分压,并计算肺有效顺应性及肺泡-动脉氧分压差。予以电化学发光法检测白细胞介素-6(interleukin-6, IL-6)及肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)水平。同时记录两组安全性。
三、统计学方法
结 果
一、两组患者用药前后血流动力学比较
用药前,比较两组血流动力学无差异(P>0.05);用药后,两组血流动力学均上升,实验组上升幅度小于对照组,差异显著(P<0.05),见表1。
二、两组患者用药前后肺功能比较
用药前,比较两组肺功能无差异(P>0.05);用药后,两组肺有效顺应性、动脉血氧分压均上升,实验组高于对照组,两组呼吸指数、肺泡-动脉氧分压差均降低,实验组低于对照组,差异显著(P<0.05),见表2。
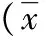
表1 比较两组患者用药前后血流动力学±s)
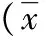
表2 比较两组患者用药前后肺功能±s)
三、两组患者用药前后炎性因子比较
用药前两组炎性因子无差异(P>0.05),实验组与对照组IL-6(78.14±9.25vs. 78.52±9.80)ng/L,t=0.201,P=0.840;TNF-α(9.84±1.13vs. 9.76±1.20)μg/L,t=0.346,P=0.729;用药后两组炎性因子均降低,实验组低于对照组,IL-6(55.60±6.94vs. 61.23±7.63)ng/L,t=3.898,P<0.001;TNF-α(6.85±0.84vs. 8.23±1.02)μg/L,t=7.458,P<0.001差异明显。
四、两组患者安全性比较
实验组与对照组均有心动过缓(3例vs. 7例)、低血压(4例vs. 9例)、谵妄(5例vs. 6例)发生,实验组不良反应率低于对照组(23.52%vs. 43.13%,χ2=4.441,P=0.035),差异明显。
讨 论
COPD是进行性加重的肺部疾病,可引起喘息、咳嗽、咳痰等临床症状,同时可诱导低氧血症,引起肺部的循环阻力上升、肺部动脉的高压状态,导致肺功能损伤,从而诱导患者出现呼吸衰竭,加剧病情[7]。COPD病情程度较重者可诱发缺氧及酸中毒等临床表现,其住院率及病死率较高,导致患者生活质量显著降低,对患者生命构成严重威胁,及时予以呼吸支持是其治疗的关键[8]。机械通气是常用方式,但长时间的气管插管、反复性吸痰等可导致患者出现躁动情绪,增加氧耗,甚至可出现非计划性的拔管,影响临床治疗[9]。相关研究发现,镇静治疗可缓解患者的痛苦,增加其机械通气期间的安全性及舒适性[10]。既往临床上多予以吗啡、舒芬太尼、芬太尼等阿片类药物,但基础研究发现其可诱导机体免疫反应产生改变,增加肺感染可能性[11]。
右美托咪定为咪唑类的一种衍生物,主要作用于大脑蓝斑核,从而调节神经递质,发挥镇静作用,且可起到镇痛效果,与阿片类药物结合后可起到协同作用,引起阿片类药物的用药剂量减少[12]。临床研究表明,不同剂量右美托咪定可起到不同的的临床效果,药物剂量过大可增加血流动力学的波动,且可影响患者感觉运动及意识状态的观察,引起深静脉血栓增加,导致气道自洁功能减弱,诱导肺部感染[13]。本研究显示,用药后两组患者血流动力学均出现上升趋势,但小剂量组上升幅度较小,提示小剂量右美托咪定可维持血流动力学稳定,剂量过大则会导致血流动力学紊乱。
临床研究报道,机械通气能够引起肺部气道压力及肺内分流增加,导致肺部出现缺血性再灌注受损,使肺通气比例产生失调[14]。肺有效顺应性作为一种肺部弹性组织指标,肺不张、肺水肿、肺部分泌物受组、支气管痉挛等均可对其产生影响,使其水平降低[15]。动脉血氧分压可反映肺部功能,同时有利于肺部缺氧状态的评估[16]。呼吸指数、肺泡-动脉氧分压差均能够客观反映肺部的弥散功能,其水平越高表明肺受损程度越重[17]。本研究显示,用药后两组患者肺有效顺应性、动脉血氧分压均上升,但小剂量组高于对照组,两组呼吸指数、肺泡-动脉氧分压差均降低,小剂量组低于对照组,提示小剂量右美托咪定可改善肺功能,分析其机制可能是小剂量右美托咪定更有利于血流动力学的稳定,减轻氧耗从而对肺功能起到保护作用[18]。
研究发现炎症反应可使系列肺结构细胞和相关炎症细胞激活,在COPD发生期间起到关键作用[19]。IL-6可参与机体的炎症反应与病理生理过程,诱导组胺释放,加剧机体的炎症反应,导致病情加重[20-24]。TNF-α有利于炎症介质的浸润和游离,导致肺功能受损,同时也可促进中性粒细胞的分解,导致炎症反应加剧,诱导组织产生纤维化[25]。同时炎性因子可引起肺部产生缺血性再灌注损伤,且可导致内皮细胞的结构与功能发生破坏。本研究显示,用药后小剂量组患者IL-6、TNF-α水平均较低,表明小剂量右美托咪定可能有利于机体炎症反应的缓解,抑制炎性因子的合成与释放,有利于肺功能的改善。同时本研究发现,小剂量组不良反应率明显较低,可能与右美托咪定浓度在血中较低,对心血管的调节,交感神经的抑制,及促进迷走神经的兴奋较轻有关,从而未引起明显的心动过缓及低血压等现象[26]。
综上所述,小剂量右美托咪定对COPD机械通气患者血流动力学的影响较小,能够保护肺功能,缓解炎症反应。但本研究由于纳入样本量较小,观察时间较短,结果可能存在一定偏倚,有待于进一步临床观察。
1 任成山, 钱桂生. 慢性阻塞性肺疾病发病机制研究现状与展望[J/CD]. 中华肺部疾病杂志(电子版), 2009, 2(2): 104-115.
2 Westhoff M, Bachmann M, Braune S, et al. Severe hypercapnic respiratory failure in acute exacerbation of COPD: significance of ventilation and extracorporal CO2removal[J]. Dtsch Med Wochenschr, 2016, 141(24): 1758-1762.
3 Amri Maleh V, Monadi M, Heidari B, et al. Efficiency and outcome of non-invasive versus invasive positive pressure ventilation therapy inrespiratory failure due to chronic obstructive pulmonary disease[J]. Caspian J Intern Med, 2016, 7(2): 99-104.
4 肖涛, 罗宇鸿, 吴锡平, 等. 盐酸右美托咪定用于机械通气的COPD患者镇静的临床观察[J]. 临床肺科杂志, 2013, 18(10): 1817-1818.
5 徐蓉蓉, 黄文起. 右美托咪定药代动力学和药效动力学的研究进展[J]. 广东医学, 2012, 33(8): 1037-1040.
6 中华医学会呼吸病学分会慢性阻塞性肺疾病学组. COPD诊治指南(2007年修订版)[J]. 继续医学教育, 2007, 21(2): 31-42.
7 Carone M, Antoniu S, Baiardi P, et al. Predictors of mortality in patients with COPD and chronic respiratory failure: the quality-of-life evaluation and survival study (QuESS): a three-year study[J]. COPD, 2016,13(2): 130-138.
8 Walterspacher S, July J, Kohlhäufl M, et al. The severe respiratory insufficiency questionnaire for subjects with COPD with long-term oxygen therapy[J]. Respir Care, 2016, 61(9): 1186-1191.
9 姜文, 陈涛. 右美托咪啶用于慢性阻塞性肺疾病患者机械通气时镇静效果分析[J]. 国际呼吸杂志, 2016, 36(16): 1228-1230.
10 聂爱玲. 急性加重期COPD患者机械通气治疗中右美托咪定的镇静效果观察[J]. 山东医药, 2015, 55(15): 79-81.
11 李有志, 金保贵. 不同浓度舒芬太尼联合咪达唑仑在机械通气COPD患者中的效果[J]. 安徽医学, 2016, 37(1): 63-66.
12 张启祥, 赵金凤. 咪达唑仑和右美托咪啶在老年慢性阻塞性肺病患者机械通气中的应用疗效对比[J]. 中国老年学杂志, 2016, (1): 132-133.
13 何少一, 蔡水奇. 不同剂量右美托咪定对老年全麻手术患者拔管后血流动力学影响[J]. 中国乡村医药, 2016, 23(10): 3-4.
14 李凡民. 镇痛镇静对机械通气患者肺功能的影响[J]. 内科急危重症杂志, 2013, 19(5): 286-287.
15 陈卫星. 不同机械通气模式对COPD呼吸衰竭患者肺功能及氧代谢的影响比较[J]. 临床肺科杂志, 2013, 18(5): 874-875.
16 Feiner JR, Weiskopf RB. Evaluating pulmonary function: an assessment of PaO2/FIO2[J]. Crit Care Med, 2017, 45(1): e40-e48.
17 郑勇, 陈科平, 谈晨. 不同机械通气模式对COPD呼吸衰竭患者肺功能及氧代谢影响的比较[J]. 疑难病杂志, 2012, 11(12): 919-921.
18 李远强. 右美托咪定对肺保护作用的研究进展[J]. 中国医师杂志, 2014, 16(5): 705-706.
19 罗治海. 炎性细胞因子检测在COPD急性加重期诊断的临床意义[J]. 中国实验诊断学, 2013, 17(7): 1287-1289.
20 Xie XM, Ke R, Zhang YH, et al. Interleukin-6 gene -174G>C polymorphism and chronic obstructive pulmonary disease risk: a meta-analysis[J]. Genet Mol Res, 2015,14(3): 8516-8525.
21 Nie G, Xie CL, Cao YJ, et al. Meta-analysis of IL-6-174G/C polymorphism and psoriasis risk[J]. Genet Mol Res, 2016, 15(2): doi: 10.4238/gmr.15028255.
22 Hu S, Chen Y, Sun XD, et al. Association between IL-6-174G/C polymorphism and risk of multiple sclerosis: a meta-analysis[J]. Genet Test Mol Biomarkers, 2014, 18(2): 127-130.
23 Han XM, Wang CH, Sima X, et al. Interleukin-6-174G/C polymorphism and the risk of Alzheimer′s disease in Caucasians: a meta-analysis[J]. Neurosci Lett, 2011, 504(1): 4-8.
24 Yin YW, Li JC, Zhang M, et al. Influence of interleukin-6 gene-174G> C polymorphism on development of atherosclerosis: a meta-analysis of 50 studies involving 33,514 subjects[J]. Gene, 2013, 529(1): 94-103.
25 刘艳红, 付英霞. COPD患者血清中超敏C-反应蛋白和肿瘤坏死因子-α的变化分析[J]. 河北医药, 2012, 34(24): 3746-3747.
26 周显琎, 徐振东, 李海冰, 等. 盐酸右美托咪定用于慢性阻塞性肺疾病急性期有效性和安全性的系统评价[J]. 中国药房, 2016, (9):1223-1226.
(本文编辑:张大春)
罗耀文,石伟. 不同剂量右美托咪定在慢性阻塞性肺疾病患者机械通气中的应用及对肺功能的影响[J/CD]. 中华肺部疾病杂志(电子版), 2017, 10(4): 441-444.
Application of different doses of Dexmedetomidine in chronic obstructive pulmonary disease patients with mechanical ventilation and the influence on pulmonary function
LuoYaowen,ShiWei.
DepartmentofAnesthesiology,ShenzhenPeople′sHospital,Shenzhen4959601,China
Correspondingauthor:LuoYaowen,Email: 4959601@qq.com
Objective To research the application of different doses of Dexmedetomidine in chronic obstructive pulmonary disease (COPD) patients with mechanical ventilation and the influence on pulmonary function. Methods All 102 cases of COPD patients from November 2014 to November 2016 in Shenzhen People′s Hospital, it was divided into control group and experimental group according to the draw method, each group of 51 cases, control group intravenous infusion of 1.0 μg/kg·h of dexmedetomidine treatment, the experimental group intravenous infusion of 0.6 μg/kg·h of dexmedetomidine treatment, two groups of hemodynamics, pulmonary function and inflammatory factor and safety before and after the medication were observed. Results Before treatment, the hemodynamics, pulmonary function and inflammatory factor of two groups was no difference (P>0.05). After medication, hemodynamic and inflammatory factor of experimental group was better than that of control group (P<0.05). The pulmonary effective compliance, arterial blood oxygen partial pressure of experimental group were higher than the control group (56.54±7.06vs. 52.96±6.42) ml/H2O, (98.34±12.16vs. 93.12±11.88)mmHg, the respiratory index, alveolar-arterial oxygen partial pressure of experimental were lower than the control group (0.23±0.02vs. 0.25±0.03), (21.20±2.65vs. 23.32±2.92)mmHg (P<0.05). The adverse reaction rate of experimental group was lower than the control group (P<0.05). Conclusion Low-dose Dexmedetomidine has little influcence on hemodynamics in patients with COPD mechanical ventilation, can protect lung function, reduce inflammation.
Chronic obstructive pulmonary disease; Dexmedetomidine; Mechanical ventilation; Lung function
10.3877/cma.j.issn.1674-6902.2017.04.016
广东省科技计划基金项目(2012B031800214)
4959601 深圳市人民医院麻醉科
罗耀文,Email: 4959601@qq.com
R563
A
2017-02-08)
