重症肌无力外周血调节性T细胞线粒体自噬异常的研究
2017-09-03王娜邹利袁江章红妍唐莉王云甫卢祖能
王娜 邹利 袁江 章红妍 唐莉 王云甫 卢祖能
重症肌无力外周血调节性T细胞线粒体自噬异常的研究
王娜 邹利 袁江 章红妍 唐莉 王云甫 卢祖能
目的 探讨线粒体自噬对重症肌无力(myasthenia Gravis,MG)患者外周血调节性T细胞(CD4+CD25+regulatory T cell,Treg)功能的影响及关系。方法 选择首次确诊、尚未接受治疗的15例MG患者,以15名健康人作为对照,分别采集外周血,以磁珠分选法获得Treg细胞,经流式细胞仪鉴定纯度后,分别通过透射电镜检测Treg细胞线粒体自噬情况、Western Blot法检测微管相关蛋白轻链3-Ⅱ(microtubule associated protein light chain 3-Ⅱ,LC3-Ⅱ)的表达水平、JC-10荧光探针检测线粒体膜电位(以红色荧光细胞数/绿色荧光细胞数比值表示)变化、羧基荧光素琥珀酰亚胺酯(CFDA-SE,CFSE)检测Treg对正常CD4+T细胞增殖抑制能力(荧光强度越强,增殖抑制能力越强)。结果 与对照组比较, MG组电镜下线粒体自噬明显减少 〔(25.60±7.81)个、(19.20±5.49)个,t=-2.596,P<0.05〕,且变形线粒体较多;MG组LC3-Ⅱ表达明显减少(0.450±0.137、0.334±0.124,t=-2.413,P<0.05);MG组Treg细胞线粒体膜电位下降 (2.153±0.537,1.726±0.494,t=2.126,P<0.05);MG组CFSE检测平均荧光强度减弱(34.82±10.64、26.49±5.94,t=2.646,P<0.05)。结论 MG患者有Treg细胞的线粒体自噬功能降低,这可能与其增殖抑制功能降低相关。
重症肌无力;线粒体自噬;Treg细胞
重症肌无力(myasthenia gravis,MG)是主要由乙酰胆碱受体抗体介导、细胞免疫依赖、补体参与、主要累及神经肌肉接头突触后膜乙酰胆碱受体的获得性自身免疫性疾病,常表现为部分或全身骨骼肌的病态疲劳。多项研究证实调节性T细胞(Treg)参与了MG的发病过程。Balandina等[1]的研究中发现虽然MG外周血中CD4+CD25+Treg的数量较健康人没有明显变化,但是其叉状头转录因子3(Foxp3) mRNA的表达及细胞抑制功能是下降的;另有研究表明MG患者外周血中CD4+CD25+Foxp3+Treg/CD4+T比值下降[2],CD4+CD25+Foxp3+Treg的数量及Foxp3的蛋白表达也均有下降[3];Xu等[4]的研究证实MG患者CD4+CD25+Treg的数量下降与功能低下是一致的。由于 CD4+CD25+Treg功能的缺陷,Treg抑制自身反应性T细胞和B细胞活化的功能减弱,结果导致自身反应性T、B细胞的异常激活,从而引发疾病的发生发展。
线粒体自噬(mitophagy)与免疫系统功能密不可分,其作用包括病原菌的识别和降解、抗原提呈、淋巴细胞的发育及效应功能、炎性反应的调节等[5]。在自噬相关蛋白7(Atg7)敲除的小鼠中,T淋巴细胞的线粒体清除发生障碍,从而使得细胞内活性氧的产生增加, 并且导致T淋巴细胞的功能障碍以及凋亡[6]。本研究拟通过观察Treg细胞线粒体膜电位、线粒体自噬情况及对Treg细胞功能的影响等方面,来阐述线粒体自噬异常与MG患者Treg细胞功能损伤有关,探讨线粒体自噬异常参与MG发生的机制。
1 对象和方法
1.1 观察对象 选择2015-01—2016-06在十堰市太和医院神经内科住院治疗的MG患者15例,男5例、女10例,年龄24.7~47.1岁,平均年龄为(35.9±11.2)岁,排除急性或慢性肝肾疾病、冠状动脉综合征、各种感染性疾病、心脏瓣膜病、恶性肿瘤、外周血管病、糖尿病、重大手术或严重外伤、严重感染的患者,患者均在入住就诊前2周内,未服用抗胆碱及糖皮质激素类药前进行抽血。按Osserman分型其中Ⅰ型6例,ⅡA型4例,ⅡB型3例,Ⅲ型2例。同时选取性别和年龄匹配的健康志愿者15名(男6名、女9名)为对照组,年龄26.6~45.6岁,平均年龄(36.1±9.5)岁,近半年内在本院进行过健康体检,常规体检各项指标均正常,未发现特殊疾病及相关病史、家族史者。本方案已通过医院伦理委员会审查,并经患者签字知情同意书。
1.2 主要试剂和仪器 淋巴细胞分离液购于天津灏洋华科生物科技有限公司;CD4+CD25+Treg细胞磁珠分选试剂盒、LD柱、MS柱购于德国Miltenyi Biotec公司,标记抗体FITC-CD4、PE-CD25购于美国eBio-science公司,RPMI1640培养液、胎牛血清(FBS)、青霉素及链霉素购于Gibco公司,JC-10探针购于武汉普兰德生物技术有限公司(40707ES03),CFDA-SE购于碧云天公司,CD3、CD28、白细胞介素2(IL-2)等购于R&D systems公司,兔抗人微管相关蛋白轻链3(LC3)、GAPDH购于CST公司。
1.3 方法
1.3.1 PBMC及CD4+CD25+Treg细胞分离:(1)PBMC:用20 mL无菌注射器吸入肝素钙润滑管壁后,采取20 mL外周血,在生物安全柜内稀释3倍,在2支无菌50 mL离心管中分别加入15 mL淋巴细胞分离液后,沿管壁缓慢加入30 mL被稀释的外周血,2000 r/min离心20 min,取白膜层细胞,用PBS洗涤2次获得PBMC。
(2)CD4+CD25+Treg(磁珠分选)及鉴定:将获得的PBMC计数〔细胞量在(3~4)×107个/mL〕,以300 g×10 min离心去上清,用Buffer重悬后加入适量CD4+T细胞生物标记的鸡尾酒抗体,混匀后4℃避光孵育5 min,加入抗生物素标记磁珠(包括生物素标记的抗小鼠CD8、CD14、CD16、CD19、CD36、CD56、CD123、TCR以及血型糖蛋白A),混匀4℃避光孵育10 min,LD柱分离出标记CD4+T细胞群。悬浮所得细胞,加入抗CD25磁珠抗体,混匀,4℃避光孵育15 min后洗涤细胞,MS柱分离出CD4+CD25-T细胞〔细胞量在(5~7)×106个/mL〕和CD4+CD25+T〔细胞(2~5)×105个/mL〕细胞,收集部分获得的细胞,分别孵育CD4-FITC、CD25-PE、CD4-FITC和CD25-PE抗体后通过流式细胞仪检测CD4+CD25-T和CD4+CD25+T细胞的纯度,CD4+T细胞纯度为95%以上,CD4+CD25+T细胞纯度为(90.2±2.6)%,与文献[7]报道基本一致,可用于后续各项实验研究。
1.3.2 自噬的检测:(1)透射电镜检测CD4+CD25+Treg细胞线粒体自噬:分别将MG和对照组所获得CD4+CD25+Treg细胞用2.5%(体积分数)的戊二醛(用PH值7.4的0.1 mmol/L磷酸缓冲液稀释)4℃固定2~4 h,以0.1 mmol/L磷酸缓冲液漂洗3次,每次15 min;1%的锇酸(用pH值为7.4的0.1 mmol/L磷酸缓冲液稀释)室温(20℃)固定2 h;以0.1 mmol/L磷酸缓冲液(PH7.4)漂洗3次,每次15 min;50%-70%-80%-90%-95%-100%-100%酒精上行梯度脱水,每个浓度各15 min;812包埋剂渗透过夜;60℃聚合48 h;60~80 nm超薄切片;铀铅双染色〔2% (体积分数)醋酸铀饱和水溶液,枸橼酸铅,各染色15 min〕,切片室温干燥过夜,电镜下观察,每组各5张切片,每张切片中随机取5个细胞计算自噬体总数,后取每张切片自噬体总数的平均值。线粒体自噬早期形成的线粒体自噬体可以通过线粒体特有的双层膜、嵴等特征辨别,而其与溶酶体融合后可通过单层膜或消化后的残留物来大致识别[8]。(2)Western blot 检测自噬相关蛋白LC3-Ⅱ的表达:分别将MG组及对照组Treg细胞收集后,裂解提取细胞总蛋白,用BCA法测蛋白浓度。SDS-PAGE电泳约1.5 h;半干转至硝酸纤维膜约50 min,5%(质量浓度)BSA常温摇床封闭0.5 h,与LC3抗体4℃孵育过夜;TBST洗膜与辣根过氧化物酶标记的羊抗兔IgG室温孵育1 h;ECL化学发光检测蛋白信号,置凝胶成像仪中曝光。LC3-Ⅱ疏水极性较强,故电泳图中上方条带为LC3-Ⅰ、下方条带为LC3-Ⅱ,以GAPDH为内参,计算LC3-Ⅱ/GAPDH的比值,作为LC3-Ⅱ相对表达量。
1.3.3 荧光显微镜检测CD4+CD25+Treg细胞线粒体膜电位:分别将MG和对照组所获得Treg细胞收集后以1000 r/min×8 min离心,去上清,0.5 mL RPMI1640培养液(不含血清)重悬,加入浓度为10 μg/mL JC-10线粒体膜电位荧光探针,37℃避光孵育20 min后离心,去上清,PBS洗涤2次后用培养液重悬后立刻进行荧光显微镜检测。JC-10主要以聚合体形式聚集在线粒体基质中为主,膜电位下降时以单体形式存在比例升高,在荧光显微镜双通道分别开启时,镜下分别显示为红光(聚合体)、绿光(单体)。故本实验中分别计数红、绿荧光数,以红光荧光数/绿光荧光数比值来评价膜电位变化情况, 即线粒体膜电位与红细胞荧光/绿色荧光呈正相关。
1.3.4 流式细胞仪检测CD4+CD25+T细胞对CD4+CD25-T细胞增殖抑制能力:将分离得到对照组的CD4+CD25-T用不含FBS的培养液1 mL重悬后,加入浓度5 uL/mL的CFSE溶液,37℃避光孵育10 min后加入1 mL FBS中止反应10 min,PBS洗涤2次后用完全培养基(RPMI1640培养液+10%FBS+青霉素、链霉素)重悬,同时加入CD3、CD28、IL-2等细胞因子刺激增殖,按细胞量CD4+CD25+T细胞∶CD4+CD25-T细胞=1∶1比例加入CD4+CD25+T细胞,共同培养4 d后,取出分别用PBS洗涤2遍后,进行流式细胞仪检测后,用FLOWJO软件进行再分析并测定对照组、MG组CFSE平均荧光强度。CD4+CD25+T细胞具有抑制CD4+CD25-T细胞增殖的功能,CFSE作为一种绿色荧光素,随着细胞分裂增殖荧光强度平均分配至相应的子代细胞,故细胞增殖越强荧光强度越弱,亦即荧光强度越弱CD4+CD25+T细胞抑制增殖能力越弱。
1.4 统计学处理 以SPSS19.0统计软件进行分析。计量结果以均数±标准差表示。两组间比较采用两个独立样本t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 透射电镜下线粒体自噬情况 MG组线粒体自噬体较对照组减少(P<0.05,表1、图1A),镜下可见MG组线粒体形态异常,相对不均一,线粒体嵴减少或消失,提示可能存在线粒体损伤(图1B)。

表1 两组各项观察指标比较(±s)

图1 透射电镜下两组Treg细胞中自噬体情况比较:3000镜下可见MG组中线粒体自噬体(箭头所示)较正常对照组减少,胞质内含线粒体残片的双层膜结构或已被溶酶体消化后有残留碎片的单层膜结构;8000倍镜下,MG组可见异常线粒体(黑色箭头所示,形态异常多变,线粒体嵴减少或消失)和正常线粒体(白色箭头所示,形态均匀,可见线粒体嵴),而对照组仅见正常线粒体
2.2 两组LC3-Ⅱ表达水平比较 MG组LC3-Ⅱ/GAPDH的相对表达(0.334±0.124)较对照组(0.450±0.137)明显减少(t=-2.413,P<0.05;表1、图2)。
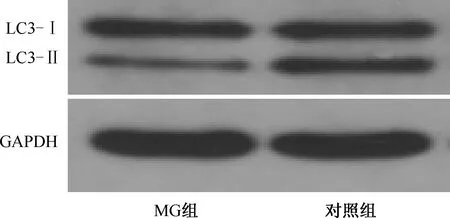
图2 MG组和对照组LC3-Ⅱ表达比较(Western blot)
2.3 两组线粒体相对膜电位比较 对照组线粒体膜电位正常,表现为以红色荧光为主,少量的绿色荧光聚集在线粒体基质中;MG组绿色荧光较对照组增加,相对红色荧光减少(图3)。MG组细胞线粒体相对膜电位(1.726±0.494)明显低于对照组(2.153±0.537,t=2.126,P<0.05)。

图3 两组Treg细胞线粒体膜电位比较(JC-10法×200倍):MG组膜电位低于对照组
2.4 两组CD4+CD25+T细胞对CD4+CD25-T细胞增殖抑制能力比较 CFSE共培养后流式细胞仪检测发现,MG患者平均荧光强度(26.49±5.94,图4A)较对照组(34.82±10.64,图4B)明显下降(t=2.646,P<0.05),即MG组CD4+CD25+T细胞(Treg)增殖抑制能力较对照组减弱。

图4 流式细胞技术检测两组CD4+CD25+T细胞 对CD4+CD25-T细胞增殖抑制能力比较
4 讨论
线粒体自噬作为一种选择性自噬方式,主要为了清除老化、过剩或受损的线粒体,从而构成一个“质量检查站”来阻止年龄相关的紊乱和衰老[9],适时清除受损线粒体,以保持其数量和质量的稳定,对于细胞正常生长和代谢具有非常重要的意义[10-11]。越来越多证据证明线粒体损伤产生的细胞内活性氧(reactive oxygen species,ROS)是各类疾病发生的重要机制,当线粒体自噬不能清除异常线粒体时,将引起ROS的堆积和线粒体毒性物质等释放从而引发细胞死亡。线粒体自噬同样也参与T细胞发育、分化等各个阶段[12]。Stephenson等[13]的研究中发现,在缺乏自噬相关蛋白5(Atg5)的外周血T细胞中线粒体量异常增加,提示自噬在线粒体的维持和T细胞存活中起了关键作用。保持正常的线粒体自噬功能,适时清除多余或受损的线粒体,维持正常的能量代谢,是维持T细胞稳态和正常免疫功能的基础。
线粒体自噬过程分4 个时期[14]:(1)前期线粒体受损后发生通透性转变,线粒体去极化,诱导线粒体自噬相关蛋白活化;(2)早期自噬体包裹受损线粒体,形成线粒体自噬体(mitophagosomes);(3)中期线粒体自噬体与溶酶体融合后形成成熟的线粒体自噬溶酶体(mitolysosomes);(4)末期线粒体被溶酶体降解。而在哺乳动物细胞自噬发生时,有两条泛素样蛋白系统参与自噬体的形成[15],其中之一为LC3参与的修饰过程,是自噬体最终形成必不可少的因素[16],主要有LC3-Ⅰ和LC3-Ⅱ两种形式,LC3-Ⅰ为自噬发生前LC3的形式,而LC3-Ⅱ是在自噬泡的环状双层膜结构闭合后,被修饰加工完成并定位在自噬体膜上的,因此,LC3-Ⅱ含量与自噬发生的程度是成正比关系的。
线粒体因其DNA缺乏组蛋白的保护,且修复机制不健全而易受外源或自身代谢产生ROS的攻击或因其他因素而发生损伤[17],线粒体受损后发生膜通透性转变(mitochondrial permeability transition,MPT),氧化磷酸化解耦联,ATP过度消耗引发细胞坏死,或者线粒体肿胀后细胞色素C释放到细胞质触发凋亡[18]。而线粒体膜电位正是反应线粒体内膜完整性及通透性的指标之一[19]。
本研究发现,MG患者Treg细胞在电镜下可见较多线粒体发生形态学改变,但线粒体自噬的发生却明显减少,通过电镜结果定性鉴定显示,MG患者Treg细胞线粒体自噬发生了异常,不能及时将异常形态的线粒体清除,从而影响细胞功能;另一方面又通过Western Blot定量的方法进一步验证MG患者Treg细胞LC3-Ⅱ表达降低,自噬水平明显下降。而且,MG组Treg细胞线粒体膜电位较正常对照组明显下降。上述结果均提示MG患者Treg细胞确实存在线粒体功能异常。
细胞内线粒体形态功能发生异常,又不能通过线粒体自噬的方式将其清除掉,从而产生大量的ROS及线粒体毒性物质,引发细胞功能障碍或死亡。既往研究表明MG患者存在Treg细胞增殖抑制功能下降[19-21],但导致该细胞此功能异常的原因并不清楚。本实验通过CFSE荧光染料的方法,发现MG患者Treg细胞对CD4+T细胞的增殖抑制能力与对照组相比明显下降,从而说明MG患者Treg细胞功能受损,增殖抑制能力下降,而Treg细胞功能的损伤极可能与线粒体自噬降低,不能将异常的线粒体及时清除,从而产生大量ROS及其他细胞毒性物质,导致Treg细胞损伤有关。本实验结果进一步提示了Treg细胞功能障碍可能与线粒体自噬降低密切相关。
综上,本研究对MG患者Treg细胞存在线粒体自噬降低的情况做了初步的鉴定。对Treg细胞内代谢情况、线粒体自噬发生降低的分子机制、线粒体自噬降低是如何影响其功能等均有待进一步的研究。
[1]Balandina A, Lecart S, Dartevelle P, et al. Functional defect of regulatory CD4(+)CD25+T cells in the thymus of patients with autoimmune myasthenia gravis[J]. Blood, 2005, 105(2): 735-741.
[2]孙延鹏,卢祖能,孙强,等. 重症肌无力胸腺基质淋巴细胞生成素表达与CD4+CD25+Foxp3+Treg细胞表型的研究[J]. 中国神经免疫学和神经病学杂志,2012,19(06): 439-443.
[3]Zhang Y, Wang HB, Chi LJ, et al. The role of FoxP3+CD4+CD25hi Tregs in the pathogenesis of myasthenia gravis[J]. Immunol Lett, 2009, 122(1): 52-57.
[4]Xu WH, Zhang AM, Ren MS, et al. Changes of Treg-associated molecules on CD4+CD25+Treg cells in myasthenia gravis and effects of immunosuppressants[J]. J Clin Immunol, 2012, 32(5): 975-983.
[5]Yang Z, Goronzy JJ, Weyand CM. Autophagy in autoimmune disease[J]. J Mol Med (Berl), 2015, 93(7): 707-717.
[6]Pua HH, Guo J, Komatsu M, et al. Autophagy is essential for mitochondrial clearance in mature T lymphocytes[J]. J Immunol, 2009, 182(7): 4046-4055.
[7]蓝三春,石蕊,张晓颖,等. 人CD4+CD25+调节性T细胞体外扩增研究[J]. 中国免疫学杂志, 2010(10): 913-918.
[8]Ding WX, Yin XM. Mitophagy: mechanisms, pathophy siological roles, and analysis[J]. Biol Chem, 2012, 393(7): 547-564.
[9]Diot A, Morten K, Poulton J. Mitophagy plays a central role in mitochondrial ageing[J]. Mamm Genome, 2016, 27(7-8): 381-395.
[10]Guarente L. Mitochondria—a nexus for aging, calorie restriction, and sirtuins?[J]. Cell, 2008, 132(2): 171-176.
[11]Melser S, Chatelain EH, Lavie J, et al. Rheb regulates mitophagy induced by mitochondrial energetic status[J]. Cell Metab, 2013, 17(5): 719-730.
[12]Bronietzki AW, Schuster M, Schmitz I. Autophagy in T-cell development, activation and differentiation[J]. Immunol Cell Biol, 2015, 93(1): 25-34.
[13]Stephenson LM, Miller BC, Ng A, et al. Identification of Atg5-dependent transcriptional changes and increases in mitochondrial mass in Atg5-deficient T lymphocytes[J]. Autophagy, 2009, 5(5): 625-635.
[14]Klionsky DJ, Abdalla FC, Abeliovich H, et al. Guidelines for the use and interpretation of assays for monitoring autophagy[J]. Autophagy, 2012, 8(4): 445-544.
[15]Kraft C, Peter M, Hofmann K. Selective autophagy: ubiquitin-mediated recognition and beyond[J]. Nat Cell Biol, 2010, 12(9): 836-841.
[16]Tanida I, Ueno T, Kominami E. LC3 and Autophagy[J]. Methods Mol Biol, 2008, 445: 77-88.
[17]Yakes FM, Van Houten B. Mitochondrial DNA damage is more extensive and persists longer than nuclear DNA damage in human cells following oxidative stress[J]. Proc Natl Acad Sci U S A, 1997, 94(2): 514-519.
[18]Lemasters JJ, Nieminen AL, Qian T, et al. The mitochondrial permeability transition in cell death: a common mechanism in necrosis, apoptosis and autophagy[J]. Biochim Biophys Acta, 1998, 1366(1-2): 177-196.
[19]Gottlieb E, Armour SM, Harris MH, et al. Mitochondrial membrane potential regulates matrix configuration and cytochrome c release during apoptosis[J]. Cell Death Differ, 2003, 10(6): 709-717.
[20]Rowin J, Thiruppathi M, Arhebamen E, et al. Granulocyte macrophage colony-stimulating factor treatment of a patient in myasthenic crisis: effects on regulatory T cells[J]. Muscle Nerve, 2012, 46(3): 449-453.
[21]Gertel-Lapter S, Mizrachi K, Berrih-Aknin S, et al. Impairment of regulatory T cells in myasthenia gravis: studies in an experimental model[J]. Autoimmun Rev, 2013, 12(9): 894-903.
[22]Gradolatto A, Nazzal D, Truffault F, et al. Both Treg cells and Tconv cells are defective in the myasthenia gravis thymus: roles of IL-17 and TNF-alpha[J]. J Autoimmun, 2014, 52: 53-63.
(本文编辑:邹晨双)
The abnormal mitophagy of regulatory T cells in peripheral blood of patients with myasthenia gravis
WANGNa,ZOULi,YUANJiang,ZHANGHongyan,TANGLi,WANGYunfu*,LUZuneng#.
*Neurology,TaiheHospitalofHubeiUniversityofMedicine,ShiyanHubei442000,China;#Neurology,RenminHospitalofWuhanUniversity,WuhanHubei430000,China
WANG Yunfu, Emial:wyfymc@163.com;LU Zuneng, Email: 13995672166@126.com
Objective To explore the impact of mitophagy on the function of regulatory T cells (CD4+CD25+regulatory T cell, Treg) in peripheral blood of patients with myasthenia gravis (MG) and the relationship between them. Methods Treg cells were isolated from 15 patients with MG who had not been treated and 15 healthy persons as the normal control, Treg cells were isolated from human PBMCs by using the magnetic separation and were identified by flow cytometry. Mitophagy was detected by transmission electron microscope and the expression of microtubule associated protein light chain 3-Ⅱ(LC3-Ⅱ)was measured by Western Blot, JC-10 fluorescent probe was used to detect the change of mitochondria transmembrane potential, the inhibition of Treg on the proliferation of normal CD4+T cells was detected by using flow cytometry and carboxyfluorescein diacetate succinimidyl ester(CFDA-SE, CFSE). Results Compared with the control group,less mitophagy occured in the MG group detected by transmission electron microscope(25.60±7.81,19.20±5.49,t=-2.596,P<0.05).The expression of LC3-Ⅱ was reduced (0.450±0.137,0.334±0.124,t=-2.413,P<0.05) in the MG group. The mitochondria transmembrane potential of Treg cells(the ration of red fluorescent cells to green fluorescent)was lower(2.153±0.537,1.726±0.494,t=2.126,P<0.05)in the MG group compared with the control group.The average fluorescence intensity of CFSE was lower in MG group(34.82±10.64,26.49±5.94,t=2.646,P<0.05) .Conclusions The mitophagy of Treg cells is reduced in MG patients. This may be related with the decreased proliferation inhibiting function of Treg.
myasthenia gravis;mitophagy;Treg cells
10.3969/j.issn.1006-2963.2017.04.008
国家自然科学基金项目(编号:81671238)
442000湖北医药学院附属十堰市太和医院神经内科(王娜、邹利、袁江、章红妍、唐莉、王云甫);430000 武汉大学人民医院神经内科(卢祖能)
王云甫,Emial:wyfymc@163.com;卢祖能,Email: 13995672166@126.com
R746.1
A
1006-2963(2017)04-0270-06
2016-12-12)
