细胞外信号调节激酶激酶5在肝癌细胞株中的异常表达及其临床意义
2017-09-03郑高云李进军
郑高云,张 岩,李进军
细胞外信号调节激酶激酶5在肝癌细胞株中的异常表达及其临床意义
郑高云,张 岩,李进军
目的:分析细胞外信号调节激酶激酶5(MEK5)在肝癌细胞株中的表达水平及其临床意义。方法:使用实时荧光定量PCR和蛋白印迹法等方法,分别检测肝癌细胞株(HepG2、Huh7)和正常肝细胞株(LO2)中的MEK5表达水平;shRNA转染肝癌细胞致MEK5基因沉默后,检测其对MEK5蛋白表达和细胞增值率的影响。通过t检验对各组进行评估。结果:与MEK5在正常肝细胞株中的蛋白表达(0.8765±0.0031)相比,MEK5在肝癌细胞株中过度表达(HepG2:1.7206±0.0031;HuH7:1.1676±0.0053,P<0.01);与MEK5在非特异性shRNA转染的细胞株中的蛋白表达(HepG2:1.5508±0.0029;HuH7:1.2167± 0.0033)相比,MEK5特异性shRNA转染后细胞株中的蛋白表达(HepG2:0.5339±0.0031;HuH7:0.4639±0.0013)受到显著抑制(P<0.01)。结论:MEK5在肝癌细胞中过度表达;抑制MEK5的表达后,肝癌细胞生长也受到抑制。
细胞外信号调节激酶激酶5;肝癌细胞株;蛋白表达;基因沉默
原发性肝细胞癌(HCC)是恶性程度较高的肿瘤之一,在所有癌症发病率中排名第5位,在全球癌症死亡率中排名第3位[1]。HCC在美国和其他发达国家相对少见[2],大多数发生在乙型肝炎或丙型肝炎感染比较常见的发展中国家,尤其是在中国。随着中国人口增长及老龄化社会的逐渐显现,2015年新诊断的HCC病例仍然处于上升的势头[3]。目前,手术切除和肝移植仍是早期HCC最佳治疗方法。但由于HCC细胞的高侵袭性、肝外转移和化疗抵抗,晚期HCC的预后较差[4]。为此,寻找新的肿瘤标记物和发现新的药物治疗靶点是HCC研究重点所在。
丝裂原活化蛋白激酶(MAPK)家族是哺乳动物细胞内广泛存在的一类介导细胞反应的信号系统,可将细胞外的刺激信号传递至细胞核内。MAPK家族种类较多,细胞外信号调节激酶激酶5(MEK5)是其家族成员之一,是一种丝氨酸/苏氨酸蛋白激酶,普遍地表达于真核生物的多种细胞和组织中[5]。越来越多的文献显示,MAPK通过调节细胞增殖、血管生成、细胞凋亡从而在癌症的发生、发展和治疗中发挥重要作用[6-7]。MEK5位于人染色体15q23,编码444个氨基酸的蛋白质,是MAPK中MEK5-ERK5信号通路的关键激酶[8-9]。MEK5是细胞外信号调节激酶5(ERK5)唯一的上游激酶。MEK5对ERK5有高度特异性,它不会引起MAPK家族的其他成员激活[10]。被MEK5激活的ERK5从胞质移位到细胞核内,才可以将细胞外信号传递到核内。ERK5在胞质内被MEKK-MEK5磷酸化后进入细胞核,发挥调节转录的功能[11]。许多文献表明,多种人类癌症中存在MEK5-ERK5的过度表达或激活,如前列腺癌[12],乳腺癌[13],恶性间皮瘤[14]、白血病[15]和结肠癌[16-17]。同时,MEK5的过度表达已被证明与细胞的增殖与转移相关[18],是癌症患者预后的观察指标。
有研究证明,MEK5-ERK5通路与HCC多重耐药有关[19]。然而,MEK5于HCC发生发展中的作用尚不明确。因此,在本研究中,使用实时荧光定量PCR(RT-qPCR)和蛋白印迹(Western blot)等方法分析了MEK5在HCC细胞株中的表达及其临床意义。
1 材料和方法
1.1 细胞株与细胞培养 两种HCC细胞株(HepG2和Huh7)和正常肝细胞株(LO2)均是从美国模式培养物集存库(ATCC,Mannasas,VA,USA)获得。所有细胞培养基均为DMEM培养基(赛默飞世尔科技公司,Waltham,MA,USA)并添加10%胎牛血清(FBS,赛默飞世尔科技公司,Waltham,MA,USA),培养条件为5%CO2,37℃。
1.2 shRNA转染使MEK5表达沉默 MEK5特异性shRNA和非特异性shRNA是根据文献中的研究方案而设计并合成[18]。shRNA序列如下:MEK5sh1,5'-CCGTTCATCGTGCAGTTCAAT-3';MEK5sh2,5'-GAGAACCAGGTGCTGGTAATT-3'。将shRNA克隆到慢病毒载体pLVX–IRES-Puro(赛业生物科学公司,苏州)中。然后将HCC细胞株HepG2和Huh7细胞接种于密度为5×105cells/well的六孔板,过夜培养直到达到70%~80%汇合度以获得最大的转染效率,采用脂质体2000(Invitrogen公司)将克隆有shRNA的慢病毒载体转染HCC细胞6 d并以嘌呤霉素筛选(1μg/mL,Sigma Aldrich公司,Louis,MO,USA)。细胞分为三组:实验组:用MEK5特异性shRNA慢病毒转染后的细胞;阴性对照组:用非特异性shRNA慢病毒转染后的细胞;空白对照组:未转染的细胞。
1.3 细胞增殖分析 转染48 h后,采用经典的MTT法测定实验组、阴性对照组和空白组的细胞增殖率。将细胞株接种到密度为5000 cells/well的96孔板中并添加20 μL浓度为5 mg/mL的3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT,Sigma-Aldrich公司)于37℃培养4h。用150 μL二甲基亚砜添加到每个孔中以溶解沉淀,并用酶标仪(多功能酶标仪分光荧光计,BioTek Synergy HT,Winooski,VT,USA)测定在490 nm处的吸光度值,从而分别在12 h、24 h、48 h和72 h时得到此三组细胞增值率,实验结果都以均数±标准差的形式统计。
1.4RNA分离和cDNA合成 RNA均是从HCC细胞株和正常肝细胞株中提取,采用Promega SV Total RNA 分离纯化试剂盒(Madison,Wisconsin, USA),并且根据制造商的说明而提取。即:样品和RNA裂解缓冲液混合,再加入RNA稀释缓冲液。离心之后,将上清液转移到新的试管,添加95%乙醇。将溶液转移到RNA提取自旋柱,所有RNA均用RNA洗涤溶液洗脱,并存储在-80℃。使用Nano-Drop 3000超微量分光光度计(赛默飞世尔科技公司)对RNA进行量化分析,根据厂家的说明利用反转录系统(Promega公司)反转录出cDNA。
1.5 实时荧光定量PCR(RT-qPCR) 用以检测HCC细胞株和正常肝细胞株中MEK5 mRNA的表达量。RT-qPCR使用ABI 7300型热循环荧光定量PCR仪(ABI,赛默飞世尔科技公司)和SYBR Green qPCR supermix UDG with ROX kit试剂盒(Invitrogen公司)进行分析。RT-qPCR的优化条件为:95℃进行10 min,然后40转95℃进行15 s,60℃进行1 min。PCR引物:MEK5,正向,5'-CTTTAATGCCTCTCCAGCTTCT-3';反向,5'-CCATCATTGAACTGCACGAT-3';GAPDH,正向,5'-GGGAAACTGTGGCGTGAT-3';反向,5'-GAGTGGGTGTCGCTGTTGA-3'。使用阈值循环(△△CT)方法[20]计算MEK5的相对表达水平,标准化内源性GAPDH的表达。每个样品一式三份进行,并计算平均值。
1.6 Western bolt分析 本研究对HCC细胞株和正常肝细胞株进行了Western blot分析。使用细胞总蛋白提取试剂盒(上海生工生物科技有限公司,中国)从细胞株中提取总蛋白。通过Pierce BCA蛋白测定试剂盒(赛默飞世尔科技公司)测定蛋白浓度。使用Bio-Rad Mini-Protein III系统(100 V,2 h,Hercules,CA,USA)在12%SDS聚丙烯酰胺凝胶上电泳分离等量的蛋白质。于200 mA,在转移缓冲液中的PVDF膜上(GE保健生命科学,马尔堡,美国)转膜50 min。在室温下用5%牛血清白蛋白(BSA,Sigma-Aldrich)封闭膜1 h。将膜与针对MEK5的单克隆抗体(1∶1000,610957,BD转导实验室,San Diego,CA,USA)和β-肌动蛋白(1∶1000,SC47778,圣克鲁斯生物技术有限公司,Dallas,TX,USA)共同温育。应用1∶500稀释度的辣根过氧化物酶标记过的第二抗体(SC516087,圣克鲁斯生物技术有限公司)温育,并使用增强化学发光检测试剂盒(ECL,GE保健生命科学)检测。所有上述程序根据制造商的说明书进行。MEK5的蛋白质表达水平相对于β-肌动蛋白的蛋白表达水平进行标准化。
1.7 统计分析 使用SPSS v.17.0(SPSS,Inc.,Chicago,IL,USA)分析所有实验数据。数据以平均值±标准偏差表示。使用t检验来分析各组之间的MEK5表达情况及细胞增值率的影响。P<0.05表示统计学上存在显著差异。
2 结果
2.1 HCC细胞株中MEK5基因异常表达 通过RT-qPCR和Western blot法测量HCC细胞株HepG2和HuH7和正常肝细胞株LO2中的MEK5表达状态。如图1、图2和表1所示,与正常肝细胞株相比时,MEK5在HCC细胞株中过度表达。
2.2 shRNA转染HCC细胞株后使MEK5基因沉默可抑制细胞增殖 根据MEK5表达水平分析结果,选择具有相对高水平MEK5表达的HCC细胞株HepG2和HuH7,以评估抑制MEK5后对细胞增殖的影响。将MEK5特异性shRNA和非特异shRNA转染到HepG2和HuH7细胞株中。进行RT-qPCR分析以检查shRNA的转染效率。根据图3、图4和表2所示结果,说明 MEK5特异性 shRNA转染后,HepG2和HuH7细胞株中MEK5表达下调。

图1 RT-qPCR分析MEK5在HCC细胞株HepG2和HuH7中的表达

图2 蛋白免疫印迹分析MEK5在HCC细胞株HepG2和HuH7中的表达

表1 MEK5在HCC细胞株HepG2、HuH7及正常肝细胞株LO2中的mRNA和蛋白表达
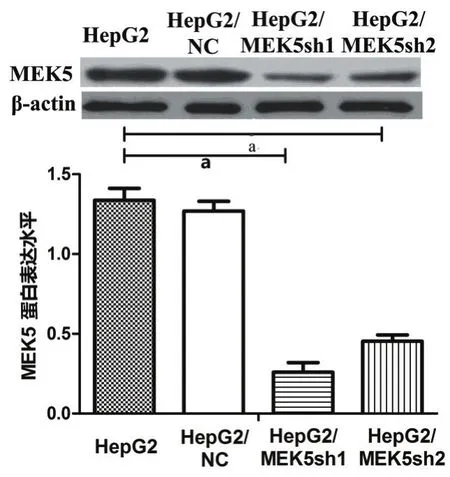
图3 蛋白免疫印迹分析MEK5在用非特异性shRNA和MEK5特异性shRNA转染的HepG2细胞株中的表达

图4 蛋白免疫印迹分析MEK5在用非特异性shRNA和MEK5特异性shRNA转染的HuH7细胞株中的表达
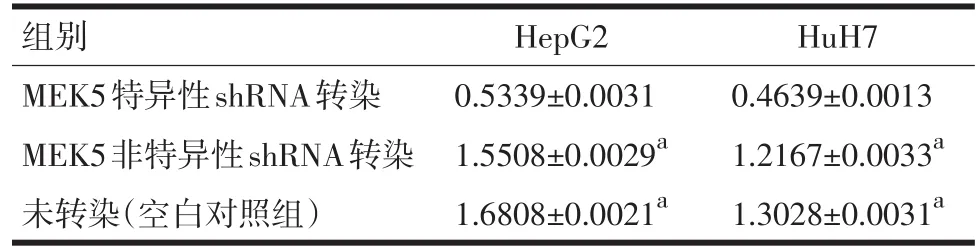
表2 MEK5在MEK5特异性shRNA和非特异性shRNA转染的HepG2、HuH7细胞株中的蛋白表达(平均吸光度A值)
为了研究MEK5表达对细胞增殖的影响,应用MTT法测定shRNA转染与非shRNA转染的细胞株的增殖率。结果表明,与非特异性shRNA转染的那些细胞株相比,MEK5特异性shRNA转染的HepG2和HuH7细胞株的增殖率,在MEK5表达沉默后受到显著抑制(P<0.05,图5和图6)。这些结果证明:MEK5表达受抑制后,HCC细胞株的细胞增殖率明显下降。
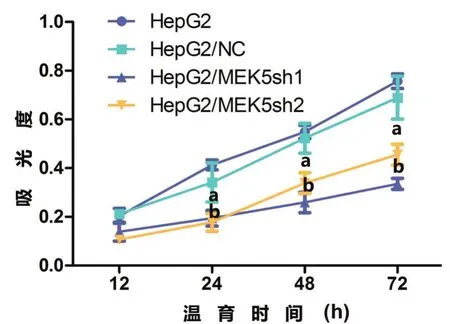
图5 MTT分析用非特异性shRNA和MEK5特异性shRNA转染的HepG2细胞株中的细胞增殖率
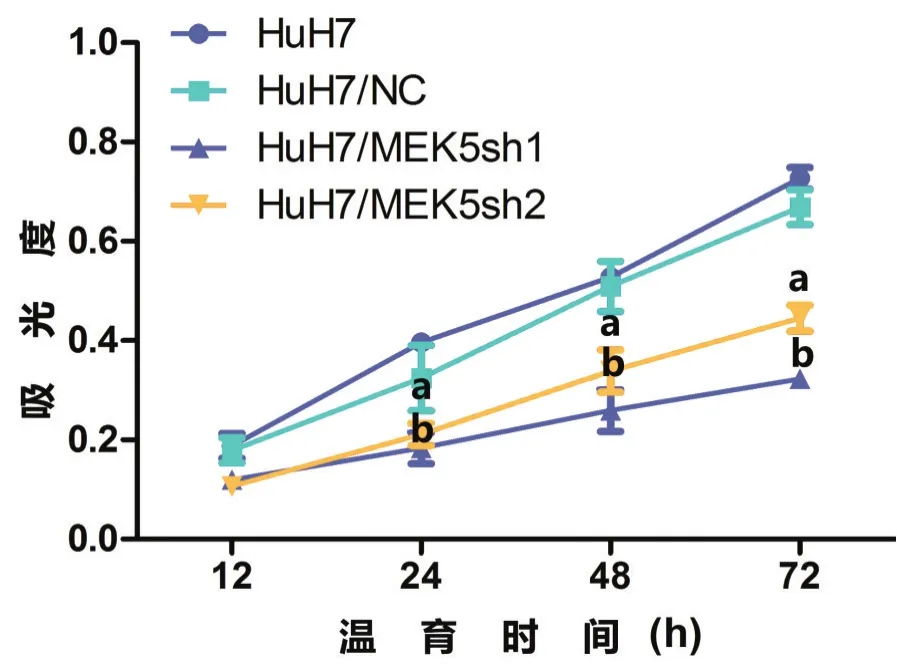
图6 MTT分析用非特异性shRNA和MEK5特异性shRNA转染的HepG2细胞株中的细胞增殖率
3 讨论
HCC是一种常见的恶性肿瘤,每年在全世界造成多达1百万例死亡[2]。虽然HCC患者的生存率由于手术技术的进步而有所改善,但患者的长期存活率仍然很差[2]。这一方面是由于肝癌患者的肝硬化背景;另一方面是由于对肝癌潜在的分子治疗靶点尚未转化为有效的治疗方法,只有索拉非尼是目前被批准用于治疗晚期肝癌的药物。所以我们迫切需要找到新的分子靶点。
既往研究表明,MEK5-ERK5途径在人发育期间调节多种细胞进程[21]。MEK5-ERK5信号通路在许多人类癌症中上调,如前列腺癌[12]、乳腺癌[13]、恶性间皮瘤[14]、白血病[15]和结肠直肠癌[16-17]。在乳腺癌细胞中,研究人员发现激活的癌基因STAT3可以结合MEK5的启动子区域,从而导致基因转录[18]。在转移性前列腺癌中,MEK5的过表达与骨转移相关[22]。然而,没有找到关于MEK5在HCC中的表达的研究报道。因此,为了探讨MEK5在HCC发生和进展中的作用,本研究检测了MEK5在HCC细胞株中的表达状态,并分析了其临床意义。
结果表明,在HCC细胞株中MEK5表达水平异常升高;而MEK5表达受抑制后,HCC细胞株的细胞增殖率明显下降。这从正反两反面得出以下结论:MEK5与HCC的发生和发展密切相关。MEK5-ERK5通路的抑制减少了HCC细胞的增殖,可能的机理是:通过降低蛋白激酶B(AKT)的磷酸化,促使抑癌基因p27和p15的表达增加,原癌基因CCND1的表达降低,从而抑制MEK5-ERK5通路,使处于G0/G1期的细胞比例增加,最终抑制肿瘤细胞增殖[23]。这可能是HCC治疗新的分子靶点。
另外,我们也可以推断:监测HCC患者MEK5的表达水平,可以帮助判断疾病预后。这也是我们下一步的研究方向。
总之,本研究证实了MEK5在HCC细胞株中表达上调;MEK5在HCC细胞株中的表达下调可以抑制细胞增殖。
[1]Lin L,Liang H,Wang Y,et al.MicroRNA-141 inhibits cell prolif⁃eration and invasion and promotes apoptosis by targeting hepato⁃cyte nuclear factor-3β in hepatocellular carcinoma cells[J].BMC Cancer,2014,14(1):879.
[2]Alejandro F,Josep LM,Jordi B.Hepatocellular carcinoma[J].The Lancet,2012,379(9822):1245-1255.
[3]Chen WQ,Zheng RS,Baade PD,et al.Cancer Statistics in China, 2015[J].CA A Cancer Journal for Clinicians,2016,66(2):115-132.
[4]Zhou N,Si ZZ,Li T,et al.Long non-coding RNA CCAT2 func⁃tions as an oncogene in hepatocellular carcinoma,regulating cellu⁃lar proliferation,migration and apoptosis[J].Oncol Lett,2016,12 (1):132-138.
[5]Mehta PB,Jenkins BL,McCarthy L,et al.MEK5 overexpression is associated with metastatic prostate cancer,and stimulates prolifera⁃tion,MMP-9 expression and invasion[J].Oncogene,2003,22(9): 1381-1389.
[6]Kato Y,Tapping RI,Huang S,et al.BMK1/ERK5 is required for cell proliferation induced by epidermal growth factor[J].Nature, 1998,395(6703):713-716.
[7]Creighton CJ,Hilger AM,Murthy S,et al.Activation of mito⁃gen-activated protein kinase in estrogen receptor alpha-positive breast cancer cells in vitro induces an in vivo molecular phenotype of estrogen receptor alpha-negative human breast tumors[J].Can⁃cer Res,2006,66(7):3903-3911.
[8]Zhou G,Bao ZQ,Dixon JE.Components of a new human protein kinase signal transduction pathway[J].J Biol Chem,1995,270 (21):12665-12669.
[9]English JM,Vanderbilt CA,Xu S,et al.Isolation of MEK5 and dif⁃ferential expression of alternatively spliced forms[J].J Biol Chem, 1995,270(48):28897-28902.
[10]Wang X,Tournier C.Regulation of cellular functions by the ERK5 signalling pathway[J].Cell Signal,2006,18(6):753-760.
[11]Rovida E,Maira GD,Tusa I,et al.The mitogen-activated protein ki⁃nase ERK5 regulates the development and growth of hepatocellular carcinoma[J].Gut,2015,64(9):1454-1465.
[12]McCracken SR,Ramsay A,Heer R,et al.Aberrant expression of extracellular signal-regulated kinase 5 in human prostate cancer [J].Oncogene,2008,27(21):2978-2988.
[13]Li Z,Li J,Mo B,et al.Genistein induces cell apoptosis in MDA-MB-231 breast cancer cells via the mitogen-activated pro⁃ tein kinase pathway[J].Toxicol In Vitro,2008,22(7):1749-1753.
[14]Ramos-Nino ME,Blumen SR,Sabo-Attwood T,et al.HGF medi⁃ates cell proliferation of human mesothelioma cells through a PI3K/ MEK5/Fra-1 pathway[J].Am J Respir Cell Mol Biol,2008,38(2): 209-217.
[15]Yang Q,Deng X,Lu B,et al.Pharmacological inhibition of BMK1 suppresses tumor growth through promyelocytic leukemia protein [J].Cancer Cell,2010,18(3):258-267.
[16]Hu B,Ren DL,Su D,et al.Expression of the phosphorylated MEK5 protein is associated with TNM staging of colorectal cancer [J].BMC Cancer,2012,12(1):1-10.
[17]Diao DC,Wang L,Wan J,et al.MEK5 overexpression is associat⁃ed with the occurrence and development of colorectal cancer[J]. BMC Cancer,2016,16(1):302.
[18]Hsieh FC,Cheng G,Lin J.Evaluation of potential Stat3-regulat⁃ed genes in human breast cancer[J].Biochem Bioph Res Co, 2005,335(2):292-299.
[19]Yan F,Wang XM,Pan C:Expression of ERK5 in multidrug-resis⁃tant hepatocellular carcinoma cell line[J].Nan Fang Yi Ke Da Xue Xue Bao,2009,29(3):483-486.
[20]Livak KJ,Schmittgen TD.Analysis of relative gene expression da⁃ta using real-time quantitative PCR and the 2-ΔΔCTmethod[J]. Methods,2001,25(4):402-408.
[21]Yang Q,Lee JD.Targeting the BMK1 MAP kinase pathway in cancer therapy[J].Clin Cancer Res,2011,17(11):3527-3532.
[22]Mehta PB,Jenkins BL,McCarthy L,et al.MEK5 overexpression is associated with metastatic prostate cancer,and stimulates prolif⁃eration,MMP-9 expression and invasion[J].Oncogene,2003,22 (9):1381-1389.
[23]Greer EL,Brunet A.FOXO transcription factors at the interface between longevity and tumor suppression[J].Oncogene 2005,24 (50):7410-7425.
(收稿:2017-03-26 修回:2017-07-20)
(责任编辑 张淑坤 屈振亮)
Expression of Mitogen/extracellular Signal-Regulated Kinase Kinase-5 in Hepatocellular Carcinoma Cell Lines and its Clinical Significance
ZHENG Gao-yun,ZHANG Yan,LI Jin-jun
The Second people's Hospital of Tianjin,Tianjin(300110),China
Objective To analyze the expression of Mitogen/extracellular signal-regulated kinase kinase-5 (MEK5)in hepatocellular carcinoma(HCC)cell lines and investigate its clinical significance. Methods The expression of MEK5 in two HCC cell lines(HepG2 and HuH7)and one normal liver cell line(LO2)was ana⁃lyzed.The protein expression of MEK5 in HepG2 and HuH7 cell lines with MEK5-specific shRNA transfection,non-targeting shRNA transfection and the blank control cells were analyzed. Results The MEK5 expression was up-regulated in HCC cell lines(HepG2:1.7206±0.0031;HuH7:1.1676±0.0053)compared to normal liver cell lines(0.8765±0.0031,P<0.01).The protein expression of MEK5 in HepG2 and HuH7 cell lines were in⁃creased with MEK5-specific shRNA transfection(HepG2:0.5339±0.0031;HuH7:0.4639±0.0013),compared to those with non-targeting shRNA transfection(HepG2:1.5508±0.0029;HuH7:1.2167±0.0033,P< 0.01). Conclusion The MEK5 expression level in HCC cell lines was significantly higher compared to that in the nor⁃mal liver cell lines.The down-regulation of MEK5 could inhibit the cell proliferation of HCC.
MEK5;hepatocellular carcinoma cell line;protein expression;gene silencing
Q555+.7;R735.7
:A
:1007-6948(2017)04-0389-05
10.3969/j.issn.1007-6948.2017.04.014
天津市第二人民医院外科(天津 300110)
郑高云,E-mail:office-zheng@163.com
