血清同型半胱氨酸水平与肝癌病变程度的相关性研究
2017-09-03李仁杰吴磊董成林张宇亮
李仁杰 吴磊 董成林 张宇亮
(1.武汉科技大学医学院生物工程系,武汉 430081;2.上海中冶医院检验科,上海 200941)
血清同型半胱氨酸水平与肝癌病变程度的相关性研究
李仁杰1,2吴磊2董成林2张宇亮2
(1.武汉科技大学医学院生物工程系,武汉 430081;2.上海中冶医院检验科,上海 200941)
目的:研究血清同型半胱氨酸(Hcy)水平与肝癌病变程度的相关性,探讨其临床意义。方法:随机选择肝癌组(n=143)、肝硬化组(n=172),检测两组受试者血清Hcy及肝功能相关指标,并观察肝硬化组不同肝功能Child-pugh分级患者血清Hcy水平变化。结果:肝癌组血清Hcy、ALT、TBIL、GGT、TBA均高于肝硬化组、对照组,其ALB、CHE低于后者,差异有统计学意义(P<0.05),随着肝硬化患者Child-pugh分级的上升,其血清Hcy、ALT、TBIL、GGT、TBA逐渐上升,ALB、CHE逐渐下降,差异有统计学意义(P<0.05)。Pearson相关性分析得出肝癌患者血清Hcy与ALT、TBIL、GGT、TBA呈正相关,与ALB、CHE呈负相关(P<0.05)。肝癌组、肝硬化组治疗后血清Hcy水平均较治疗前下降,但肝癌组血清Hcy水平仍高于肝硬化组,差异有统计学意义(P<0.05)。结论:血清Hcy水平与肝癌患者病变程度存在相关性,据此判断肝癌患者病变程度可为临床治疗与预后评估提供一定参考。
同型半胱氨酸;肝癌;肝硬化;Child-pugh分级;相关性
同型半胱氨酸(Hcy)是蛋氨酸代谢过程中产生的一种含硫氨基酸,其水平升高是独立于高血压、糖尿病、胆固醇等因子之外的动脉粥样硬化、心脑血管疾病重要危险因素之一[1]。肝脏和肾是Hcy的主要代谢器官,故近年来越来越多的患者开始关注血清Hcy水平与肝脏病变的相关性,试图寻找一项敏感指标用于肝功能损害的早期判断,以指导肝脏疾病的诊断与治疗[2]。在总结过往研究的基础上,此次研究就血清Hcy与肝癌病变程度的相关性进行了观察,现报道如下。
1 资料与方法
1.1 研究对象
我院2014年1月至2017年1月就诊患者中随机选择肝癌组(n=143)、肝硬化组(n=172),所有病例均经病理组织学和影像学检查确诊[3]。两组受试者性别、年龄组间差异无统计学意义(P>0.05),具有可比性。本临床研究已征得我院医学伦理委员会批准,并征得受试者知情同意。
1.2 检测方法
抽取受试者入组次日清晨空腹静脉血6 mL,2500 r/ min离心15 min,分离血清,-20℃保存,待测。检测指标包括血清Hcy、谷丙转氨酶(ALT)、总胆红素(TBIL)、谷氨酰转肽酶(GGT)、白蛋白(ALB)、总胆汁酸(TBA)、胆碱酯酶(CHE)[4],以AU5800型全自动生化分析仪(美国BeckmanCoulter公司)检测,试剂盒购自德国Bayer公司。
1.3 观察指标
参照肝功能Child-pugh分级标准[5],将肝硬化组患者分别纳入A级、B级、C即共3个亚组,比较各组受试者血清Hcy及肝功能指标的差别,运用Pearson相关性分析,计算肝癌患者血清Hcy与各项肝功能指标的相关性。于肝硬化组、肝癌组患者治疗后再次检测其血清Hcy水平,观察患者血清Hcy水平在治疗后的变化。
1.4 统计学分析
对本临床研究的所有数据采用SPSS18.0进行分析,性别以(n)表示,并采用χ2检验,血清指标检测结果以表示,并采用t检验,相关性分析采用Pearson法,以P<0.05为差异有统计学意义。
2 结果
2.1 血清指标检测结果
肝癌组血清Hcy、ALT、TBIL、GGT、TBA均高于肝硬化组,其ALB、CHE低于后者,差异有统计学意义(P<0.05),随着肝硬化患者Child-pugh分级的上升,其血清Hcy、ALT、TBIL、GGT、TBA逐渐上升,ALB、CHE 逐渐下降,差异有统计学意义(P<0.05)。见表1。
2.2 相关性分析
Pearson相关性分析示,肝癌患者血清Hcy与ALT、TBIL、GGT、TBA呈正相关,与ALB、CHE呈负相关(P<0.05)。见表2。
表1 各组受试者血清指标检测结果比较

表1 各组受试者血清指标检测结果比较
注:与肝癌组比较,*P<0.05;肝硬化组各亚组组间比较,&P<0.05
指标肝癌组(n=143)肝硬化组(n=172)A级组(n=66)B级组(n=58)C级组(n=48)Hcy (μmol/L)21.49±6.7312.26±2.75*15.64±3.61*18.82±5.47*&ALT(U/L)97.65±15.6848.33±9.54*68.62±14.03*91.36±15.71*&TBIL(μmol/L)77.83±20.0623.71±6.42*31.58±9.64*47.13±11.52*&GGT(U/L)226.94±38.35120.23±19.48*152.47±18.83*175.26±21.40*&ALB(g/L)21.08±5.2736.29±5.54*30.15±4.06*25.82±3.31*&TBA(μmol/L)120.59±14.3822.06±5.71*63.69±14.58*92.37±30.35*&CHE(U/L)2629.58±642.595536.39±1124.08*3737.95±842.35*2526.17±349.64*&

表2 肝癌患者血清Hcy与肝功能相关指标的相关性分析
2.3 治疗前后血清Hcy水平变化
肝癌组、肝硬化组治疗后血清Hcy水平均较治疗前下降,但肝癌组血清Hcy水平仍高于肝硬化组,差异有统计学意义(P<0.05)。见表3。
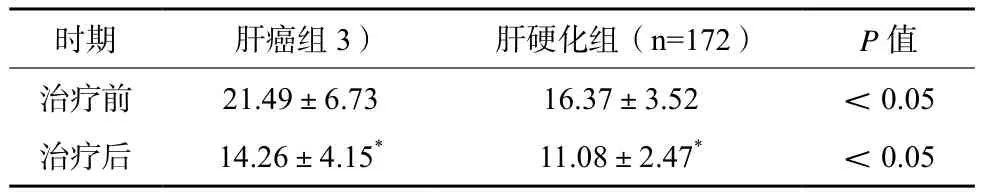
表3 肝癌组、肝硬化组患者治疗前后血清Hcy水平变化比较(μmol/L,x±s)
3 讨论
Hcy是甲硫氨酸脱甲基后的产物,血液内Hcy以蛋白结合型、Hcy-半胱氮酸混合型二硫化物、高胱氨酸、还原型Hcy共4种形式存在[6]。作为甲硫氨酸循环的重要环节及甲硫氨酸代谢的中间产物,Hcy的主要代谢器官为肝脏与肾脏,而得益于肝脏强大的代偿能力,轻微肝脏损伤与病变往往不会表现为血清Hcy的显著改变[7]。因此,一旦血清Hcy升高,即表明肝细胞无法有效处理Hcy代谢,实质细胞受到严重损伤[8]。
本组肝癌患者ALT、TBIL、GGT、TBA高于肝硬化患者,其ALB、CHE低于后者,而肝硬化患者随肝功能分级升高Hcy水平升高,与过往研究一致[9-10]。说明随着肝细胞损伤的逐渐加重,Hcy代谢障碍也随之加剧,故随着肝硬化患者Child-pugh分级的上升,其血清Hcy水平逐渐增高。与肝硬化患者相比,肝癌患者肝脏病变程度更为严重,蛋氨酸代谢改变可导致Hcy水平进一步上升,与此同时,Hcy水平上升还可增强其自身细胞毒机制,造成病变继续进展[11-12]。
通过相关性分析,可以发现,血清Hcy随肝癌患者ALT、TBIL、GGT、TBA的升高而升高,这一结果说明血清Hcy水平与肝癌病变程度的相关性,而肝癌患者病变的进展往往伴随着超氧化物合成增加、酶基因突变等病理生理改变,上述变化可造成肝细胞损伤加重,形成恶性循环,最终导致血清Hcy水平大幅上升[13-14]。也有学者指出,营养不良是肝硬化、肝癌患者的特征性表现[15],而营养不良性贫血、FA缺乏、维生素B12不足均可对体内Hcy代谢造成一定影响[16],因此,血清Hcy水平虽然受多种因素影响,但在反映肝功能损伤程度方面具有较高的敏感性与特异性。
细胞内甲硫氨酸去甲基生成Hcy的代谢途径主要包括3种,一是再甲基化参与甲硫氨酸循环,二是缩合为胱硫醚,γ-胱硫醚酶的催化作用可使胱硫醚进一步裂解为胱氨酸和α-酮丁酸,三是直接释放入细胞外基质内[17]。肝实质细胞的严重损伤,可造成甲硫氨酸再甲基化、缩合及Hcy释放能力增强,加之肝脏对Hcy的清除机制发生障碍,均造成体内大量Hcy蓄积,并表现为血清Hcy水平显著升高[18]。本研究肝癌、肝硬化患者治疗后肝功能有所恢复,肝实质细胞损伤得到一定控制,故其血清Hcy水平均较治疗前下降。
综上所述,血清Hcy水平可反映肝细胞损伤程度,且与肝癌、肝硬化患者肝功能、营养状态具有密切相关性,有望作为一项敏感的血清指标用于肝癌病变程度的判断,以指导临床。
[1] CHANG S C, GOLDSTEIN B Y, MU L, et al. Plasma folate, vitamin b12, and homocysteine and cancers of the esophagus, stomach, and liver in a chinese population[J]. Nutr Cancer, 2015, 67(2): 212-223.
[2] 孙珍珍. 同型半胱氨酸通过内质网应激致肝脂质蓄积作用[D].重庆:重庆医科大学, 2015.
[3] DEMINICE R, DE SOUZA PADILHA C, BORGES F, et al. Resistance exercise prevents impaired homocysteine metabolism and hepatic redox capacity in Walker-256 tumor-bearing male Wistar rats[J]. Nutrition, 2016, 32(10): 1153-1158.
[4] LIANG T J, LIU H, ZHAO X Q, et al. Quantitative assessmentof the association between MTHFR rs1801131 polymorphism and risk of liver cancer[J]. Tumor Biol, 2014, 35(1): 339-343.
[5] 王吉耀. 现代肝病治疗:理论与进展[M]. 上海:上海医科大学出版社, 1999.
[6] FENG X, JIANG J, SHI S, et al. Knockdown of miR-25 increases the sensitivity of liver cancer stem cells to TRAIL-induced apoptosis via PTEN/PI3K/Akt/Bad signaling pathway[J]. Int J Oncol, 2016, 49(6): 2600-2610.
[7] MA H, NING J, JIN X, et al. Betaine homocysteine methyltransferase (BHMT) as a specific and sensitive blood marker for acute liver injury[J]. Biomarkers, 2014, 19(7): 578-584.
[8] POLYZOS S A, KOUNTOURAS J, ANASTASILAKIS A D, et al. Association between circulating irisin and homocysteine in patients with nonalcoholic fatty liver disease[J]. Endocrine, 2015, 49(2): 560-562.
[9] TAYSI S, KELES M, GUMUSTEKIN K, et al. Plasma homocysteine and liver tissue S-adenosylmethionine, S-adenosylhomocysteine status in vitamin B6-deficient rats[J]. Eur Rev Med Pharmacol Sci, 2015, 19(1): 154-160.
[10] 辛敬平, 鲁莉. 原发性肝癌患者血清D-二聚体和同型半胱氨酸检测的临床价值[J]. 血栓与止血学, 2014, 20(1): 33-34.
[11] JIN B, GONG Z, YANG N, et al. Downregulation of betaine homocysteine methyltransferase (BHMT) in hepatocellular carcinoma associates with poor prognosis[J]. Tumor Biol, 2016, 37(5): 5911-5917.
[12] 曾东晓, 张海东, 黄鑫, 等. HBV相关肝病患者血清同型半胱氨酸水平变化的临床价值探讨[J]. 中西医结合肝病杂志, 2016, 26(6): 327-329.
[13] JANSEN E, BEEKHOF P, VIEZELIENE D, et al. Long-term stability of cancer biomarkers in human serum: biomarkers of oxidative stress and redox status, homocysteine, CRP and the enzymes ALT and GGT[J]. Biomarkers, 2015, 9(5): 425-432.
[14] DAY C R, KEMPSON S A. Betaine chemistry, roles, and potential use in liver disease[J]. Biochim Biophys Acta, 2016, 1860(6): 1098-1106.
[15] 刘梅娟, 夏燕飞, 周春兰. 肝硬化患者蛋白营养不良及营养支持的研究现状[C]// 广东肝胆胰疾病防治论坛. 2012.
[16] GUO M, SUN Y, ZHANG X D. Enhanced Radiation Therapy of Gold Nanoparticles in Liver Cancer[J]. Appl Sci, 2017, 7(3): 232.
[17] ZHENG R, ZHAO W, DAI D, et al. Associations between MTHFR Ala222Val polymorphism and risks of hepatitis and hepatitis-related liver cancer: a meta-analysis[J]. Tumor Biol, 2014, 35(2): 1313-1318.
[18] DU Y F, LUO W P, LIN F Y, et al. Dietary choline and betaine intake, choline-metabolising genetic polymorphisms and breast cancer risk: a case–control study in China[J]. Br J Nutr, 2016, 116(6): 961-968.
R446.1
A
2095-5200(2017)04-078-03
10.11876/mimt201704032
李仁杰,本科,检验主管技师,研究方向:检验临床,Email:lirenjie1221@sina.com。
