甲状腺相关性眼病患者TNF-α水平与疾病活动度的相关性研究
2017-09-03张波孟强
张波 孟强
(山东省济宁医学院附属医院内分泌科,山东济宁 272000)
甲状腺相关性眼病患者TNF-α水平与疾病活动度的相关性研究
张波 孟强
(山东省济宁医学院附属医院内分泌科,山东济宁 272000)
目的:分析甲状腺相关性眼病(Thyroid associated ophthalmopathy,TAO)患者肿瘤坏死因子-α(TNF-α)水平与疾病活动度的相关性。方法:选取我院2014年7月至2016年7月收治的65例TAO患者(TAO组)及同期50名健康体检者(NC组)。使用酶联免疫吸附法(ELISA法)检测受试者血清TNF-α水平,以及TAO组接受1个疗程米歇尔方案治疗后血清TNF-α水平变化,并计算血清TNF-α水平与TAO患者临床活动性积分(CAS)、疾病严重度评分(NOSPECS)的相关性。结果:TAO组血清TNF-α水平高于NC组,差异有统计学意义(P<0.05)。65例患者均完成1疗程米歇尔方案治疗,其中36例治疗有效,有效率为55.38%,治疗有效者治疗后血清TNF-α水平低于治疗无效者,差异有统计学意义(P<0.05)。随着TAO患者CAS评分与NOSPECS评分的增加,其血清TNF-α均逐渐上升,差异有统计学意义(P<0.05)。Spearman秩相关分析示,血清TNF-α水平与患者治疗前CAS评分(r=0.608)、NOSPECS评分(r=0.559)均呈正相关(P<0.05)。结论:TAO患者血清TNF-α水平与疾病活动度显著相关,据此实施病情评估与疗效评价有望为TAO的临床治疗提供一定参考。
甲状腺相关性眼病;肿瘤坏死因子-α;疾病活动度;相关性
甲状腺相关性眼病(Thyroid associated ophthalmopathy,TAO)又称Graves眼病,是临床常见眼眶疾病之一,多由免疫因素、遗传因素和外界环境共同引起,其中免疫因素起主导作用[1]。在自身免疫过程中,淋巴细胞发挥了重要作用,而各类细胞因子尤其是肿瘤坏死因子-α(TNF-α)在自身免疫反应的发生发展中扮演了关键角色[2]。因此,探究TAO患者TNF-α水平及其与疾病活动度的相关性,对于进一步了解TAO发病机制、指导更为针对性的治疗方案均有着重要意义[3]。为此,本研究进行了前瞻性对照分析,现作报道如下。
1 资料与方法
1.1 一般资料
入组标准:1)结合临床表现及影像学检查,并参照相关文献标准确诊[4]TAO;2)病程<2年,就诊时处于急性期或亚急性期。排除入组前3个月内有激素及免疫抑制剂使用史者、合并其他免疫性疾病或恶性肿瘤者。2014年7月至2016年7月符合上述标准TAO患者65例,选取同期50名健康体检者作为对照组(NC组)。TAO组男34例,女31例,年龄27~55岁,平均(42.08±11.45)岁,病程3~15个月,平均(6.71±1.83)个月;NC组男26例,女24例,年龄28~55岁,平均(41.39±9.52)岁。2组受试者年龄、性别比例比较,差异无统计学意义(P>0.05),具有可比性。本临床研究已征得我院医学伦理委员会批准,受试者均知情同意并签署知情同意书。
1.2 血清TNF-α检测
抽取受试者入组次日清晨空腹静脉血5 mL,以3000 r/ min离心10 min,将上清液转移至EP管内,-20℃保存备用。使用酶联免疫吸附法(ELISA法)检测血清标本TNF-α吸光度(OD)值,试剂盒购自北京四正柏生物科技有限公司,检测设备包括i2000全自动化学发光免疫分析仪(美国雅培公司)及ANTHOS 2000自动酶标分析仪(英国安图斯公司),根据TNF-α标准品标准浓度曲线及标本OD450值计算标本TNF-α水平[5]。
1.3 分析方法
TAO组患者首次血清样本采集后接受1疗程米歇尔方案治疗,并于治疗后再次检测其血清TNF-α水平。米歇尔方案:强的松口服,每日1次,每次20 mg,每周二、三、五、七饭后服用;地塞米松静脉注射,每周1次,每次20 mg。4周为1疗程。此外,分别于治疗前、治疗后评价患者临床活动性积分(CAS)、疾病严重度评分(NOSPECS),并使用Spearman秩相关分析,计算血清TNF-α水平与TAO患者治疗前CAS、NOSPECS的相关性。CAS评分标准[6]:包括眼球或球后疼痛或压迫感、眼球上下及左右方向运动感疼痛、眼睑充血、眼结膜弥漫性充血、球结膜水肿、眼阜水肿、眼睑水肿、1~3个月内研究突眼度增加≥2 mm、1~3个月内视敏度下降1行、1~3个月内眼球运动在不同方向下降≥5°,共10项症状,各症状存在即记1分,总分0~10分,CAS评分0~2分为无活动,3~6分为轻度活动,7~10分为活动。NOSPECS评分标准参照相关文献[7],共包括6项指标,总分0~18分,NOSPECS评分1~2分为轻度,3~8分为中度,9~18分为重度。
1.4 统计学分析
对本临床研究的所有数据采用SPSS18.0进行分析,性别以n表示,并采用χ2检验,TNF-α水平、CAS评分、NOSPECS评分等计量资料以表示,并采用t检验,以P<0.05为差异有统计学意义。
2 结果
TAO组治疗前血清TNF-α水平(12.18±2.94)ng/mL高于健康NC组的(2.31±0.45)ng/mL,差异有统计学意义(P<0.05)。
65例患者均完成1疗程米歇尔方案,其中36例有效(TAO分级下降),29例治疗无效,有效率为55.38%。有效者与无效者治疗前血清TNF-α水平比较,差异无统计学意义(P>0.05),治疗有效者治疗后血清TNF-α水平低于治疗无效者,差异有统计学意义(P<0.05)。见表1。
表1 治疗有效、治疗无效患者治疗前后血清TNF-α水平变化比较
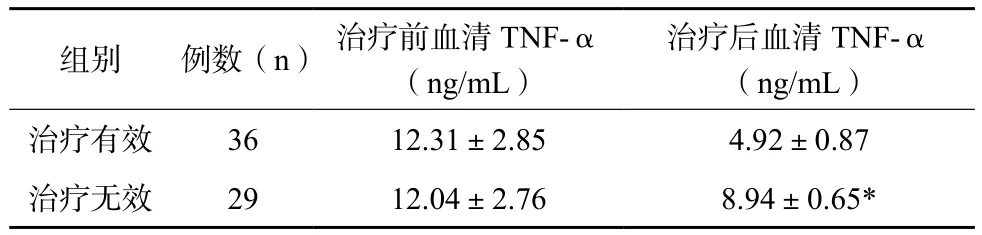
表1 治疗有效、治疗无效患者治疗前后血清TNF-α水平变化比较
注:与治疗有效组比较,*P<0.05
治疗后血清TNF-α(ng/mL)治疗有效3612.31±2.854.92±0.87治疗无效2912.04±2.768.94±0.65*组别例数(n)治疗前血清TNF-α(ng/mL)
随着TAO患者CAS评分与NOSPECS评分的增加,其血清TNF-α均逐渐上升,差异有统计学意义(P<0.05)。见表2。Spearman秩相关分析示,血清TNF-α水平与患者治疗前CAS评分(r=0.608)、NOSPECS评分(r=0.559)均呈正相关(P<0.05)。
表2 不同评分TAO患者治疗前血清TNF-α水平检测结果

表2 不同评分TAO患者治疗前血清TNF-α水平检测结果
注:与轻度组比较,*P<0.05;与中度组比较,#P<0.05
指标例数(n)血清TNF-α(ng/mL)CAS评分无活动(0~2分)0--轻度活动(3~6分)4410.52±1.84活动(7~10分)2116.30±2.57*NOSPECS评分轻度(1~2分)158.82±1.79中度(3~8分)3111.30±1.52*重度(9~18分)1917.64±1.98*#
3 讨论
作为一种器官特异性自身免疫性疾病,TAO发病的影响机制众多,包括性别、吸烟史、家族史、甲状腺炎症、外伤等原因均可诱发TAO的发生与加重,目前临床尚未完全了解该病发病机制,但普遍认为自身免疫性T细胞与B细胞的激活是TAO发病中的必要环节[8-9]。已有研究证实,在TAO的发生发展过程中,多种细胞因子均发挥了重要作用,大部分细胞因子可通过旁分泌或自分泌方式,诱导局部炎症的加剧与扩散,进而引发眼部特征的组织学、解剖学改变[10]。
TNF-α主要由活化的单核巨噬细胞产生,主要以内分泌方式进入血清,结合1型TNF受体p55及2型TNF受体p75,参与全身性免疫应答和炎症反应。既往研究发现,TAO患者眼眶组织中可检出TNF-α,而在正常人群中,眼眶组织未见TNF-α表达[11];同时,有学者认为,TNF-α mRNA表达水平与TAO患者眼外肌肥厚程度关系密切[12]。其机制可能为:作为一种重要炎性介质,TNF-α可诱发眶内结缔组织、成纤维细胞、脂肪细胞增殖,从而引发局部大量HLA-Ⅰ类分子、粘附分子以及干扰素-γ(IFN-γ)、白细胞介素-1(IL-1)等其他细胞因子富集,逐渐引发免疫反应的维持与加强[13]。此外,TNF-α还可刺激眶成纤维细胞糖胺聚糖(GAG)大量生成,也是导致眼肌水肿、眼外肌体积增大、眶内脂肪含量上升等病理生理变化的主要原因,而上述变化的进展可造成TAO患者突眼程度、眼肌肥厚进一步加剧[14-15]。
在治疗前后TNF-α水平变化的对比中,可以发现,无论是治疗有效还是治疗无效的患者,其治疗前TNF-α水平均较高且组间比较差异无统计学意义,但治疗有效者疗程结束后血清TNF-α水平下降更为明显,说明TAO患者血清TNF-α高表达没有特异性,但不同患者对米歇尔方案的应答存在差异,故短期治疗后炎症活跃状态存在差异,并表现为血清TNF-α水平下降程度的不同[16]。
CAS评分主要用于TAO活动度的评估,NOSPECS评分可反映患者眼部症状体征的表现及严重程度[17-18],本研究结果示,血清TNF-α水平与CAS评分、NOSPECS评分呈显著正相关,说明TNF-α能够有效反映眼病活动性,在评价治疗效果、预测预后质量方面具有较高的参考价值。综上所述,TAO患者血清TNF-α水平较高且与疾病活动度存在密切相关,监测患者血清TNF-α水平变化能够指导疗效评估与预后判断,而针对TNF-α的靶向药物研发有望为TAO的治疗提供新的思路。
[1] MATHEIS N, GRUS F H, BREITENFELD M, et al. Proteomics differentiate between thyroid-associated orbitopathy and dry eye syndromeproteomics of tears[J]. Invest Ophthalmol Vis Sci, 2015, 56(4): 2649-2656.
[2] ANTONELLI A, FERRARI S M, CORRADO A, et al. Autoimmune thyroid disorders[J]. Autoimmun Rev, 2015, 14(2): 174-180.
[3] 楚英娜. 甲状腺相关性眼病[D].郑州:郑州大学, 2008.
[4] WU T, MESTER T, GUPTA S, et al. Thyrotropin and CD40L Stimulate Interleukin-12 Expression in Fibrocytes: Implications for Pathogenesis of Thyroid-Associated Ophthalmopathy[J]. Thyroid, 2016, 26(12): 1768-1777.
[5] 曾程程, 魏锐利, 牟旆, 等. 可溶性CD40L促进甲状腺相关性眼病患者眼眶成纤维细胞增殖和透明质酸合成酶表达[J]. 第二军医大学学报, 2015, 36(10): 1138-1142.
[6] NPIANTANIDA E, LAI A, SASSI L, et al. Outcome prediction of treatment of Graves’ hyperthyroidism with antithyroid drugs[J]. Horm Metab Res, 2015, 47(10): 767-772.
[7] 唐喜香, 穆攀伟, 王曼曼, 等. 白细胞介素2、6和17水平与甲状腺相关性眼病患者病情活动度的相关性研究[J]. 中华内分泌代谢杂志, 2015, 31(11): 946-950.
[8] AL-JAMEIL N, KHAN M F, AL-RASHID M, et al. Thyroid dysfunction: an autoimmune aspect[J]. Int J Clin Exp Med, 2015, 8(5): 6677.
[9] NOWAK M, SIEMI■SKA L, KARPE J, et al. Serum concentrations of HGF and IL-8 in patients with active Graves’orbitopathy before and after methylprednisolone therapy[J]. J Endocrinol Invest, 2016, 39(1): 63-72.
[10] 俞丹洋, 刘凤权, 曹芳, 等. 胰岛素样生长因子1受体在甲状腺相关性眼病眼眶脂肪细胞增殖和分化中的作用[J]. 第二军医大学学报, 2016, 37(12): 1488-1494.
[11] KHONG J J, BURDON K P, LU Y, et al. Association of Polymorphisms in MACRO Domain Containing 2 With Thyroid-Associated OrbitopathyThyroid-Associated Orbitopathy[J]. Invest Ophthalmol Vis Sci, 2016, 57(7): 3129-3137.
[12] KHONG J J, WANG L Y, SMYTH G K, et al. Differential Gene Expression Profiling of Orbital Adipose Tissue in Thyroid OrbitopathyGene Expression Profiling of Orbital Tissue in TO[J]. Invest Ophthalmol Vis Sci, 2015, 56(11): 6438-6447.
[13] SMITH T J. Emerging Role of Fibrocytes in the Pathogenesis of Thyroid Eye Disease[M]//Thyroid Eye Disease. Springer New York, 2015: 23-32.
[14] 吕兆琴. 肿瘤坏死因子-α基因-308G/A、-863C/A多态性与甲状腺相关性眼病的相关性研究[D]. 太原:山西医科大学, 2008.
[15] 毛齐彬. 糖皮质激素治疗后TNF--α水平与甲状腺相关性眼病活动度的相关性研究[D]. 杭州:浙江大学, 2015.
[16] ROTONDO DOTTORE G, LEO M, CASINI G, et al. Antioxidant Actions of Selenium in Orbital Fibroblasts: A Basis for the Effects of Selenium in Graves’ Orbitopathy[J]. Thyroid, 2017, 27(2): 271-278.
[17] BAHN R S. Current insights into the pathogenesis of Graves’ophthalmopathy[J]. Horm Metab Res, 2015, 47(10): 773-778.
[18] BERCHNER-PFANNSCHMIDT U, MOSHKELGOSHA S, DIAZ-CANO S, et al. Comparative Assessment of Female Mouse Model of Graves’ Orbitopathy Under Different Environments, Accompanied by Proinflammatory Cytokine and T-Cell Responses to Thyrotropin Hormone Receptor Antigen[J]. Endocrinology, 2016, 157(4): 1673-1682.
R581
A
2095-5200(2017)04-067-03
10.11876/mimt201704028
山东省自然科学基金,编号:ZR2014HL031。
张波,硕士,主治医师,研究方向:内分泌临床,Email:zhangbobo4560@163.com。
