肥胖型多囊卵巢综合征不孕患者内分泌特点
2017-09-03吴秀芳王迎陈琛
吴秀芳 王迎 陈琛
(聊城市东昌府人民医院妇产科,山东聊城 252000)
肥胖型多囊卵巢综合征不孕患者内分泌特点
吴秀芳 王迎 陈琛
(聊城市东昌府人民医院妇产科,山东聊城 252000)
目的:分析肥胖型多囊卵巢综合征(PCOS)不孕患者内分泌特点,探索其治疗思路。方法:155例PCOS不孕患者,按照其体质量指数(BMI),将BMI≥25 kg/m2者纳入肥胖组(n=107),将BMI<25 kg/ m2纳入非肥胖组(n=48),比较两组患者人体测量学指标特征及内分泌特点,并运用Pearson相关性分析,计算BMI与各项内分泌指标的相关性。结果:肥胖组体质量、BMI、腰围、腰臀比均高于非肥胖组,肥胖组SHBG、LH、E2、PO低于非肥胖组,肥胖组TC、TG、FINS高于非肥胖组,差异均有统计学意义(P<0.05)。Pearson相关性分析示,BMI与SHBG、LH、E2、PO均呈负相关,与TC、TG、FINS均呈正相关(P<0.05)。结论:肥胖型PCOS不孕患者内分泌特点以高雄激素水平、胰岛素抵抗为主,且上述变化与肥胖互为因果,针对BMI予以干预治疗,有望改善患者预后。
肥胖;多囊卵巢综合征;不孕;内分泌
多囊卵巢综合征(PCOS)是内分泌紊乱性疾病,以持续无排卵、高雄激素血症、胰岛素抵抗为主要临床特征,也是引起育龄期妇女月经紊乱和无排卵性不孕的主要原因[1-2]。虽然临床对PCOS不孕的发病机制尚不明确,但大量研究发现, 50%~80%的PCOS患者处于超重或肥胖状态,且该类患者治疗与受孕难度更高,受孕后也有着较高的流产风险[3]。因此,了解肥胖型PCOS不孕患者的内分泌特点,有助于了解PCOS的发病机制,为临床诊疗提供新的思路。
1 对象与方法
1.1 研究对象
依据鹿特丹PCOS诊断标准[4]选择2014年7月至2016年10月155例PCOS不孕患者,年龄21~41岁,平均(29.16±4.39)岁,排除合并其他雄激素过多相关疾病者、合并原发性高脂血症或心脑血管疾病者,以及既往有卵巢手术史者、入组前3个月内有激素治疗史者。在征得患者知情同意后,将BMI≥25 kg/m2者纳入肥胖组(n=107),将BMI<25 kg/m2纳入非肥胖组(n=48)。本研究已征得我院医学伦理委员会批准。
1.2 资料采集
抽取患者入组次日空腹静脉血5 mL,以3000 r/min离心10 min,分离血清,使用Immulife 2000化学发光全自动免疫分析仪(德国西门子公司)检测其血清SHBG、DHEAS水平;使用ADVIA Centaur XP化学发光全自动免疫分析仪(德国西门子公司)检测总睾酮(TT)、性激素结合球蛋白(SHBG)、硫酸脱氢表雄酮(DHEAS)、卵泡刺激素(FSH)、促黄体生成素(LH)、雌二醇(E2)、孕酮(PO)、催乳素(PRL)等指标[5]。全自动生化分析仪检测血脂[6]。FINS检测采用放射免疫法[7]。
1.3 统计学分析
运用Pearson法,计算患者BMI与上述指标的相关性,以SPSS18.0进行分析,以P<0.05为差异有统计学意义。
2 结果
2.1 人体测量学指标
肥胖组体质量、BMI、腰围、腰臀比均高于非肥胖组,差异有统计学意义(P<0.05),两组患者身高、臀围比较,差异无统计学意义(P>0.05)。见表1。
表1 两组患者人体测量学指标比较
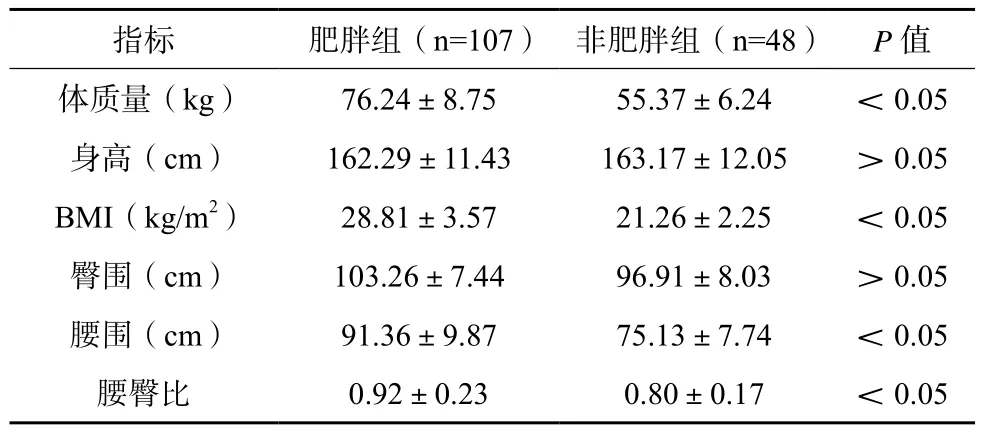
表1 两组患者人体测量学指标比较
指标肥胖组(n=107)非肥胖组(n=48)P值体质量(kg)76.24±8.7555.37±6.24<0.05身高(cm)162.29±11.43163.17±12.05>0.05 BMI(kg/m2)28.81±3.5721.26±2.25<0.05臀围(cm)103.26±7.4496.91±8.03>0.05腰围(cm)91.36±9.8775.13±7.74<0.05腰臀比0.92±0.230.80±0.17<0.05
2.2 性激素及血脂指标比较
肥胖组SHBG、LH、E2、PO低于非肥胖组,差异有统计学意义(P<0.05),两组患者TT、DHEAS、FSH、PRL比较,差异无统计学意义(P>0.05),肥胖组TC、TG、FINS高于非肥胖组,差异有统计学意义(P<0.05),两组患者HDL-C、LDL-C比较,差异无统计学意义(P>0.05),见表2。
2.3 相关性分析
Pearson相关性分析示,BMI与SHBG、LH、E2、PO均呈负相关,与TC、TG、FINS均呈正相关(P<0.05),见表3。
表2 两组指标比较

表2 两组指标比较
指标肥胖组(n=107)非肥胖组(n=48)P值TT(ng/dL)53.03±5.2147.49±4.66>0.05 SHBG(nmol/L)10.31±2.0821.35±4.17<0.05 DHEAS(μg/dL)203.38±39.17216.51±38.84>0.05 FSH(mIU/mL)5.48±0.575.59±0.61>0.05 LH(mIU/mL)9.08±1.3412.70±2.58<0.05 E2(pg/mL)45.02±5.8754.02±7.15<0.05 PO(ng/mL)0.40±0.130.57±0.16<0.05 PRL(ng/mL)9.15±1.8110.39±2.06>0.05 TC(mmol/L)7.02±1.886.05±1.63<0.05 TG(mmol/L)3.16±0.852.50±0.79<0.05 HDL-C(mmol/L)3.13±0.913.07±0.88>0.05 LDL-C(mmol/L)1.16±0.221.20±0.19>0.05 FINS(mIU/mL)16.91±2.3313.35±2.87<0.05

表3 BMI与内分泌指标的相关性分析(r值)
3 讨论
PCOS为育龄妇女人群最常见的内分泌疾病,可导致稀发排卵或不排卵,并引发肥胖、多毛、痤疮、卵巢多囊性改变等病理生理变化[8-9]。此次研究就肥胖型PCOS不孕患者内分泌特点进行了分析,结果表明,与非肥胖患者相比,肥胖患者SHBG、LH、E2、PO均偏低,其原因可能为:1)SHBG又称睾酮-雌激素结合球蛋白或甾体结合蛋白,是肝细胞合成的一种具有激素结合能力的球蛋白,其主要功能为特异性结合、转运性激素,以睾酮为代表的雄性激素可与SHBG结合,借助SHBG的保护作用,雄激素能够避免血管吸附、生物化学破坏及快速降解,并通过游离状态发挥生物学活性。SHBG水平的下降意味着游离睾酮浓度增加,游离睾酮浓度的上升又可影响胰岛素清除,进而诱导肌肉产生胰岛素抵抗,而胰岛素抵抗状态往往使得机体代偿性分泌更多胰岛素,高胰岛素状态对SHBG生成的抑制,可导致一系列恶性循环出现,加剧内分泌紊乱状态,并使得治疗更为棘手[10-12]。2)LH是卵泡发育、成熟及排卵必备的蛋白激素,在激发排卵、促进颗粒粒细胞黄素化、分泌孕激素等环节均扮演着重要角色,其水平下降意味着卵巢内卵泡发育经历的募集、选择、优势化、排卵等一系列环节严重受阻,并可造成多个发育不全的小卵泡停留在各阶段或提前闭锁,从而形成多囊性卵巢形态[13-14]。3)E2主要由卵巢滤泡、黄体及妊娠时胎盘分泌,而低E2水平被认为是卵巢衰退的先兆,并伴随着女性性器官及副性征的发育异常,随着E2水平的降低,患者子宫内膜增生、子宫平滑肌收缩过程受限,是导致PCOS患者月经异常甚至闭锁的主要原因[15],此外,E2水平下降后,其抗雄激素作用无法有效发挥,也是造成PCOS患者总雄激素水平升高的重要原因之一[16]。4)PO的周期性调节功能,对于保证正常月经周期具有重要意义,血清PO水平降低被定义为“PO撤退”,这一变化一方面可弱化抗雄激素作用、影响促排卵环境,另一方面,低水平PO能够显著提高早期流产风险,这也是PCOS不孕患者即便怀孕成功仍具有较高流产风险的可能原因[16-17]。
除激素水平异常外,肥胖型PCOS不孕患者还处于血脂代谢紊乱及伴胰岛素抵抗的高胰岛素血症状态,本研究相关性分析示,肥胖与高雄激素血症、高胰岛素血症及代谢紊乱互为因果,考虑与肥胖引发的卵巢形态学、血流动力学改变可加剧高胰岛素血症、高雄激素血症及糖脂代谢紊乱,而内分泌紊乱状态可进一步影响卵巢形态学与血流动力学有关[18]。
综上所述,与非肥胖型PCOS不孕患者相比,肥胖型患者内分泌特点以高雄激素血症、高胰岛素血症及糖脂代谢紊乱为主,且各因素间互为因果,因此,在改善患者内分泌紊乱的基础上,重视体质量的干预,有望提高患者排卵能力及妊娠率。
[1] SEVER M J, KOCJAN T, PFEIFER M, et al. Short-term combined treatment with liraglutide and metformin leads to significant weight loss in obese women with polycystic ovary syndrome and previous poor response to metformin[J]. Eur J Endocrinol, 2014, 170(3): 451-459.
[2] GAMBINERI A, FANELLI F, TOMASSONI F, et al. Tissuespecific dysregulation of 11β-hydroxysteroid dehydrogenase type 1 in overweight/obese women with polycystic ovary syndrome compared with weight-matched controls[J]. Eur J Endocrinol, 2014, 171(1): 47-57.
[3] 高红艳. 多囊卵巢综合征的体质类型特点及与BMI相关性的流行病学调查研究[D]. 济南:山东中医药大学, 2015.
[4] GLINTBORG D, MUMM H, ALTINOK M L, et al. Adiponectin, interleukin-6, monocyte chemoattractant protein-1, and regional fat mass during 12-month randomized treatment with metformin and/or oral contraceptives in polycystic ovary syndrome[J]. J Endocrinol Invest, 2014, 37(8): 757-764.
[5] GOODMAN N F, COBIN R H, FUTTERWEIT W, et al. American Association of Clinical Endocrinologists, American College of Endocrinology, and Androgen Excess and PCOS Society Disease State Clinical Review: Guide to the Best Practices in the Evaluation and Treatment of Polycystic Ovary Syndrome-Part 2[J]. Endocr Pract, 2015, 21(12): 1415-1426.
[6] PACE J L. The Polycystic Ovary Syndrome and Acne[M]// Pathogenesis and Treatment of Acne and Rosacea. Springer Berlin Heidelberg, 2014: 569-577.
[7] 罗雪娇. 血清胰岛素检测方法的对比分析及临床意义研究[D].上海:上海交通大学, 2009.
[8] SETJI T L, BROWN A J. Polycystic ovary syndrome: update on diagnosis and treatment[J]. Am J Med, 2014, 127(10): 912-919.
[9] LIVADAS S, KOLLIAS A, PANIDIS D, et al. Diverse impacts of aging on insulin resistance in lean and obese women with polycystic ovary syndrome: evidence from 1345 women with the syndrome[J]. Eur J Endocrinol, 2014, 171(3): 301-309.
[10] 王萍, 江钟立, 林枫, 等. 应用肥胖国际功能、失能和健康分类综合核心组合描述肥胖型多囊卵巢综合征的疾病特征[J]. 中华物理医学与康复杂志, 2015, 37(1): 20-23.
[11] CALDERON-MARGALIT R, SISCOVICK D, MERKIN S S, et al. Prospective Association of Polycystic Ovary Syndrome With Coronary Artery Calcification and Carotid-Intima-Media ThicknessSignificance[J]. Arterioscler Thromb Vasc Biol, 2014, 34(12): 2688-2694.
[12] GUPTA A, JAKUBOWICZ D, NESTLER J E. Pioglitazone therapy increases insulin-stimulated release of D-chiro-inositolcontaining inositolphosphoglycan mediator in women with polycystic ovary syndrome[J]. Metab Syndr Relat Disord, 2016, 14(8): 391-396.
[13] 肖卓妮. 卵泡刺激素受体基因与多囊卵巢综合征关系的初步研究[D].武汉:武汉大学, 2004.
[14] LEBLANC S, BATTISTA M C, NOLL C, et al. Angiotensin II type 2 receptor stimulation improves fatty acid ovarian uptake and hyperandrogenemia in an obese rat model of polycystic ovary syndrome[J]. Endocrinology, 2014, 155(9): 3684-3693.
[15] DUMESIC D A, OBERFIELD S E, STENER-VICTORIN E, et al. Scientific statement on the diagnostic criteria, epidemiology, pathophysiology, and molecular genetics of polycystic ovary syndrome[J]. Endocr Rev, 2015, 36(5): 487-525.
[16] KAHAL H, ABOUDA G, RIGBY A S, et al. Glucagon like peptide-1 analogue, liraglutide, improves liver fibrosis markers in obese women with polycystic ovary syndrome and nonalcoholic fatty liver disease[J]. Clin Endocrinol, 2014, 81(4): 523-528.
[17] CASSAR S, TEEDE H J, MORAN L J, et al. Polycystic ovary syndrome and anti-Müllerian hormone: role of insulin resistance, androgens, obesity and gonadotrophins[J]. Clin Endocrinol, 2014, 81(6): 899-906.
[18] PANIDIS D, TZIOMALOS K, PAPADAKIS E, et al. The role of orlistat combined with lifestyle changes in the management of overweight and obese patients with polycystic ovary syndrome[J]. Clin Endocrinol, 2014, 80(3): 432-438.
R711.75
A
2095-5200(2017)04-047-03
10.11876/mimt201704020
吴秀芳,本科,副主任医师,研究方向:妇产科临床,Email:dcfyyzk@163.com。
