金铁锁染色体制片技术研究
2017-09-01辛亚龙唐军荣陈正宇辛培尧
邱 芬,辛亚龙,唐军荣,李 斌,陈 杰,陈正宇,辛培尧*
(1.西南林业大学 云南省高校林木遗传改良与繁育重点实验室,云南 昆明 650224;2.毕节市中药研究所,贵州 毕节551700; 3.西双版纳迪升药业有限责任公司,云南 景洪 666100)
金铁锁染色体制片技术研究
邱 芬1,辛亚龙1,唐军荣1,李 斌1,陈 杰2,陈正宇3,辛培尧1*
(1.西南林业大学 云南省高校林木遗传改良与繁育重点实验室,云南 昆明 650224;2.毕节市中药研究所,贵州 毕节551700; 3.西双版纳迪升药业有限责任公司,云南 景洪 666100)
以金铁锁组培苗根尖为材料,对其染色体制片过程中预处理、固定、解离、染色等环节的最佳处理条件进行探讨。结果表明,金铁锁根尖在室温下用0.003 mol/L 8-羟基喹啉溶液预处理5.0 h后,放入预冷的卡诺固定液[V(无水乙醇)∶V(冰乙酸)=3∶1]中于冰水中处理30 min,然后用解离液[V(浓HCl)∶V(无水乙醇)=1∶1]处理120 s,再用卡宝品红染色液对根尖染色25 min(先染色20 min后复染5 min),能得到良好的镜检效果。金铁锁根尖体细胞的染色体数目为2n=2x=28,为二倍体。
金铁锁; 染色体; 制片技术
金铁锁(PsammosilenetunicoidesW.C.Wu et C.Y.Wu)隶属石竹科(Caryophyllaceae)金铁锁属(Psammosilene),是我国西南地区特有的单种属植物及传统的药用植物,又名独定子、金丝矮陀陀、土人参等。金铁锁主要分布于云南、贵州、西藏等地,出现在横断山脉和金沙江沿岸海拔2 000~3 800 m处[1-3]。喜光照及湿润,适于生长在气温较为温和、年温差较小的环境中,能在-22.4 ℃低温生存,是一种较耐寒而不耐高温的植物[4]。在传统中药理论里,其根具有散瘀定痛、止血、消痈排脓的功效,用于跌打损伤、风湿胃痛、创伤出血等治疗。金铁锁是云南白药的中药成分之一,现已作为稀有濒危物种列于《中国植物红皮书》中,是国家2级保护植物[5-7]。
利用植物染色体制片,对其体细胞染色体直接进行观察、计数以及核型分析,是植物细胞学和遗传学研究的重要手段。然而,在进行这些研究前,必须要获得效果良好的染色体制片。而制片过程中的各处理条件却因所处理植物的不同而存在明显差异。金铁锁染色体制片技术中各个环节的研究对于金铁锁的细胞学及遗传学研究具有重要意义。已有研究以野生金铁锁为材料,对其染色体数目进行了观察和计数,但并未对制片过程中具体的处理条件进行详细说明[8]。鉴于此,以金铁锁组培苗根尖为材料,利用常规染色法,对其染色体制片技术进行优化,为金铁锁的遗传改良工作提供理论依据。
1 材料和方法
1.1 试验材料
试验材料为西南林业大学林木遗传育种实验室培养的金铁锁组培生根苗,截取根尖约1 cm备用。
1.2 试验方法
1.2.1 预处理 将上述备用材料置于0.003 mol/L 8-羟基喹啉溶液中,于室温条件下分别预处理 4.0、4.5、5.0、5.5、6.0 h,观察不同预处理时间对染色体分散和缢缩情况的影响。
1.2.2 固定 将装有卡诺固定液[V(无水乙醇)∶V(冰乙酸)=3∶1]的离心管放入-20 ℃冰箱中预冷5 min,把经过预处理的金铁锁根尖在蒸馏水中浸泡15 min后转入离心管里,然后放入0 ℃的冰箱中处理30 min,处理后的根尖如不立刻使用可以将其放入95%乙醇溶液中浸泡,再置于70%乙醇溶液中保存在4 ℃的冰箱里过渡。
1.2.3 解离 配制解离液[V(浓HCl)∶V(无水乙醇)=1∶1],装入5个离心管中,将固定好的根尖用蒸馏水清洗5~6次或浸泡15 min以上,再将洗好的根尖分别放入装有解离液的离心管解离90、105、120、135、150 s,观察不同解离时间对染色体分散程度和压片效果的影响。
1.2.4 染色 将解离好的根尖用蒸馏水换洗5~6次后置于载玻片上;用手术刀截取根尖前端1~2 mm的部分;然后用滤纸吸去多余的水分,滴加卡宝品红染色液1~2滴,分别染色10 min+5 min(即先染色10 min后复染5 min,下同)、15 min+5 min、20 min+5 min、25 min+5 min、30 min+5 min,观察不同染色时间对染色体染色效果的影响。
1.2.5 镜检 采用常规压片法压片,使用Olympus BX51型显微镜进行观察,选择50个处于细胞分裂中期、染色体分散较好的材料统计染色体数目。
2 结果与分析
2.1 不同预处理时间对金铁锁染色体制片的影响
从表1可以看出,在0.003 mol/L 8-羟基喹啉溶液中处理不同时间,金铁锁根尖细胞染色体分散和缢缩程度有明显的差异。用0.003 mol/L 8-羟基喹啉溶液对金铁锁根尖细胞预处理4.0 h时,染色体分散,收缩不明显,条数不清晰,不能进行数目的统计(图1-a);处理6.0 h时染色体较分散并收缩变短,呈点状,条数模糊(图1-c);处理5.0 h时效果最好,染色体较分散且缢缩地较短,同时还发现个别细胞染色体数目出现加倍现象(图1-b)。

表1 不同预处理时间对金铁锁染色体制片的影响
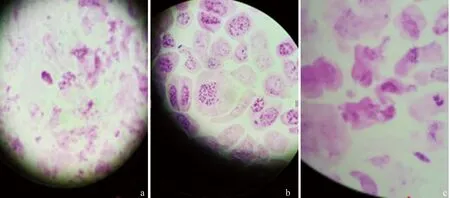
a、b、c:分别预处理4.0、5.0、6.0 h图1 金铁锁染色体制片预处理效果比较
2.2 不同解离时间对金铁锁染色体制片的影响
不同解离时间条件下,根尖软化、细胞分散的效果差异明显(表2)。解离的时间过短,细胞和染色体都不能分散开(图2-a)。随着解离时间的增加,压片越来越容易且细胞和染色体的分散程度越来越好,但当解离时间超过150 s时,压片后的细胞会破碎且细胞的染色体被破坏、溢出细胞外、有杂质,使得镜检时无法统计染色体数目(图2-b)。而使用V(浓HCl)∶V(无水乙醇)=1∶1的解离液解离120 s时解离效果较好,个别细胞的染色体数目还出现加倍现象(图2-c)。

表2 不同解离时间对金铁锁染色体制片效果的影响

a: 细胞不完全分散,染色体聚拢; b: 细胞完全分散,细胞破裂,染色体分散; c: 细胞完全分散,染色体完全分散图2 金铁锁根尖解离的效果
2.3 不同染色时间对金铁锁染色体制片的影响
解离后的根尖材料用卡宝品红进行不同时间的初染和复染(表3)。染色时间过短,染色体不能很好地着色(图3-a),随着染色时间的延长,染色效果逐渐变好,但当染色时间超过30 min(25 min+5 min)时,不但细胞的细胞质和细胞壁染色过深使得对染色体的区分变得困难,而且由于染液干涸沉淀留在细胞中,细胞内可着色的其他杂质也被着色,从而干扰对染色体数目的统计(图3-b)。用卡宝品红对根尖染色20 min+5 min,即先染色20 min后复染5 min时,观察到的细胞染色体条数清晰,得到的染色体的染色效果相对最好,个别细胞染色体数目还出现加倍的现象(图3-c)。

表3 不同染色时间对金铁锁染色体制片效果的影响
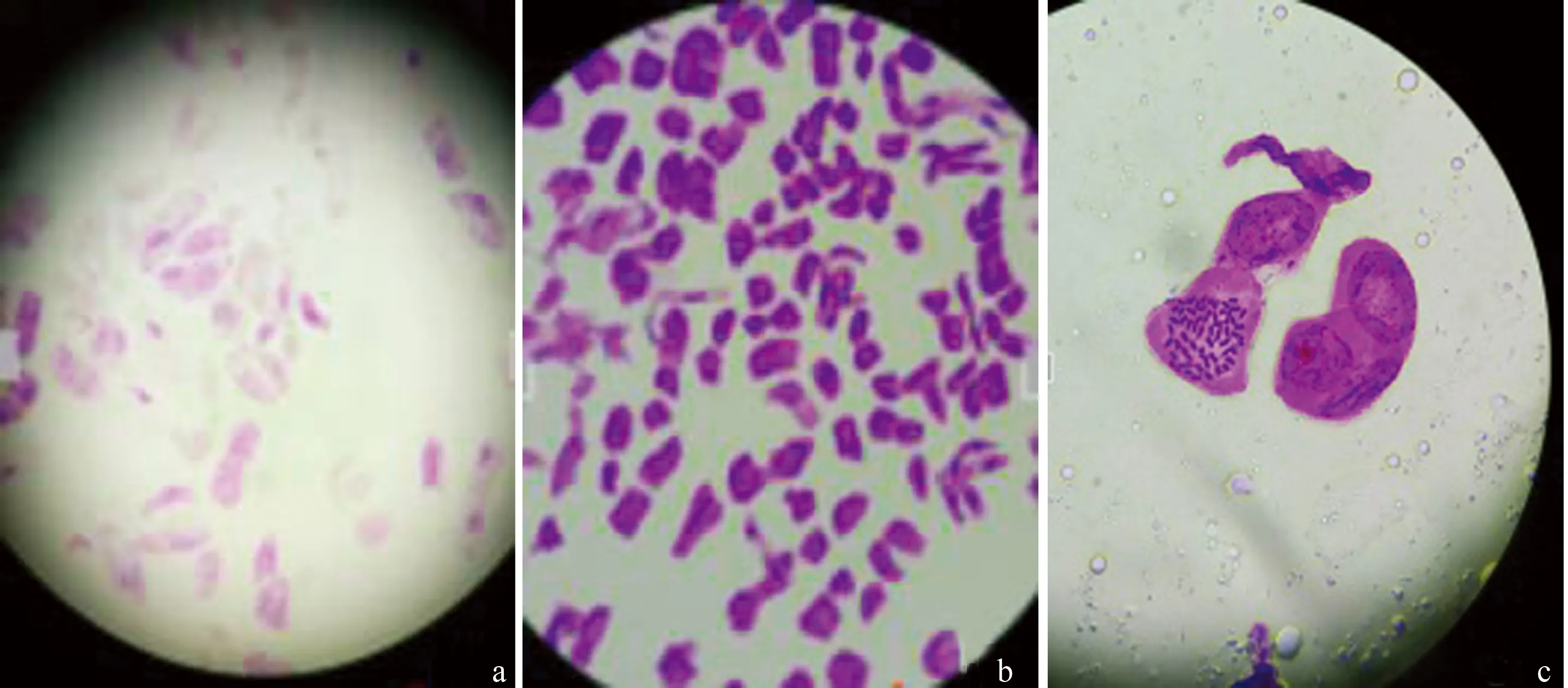
a:染色体着色过浅; b:细胞质、细胞壁和染色体着色过深; c:染色效果较好图3 金铁锁根尖材料染色的效果
2.4 金铁锁染色体数目
利用常规压片法制片,并用显微镜进行计数,选取50个分散较好的细胞进行观察统计。结果表明,金铁锁二倍体根尖细胞的染色体数目为2n=2x=28(图4)。
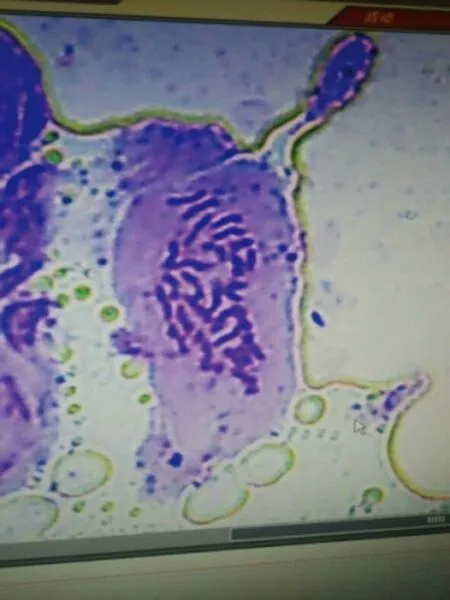
图4 金铁锁根尖体细胞染色体数目
3 结论与讨论
已有的研究表明,在一天中8:00—10:00为一般植物细胞有丝分裂中期的高峰期[9]。本试验材料为组培苗,在恒温培养室内培养,并且组培苗一直处在组织培养的光培养阶段,细胞的分裂不受温度和光照的限制,因此,在光培养的任何时间段内取材均可[10]。
刘永安等[11]认为,为了得到比较可靠的研究结论,至少应该统计30个染色体分散良好的细胞,如果材料的染色体大且数目少,可以适当地少统计一些细胞,如果材料的染色体小且数目多则需要多统计一些细胞,而且只有当所统计的细胞材料中85%以上的细胞具有相同的染色体数目时,才能确定该植物的染色体数目。所以,为了确保结论的可靠性,本试验共统计50个金铁锁根尖细胞的染色体数目。这样做既符合生物学一般的统计学规定,又在一定程度上减少了试验中误差的影响。在染色体制片过程中,发现了个别细胞存在加倍的现象。辛培尧等[12]在进行大麻染色体制片的研究中也发现了这种现象。这是由于材料在进行药物低温预处理过程中,药剂抑制了纺锤丝的形成,从而产生了染色体加倍的现象[13]。
早期的研究将金铁锁划分在石竹科蝇子草属,之后则认为它的亲缘关系与肥皂草属更近[8]。张雷等[14]研究发现,蝇子草属植物染色体基数有多种,即x=6、8、9、10、12、14、15、17,多数为x=12。杨德奎等[15]则认为,肥皂草的染色体数目为2n=28。钱子刚[16]研究表明,金铁锁的染色体基数为x=12,这与本试验的结果有差异。而潘跃芝等[8]通过对金铁锁减数分裂的观察,认为金铁锁染色体数目为2n=2x=28,减数分裂时形成14个二价体,即其染色体基数为x=14,为二倍体,这与本研究的结果相一致。而同一种植物中染色体基数也有可能存在不同,关金枝[17]研究发现,鱼腥草种内染色体基数存在3种情况,即x=8、9、12。舒红锁[18]在对石蒜科石蒜属植物忽地笑不同种源的鉴定研究中发现,种源不同的忽地笑不仅外形有差异,且染色体数目也不同,存在多种情况,即2n=12、13、14、15、16。不同的研究结果存在差异,可能与材料的来源有着较大的关系,其具体原因有待进一步的研究来阐明。
金铁锁应用范围广而资源少。王垄等[19]的研究表明,金铁锁的主要活性成分为皂苷类。金铁锁主要药用部分为根,提高其根内的皂苷成分含量,是其遗传改良的主要目标之一。多倍体植株除具有巨型性的特点外,其营养体内的生物合成量也随倍性的增加而增加[20]。因此,可以通过选育金铁锁多倍体品种提高其药效成分含量。而染色体制片技术是鉴定其倍性是否增加的最直接手段。本研究结果不仅可为金铁锁细胞学及遗传学研究提供理论依据,也可为今后的金铁锁多倍体育种中倍性的鉴定提供实践指导。
[1] 金虹,谭克勤.西南民族药金铁锁的研究现状及展望[J].中医药导报,2005,11(12):66-68.
[2] 谢晖,钱子刚,杨耀文,等.金铁锁居群繁殖生物学初步研究[J].中药材,2003,26(10):702-703.
[3] 朱常成,徐士奎,钱子刚,等.金铁锁的地理分布及分布区的初步分析[J].中国现代应用药学,2007,24(1):28-31.
[4] 杨丽云,陈翠,赵菊,等.金铁锁生态学初步研究[J].中国农学通报,2009,25(18):367-371.
[5] 中华本草编委会.中华本草(第2卷)[M].上海:科学技术出版社,1999.
[6] 中国科学院植物研究所.中国植物红皮书(第一册)[M].北京:科学出版社,1991.
[7] 张洪魁.中国中药资源志要[M].北京:科技出版社,1994.
[8] 潘跃芝,杨志云,龚洵.中国特有植物金铁锁的细胞学研究[J].云南植物研究,2004,26(2):204-206.
[9] 丁鸿,邱东萍,陈少雄.植物染色体标本的制备和染色体核型分析研究进展[J].南方农业学报,2012,43(12):1958-1962.
[10] 林源,唐军荣,张颖,等.无籽刺梨染色体制片技术及染色体数目研究[J].中国南方果树,2015,44(1):76-78.
[11] 刘永安,冯海生,陈志国,等.植物染色体核型分析常用方法概述[J].贵州农业科学,2006,34(1):98-102.
[12] 辛培尧,萧凤回,罗思宝,等.大麻染色体制片技术[J].安徽农业科学,2008,36(1):26,95.
[13] 李懋学,张敩方.植物染色体研究技术[M].哈尔滨:东北林业大学出版社,1991.
[14] 张雷,姚洪庆,吴允鹏,等.麦瓶草的染色体数目观察及核型分析[J].德州学院学报,2015,31(4):80-83.
[15] 杨德奎,周俊英.山东10种植物的核型分析[J].广西植物,1999,19(4):349-354,395-397.
[16] 钱子刚.药用植物金铁锁种质资源研究及其鲨烯合成酶cDNA的克隆[D].昆明:中国科学院昆明植物研究所,2008.
[17] 关金枝.湖北省鱼腥草种质资源的遗传多样性研究[D].武汉:华中农业大学,2010.
[18] 舒红锁.不同种源忽地笑的鉴定[D].南京:南京林业大学,2010.
[19] 王垄,周欣.金铁锁总皂苷含量测定[J].贵州师范大学学报(自然科学版),2012,30(3):4-6.
[20] 萧凤回,郭巧生.药用植物育种学[M].北京:中国林业出版社,2008.
Study on Chromosome Slice Technique ofPsammosilenetunicoides
QIU Fen1,XIN Yalong1,TANG Junrong1,LI Bin1,CHEN Jie2,CHEN Zhengyu3,XIN Peiyao1*
(1.Key Laboratory for Forest Genetic and Tree Improvement & Propagation in Universities of Yunnan Province,Southwest Forestry University,Kunming 650224,China; 2.Bijie Institute of Traditional Chinese Medicine,Bijie 551700,China;3.Xishuangbanna Disheng Pharmaceutical Co.,Ltd.,Jinghong 666100,China)
The root tips of tissue culture seedlings ofPsammosilenetunicoideswere used as materials to find the optimum treatment condition in steps of preculture,fixing,dissociation,and dyeing in slice production process.The results showed that the good microscopic images would be obtained when the root tip ofP.tunicoideswas pretreated with 0.003 mol/L 8-hydroxyquinoline solution for 5.0 hours at room temperature,then put into the Carnoy solution[V(anhydrous ethanol)∶V(glacial acetic acid)=3∶1] and treated with ice water for 30 min,afterwards treated with dissociation solution[V(concentrated HCl)∶V(anhydrous ethanol)=1∶1] for 120 s,and finally dyed with Carbol fuchsin for 25 min(dyed for 20 min and redyed for 5 min).The chromosome number of somatic cell inP.tunicoidesroot tips is 2n=2x=28.It is diploid plant.
Psammosilenetunicoides; chromosome; slice technique
2017-03-24
云南省教育厅科学研究基金项目(2016ZZX152);贵州省社发公关项目(黔科合SY字[2015]3027号);云南省林学一级学科博士点建设项目;西南林业大学科研基金项目(XL21611)
邱 芬(1990-),女,湖北荆州人,在读硕士研究生,研究方向:植物遗传育种与繁育。E-mail:331308230@qq.com
*通讯作者:辛培尧(1975-),男,甘肃临洮人,副教授,博士,主要从事林木遗传育种与繁育研究。E-mail:xpytgyx@163.com
S567.23+9
A
1004-3268(2017)08-0111-05
