红脂大小蠹雄性配偶选择行为及其对生殖的影响
2017-09-01陈海峰
陈海峰
(廊坊师范学院 生命科学学院,河北 廊坊 065000)
红脂大小蠹雄性配偶选择行为及其对生殖的影响
陈海峰
(廊坊师范学院 生命科学学院,河北 廊坊 065000)
为研究红脂大小蠹(Dendroctonusvalens)雄性能否依据信息素对雌性进行选择,以及这种选择行为对生殖的影响,首先使用Y-型嗅觉仪验证这种选择行为,然后用玻璃夹板技术分析雄性对其选择(P)和未选择(NP)的雌性在求偶和交配行为上的差异,最后用木段接种技术研究雄性与P雌性和NP雌性配对后在坑道构筑、产卵和幼虫发育上的差异。结果表明,雄性对雌性有着显著的基于信息素的选择行为。在求偶和交配行为上,雄性对P雌性更易求偶成功,交配时间更长(P<0.05)。当雄性和P雌性配对时,前10 d筑出更长的且更清洁的坑道(P<0.05)。20 d时,P雌性后代中孵化幼虫占后代总数量的比例极显著高于NP雌性(P<0.001)。30 d时,P雌性的幼虫质量极显著高于NP雌性(P<0.001)。以上结果表明,红脂大小蠹存在基于信息素的雄性配偶选择行为,其对生殖产生显著影响。
红脂大小蠹; 配偶选择; 信息素; 求偶; 交配; 生殖
红脂大小蠹(DendroctonusvalensLeConte)是危害油松、白皮松、华山松、樟子松等松科植物的重要外来入侵害虫。据考证,该虫原产于北美洲,20世纪80年代随木材贸易入侵我国[1]。野外种群的性比接近1∶1.02(♂∶♀)[2]。红脂大小蠹主要危害胸径在30 cm以上的成材松树的主干和主、侧根,以及油松的新鲜伐桩,侵入部位多在树干地表基部至1.2 m处[2]。雌性先开始聚集攻击,取食松树韧皮部形成层,并蛀主坑道,筑坑道的同时,将粪屑移出侵入孔外,粪屑含有挥发性信息素,在4~6 d内,吸引雄性过来与雌性配对[2-3]。红脂大小蠹是单配制,并具有双亲关怀[2-4]。在红脂大小蠹的后肠提取物中发现了5种常见的小蠹虫信息素组分,包括反-马鞭草烯醇(trans-verbenol)、顺-马鞭草烯醇(cis-verbenol)、桃金娘烯醇(myrtenol)、桃金娘烯醛(myrtenal)和马鞭草烯酮(verbenone)[5-6],其他信息素,如frontalin、endo-brevicomin也已在红脂大小蠹中被发现[7]。并且,室内试验结果表明,红脂大小蠹能依据信息素进行种间识别和配偶识别[8]。既然信息素在红脂大小蠹的通讯和配对中占据如此重要的地位,而且又是雌性首先聚集攻击,那么雄性很有可能依据雌性的信息素进行配偶选择。如果雄性配偶选择真的如此进化,那么雄性和其选择的雌性进行配对将可能与未被其选择的雌性在求偶、交配和生殖上有着显著不同。基于以上假设,进行了如下试验:(1)雄性是否能够依据雌性的信息素进行配偶选择;(2)雄性是否更愿意与被其选择的雌性交配,其求偶和交配行为动作上有何不同;(3)是否被选择的雌性产生的后代具有更高的适合度。通过这3个试验,探讨红脂大小蠹是否存在雄性配偶选择行为及其对生殖的影响,从而验证达尔文的性选择理论,并为这种重要林业害虫的防治提供理论依据。
1 材料和方法
1.1 试验动物
试验昆虫是用小蠹虫诱捕器于山西省古交市的关帝山国有林经营管理局屯兰川林场(37°48′ N、111°44′ E,平均海拔1 400 m)野外诱捕获得。在红脂大小蠹的扬飞高峰期,于每日16:00—18:00收集诱捕器中的虫子并将雌、雄虫分别放置于饲养盒内。所有虫子带回实验室后,当日测量身体指标:体质量(精确至0.000 1 g)和体长(头部的最前端至鞘翅的尾端,精确至0.02 mm)。由于体质量和体长呈极显著正相关(Pearson相关分析,r=0.891,P<0.001,N=72),因此只取体长作为大小指标。为了消除大小的影响,仅选择体长平均值±标准误在(6.88±0.07)mm(N=427)内的虫子用于试验。
1.2 红脂大小蠹雄性配偶选择行为试验
将野外诱捕的雌性带回实验室后,分别置于离心管内(高12.5 cm、直径2.2 cm,瓶盖上打3个直径1.0~1.5 mm的孔用于通气)。将每5片新鲜油松韧皮(每片11 cm× 0.5 cm× 0.02 cm)置于1个离心管内,用于模仿野外雌性攻击油松。雌性在离心管内取食并构筑坑道36 h后,获得雌性留下的粪屑(即粪便和蛀食颗粒的混合物)。粪屑含有雌性产生的非常重要的挥发性雄性引诱物[5-6]。为了检验雄性配偶选择是否只依据气味,将试验分为2个阶段:第1阶段使用雌性活体,第2阶段使用第1阶段相同雌性的粪屑代替雌性进行试验。
雄性配偶选择试验由Y-型嗅觉仪完成。Y-型嗅觉仪由1个Y-型玻璃管和相应配件(采样仪、流量计、活性炭过滤管等)组成(图1)。通过Y-型嗅觉仪的气流由1个与主茎连接的QC-1型大气采样仪(北京市劳动保护科学研究所)引入,气流最先通过连接于Y-型管两臂末端的活性炭过滤,过滤气流经加湿,进入气味检测腔,再由Y-型管两臂流向主茎。每个气味检测腔与分支臂之间用铁丝网分隔(孔径2 mm)。气流强度由采样仪内置流量计控制,通过Y-型管两臂的气流维持在150 mL/min。为了消除视觉的影响,整个装置用红黑双层布覆盖,试验时覆盖的外层为红布面。

1:雄性释放区域;2:铁丝网;3:气味检测腔(雌性活体或者雌性粪屑);4:活性炭。箭头指示气流方向图1 Y-型嗅觉仪结构
在第1阶段测试时,先将2个雌性分别置于气味检测腔30 min,然后将1个雄性放入主茎的末端。每个雄性给予10 min选择时间。判断其对某一臂选择与否的标准是:当小蠹通过Y-型管两分支臂连接处的距离超过5 cm,则判定其对该臂做出了选择,即小蠹对该腔中的雌性做出了选择行为。被选择的雌性标记为P(preferred),未被选择的雌性标记为NP(non-preferred)。测试完成后,雄性仍停留在主茎或者前进距离没有超过分支臂的1/2长度,视为试验失败。每个组合测试完,Y-型嗅觉仪均需要用丙酮和蒸馏水清洗干净并烘干备用。实验室温度保持在(27±3)℃、相对湿度维持在(60±12)%。总共进行191组试验。第1阶段完成后,将每一个体放回各自离心管静置24 h,进行第2阶段试验。
第2阶段,Y-型嗅觉仪的操作程序与第1阶段相同,但气味检测腔里放置的不再是活体雌性,而是相应第1阶段同组里的2个雌性的粪屑,粪屑在2个分支臂的放置方位与第1阶段相反。试验前,相应雌性的粪屑取自模拟野外蛀道和取食的离心管,用分析天平(精度0.000 1 g)称质量,每个雌性的粪屑称取(100±5)mg用于试验。粪屑称取后,1 h内完成雄性选择试验。第2阶段共进行148组试验。
1.3 红脂大小蠹雄性配偶选择对求偶与交配行为的影响试验
上述试验完成后,随机选取一组中的P或NP雌性,并与同组的雄性组合进行求偶和交配行为试验。使用玻璃夹板法完成。取无色透明玻璃2块,长、宽各25 cm,用药棉醮取95%乙醇进行擦拭消毒,之后用蒸馏水冲洗干净,晾干备用。从野外油松干部(距地面0.5~1.5 m处)采集整块新鲜韧皮,用剪刀剪成略小于玻璃大小(23 cm×23 cm)。在新鲜韧皮中心处用1.5 cm孔径的打孔器打一孔,然后将韧皮夹在2块玻璃之间,并将雌性(P或NP)放于孔中,玻璃夹缝四周用保鲜膜包裹固定,以减少水分散失;同时用针在四侧各均匀扎下6个通气孔。雌性于玻璃夹板中蛀道取食24 h后,将雄性引入孔中,并使用Sony DCR-HC40E数码摄像机录像30 min。记录并分析以下行为:(1)求偶动作;(2)是否交配;(3)交配时间;(4)相遇和离开(即雄性移向雌性,用触角触碰雌性腹部末端,然后离开)发生的频数。共有19个P雌性和17个NP雌性用于本试验。
1.4 红脂大小蠹雄性与P和NP雌性配对后生殖上的差异试验
采用木段接种的方法进行试验。由于粗木段有助于接种成功,因此选取60~70龄油松的基部锯取直径29~35 cm、长70 cm的木段。将木段带回室内后,立即用石蜡密封两端截面,防止水分散失。然后使用打孔器在木段侧面隔30 cm打一圆孔(直径1.9 cm),深达韧皮部,孔深在2 cm左右。直径29~33 cm木段上均匀打孔6个,直径33~35 cm木段上均匀打孔8个。孔与孔的间距保证在30 d内坑道不会在幼虫取食下相互贯通。将1个雌性(P或NP)置于孔中,编号,用订书机将4 cm× 4 cm的铁丝网(孔径2 mm)钉在圆孔口,防止虫子逃脱,24 h后观察接入孔是否有蛀屑出现,如果蛀屑出现,将同组的相应雄性引入接入孔,并将雄性引入的日期视为雌雄配对的第1天。共有49个P雌性和48个NP雌性与雄性进行配对。所有木段垂直竖立放置于实验室内,实验室温度(27±3)℃、相对湿度(60±12)%、光周期12 h /12 h(L/D)。
在雌雄配对后的5、10、20、30 d分别剖开木段。剖木段时,使用特制的改锥,沿接入孔小心扒开树皮,用软毛笔将卵粒和幼虫移至培养皿中。为了测定雌性后代的适合度,观测以下指标:(1)5、10、20 d主坑道和卵室的长度;(2)5、10、20、30 d卵和幼虫的数量;(3)5、10、20 d卵室被粪屑覆盖的比例;(4)30 d幼虫的质量。使用硫酸纸绘出坑道结构,并作出主坑道、卵室和粪屑的标记,使用游标卡尺(0.02 mm)对坑道图进行测量。主坑道长度定义为自接入孔至卵室前端的长度。卵室长度为自主坑道末端至卵室末端的长度,如有分支,合并卵室长度之和。每只雌性的卵和幼虫数量之和作为此雌性后代数量。幼虫质量使用分析天平(精度0.000 1 g)称取。
1.5 数据分析
所有数据均使用SPSS 20.0统计软件分析。在做进一步统计检验前,用Shapiro-Wilk 检验和Levene’s检验分别检验数据的正态性和方差齐次。Y-型嗅觉仪的雌性活体和粪屑的一致性比较使用二项分布检验。雌性体长对雄性配偶选择的影响使用配对样本t检验分析。使用Mann-WhitneyU检验分析雄性求偶行为在P和NP雌性之间的差异。使用独立样本t检验分析P和NP雌性在交配时间上的不同。在卵室清洁(粪屑堵塞)上,使用卡方检验分析雄性与P和NP雌性配对后的区别。各个时间段的卵数量和幼虫数量、质量使用独立样本t检验进行分析。描述性统计值用平均值±标准误表示。统计图由GraphPad Prism 5.0绘制。
2 结果与分析
2.1 红脂大小蠹雄性配偶选择试验结果
在第1阶段,191组Y-型嗅觉仪试验中有148组的雄性做出了选择(二项分布检验:P<0.001)。43组未成功试验中,有11例停留在原地,未作移动;14例进入其中一个分支臂,但未超过5 cm;18例停留在主茎,未进入分支臂。每一组试验中,P雌性体长[(6.86±0.04)mm,N=148]和NP雌性体长[(6.89±0.04)mm,N=148]无显著差异(配对t检验:t147=-1.512,P=0.133)。在第2阶段试验中,139个雄性在选择相应雌性的粪屑上与第1阶段的选择一致,9个雄性选择失败或未作选择(二项分布检验:P<0.001)。以上试验结果表明,雄性能够对雌性进行选择,而且,雄性的配偶选择仅仅是通过信息素。
2.2 红脂大小蠹雄性配偶选择对求偶与交配行为的影响
雄性对P和NP雌性在交配前的求偶动作类型上没有明显差异(图2)。雌雄虫相遇后,通常雄性表现主动,面向雌性并主动靠近雌性,触角抵触雌性腹部末端(排泄孔附近),其动作似雄性在进行气味识别。短暂停留后,雄性或者离开,或者爬上雌性腹部,试图插入阳器交配。离开行为往往发生在雄性与雌性短暂接触后。雄性靠近雌性,爬上雌性腹部后,通常会尝试插入,但经常插入失败,导致交配无法继续进行,这是由于雌性阻止了雄性插入动作(19个P雌性有1个阻止,17个NP雌性有5个阻止)。雌性通过先向后移动,推开雄性,然后向前移动,使雌雄分开,雄性插入失败。如果雄性插入失败,其会继续求偶的系列动作,或者放弃尝试。
19例雄性和P雌性配对的试验中,有18例成功交配(图2A);17例雄性和NP雌性配对的试验中,只有12例成功交配(图2B;Fisher精确检验,P=0.031)。雄性和NP雌性配对中,相遇和离开行为发生的频数明显偏高(雄性和NP雌性配对中有54个离开行为,而雄性和P雌性配对中只有6个离开行为;Mann-WhitneyU检验,P=0.002;图2)。雄性和P雌性的交配时间显著长于与NP雌性的交配时间[P雌性:(3.33±0.22)min,N=18; NP雌性:(2.46±0.19)min,N=12;独立样本t检验:t28=2.543,P=0.017]。
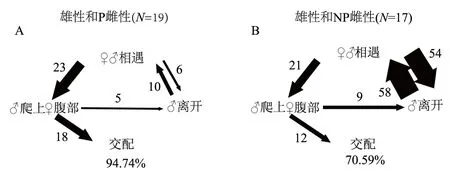
箭头的宽度代表动作转换的频数;A和B图的底部显示交配成功的百分数图2 红脂大小蠹雄性与P雌性(A)、NP雌性(B)求偶动作流程
2.3 红脂大小蠹雄性与P和NP雌性配对后生殖上的差异
木段接种试验中,91.75%(N=89)的雌性在放入接入孔24 h后开始钻蛀(8个雌性未见钻蛀,其中2个P雌性和6个NP雌性)。在接种后5 d和10 d,P雌性和雄性构筑的坑道显著长于NP雌性(表1)。5 d时,66.7%(N=8)的P雌性构筑卵室,只有20%(N=2)的NP雌性构筑卵室(Fisher精确检验:P=0.043)。同种类型的雌雄配对坑道长度在不同树的木段间无显著差异(χ2<2.35,P>0.05),在同一树的不同木段间也无显著差异(χ2=0,P>0.05)。
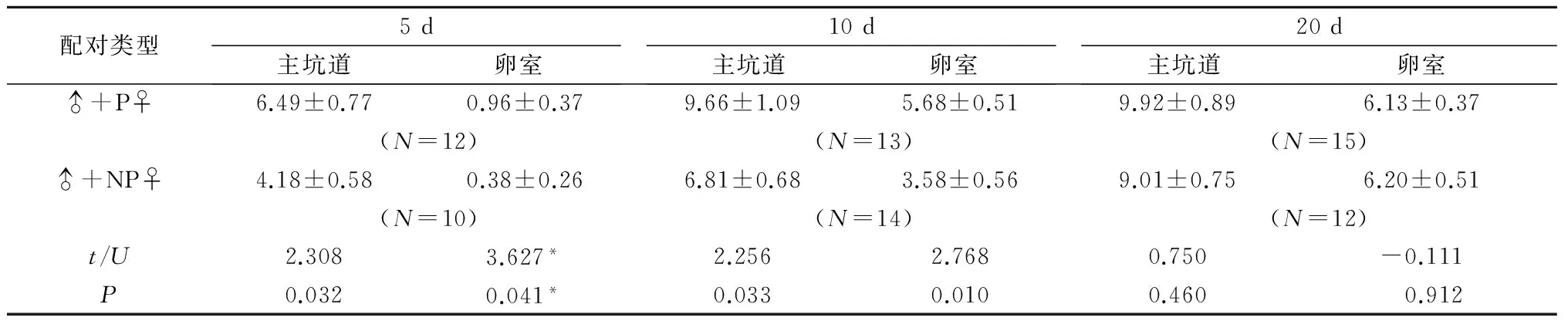
表1 红脂大小蠹雌雄配对5、10、20 d时主坑道和卵室的长度 cm
注:*统计分析基于Mann-WhitneyU检验,其他使用独立样本t检验。
卵室的清洁度在P雌性和NP雌性的坑道中有显著不同。P雌性清洁坑道占总坑道的70.21%(N=33),NP雌性仅占54.76%(N=23)(卡方检验:χ2=3.452,df=1,P=0.043)。在不清洁的坑道里,NP雌性坑道内粪屑阻塞的比例约是P雌性的2倍[P雌性:(23.86±2.55)%,N=14;NP雌性:(46.62±5.97)%,N=19](Mann-WhitneyU检验:U=12.4,N1=14,N2=19,P=0.023)。
在配对5 d和10 d,P雌性比NP雌性产下更多的卵和幼虫(5 d,Mann-WhitneyU检验:U=28,N1=12,N2=10,P=0.027;10 d,独立样本t检验:t25=2.603,P=0.015; 图3)。在配对20 d和30 d时,P雌性和NP雌性的后代数量无显著差异(20 d,独立样本t检验:t25=1.051,P=0.303;30 d,独立样本t检验:t15=0.682,P=0.506)。但是,在配对20 d时,P雌性后代中幼虫的比例极显著高于NP雌性(独立样本t检验:t25=4.864,P<0.001;图4),显示出P雌性的后代发育较快。雌性在配对20 d左右把卵产完(图3)。在配对30 d时,未孵化卵在NP雌性坑道中还存在(6个坑道中有1个),而P雌性坑道中未见卵粒。在配对30 d时,P雌性产生的单个幼虫质量极显著高于NP雌性产生的幼虫(独立样本t检验:t11=-6.188,P<0.001;图5)。幼虫数量和质量在相同类型配对之间无显著差异(F<1.536,P>0.05),
其也未受木段影响(F<5.752,P>0.05)。在配对30 d时,NP雌雄亲本比P雌雄亲本有更高的死亡率(P雌性:28.57%,N=2; NP雌性:83.33%,N=5;Fisher精确检验:P=0.043)。

*表示P≤0.05,图5同图3 红脂大小蠹配对不同时间P雌性和NP雌性产生的后代总数量(卵数+幼虫数)
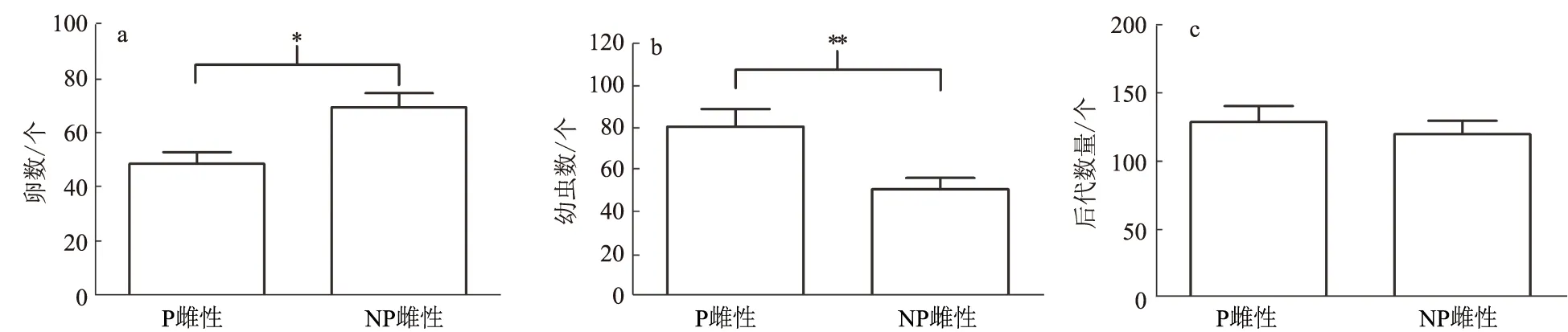
*表示P≤0.05,**表示P≤0.01图4 红脂大小蠹配对20 d时P雌性和NP雌性产生的卵数(a)、幼虫数(b)和后代总数量(c)
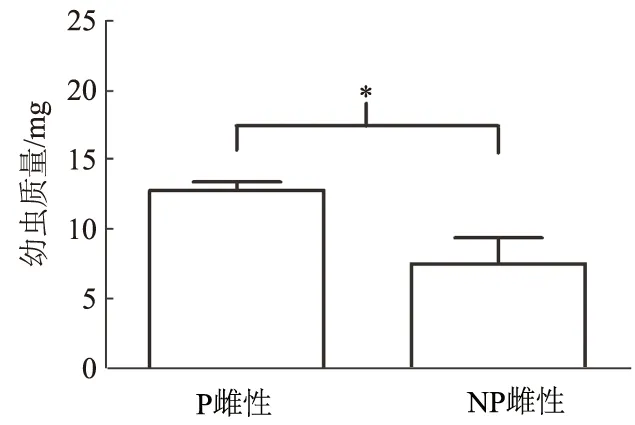
图5 红脂大小蠹配对30 d时P雌性和NP雌性的幼虫质量
3 结论与讨论
本研究结果显示,雄性红脂大小蠹能够利用信息素对雌性进行评价和选择,并且对选择的雌性求偶更顺利、易成功,雄性与被选择的雌性配对后构建坑道较快,坑道更清洁,被选择的雌性产卵更快,后代发育速度也更快,平均体质量更高。
红脂大小蠹雄性配偶选择行为的产生有着多方面的原因。在野外,诱捕器诱捕的红脂大小蠹雌雄性比是1.02∶1,但具体到野外设置的每个木桩上是动态波动的,有效性比在聚集攻击的开始阶段严重偏雌[3],这为雄性配偶选择的产生提供了有利条件。大规模攻击的早期,有效性比偏雌增加了雌性的竞争,而且雄性可以有更多的机会接近未配对的雌性。雄性由于只能与1个雌性配对,所以对雌性的选择也会相对慎重。雄性在交配后,有协助雌性产卵、构筑坑道和清理坑道的行为,其付出很多,这也促使雄性不会轻易与雌性配对,而是选择最优的雌性进行配对。因此,大规模攻击、雌性先筑坑道、有效性比偏雌、单配制以及父系关怀促成了雄性配偶选择的发生。
信息素在雄性配偶选择行为中起重要作用,这是由于雄性在到达被攻击的寄主油松时,无法看见雌性,此时雌性都蛀进韧皮内,而侵入孔外面的粪屑有着雄性可以分辨雌性的信息素。本研究明确了雄性能够分辨雌性活体及粪屑释放的挥发性信息素,并能根据这些信息素进行有效选择。不同个体间的信息素存在变异,很多动物类群可以根据这些变异完成配偶识别。个体间变异可以是定量的(量的不同),也可以是定性的(种类的不同),也可能具有不同的释放速率[9]。在小蠹类中,很多研究表明个体间(雌性或者雄性)信息素的变异很大[10-12]。小蠹每个种类的信息素一般具有固定的几个活性成分[13-14],但一些含量小的次要成分(残留或者前体)[9]也可能在雄性配偶选择中起重要作用。
本研究验证了雄性对P雌性和NP雌性在求偶行为和生殖上有着显著的不同。当雄性和P雌性配对时,前10 d筑出更长的且更清洁的坑道。20 d时,P雌性后代中孵化幼虫占后代总数量的比例极显著高于NP雌性。30 d时,P雌性的幼虫质量显著高于NP雌性。红脂大小蠹的坑道构筑通常在20 d内完成。本试验结果显示,配对的前10 d更为重要,关系到幼虫的适合度。雄性和P雌性构建较长和清洁的坑道,这样就有适宜的环境供雌性产卵和幼虫发育。长的坑道可以减小卵粒的密度,使卵粒孵化后有更多的韧皮资源取食,减轻幼虫间对食物资源的竞争,增加发育速度、存活率和适合度。这种情况对红脂大小蠹这样的r策略昆虫的后代发育很重要,因为寄主油松只有有限的韧皮资源,早孵化和早发育的幼虫能够在不同雌性后代的后期竞争中处于有利地位[15]。
既往的配偶选择研究主要是对个体大小的选择,基于信息素的配偶选择研究近几年才逐渐受到重视,而且相关研究也很少[16]。达尔文的性选择理论将配偶选择着重于雌性对雄性的选择,这也是动物界常见的现象,相关研究也很多,但雄性对雌性的配偶选择研究则少见报道[16]。本研究显示,雄性红脂大小蠹能够利用雌性产生的信息素进行配偶选择,尤其引人注目的是,雄性通过配偶选择在生殖上有着显著不同。鉴于化学通讯在小蠹类中如此重要,推测基于信息素的配偶选择行为在小蠹类中可能较为常见,其他类群的相关研究还需进一步开展。
[1] Yan Z L,Sun J H,Don O,etal.The red turpentine beetle,DendroctonusvalensLeConte(Scolytidae):An exotic invasive pest of pine in China[J].Biodiversity and Conservation,2005,14(7):1735-1760.
[2] 殷惠芬.强大小蠹的简要形态学特征和生物学特征[J].动物分类学报,2000,25(1):120-121.
[3] Smith R H.Red turpentine beetle[J].US Department of Agriculture Forest Pest Leaflet,1971,55(2):1-8.
[4] Kirkendall L R.The evolution of mating systems in bark and ambrosia beetles(Coleoptera:Scolytidae and Platypodidae)[J].Zoological Journal of the Linnean Society,1983,77(4):293-352.
[5] Shi Z H,Sun J H.Quantitative variation and biosynthesis of hindgut volatiles associated with the red turpentine beetle,DendroctonusvalensLeConte,at different attack phases[J].Bulletin of Entomological Research,2010,100(3):273-277.
[6] Zhang L W,Sun J H.Electrophysiological and behavioral responses ofDendroctonusvalens(Coleoptera:Curculionidae:Scolytinae) to candidate pheromone components identified in hindgut extracts[J].Environmental Entomology,2006,35(5):1232-1237.
[7] Liu Z D,Xu B B,Miao Z W,etal.The pheromone frontalin and its dual function in the invasive bark beetleDendroctonusvalens[J].Chemical Senses,2013,38(6):485-495.
[8] Zhang L W,Clarke S R,Sun J H.Electrophysiological and behavioral responses ofDendroctonusvalens(Coleoptera:Curculionidae:Scolytinae) to four bark beetle pheromones[J].Environmental Entomology,2009,38(2):472-477.
[9] Johansson B G,Jones T M.The role of chemical communication in mate choice[J].Biological Reviews,2007,82(2):265-289.
[10] Birgersson G,Schlyter F,Bergström G,etal.Individual variation in aggregation pheromone content of bark beetleIpstypographus[J].Journal of Chemical Ecology,1988,14(9):1737-1761.
[11] Pureswaran D S,Borden J H.Is bigger better? Size and pheromone production in the mountain pine beetle,DendroctonusponderosaeHopkins(Coleoptera:Scolytidae)[J].Journal of Insect Behaviour,2003,16(6):765-782.
[12] Pureswaran D S,Sullivan B T,Ayres M P.Fitness consequences of host selection and pheromone production strategies in a tree-killing bark beetle(Coleoptera:Curculionidae:Scolytinae) [J].Oecologia,2016,148(4):720-728.
[13] Symonds M R E,Elgar M A.The mode of pheromone evolution:Evidence from bark beetles[J].Proceedings of the Royal Society of London Series B(Biological Sciences),2014,271(1541):839-846.
[14] Blomquist G J,Figueroa-Teran R,Aw M,etal.Pheromone production in bark beetles[J].Insect Biochemistry and Molecular Biology,2010,40(10):699-712.
[15] Faccoli M.Breeding performance ofTomicusdestruensat different densities:The effect of intraspecific competition[J].Entomologia Experimentalis et Applicata,2009,132(2):191-199.
[16] Edward D A,Chapman T.The evolution and significance of male mate choice[J].Trends in Ecology & Evolution,2011,26(12):647-654.
Effects of Male Mate Choice on the Reproduction ofDendroctonusvalens
CHEN Haifeng
(Faculty of Life Science,Langfang Teachers University,Langfang 065000,China)
To investigate whether males ofDendroctonusvalenscould choose females according to pheromones,and effects of the selection behavior on reproduction,we used Y-tube olfactometer to validate this selection behavior,and used phloem sandwich experiments to test whether male mate preferences affected courtship displays by allowing males to mate with preferred(P)and nonpreferred(NP)females,respectively.We also used bolt inoculation experiments to validate the differences in egg gallery,oviposition,and larval development when males were paired with P females and NP females,respectively.The results showed that males could choose females based on pheromones.Males paired with P females improved the compatibility of courtship interaction,and the duration of copulation(P<0.05).When males were paired with P females,males and females constructed larger and cleaner galleries during the first 10 days after gallery initiation(P<0.05).P females had an overall higher proportion of larvae to eggs when compared to P females at 20 days(P<0.001),and the larvae of P females also had higher weights at 30 days(P<0.001).In a word,Dendroctonusvalenshad a behavior of male mate choice based on pheromones,which affected reproduction significantly.
Dendroctonusvalens; mate choice; pheromones; courtship; mating; reproduction
2017-01-17
河北省自然科学基金项目(C2014408003);河北省教育厅青年基金项目(QN2014112);廊坊师范学院博士基金项目(LSLQ201403)
陈海峰(1980-),男,安徽淮北人,副教授,博士,主要从事动物行为学研究。E-mail:spiderlab@qq.com
Q968.1
A
1004-3268(2017)08-0077-06
