分子印迹光子晶体凝胶传感器检测食品中的防腐剂
2017-08-31潘彦光黄振坚朱德荣黄艳梅曾青松
顾 航,潘彦光,黄振坚,朱德荣,黄艳梅,曾青松,孙 慧*
(1.广州大学 环境科学与工程学院,广东 广州 510006;2.广东医科大学 药学院,广东 东莞 523808)
分子印迹光子晶体凝胶传感器检测食品中的防腐剂
顾 航1,潘彦光1,黄振坚1,朱德荣2*,黄艳梅1,曾青松1,孙 慧1*
(1.广州大学 环境科学与工程学院,广东 广州 510006;2.广东医科大学 药学院,广东 东莞 523808)
将响应性光子晶体与分子印迹技术相结合,建立了一种反蛋白石结构的分子印迹光子晶体凝胶传感器,并成功用于水果罐头中痕量防腐剂尼泊金乙酯的筛查。该传感器对尼泊金乙酯具有良好的识别能力,抗干扰能力强,对待测物的识别过程可通过光纤光谱仪转化成可读的光学信号,其布拉格衍射峰位移值与尼泊金乙酯浓度呈线性相关,定量下限为83 mg/L,且可重复使用。该检测平台具有便携式特征,无需对样品进行前处理,可准确、灵敏、快捷地检测复杂样品中的目标分析物,适于现场快速筛查和检测。
分子印迹;光子晶体;传感器;尼泊金乙酯
尼泊金乙酯常被作为食品、皮革、制药、化妆品等的防腐剂,但它是一种环境内分泌干扰物,具有雌激素活性,在乳腺癌的产生过程中扮演了重要角色[1-4]。鉴于此类物质的使用日益广泛,人们的暴露机会和接触水平逐渐增加,因此需加强对人群实际暴露剂量和危害效应的监查。目前对实际样品中尼泊金乙酯检测的传统方法有气相色谱法[5]、高效液相色谱法[6-7]、紫外分光光度法[8]等。这些方法或检测灵敏度不高,或需复杂的样品前处理步骤以及大型设备,不适于现场实时、快速检测。因此,建立一种现场快速筛查大量复杂样品中防腐剂的新方法具有重要的理论意义和应用价值。
光子晶体(Photonic crystal,PC)是一种新兴的光学材料,其特征是不同介电常数的介质材料在空间周期性排列,具有光学调控性能[9-10]。分子印迹聚合物(Molecularly imprinted polymers,MIP) 具有与模板分子在空间结构和官能团上互补的孔穴,从而能够对目标化合物进行选择性识别[11-12]。但MIP对模板分子的识别过程不具备自表达特性,因此将MIP对模板分子的识别过程转化为可读信号,使其具有自表达特性十分迫切且必要。将分子印迹技术引入到PC的骨架结构中,所制备的分子印迹光子晶体(MIPC)凝胶具备MIP的特异识别性、构效预定性等特点,也具备PC的三维有序结构。由于MIPC具有特殊的反蛋白石光子晶体结构,在吸收目标化合物后,根据布拉格衍射定律,晶体结构的微变能够引起衍射波长的显著变化,甚至发生颜色改变,这为实现“裸眼检测”提供了可能[13-14]。该技术为光子晶体材料选择性的提高开拓了全新的思路,成为目前非常具有吸引力的新型传感材料,在环境监测、药物分析、毒物分析、临床诊断、病毒检测、产品质量管理、海关安检等诸多方面存在着巨大的应用潜力[15-18]。该方法简单快速、直观,但是不同批次制备的MIPC具有一定差异,需用标准溶液进行校正。
本研究利用分子印迹光子晶体技术,建立了便携式尼泊金乙酯MIPC凝胶传感器,采用便携式光纤光谱仪将特异性识别过程转换为可读的光学信号,并应用于水果罐头中尼泊金乙酯的筛查和检测。本传感器具有足够的灵敏度,可用以初步筛查和检测水果罐头中尼泊金乙酯含量是否超过行业标准,较传统分析方法更为简便、快速、高效,适于现场快速监测。
1 实验部分
1.1 试剂与材料
尼泊金乙酯(模板分子)、甲基丙烯酸(MAA)、正硅酸四乙酯、乙二醇二甲基丙烯酸甲酯(EGDMA)(Aladdin试剂公司);2,2’-偶氮二异丁腈(AIBN,天津市大茂化学试剂厂);乙腈、冰醋酸、甲醇(天津市致远化学试剂有限公司);载玻片(25 mm × 40 mm×1 mm,本地供应商)。
1.2 仪 器
数显恒温水浴锅(HH-1,金坛市杰瑞尔电器有限公司),台式离心机(TDL-60C,广州市深华生物技术有限公司),电热恒温鼓风干燥箱(DGG-9053AD,上海森信实验仪器有限公司),电子天平(BS224S,北京赛多利斯仪器系统有限公司),恒温振荡仪(ZHWY-100B,广州科桥实验技术设备有限公司),数控超声波清洗仪(KH-300DE,昆山禾创超声仪器有限公司),扫描电子显微镜(JSM-7001F,日本电子株式会社),光纤光谱仪(USB2000+,美国海洋光学),恒温恒湿培养箱(WS-01,黄石市恒丰医疗器械有限公司),Agilent 1200 Series 高效液相色谱仪(美国安捷伦科技有限公司)。
1.3 单分散SiO2纳米微球的合成及光子晶体模板的制备
采用改进的 Stöber法制备SiO2纳米微球:在250 mL锥形瓶加入4.5 mL 25%的浓氨水、16.25 mL无水乙醇、24.75 mL超纯水,以1 100 r/min进行磁力搅拌。然后迅速倒入由9 mL 正硅酸乙酯(TEOS)和45.5 mL无水乙醇组成的混合溶液,继续搅拌1 min后,以400 r/min反应2 h。离心生成的SiO2微球溶液,去除上清液,然后加入无水乙醇超声分散,重复上述操作,直至洗净氨水和剩余反应物。加入适量无水乙醇,超声分散备用。
采用垂直沉降自组装法制备三维光子晶体模板:将载玻片裁成10 mm×40 mm规格,浸泡食人鱼溶液(V浓硫酸∶V30%过氧化氢=7∶3) 12 h,用超纯水超声冲洗干净,烘干备用。量取4 mL 2% SiO2分散液至5 mL烧杯后,垂直插入小载玻片。放入恒温恒湿生化培养箱(温度为30 ℃、湿度为45%),乙醇自然挥干后,SiO2排列在载玻片表面,形成具有明显 Bragg 衍射的光子晶体模板。
1.4 尼泊金乙酯MIPC凝胶传感器制备
准确称量0.016 6 g(0.1 mmol)模板分子尼泊金乙酯至2 mL离心管中,加入50 μL甲醇,置于超声仪中超声溶解完全后,依次加入功能单体MAA 42.45 μL(0.5 mmol)、交联剂EGDMA 18.9 μL(0.1 mmol)。避光放置12 h后加入引发剂0.002 g AIBN,通N25 min,即为前驱液。用两片有机玻璃将光子晶体模板夹紧形成“三明治”结构,且使含光子晶体模板端突出1 mm的长度,从下方缓缓注射10 μL前驱液到夹层中,然后放入密闭除氧的玻璃器皿,置于60 ℃反应6 h。然后置于4%氢氟酸中浸泡,使载玻片和有机玻璃分离。有机玻璃上形成反蛋白石结构的分子印迹膜。用甲醇-水-醋酸(3.5∶6∶0.5,体积比)混合溶液反复洗脱模板分子,直至检测不到尼泊金乙酯。制备非印迹光子晶体(NMIPC)传感器的步骤与上述过程一致,只是预聚液不加入模板分子。
1.5 MIPC响应条件的优化
1.5.1 洗脱液的选择 以甲醇-水-醋酸为洗脱液,设置其体积比分别为9∶0∶1、4∶5∶1、3.5∶ 6∶0.5和2.5∶7∶0.5,分别记为1#~4# 洗脱液。分别取5 mL,加入0.016 6 g尼泊金乙酯,观察其溶解情况;并考察4种洗脱液的洗脱效果。
1.5.2 测试溶液中甲醇浓度的影响 分别配制尼泊金乙酯浓度为0.01 mol/L,而甲醇体积分数为10%、15%、20%、25%与30%的系列溶液。将MIPC依次插入各溶液吸附10 min,晾干,用光纤光谱仪记录Bragg衍射峰数据。
1.5.3 pH值对传感性能的影响 用磷酸缓冲溶液分别配制pH 4.0~8.0、尼泊金乙酯浓度为0.01 mol/L,甲醇体积分数为20%的系列溶液。将MIPC依次插入各溶液吸附10 min,晾干,测Bragg衍射峰数据。
1.5.4 温度的影响 配制成甲醇体积分数为20%,浓度为0.015 mol/L尼泊金乙酯溶液,水浴加热使其温度依次为20、25、30、35、40 ℃,将MIPC依次插入各溶液吸附10 min,晾干,测Bragg衍射峰数据。
1.6 MIPC传感器的选择性
分别用2-羟基异丁酸、苯佐卡因、 普鲁卡因和尼泊金乙酯配制成浓度为0.01 mol/L,甲醇体积分数为20%的标准溶液。将MIPC依次插入各溶液吸附10 min,晾干,测Bragg衍射峰数据。
1.7 水果罐头中尼泊金乙酯的测定
取水果罐头汁液,加适量甲醇稀释后,将MIPC依次插入各溶液吸附10 min,晾干,用光纤光谱仪记录Bragg衍射峰数据。
2 结果与讨论
2.1 单分散SiO2纳米微球的合成以及光子晶体模板的制备

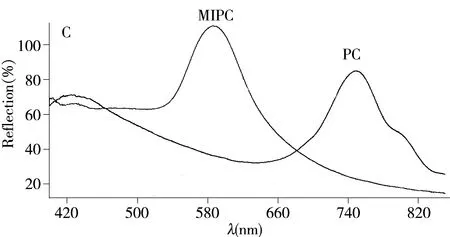
图1 PC(A)、MIPC(B)的SEM表征及光学衍射图(C)Fig.1 SEM of PC(A),MIPC(B) and their diffraction spectra(C)
为了实现裸眼检测,MIPC吸附目标分子所引起的衍射峰变化需在可见光区域。胶体微球的大小、单分散性和球形度等性质均影响自组装成光子晶体的质量,进而决定着印迹凝胶膜的检测效果。本研究采用改进的Stöber法制备出了单分散性好、球形度高的SiO2微球,粒径约为353 nm。图1A为垂直沉降法制备出的光子晶体(PC)的扫描电镜图像。由图可见,SiO2微球粒径大小均一,规整地排列在同一个平面上,呈现面心立方紧密堆积的蛋白石结构。除去SiO2和模板分子后得到了反蛋白石结构的MIPC,其反蛋白石结构的孔穴仍然保持规整的面心立方排布(图1B)。由图1C可以看出,光子晶体(PC)衍射峰位于748 nm;当制成反蛋白石结构的MIPC后,由于孔穴收缩,衍射峰位于586 nm,恰好处于两个光区(黄-绿)的分界处。当待测物吸附到MIPC,并引起衍射峰发生位移时,则很容易出现颜色的变化,从而可实现裸眼检测。
2.2 MIPC传感器响应条件的优化
合适的洗脱液应对模板分子具有足够的溶解度,且经多次洗脱MIPC凝胶后,光子晶体凝胶不出现龟裂。目前在分子印迹领域中最常用的洗脱液为醋酸-甲醇(体积比1∶9),但此洗脱液会造成凝胶传感器和有机玻璃片的龟裂。对比了“1.5.1”所述4组洗脱液的效果,发现1#、2#、3#洗脱液均可将预聚液中的模板分子完全溶解,但1#和2# 会使分子印迹传感器产生不同程度的裂痕,其中1# 最为严重。由于光子晶体的有序结构被严重破坏,随着洗脱次数的增加,Bragg衍射信号会急剧减弱甚至反射峰消失,从而影响传感器的重复使用性能。因此,实验最终选择3# 洗脱液,即甲醇-水-醋酸溶液(体积比3.5∶6∶0.5),该溶液可将模板分子有效洗脱,且不会造成凝胶传感器和有机玻璃片的龟裂。随着洗脱的进行,印迹分子不断被洗脱下来,MIPC孔径逐渐缩小,根据布拉格方程,衍射峰发生蓝移Bragg(图2)。
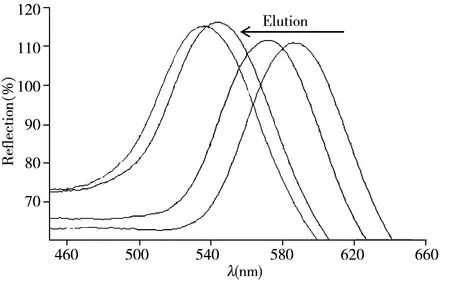
图2 MIPC凝胶Bragg衍射峰随洗脱次数的变化Fig.2 Optical response of MIPC upon elution
实验结果显示,样品中的甲醇浓度对MIPC响应效果有很大影响。当尼泊金乙酯溶液(0.01 mol/L)中不含甲醇时,MIPC对尼泊金乙酯几乎不吸附;随着甲醇体积分数的增大,MIPC的Bragg衍射峰发生红移,说明传感器的吸附量不断增大;当甲醇体积分数增至20%~25%之间时,传感器的吸附量不再增加;甲醇达到30%后,吸附量反而下降。分析原因,当样品溶液中水含量较高时,尼泊金乙酯与功能单体之间的氢键作用力较弱,导致凝胶对尼泊金乙酯的吸附能力较低,所以Bragg衍射峰不发生改变;另一方面,本研究在制备MIP时用甲醇作为致孔剂,所以在样品溶液中适当增加甲醇含量,会提高凝胶对尼泊金乙酯的吸附能力;但甲醇含量过高时,一部分尼泊金乙酯从凝胶中溶解出来,反而导致吸附量下降。因此实验选择样品溶液中甲醇体积分数为20%。而对于空白样品,不论是否加入甲醇,Bragg衍射峰均不发生位移,说明甲醇不会引起其Bragg衍射峰的改变。
保持尼泊金乙酯溶液浓度为0.01 mol/L,考察pH值对MIPC传感器的影响。结果显示,当pH值从4.0升至5.5时,Bragg衍射峰位移值增加,说明MIPC对尼泊金乙酯的吸附量不断增大; pH值超过 5.5时,Bragg衍射峰位移值略有减小。说明弱酸性溶液中,功能单体与模板分子之间的氢键与离子键的协同作用较明显,MIPC对模板分子的吸附能力较强,所以Bragg衍射峰位移较明显。随着pH值的增大,功能单体MAA的解离程度增加,氢键作用力减弱,因此Bragg衍射峰位移减少。
考察了温度对MIPC识别性能的影响。结果表明,在20~30 ℃时,MIPC对尼泊金乙酯的吸附效果基本相同,Bragg衍射峰位置相近;继续升高温度,衍射峰位移逐渐减小;当温度高于60 ℃,Bragg衍射现象消失。推测当温度高于30 ℃时,一方面光子晶体发生不规则溶胀现象,晶格结构变形;另一方面,在高温下识别位点与尼泊金乙酯分子之间的氢键作用力减弱,所以由吸附引起的Bragg衍射位移现象减弱;温度达60 ℃时,Bragg衍射发生了不可逆转的消失现象,推测反蛋白石光子晶体表面发生了形变,光子晶体的有序结构被破坏。因此MIPC传感器的使用温度在20~30 ℃之间。
2.3 MIPC传感性能的研究
将MIPC浸泡在不同浓度的尼泊金乙酯溶液中,晾干后,用光纤光谱仪检测光谱图。结果显示,随着浓度升高,MIPC 传感器的Bragg衍射峰发生红移,说明吸附量逐渐增高,MIPC三维有序孔状结构的晶格参数发生变化。由浓度差形成Donnan势,驱使尼泊金乙酯涌入MIPC凝胶并填充印迹孔穴;尼泊金乙酯的羟基与识别位点上的羧基相互作用,使得凝胶孔穴内部的离子强度增大,导致光子晶体水凝胶的晶格结构膨胀,从而使Bragg衍射峰红移[19]。在0.000 5~0.015 mol/L浓度范围内,Bragg衍射位移值(y)随尼泊金乙酯浓度(x,mol/L)变化,线性方程为y=3.045 6+1.602 9x,相关系数(r)为0.993 6。考虑到样品基质或测量仪器的噪音可能引起的Bragg衍射位移误差,实验设定Bragg衍射位移3 nm为最小检出值,根据线性方程计算得到该MIPC的定量下限为0.000 5 mol/L(83 mg/L)。
MIPC传感器应具有可逆的溶胀-收缩弹性,方能将模板分子的识别/洗脱过程转化为可逆的光学信号。通过优化制备条件,当模板分子、功能单体及交联剂的摩尔比为1∶5∶1时,可以制备出柔韧性良好,凝胶网络骨架结构稳定,以及容易再生,并能重复使用的MIPC凝胶。循环使用同一MIPC检测0.015 mol/L的尼泊金乙酯,识别前后衍射峰位移量的相对标准偏差(RSD)均小于5%,说明其具有良好的可重复利用性。同一传感器重复使用40余次后,仍具有良好的响应性能。
选择2-羟基异丁酸、苯佐卡因和盐酸普鲁卡因进行干扰实验(浓度均为0.01 mol/L)。结果显示,MIPC传感器对普鲁卡因和2-羟基异丁酸基本无响应,但在吸附苯佐卡因时,峰位移了约8 nm,而吸附尼泊金乙酯时则移动了20 nm,说明传感器具有很好的选择性识别性能。由于尺寸、形状和作用点等因素影响,尼泊金乙酯分子能够与分子印迹纳米孔穴重新结合,从而引起水凝胶体积的较大变化,带动晶格参数变化,使Bragg衍射峰的位置发生较明显的变化。普鲁卡因和2-羟基异丁酸与印迹分子的结构差别较大,所以基本无响应;但苯佐卡因与尼泊金乙酯的结构非常相似,均含有苯甲酸乙酯功能团,因此会产生少量吸附,从而引起Bragg衍射峰位移。在相同测试条件下,NMIPC对尼泊金乙酯以及其他药物几乎无响应。说明MIPC中具有与模板分子在空间结构和官能团上互补的孔穴,从而能够对目标化合物进行选择性识别,且印迹孔穴的存在会导致MIPC呈现较大的吸附容量。

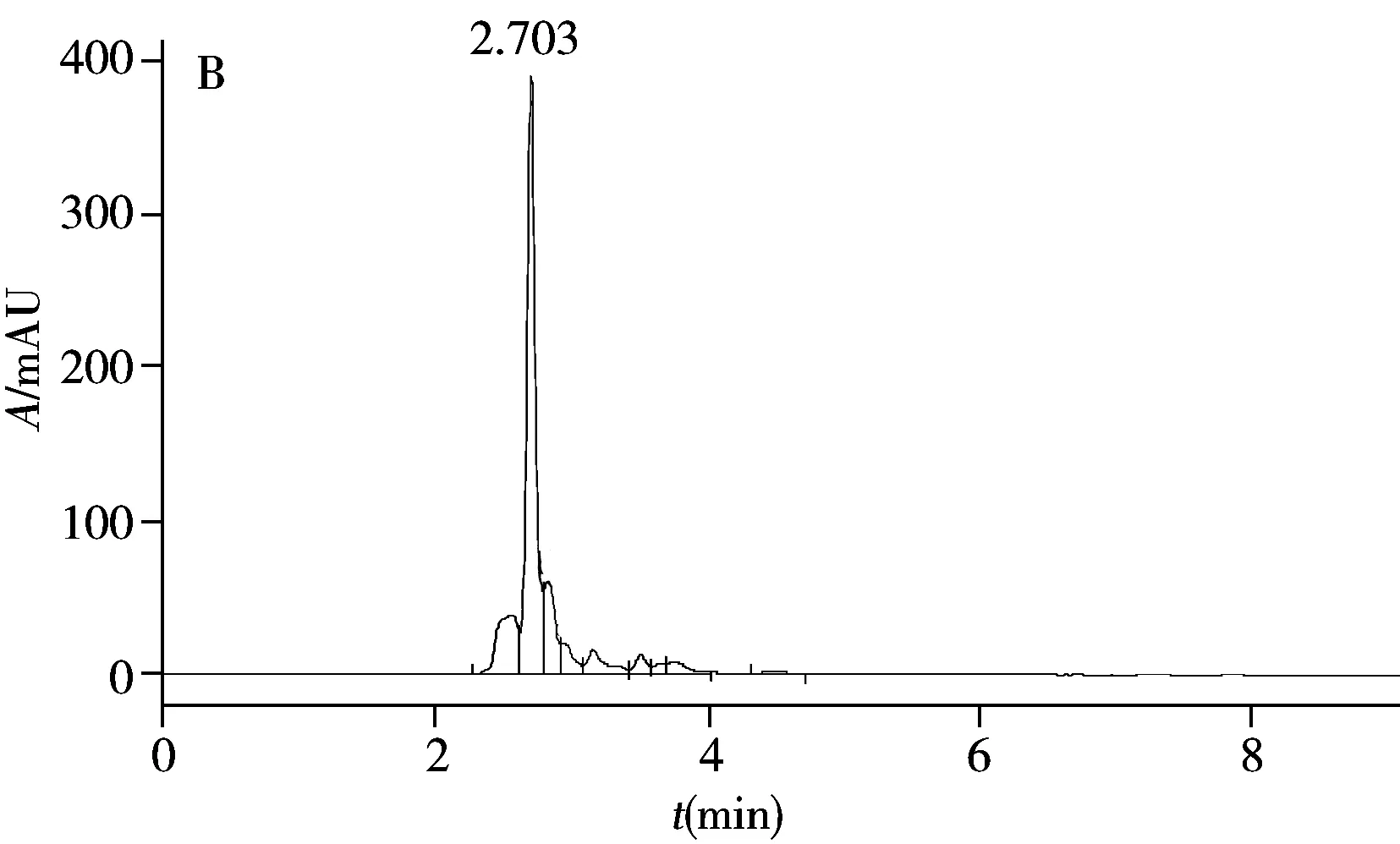

图3 MIPC衍射谱图(A)及添加尼泊金乙酯前(B)后(C)水果罐头的HPLC色谱图Fig.3 MIPC diffraction spectra(A) and HPLC chromatographs of canned fruits before(B) and after(C) adding ethylparaben
2.4 应 用
根据国际规定,水果罐头中尼泊金乙酯的含量不能超过1 g/kg(近似浓度为6 mmol/L)。从市场上购买标示不含有尼泊金乙酯的水果罐头,将水果浸泡液分成两份。1份只添加甲醇,使甲醇体积分数为20%,另1份添加尼泊金乙酯,配成含1 mmol/L尼泊金乙酯的20%甲醇溶液。采用MIPC传感器和HPLC进行对比测定。如图3所示,对不含尼泊金乙酯的溶液,采用HPLC未检出尼泊金乙酯,MIPC的衍射峰也几乎没有偏移,说明MIPC传感器也未检出尼泊金乙酯。对于添加尼泊金乙酯的水果罐头溶液,采用HPLC测得平均浓度为1.019 mmol/L;MIPC也明显观察到峰位移,5次测量的平均值为5 nm,根据线性方程计算得尼泊金乙酯的浓度约为1.095 mmol/L。说明MIPC传感器对实际样品的检测准确度与HPLC方法相当,因此本传感器可用于水果罐头中尼泊金乙酯含量的初步筛查和检测。
3 结 论
本文以单分散SiO2微球制备光子晶体模板,利用填充聚合法制备了具有反蛋白石结构的尼泊金乙酯MIPC传感器,并成功用于水果罐头中尼泊金乙酯含量的筛查。该传感器抗干扰能力强,可重复使用,能利用便携式光纤光谱仪将待测物的特异性识别过程转换为可读的光学信号从而进行定量分析,测定结果准确,较传统分析方法更为简便、快速、高效,适于现场快速监测。可通过加标方法,或者利用标准方法进行对照实验,校正结果,扣除非特异性吸附产生的影响,从而进一步增加方法的精确度。
[1] Haman C,Dauchy X,Rosin C,Munoz J F.WaterRes.,2015,68:1-11.
[2] Li X J,Chen M S,Dai J L,Tang X,Zou Z X,Lü S Y,Zhou X H.J.Instrum.Anal.(李小晶,陈旻实,戴金兰,唐熙,邹哲祥,吕水源,周雪晖.分析测试学报),2013,32(8):973-977.
[3] Darbre P D,Harvey P W.J.Appl.Toxicol.,2008,28(5):561-578.
[4] Barr L,Metaxas G,Harbach C A,Savoy L A,Darbre P D.J.Appl.Toxicol.,2012,32(3):219-232.
[5] Wang L,Mao Q H,Yuan S J,Huang D Y,Zhang J B.Environ.Chem.(王亮,毛茜慧,袁守军,黄德英,张继彪.环境化学),2016,35(1):49-56.
[6] Zheng H H.Environ.Chem.(郑和辉.环境化学),2013,32(3):522-523.
[7] Chen X Z,Xia B Q,Shen X R,Cheng J,Shen Y,Han C.J.Instrum.Anal.(陈祥准,夏碧琪,沈祥茹,程洁,沈燕,韩超.分析测试学报),2015,34(4):443-447.
[8] Fang F,Su H,Yao Z X,Chen C,Liang X M,Huang L M.J.Instrum.Anal.(方凤,粟晖,姚志湘,陈成,梁晓梅,黄丽梅.分析测试学报),2013,32(6):732-736.
[9] Chen Y,Guo Z P,Wang J Y,Chen Y.Chin.J.Chromatogr.(陈蕴,郭振朋,王进义,陈义.色谱),2014,32(4):336-342.
[10] Yetisen A K,Butt H,Volpatti L R,Pavlichenko I,Humar M,Kwok S J J,Koo H,Kim K S,Naydenova I,Khademhosseini A,Hahn S K,Yun S H.Biotechnol.Adv.,2016,34(3):250-271.
[11] Wang X,Mu Z D,Liu R,Pu Y P,Yin L H.FoodChem.,2013,141:3947-3953.
[12] Sun H,Lai J P,Chen F,Zhu D R.Anal.Bioanal.Chem.,2014,407(2015):1745-1752.
[13] Lan X B,Zhao W B,Wang M F,Qi W,Su R X,He Z M.Chin.J.Anal.Chem.(兰小波,赵文斌,王梦凡,齐崴,苏荣欣,何志敏.分析化学),2015,43(4):471-478.
[14] Xue F,Duan T R,Xue M,Liu F,Wang Y F,Wei Z Q,Wang M,Zhang P,Yuan Z G,Meng Z H.Chin.J.Anal.Chem.(薛飞,段廷蕊,薛敏,刘烽,王一飞,韦泽全,王淼,张盼,袁梓高,孟子晖.分析化学),2011,39(7):1015-1020.
[15] Meng L,Meng P J,Zhang Q Q,Wang Y J.Chin.J.Anal.Chem.(孟梁,孟品佳,张庆庆,王彦吉.分析化学),2015,43(4):495-501.
[16] Luan C X,Xu Y S,Chen B A,Yang Z X.Sens.ActuatorB,2017,242:1259-1264.
[17] Lu W,Dong X,Qiu L L,Yan Z Q,Meng Z H,Xue M,He X,Liu X Y.J.Hazard.Mater.,2017,326:130-137.
[18] Sai N,Wu Y T,Yu G G,Sun Z,Huang G W.Talanta,2016,161:1-7.
[19] Lee Y J,Pruzinsky S A,Braun P V.Langmuir,2004,20(8):3096-3106.
Determination of Preservatives in Food Using a Molecularly Imprinted Photonic Crystal Gel Sensor
GU Hang1,PAN Yan-guang1,HUANG Zhen-jian1,ZHU De-rong2*, HUANG Yan-mei1,ZENG Qing-song1,SUN Hui1*
(1.College of Environmental Science and Engineering,Guangzhou University,Guangzhou 510006,China;2.School of Pharmacy,Guangdong Medical University,Dongguan 523808,China)
An inverse opal structural molecular imprinted photonic crystal(MIPC) sensor was established by combining the responsive photonic crystal and molecular imprinting techniques.The 3-D opal structure was obtained by vertical deposition self-assembly of monodisperse silica nanospheres which were prepared by Stöber method.MIPC was obtained after removing SiO2nanospheres and imprinted molecules.Scanning electron microscope showed that the MIPC possessed a highly ordered 3-D macroporous structure.The recognition for target analytes could be directly transferred into readable optical signals through a fiber optic spectrometer.The factors,such as eluate,pH value,sample matrix and molecular imprinted polymer(MIP) synthesis conditions,were optimized to improve the recognition ability and sensing properties of MIPC sensor.The MIPC sensor showed a good selectivity to ethyl paraben against interferons(2-hydroxy isobutyric acid,benzocaine and procaine) studied.Under the optimized conditions,the shift value of Bragg Diffraction peak of MIPC sensor was linearly related with the concentration of ethyl paraben.The sensor could be re-used with well performance,and the quantitation limit is 83 mg/L.The MIPC sensor could be applied directly and conveniently in monitoring of the target analytes in complex samples with good accuracy and sensitivity,and there is no need for sample processing.So it is suitable for on-site rapid screening and detection.
molecular imprinting; photonic crystal; sensor; ethyl paraben
2017-04-18;
2017-05-18
国家自然科学基金项目(21477026 ); 广东省自然科学基金项目(2014A030313525);广州市科技计划项目(201607010295); 国家级大学生创新项目(201511078008)
10.3969/j.issn.1004-4957.2017.08.013
O657.3;S482.294
A
1004-4957(2017)08-1023-06
*通讯作者:孙 慧,博士,教授,研究方向:环境分析,Tel:020-39366943,E-mail:cherrysunhui@aliyun.com 朱德荣,博士,副教授,研究方向:电化学,Tel:0769-22896559,E-mail:drzhu123@aliyun.com
