利用短柄草进行TaWRKY2的抗赤霉病功能分析
2017-08-31郭秀秀苏培森虞光辉葛文扬王宏伟李宪彬孔令让李安飞
郭秀秀,王 亮,苏培森,虞光辉,葛文扬,王宏伟,李宪彬,孔令让,李安飞
山东农业大学 农学院,山东 泰安 271018
利用短柄草进行TaWRKY2的抗赤霉病功能分析
郭秀秀,王 亮,苏培森,虞光辉,葛文扬,王宏伟,李宪彬,孔令让,李安飞*
山东农业大学 农学院,山东 泰安 271018
赤霉病是小麦的重要病害,严重影响小麦的产量和品质,但由于小麦遗传转化较难,其抗病机制的研究一直进展缓慢。短柄草作为单子叶模式植物,在生长特性和遗传研究等方面具有很大优势。本研究首先明确了短柄草穗部赤霉病发生的最适条件为:温度28°C,相对湿度75%。比较小麦Apogee抗、感赤霉病近等基因系受赤霉菌诱导的表达谱,在抗病材料中克隆到一个特异表达的基因并命名为TaWRKY2。利用农杆菌介导的方法将TaWRKY2基因转入短柄草Bd21中,通过穗部接菌鉴定和叶片离体鉴定的方法对转基因植株进行抗病性鉴定,结果表明,与受体Bd21相比,转基因短柄草植株的穗部和叶片赤霉病抗性均增强。作为SA信号路径下游的基因,TaWRKY2可能通过介导水杨酸路径下游病程相关蛋白基因(Pathogenesis related gene,PR基因)的表达,参与抗赤霉病过程。
赤霉病;短柄草;TaWRKY2
赤霉病(Fusahum graminearum)是小麦的主要病害之一,严重时会造成重大经济损失,而且感染赤霉病的小麦会产生多种真菌毒素,对人类的健康构成威胁。近年来,中国黄淮麦区和关中麦区赤霉病的发生也日趋严重。2012年,在河南、山东、安徽等地小麦赤霉病大爆发,对小麦生产造成了严重损失[1,2]。尽管化学防治能够减轻赤霉病危害,但培育抗赤霉病小麦新品种仍是控制和减小赤霉病危害的最安全、有效的措施。目前,传统的杂交育种是选育小麦抗赤霉病新品种的有效途径,在提高小麦的抗病性方面发挥了重要的作用[3]。但是,由于赤霉病抗源非常少,通过传统育种的方法很难在赤霉病育种工作中取得突破。随着基因工程和植物组织培养技术的发展,利用转基因技术创制抗病种质材料的方法应运而生[4]。但是,小麦作为异源六倍体作物基因组复杂,而且作为单子叶植物其遗传转化的效率很低并且稳定性差。此外,小麦转基因带来的安全问题以及人们对于转基因技术认识的局限也限制了小麦转基因技术的应用。短柄草因其具有植株矮小、自交可育、生活周期短、生长条件简单、再生能力强和转化效率高等优点[5,6],已成为单子叶植物研究基因功能的最理想的模式植物。更为重要的是,其全基因组测序已经于2010年完成[7]。Peraldi等[8]认为短柄草可以用来研究小麦赤霉病,但其并没有研究其发病条件,其穗部接种禾谷镰刀菌后,如果条件不合适会导致菌丝迅速生长并包裹整个接菌小穗,尚不能应用到小麦赤霉病II型抗性的研究上。所以,利用短柄草研究小麦赤霉病体系亟待建立。
WRKY家族是近年来发现的植物所特有的一种新型锌指类转录因子。因其N端含有一个由7个氨基酸WRKYGQK组成的高度保守区得名[9]。WRKY转录因子的主要生物学功能是调控植物的逆境防卫反应及其信号转导途径的建立[10-12]。在拟南芥中,对72个AtWRKY基因的功能分析表明,其中的49个基因响应了植物细菌性病原体的入侵和水杨酸的处理,4个基因在植物组织中被脱落酸诱导[13];此外,拟南芥中的抗性基因AtRRS1是典型的WRKY52蛋白,对植物病原青枯菌(Ralstonia solanacearum)有明显抗性[14],有研究表明AtWRKY22和AtWRKY29作为MAPK通路中重要的下游组成成分,可以提高拟南芥对真菌和细菌的抗性[15]。Birkenbihl等[16]通过研究拟南芥AtWRKY33基因的突变体,发现AtWRKY33基因通过调节水杨酸、茉莉酸信号转导途径和基因表达来抵抗灰霉菌的侵染。通过对水稻中的45个WRKY转录因子在不同生物胁迫下表达情况的研究发现:当稻瘟病病菌侵染水稻植株时有15个转录因子响应表达,其中有12个转录因子在细菌诱导水稻植株时出现了上调表达的情况;另有研究表明粳稻亚种中的OsWRKY45-1和籼稻亚种中的OsWRKY45-2,在水稻中过量表达可以提高水稻抵抗真菌病原体侵染的能力,对于抵抗水稻白叶枯病也有一定的作用[17]。小麦中对WRKY基因的研究发现TaWRKY34基因可能与小麦抗白粉病有关[18],苟璐璐[19]也报道在条锈菌诱导下,WRKY转录因子的表达量发生变化。
本课题组研究发现,TaWRKY2基因可以响应禾谷镰刀菌的诱导,推测该基因可能与提高小麦的赤霉病抗性有关。本研究从小麦Apogee抗、感赤霉病近等基因系中克隆得到一个在抗病品种中特异表达的基因TaWRKY2,通过农杆菌介导的遗传转化的方法将其转到短柄草Bd21中,获得转基因短柄草植株,得到转基因纯系后进行赤霉病抗性鉴定,研究了TaWRKY2基因的功能,以期为小麦抗赤霉病分子育种提供有效的候选基因。
1 材料与方法
1.1 实验材料
本实验所用到的植物材料:小麦赤霉病感、抗近等基因系Apogee/Apogee73S2由美国农业部D.Garvin惠赠,短柄草品种Bd21由山东农业大学农学院吴佳洁博士提供。所用的禾谷镰刀菌菌株由山东农业大学植物保护学院梁元纯教授惠赠;农杆菌菌株AGL1为本实验室保存;过表达载体为改造的pCAMBIA1300,由山东农业大学生命科学院安海龙教授惠赠。
1.2 实验方法
1.2.1 短柄草抗赤霉病体系建立 Peraldi等认为短柄草可以与禾谷镰刀菌产生相互作用,但是并没有探索短柄草接种赤霉菌后的发病条件,使得接菌小穗菌丝迅速生长并包裹整个穗部,难以应用到实际的研究中。本实验设立了2个不同的温度条件分别为25°C和28°C,3个不同的相对湿度环境分别为40%、75%和95%以上。
1.2.2TaWRKY2基因克隆及载体构建 分析禾谷镰刀菌处理72 h后的感、抗赤霉病近等基因系颖壳的表达谱差异,得到一个在抗病材料中特异表达的基因片段,通过检索小麦基因组数据库(http://wheat-urgi.versailles.inra.fr/)得其完整cDNA序列信息,根据其cDNA序列设计特异引物(表1),以禾谷镰刀菌处理72 h抗病材料cDNA为模板进行扩增。PCR产物用1%的琼脂糖凝胶电泳,并用胶回收试剂盒回收PCR产物,将回收产物与pMD18-T载体连接,转入大肠杆菌,进行菌落PCR验证后挑取阳性单克隆测序。
用分别含有KpnI和Spel酶切位点的引物TaWRKY2-F/R扩增pMD18-TaWRKY2质粒,PCR产物经电泳检测后回收备用。提取短柄草遗传转化载体pCAMBIA1300-sGFP,分别用KpnⅠ和Spel对pCAMBIA1300-sGFP转化载体和上述PCR回收产物进行双酶切,回收载体片段和目的基因片段,连接并转化DH5α感受态细胞,阳性克隆提取质粒,转化AGL1农杆菌感受态细胞,菌液PCR鉴定阳性克隆。

表1 引物列表Table1 List of primer sequences
1.2.3TaWRKY2转基因短柄草植株的获得 取短柄草幼嫩的种子,用23 mL10%次氯酸钠和27 mL无菌水灭菌5 min,然后用无菌水冲洗3~5次,取出幼胚,幼胚盾片向上接种在愈伤诱导培养基(CIM)上[20]。将取出的幼胚于28°C下暗培养4周诱导愈伤组织,愈伤组织经过2次继代后侵染,侵染后的愈伤经过2次筛选进入分化阶段,每次筛选时长为2周,30 d后进行壮苗,长出根后可以移栽到基质中。进入分化阶段以后培养条件由原来的暗培养变为光照培养,光周期为16 h光照/8 h黑暗。
1.2.4 转TaWRKY2基因短柄草检测 首先通过PCR检测以确定外源的TaWRKY2基因是否已整合到短柄草的基因组中,扩增引物序列见表1。然后通过观察报告基因绿色荧光蛋白的表达情况确定外源TaWRKY2在短柄草转基因株系中的表达情况。
1.2.5 转TaWRKY2短柄草的抗赤霉病功能鉴定 转TaWRKY2短柄草植株的抗赤霉病鉴定是通过类似小麦的单花滴注接种方法和叶片离体培养的方法进行的。
转基因短柄草穗部接菌鉴定主要是参考小麦穗部接菌的方法[21]。短柄草穗部赤霉病鉴定通过选取尚未开花的短柄草小穗,选取倒数第二或第三个小花进行标记并接种赤霉菌,每个小花接种2.5 μL赤霉菌菌液(菌液的浓度为5-10×105个孢子/mL)。接种后套袋保湿,3 d后摘袋并开始记录表型变化。
短柄草叶片离体培养的培养方法参考Chen等[22,23],在直径9 cm的玻璃培养皿中倒入1%的琼脂培养基,待凝固后切除中间宽3 cm的培养基待用。剪取3个不同转基因株系和野生型Bd21的幼嫩的叶片,每份材料取6片叶子,叶长大约5 cm,用1 mL的枪头在叶片近轴面的中间轻轻制造一个大小一致的接种点。把离体叶片的两端插入培养基里,并用培养基块压住切口。在伤口处接种2 μL浓度为每亳升1×106个禾谷镰刀菌分生孢子的菌液,封口膜封口,置于光照培养箱(24°C 16 h/20°C 8 h),5 d后观察发病症状,并进行台盼蓝染色。
2 结果与分析
2.1 短柄草抗赤霉病体系建立
通过调整短柄草穗部与禾谷镰刀菌互作的条件,发现在温度为28°C,相对湿度75%的条件下短柄草的接菌穗可以在10 d内完全延展,但不至于菌丝过量生长(如图1),此条件可以满足短柄草穗部的赤霉病抗性鉴定。
2.2 TaWRKY2基因克隆及载体构建
通过分析小麦赤霉病感、抗近等基因系Apogee/Apogee73S2表达谱数据得到了在接种禾谷镰刀菌的条件下特异表达的基因TaWRKY2,其可能与小麦赤霉病抗性相关。利用qRT-PCR对该基因在近等基因系Apogee/Apogee73S2中的表达模式分析,表明禾谷镰刀菌处理下TaWRKY2基因在Apogee中的表达量略有上升,而在Apogee73S2中的表达量有较显著的增加,其表达量的变化见图2。

图1 短柄草Bd21穗部接种赤霉菌后3d、7d和10d后的发病情况Fig.1Theincidenceof3days,7daysand10daysafterinoculation withFusahumgraminearuminBrachypodiumdistachyonBd21
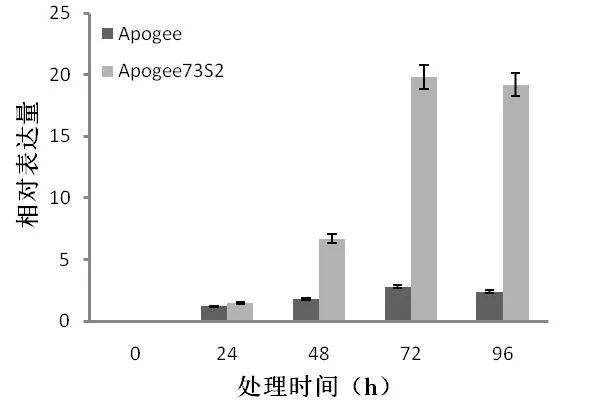
图2 赤霉病诱导下TaWRKY2在感、抗近等基因系Apogee/Apogee73S2中的表达模式Fig.2ExpressionpatternsofTaWRKY2innear-isogeneticlinesApogee/Apogee73S2inducedbyFusahumgraminearum
将克隆得到的TaWRKY2基因连接到PMD19-T载体上,测序正确后亚克隆至表达载体,该表达载体含有2个报告基因,分别为潮霉素hptⅡ筛选标记和GFP绿色荧光标记。然后通过冻融法将构建好的表达载体转入农杆菌AGL1感受态,经过菌落PCR验证阳性克隆后加入40%甘油(v/v),存入-80°C待用。
2.3 TaWRKY2基因短柄草的遗传转化
本实验中TaWRKY2的遗传转化所用的愈伤组织是2013年10月27日剥取的幼胚诱导产生的。本实验剥取43个短柄草的幼胚,经过4周的培养,诱导得到10个胚性愈伤,经过第一次继代得到367个胚性愈伤,2周后进行第二次继代,得到1442个胚性愈伤。选取80个胚性愈伤进行TaWRKY2的农杆菌侵染转化,得到27株转基因阳性植株。现将组织培养的数据列于表2。

表2 短柄草侵染转化数据统计表Table 2 Data statistics ofBrachypodium distachyoninfection transformation
2.4 转TaWRKY2基因短柄草检测
转基因苗DNA水平的鉴定:将组培得到的抗性短柄草植株剪取叶片,用SDS法提取DNA,经过PCR检测目的基因,PCR鉴定以短柄草基因组DNA为模板扩增目的基因,然后用1%的琼脂糖凝胶电泳,鉴定得到27株阳性植株,结果见图3A。
转基因短柄草的表达鉴定:将转基因短柄草T0代种子在滤纸上发芽,发芽3天后在荧光显微镜下观察胚芽鞘的绿色荧光表达情况,有绿色荧光的表达则说明该基因已成功转移到短柄草植株中,并能够成功表达,结果见图3B。

图3 AT0代转基因短柄草植株的PCR检测结果Fig.3AIdentification of transgenicBrachypodium distachyon1-8:转基因植株;9:野生型;10:阳性对照;11:阴性水对照;M:Maker。1-8 Transgenic plants;9 Wild type;10 Positive control;11 PCR product of negative control of ddH2O;M:Maker.
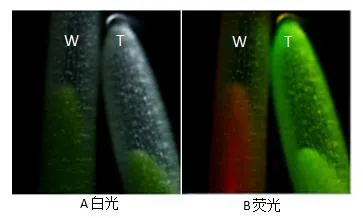
图3 B T1代转基因植株的荧光检测Fig.3B Fluorescence detection of T1generation transgenic plantsA图是正常光下胚芽鞘部分的图像,B图是绿色荧光下胚芽鞘部分的图像;W是野生型;T是转基因型。AUnder normal light;B Under green fluorescence;W:Wild type;T:Transgenic type.
2.5 转TaWRKY2基因短柄草的抗赤霉病能力鉴定
短柄草转基因植株抗赤霉病鉴定主要由穗部接菌鉴定和幼苗离体叶片接种鉴定两个方面进行,均参照小麦的赤霉病鉴定方法进行。
短柄草的穗部接菌鉴定,采用单花滴注法接菌3 d后摘袋,从第4 d开始记录短柄草发病情况并统计野生型对照和转基因短柄草植株接菌后的延展情况,如图4A。延展率是指发病小穗数与总小穗数的比值。相比野生型,转基因短柄草小穗延展率降低,说明TaWRKY2可以提高短柄草穗部对赤霉菌的抗性(图4B)。

图4 A短柄草穗部接种赤霉菌的发病情况Fig.4ABrachypodium distachyonincidence of ear inoculation ofFusahum graminearum图4B转TaWRKY2基因短柄草后代穗部赤霉病抗性鉴定Fig.4B Identification of resistance toFusariumhead blight in transgenic plants withTaWRKY2
叶片离体培养大约5 d后观察赤霉菌的侵染情况,并拍照记录,如图5A。然后用台盼蓝染色,脱色后测量坏死斑的大小,结果表明,相比于野生型短柄草叶片转基因短柄草叶片的坏死斑明显较小,说明TaWRKY2对短柄草叶片感染赤霉菌也有一定的抗性见图5B。

图5 转TaWRKY2基因短柄草叶片离体抗赤霉病鉴定Fig.5 Phenotypes of detached leaves of transgenicBrachypodium distachyonwith geneTaWRKY2againstFusahum graminearuminfectionA:野生型短柄草和转TaWRKY2基因型短柄草离体叶片在接种赤霉菌5 d后的发病表型;B野生型和转基因植株叶片坏死斑平均长度。A.The isolated leaves of wild type and transgenicTaWRKY2geneB.distachyonwere inoculated withF.graminearumand the phenotypes were checked 5 days later;B.Average length of leaf necrosis spot in wild type and transgenic plants.
3 讨论
Peraldi[8]等研究了赤霉病在短柄草中的发病过程和机理,发现禾谷镰刀菌与短柄草穗部存在互作,但利用短柄草研究小麦赤霉病的可行性尚需进一步验证。本研究首先以二穗短柄草Bd21为材料,探索了其穗部进行赤霉病抗性鉴定的适宜条件。发现短柄草Bd21在室温条件下具有较强II型抗性,单花滴注法接种禾谷镰刀菌两周后,禾谷镰刀菌的菌丝仍然很难通过穗轴延展到邻近的小穗,抗赤霉病相关基因的抗病性鉴定仍存在较大的难度。但在温度为28°C,相对湿度为75%的条件下,禾谷镰刀菌可以通过穗轴侵染其邻近的小穗,发病过程与小麦中类似,因此,外界条件是影响短柄草抗赤霉病鉴定的重要因素。
SA、JA和乙烯作为植物抗病防卫基本信号通路的3种信号分子,在抵御环境胁迫应答过程中都起着重要作用。禾谷镰刀菌的侵染机制非常复杂,在侵染初期属于寄生型,48小时后转为腐生型侵染,目前,小麦通过信号转导抗病的分子机制尚不明确。早在2006年Makandar等[24]报道在小麦中过表达来自拟南芥的AtNPR1基因时,转基因小麦对赤霉病的抗性有所提高,而NPR1基因是SA信号路径的关键因子,WRKY转录因子位于SA信号路径中NPR1基因的下游。由于一个转录因子的过量表达能够激活下游多个抗逆基因的表达,从而获得具有综合抗逆能力的转基因植株,所以转录因子在小麦抗逆方面的应用具有更高的价值。其中WRKY转录因子能够与下游基因结合调控植物的生物和非生物胁迫,己经成为作物改良的重要研究内容[25]。
本研究利用Apogee抗、感赤霉病近等基因系,发现了一个在抗病材料中特异表达的WRKY基因,暗示了该基因很可能参与了小麦赤霉病的抗病性过程。过量表达该基因的短柄草转基因植株无论是穗部还是叶片都表现出较强的的赤霉病抗性,这说明利用短柄草进行赤霉病抗性分析是可行的,而该基因在小麦中的赤霉病抗病能力需要进一步验证。Ding等[26]利用转录组和蛋白组学研究小麦-禾谷镰刀菌互作的结果推测,在禾谷镰刀菌侵染前期水杨酸信号路径可能扮演重要角色,而当其侵染机制转换成腐生阶段时,小麦茉莉酸通路可能起到更重要的作用。而本研究中荧光定量显示该基因随禾谷镰刀菌侵染主要在后期诱导表达,表明TaWRKY2可能在侵染后期发挥作用,因此该基因如何受水杨酸和茉莉酸交叉调控还需进一步研究。另外,Gao等[27]报道将拟南芥中克隆得到的AtNPR1基因导入小麦后发现转基因小麦的叶片和穗部与禾谷镰刀菌作用时表现出了相反的表型,但本研究中并未发现这一点。本研究通过同源克隆技术得到了在小麦感、抗赤霉病材料中差异表达的TaWRKY2基因,通过在二穗短柄草中的过量表达该基因,提高了短柄草对赤霉病的抗性。
4 结论
本研究初步建立了利用短柄草鉴定小麦穗部赤霉病抗性体系,明确了最适的发病条件为:温度28°C,相对湿度75%。本研究利用Apogee抗、感赤霉病近等基因系,从小麦抗病材料Apogee中克隆得到一个差异表达的基因TaWRKY2。该基因在短柄草中过量表达后发现其穗部和离体叶片均比受体对照表现出更强的赤霉病抗性,说明该基因可能参与小麦抗赤霉病过程。
参考文献
[1]Yao J,Zhou M,Zhang X,et al.Molecular breeding for wheat Fusarium head blight resistance in China[J].Cereal Research Communications,2008,36(S6):203-212
[2]李海军,孙苏阳,王永军,等.小麦赤霉病发生原因与防治措施[J].农技服务,2008,28(9):78,87
[3]何中虎,夏先春,陈新民,等.中国小麦育种进展与展望[J].作物学报,2011,37(2):202-215
[4]TesterM,LangridgeP.Breedingtechnologiestoincreasecropproductioninachangingworld[J].Science,2010,327(5967):818-822
[5]Draper J,Mur LAJ,Jenkins G,et al.Brachypodium distachyon.A new model system for functional genomics in grasses[J].Plant Physiology,2001,127(4):1539-1555
[6]Vogel JP,Gu YQ,Twigg P,et al.EST sequencing and phylogenetic analysis of the model grassBrachypodium distachyon[J].Theoretical andApplied Genetics,2006,113(2):186-195
[7]Vogel JP,Garvin DF,Mockler TC,et al.Genome sequencing and analysis of the model grassBrachypodium distachyon[J].Nature,2010,463(7282):763-768
[8]Peraldi A,Beccari G,Steed A,et al.Brachypodium distachyon:a new pathosystem to study Fusarium head blight and otherFusariumdiseases of wheat[J].BMC Plant Biology,2011,11(1):100
[9]Eulgem T,Rushton PJ,Robatzek S,et al.The WRKY superfamily of plant transcription factors[J].Trends in Plant Science,2000,5(5):199-206
[10]Rushton PJ,Torres JT,Parniske M,et al.Interaction of elicitor-induced DNA-binding proteins with elicitor response elements in the promoters of parsley PR1 genes[J].The EMBO Journal,1996,15(20):5690
[11]Yu D,Chen C,Chen Z.Evidence for an important role of WRKY DNA binding proteins in the regulation of NPR1 gene expression[J].The Plant Cell,2001,13(7):1527-1540
[12]Deslandes L,Olivier J,Theulières F,et al.Resistance to Ralstonia solanacearum in Arabidopsis thaliana is conferred by the recessiveRRS1-Rgene,a member of a novel family of resistance genes[J].Proceedings of the National Academy of Sciences,2002,99(4):2404-2409
[13]Tosti N,Pasqualini S,Borgogni A,et al.Gene expression profiles of O3-treated Arabidopsis plants[J].Plant,Cell&Environment,2006,29(9):1686-1702
[14]Deslandes L,Olivier J,Peeters N,et al.Physical interaction between RRS1-R,a protein conferring resistance to bacterial wilt,and PopP2,a type III effector targeted to the plant nucleus[J].Proceedings of the National Academy of Sciences,2003,100(13):8024-8029
[15]Asai T,Tena G,Plotnikova J,et al.MAP kinase signalling cascade in Arabidopsis innate immunity[J].Nature,2002,415(6875):977-983
[16]Birkenbihl RP,Diezel C,Somssich IE.ArabidopsisWRKY33is a key transcriptional regulator of hormonal and metabolic responses toward Botrytis cinerea infection[J].Plant physiology,2012,159(1):266-285
[17]Rushton PJ,Somssich IE,Ringler P,et al.WRKY transcription factors[J].Trends in Plant Science,2010,15(5):247-258
[18]秦 伟,赵光耀,曲志才,等.小麦白粉病菌诱导的TaWRKY34基因的鉴定与分析[J].作物学报,2010,36(2):249-255
[19]苟璐璐.条锈菌诱导的小麦转录因子TaWRKY基因的克隆及表达分析[D].雅安:四川农业大学,2011
[20]Bablak P,Draper J,Davey MR,et al.Plant regeneration and micropropagation ofBrachypodium distachyon[J].Plant Cell,Tissue and Organ Culture,1995,42(1):97-107
[21]侯文倩.小麦赤霉病抗病相关基因的分离鉴定及BSMV-VIGS功能验证[D].泰安:山东农业大学,2014
[22]牟晶晶.小麦硬脂酰基载体蛋白脂肪酸去饱和酶基因(TaSSI2-1)的功能分析[D].泰安:山东农业大学,2015
[23]Zhang XW,Jia LJ,Zhang Y,et al.In planta stage-specific fungal gene profiling elucidates the molecular strategies ofFusarium graminearumgrowing inside wheat coleoptiles[J].The Plant Cell,2012,24(12):5159-5176
[24]Makandar R,Essig JS,Schapaugh MA,et al.Genetically engineered resistance to Fusarium head blight in wheat by expression ofArabidopsisNPR1[J].Molecular Plant-Microbe Interactions,2006,19(2):123-129
[25]金 慧.水杨酸诱导番茄WRKY转录因子的克隆及功能分析[D].大连:大连理工大学,2011
[26]Ding L,Xu H,Yi H,et al.Resistance to hemi-biotrophicF.graminearuminfection is associated with coordinated and ordered expression of diverse defense signaling pathways[J].PloS One,2011,6(4):e19008
[27]Gao CS,Kou XJ,Li HP,et al.Inverse effects of ArabidopsisNPR1gene on fusarium seedling blight and fusarium head blight in transgenic wheat[J].Plant Pathology,2013,62(2):383-392
Functional Analysis ofTaWRKY2Involved in Fusarium Head Blight Resistance UsingBrachypodium distachyon
GUO Xiu-xiu,WANG Liang,SU Pei-sen,YU Guang-hui,GE Wen-yang,WANG Hong-wei,LI Xian-bin,KONG Ling-rang,LIAn-fei*
College of Agronomy/Shandong Agricultural University,Tai’an271018,China
Fusariumhead blight(FHB)is an important disease of wheat,which affects the quality and yield of wheat seriously.However,due to the difficulty of genetic transformation of wheat,the progress is slow in the research of FHB disease resistance mechanism.As a model of monocot plants,Brachypodium distachyonhas great advantages in terms of growth characteristics and genetic research.In this study,we established the system of FHB evaluation onB.distachyon,with the optimal conditions at 28°C and humidity of 75%.Based on the analysis of the gene expression profiling,we cloned a specific gene from FHB-resistant near-isogenic line of Apogge induced byFusahum graminearum,and it was designated asTaWRKY2and overexpressed inB.distachyonof Bd21 subsequently.The results showed that the transgenicB.distachyonexhibited stronger resistance to FHB both on spike and detached leaf.As a downstream transcription factor of SA signaling,TaWRKY2may participate in the process of resistance to scab by mediating the expression of pathogenesis related protein genes.
Fusariumhead blight;Brachypodium distachyon;TaWRKY2
S512.1
A
1000-2324(2017)04-0570-06
2016-06-05
2016-11-10
国家自然基金(31520103911,31471488);山东省良种工程
郭秀秀(1990-),女,在读硕士研究生.主要从事小麦和短柄草的遗传转化工作.E-mail:guoxiuxiumkk@126.com
*通讯作者:Author for correspondence.E-mail:lianfei@sdau.edu.cn
