手性拆分2-溴丙酸甲酯的菌株筛选及优化
2017-08-30魏盼盼陆跃乐陈小龙
魏盼盼,陆跃乐,陈小龙
(浙江工业大学 生物工程学院,浙江 杭州 310014)
手性拆分2-溴丙酸甲酯的菌株筛选及优化
魏盼盼,陆跃乐,陈小龙*
(浙江工业大学 生物工程学院,浙江 杭州 310014)
2-溴丙酸甲酯是一种重要的农药中间体,其光学纯构型可用于多种手性农药的合成。该研究从自然界筛选出可以选择性水解拆分2-溴丙酸甲酯的菌株,并对此菌株进行菌种鉴定和发酵培养基优化,最终通过全细胞催化获得R-2-溴丙酸甲酯。经鉴定,该S-型水解酶菌株为枯草芽孢杆菌(Bacillussubtilis),对映体过量值达85%以上。经单因素和正交试验分析,确定该菌株最佳培养基成分为麦芽糖20 g·L-1,蛋白胨30 g·L-1,MgSO4·7H2O 0.5 g·L-1,NaCl 1 g·L-1,玉米油10 mL·L-1。最终脂肪酶活性为优化前的1.64倍,该方法可为多种手性农药单一对映异构体的合成提供初始光学纯原料,从而降低生产成本,并利于农药减量使用。
手性农药;R-2-溴丙酸甲酯; 不对称水解; 生物催化
苯氧羧酸类除草剂是一类最早实现工业化的手性除草剂,如精噁唑禾草灵等,此类除草剂具备毒性低、活性高、安全等一系列优点[1-2]。在如今的农药市场上,高纯度异构体作为除草剂其市场占有率超过50%[3],此类除草剂的R构型活性远远高于S构型活性[4]。单一使用R型苯氧羧酸类除草剂不仅可以节约成本,减少资源使用,也可以降低对环境造成的伤害。而现今农药市场上单一构型苯氧羧酸类除草剂,价格较为昂贵,若能高效廉价获得R型苯氧羧酸类除草剂将会推进除草剂行业迅猛发展。获得单一构型苯氧羧酸类除草剂主要是通过2个途径:提高R-对羟基苯氧基乳酸/酯的合成效率和增加卤代2-丙酸/酯的光学纯度[5]。
2-溴丙酸甲酯,在有机化学中属于合成原料,并且是苯氧羧酸类除草剂禾草灵、吡氟禾草灵、禾草克等一系列除草剂的重要中间体。目前,获得单一构型2-溴丙酸甲酯的方法主要为化学合成[6]和生物拆分法。曹雪荣等[7]采用固定化柱状假丝酵母脂肪酶的方法,获得了单一构型2-溴丙酸甲酯,其ee值达到90%以上。Tasnádi等[8]通过构建工程菌高产还原酶,将β-卤代丙烯酸酯衍生物脱卤还原成R-2-溴丙酸甲酯,该对映体过量值高达96%。现有利用酶法拆分获得单一构型的方法主要局限于固定化酶或者是工程菌中,两者的立体选择性高,但是固定化酶前期步骤繁琐,工程菌不稳定,不适合工业化生产。
本研究从自然界土壤中筛选具有选择性降解2-溴丙酸甲酯能力的菌株并且对其进行鉴定和发酵培养基优化,进一步提高催化效率。
1 材料与方法
1.1 菌株
从土壤中筛选出可水解拆分2-溴丙酸甲酯的菌株,筛选ees值最高菌株,命名为Fer-ly-16。
1.2 培养基
种子培养基。蛋白胨10 g·L-1,酵母提取物5 g·L-1,NaCl 10 g·L-1,pH值 7.0,121 ℃高压蒸汽灭菌20 min。
发酵基础培养基。蛋白胨10 g·L-1,蔗糖10 g·L-1,橄榄油10 g·L-1,K2HPO41 g·L-1,MgSO4·7H2O 0.5 g·L-1,pH 值7.0,115 ℃高压蒸汽灭菌20 min。
富集培养基。蛋白胨 10 g·L-1,无水K2HPO41 g·L-1,无水MgSO40.5 g·L-1,底物100 μL,pH值7.0,121 ℃高压蒸汽灭菌20 min。
初筛培养基。橄榄油10 g·L-1,(NH4)2SO45 g·L-1,无水K2HPO41 g·L-1,MgSO4·7H2O 0.5 g·L-1,NaCl 5 g·L-1,121 ℃高压蒸汽灭菌20 min。
复筛培养基。蛋白胨10 g·L-1,酵母粉5 g·L-1,蔗糖10 g·L-1,MgSO4·7H2O 0.5 g·L-1,橄榄油10 g·L-1,无水K2HPO41 g·L-1,pH 值7.0,121 ℃高压蒸汽灭菌20 min。
1.3 试剂及溶液配制
Rac-2-溴丙酸甲酯(分析纯)购于上海阿拉丁生化科技股份有限公司;其余试剂均为分析纯,购于国药集团化学试剂有限公司。
PVA橄榄油乳化液的制备。取20 g聚乙烯醇(PVA),加入800 mL去离子水,加热,不断搅拌使其完全溶解,用0.1 mol·L-1NaOH调pH值至7.0,过滤后,定容至1 000 mL,配置成2%聚乙烯醇(PVA)溶液。取上述溶液300 mL,加入100 mL橄榄油,高速匀浆机高速搅拌成乳白色液体,无油状物质即可(乳化液现配现用)。
0.1 mol·L-1pH值 7.0的磷酸钠缓冲液配制方法参考http://www.biomart.cn/experiment/430/478/479/28726.htm。
1.4 仪器
气相色谱仪(FULI 9790),高速冷冻离心机(长沙湘智),恒温培养箱(DNP-9082),恒温调速回转式摇床(DKY-1),光学显微镜(奥林巴斯CH-20)。
1.5 方法
1.5.1 产脂肪酶菌株的筛选
富集培养。将50 mL灭菌生理盐水倒入250 mL锥形瓶中,再加入5 g土样,将锥形瓶置于30 ℃,180 r·min-1摇床中,1 h后取出,静置30 min;取1 mL上清于富集培养基中,30 ℃,180 r·min-1摇床培养4 d;取1 mL 4 d后培养的菌液于富集培养基,为第2次富集;如此富集培养3次。
平板筛选。取富集后的菌液进行稀释,稀释浓度为10-8、10-10、10-12、10-14,取以上4个浓度的菌液各100 μL,涂布于初筛固体培养基中,每个浓度做3组。置于30 ℃培养箱,恒温培养直至有菌落产生。将平板置于365 nm紫外下,挑取有荧光产生的菌落,将此类菌落挑取划线于新初筛固体平板中,划线纯化,保存于斜面培养基中。
复筛筛选。将斜面培养基中菌落接种于种子培养基中,培养12~16 h,取1 mL种子液培养基于复筛液体培养基中,30 ℃,180 r·min-1,培养48 h,得到50 mL发酵液。取发酵液,4 ℃ 8 000g离心20 min,去掉上清得到菌体,加入10 mL 0.1 mol·L-1pH值7.0的磷酸钠缓冲液,加入100 μL底物,30 ℃,180 r·min-1进行反应,根据固定化酶对底物反应时间[7],在4 h时停止反应,进行处理。
1.5.2 菌株活化及菌株发酵培养
菌株划线于LB平板,过夜培养,挑取单菌落于LB液体培养基中,过夜培养,接种于发酵培养基中,30 ℃,180 r·min-1振荡培养48 h,得到50 mL发酵液。
1.5.3 菌体及上清液催化水解反应
取50 mL发酵液,4 ℃,8 000g离心20 min,去除上清液,得到全细胞,加入10 mL 0.1 mol·L-1pH 值7.0的磷酸钠缓冲液,然后加入100 μL底物,将10 mL反应液放于30 ℃水浴摇床中反应。每隔2 h取1 mL反应液,加入0.1 mol·L-1HCl,直至反应液pH值为2,加入等体积乙酸乙酯,放入摇床内完全萃取,取上清液500 μL,加入少量无水硫酸钠除水,14 000g,离心1 min后,取上清液200 μL进样检测。
1.5.4 检测方法
气相色谱条件载气为氮气,检测器210 ℃,进样器210 ℃。升温程序:80 ℃,1 min;以10 ℃·min-1升温至160 ℃;160 ℃,2 min;以6 ℃·min-1升温至180 ℃;180 ℃,1 min;以10 ℃·min-1升温至190 ℃;190 ℃,降温。进样量2 μL,气相柱为BGB-174毛细管手性色谱柱。
底物对映体过量值(ees)和酯转化率(C)按下列公式计算:
ees=│([S]S-[S]R)/([S]S+[S]R)│×100。
C=([S]SA+[S]RA- [S]S-[S]R)/([S]SA+[S]RA)。
式中:[S]S和[S]R是样品中S构型和R构型含量,ees为底物对映体过量值;[S]SA和[S]RA为未催化前样品中S构型和R构型含量,C为酯转化率。
1.5.5 产脂肪酶菌株鉴定
选取对底物有效果的菌株进行生理生化鉴定,将挑取的单菌落接种于LB培养基,并划线于LB固体平板中,培养16 h后,观察平板中菌落,将菌液稀释后进行革兰氏染色。将单菌落接种于LB液体培养基,30 ℃培养16 h,隔2 h取样,测其生长曲线。取单菌落接种于LB液体培养基,30 ℃ 180 r·min-1振荡培养16 h后,进行16S rDNA分子鉴定。
1.5.6 发酵培养基优化及发酵条件优化
以发酵培养基为基础,设计碳源(1%添加量,蔗糖、麦芽糖、甘露醇、橄榄油、壳聚糖、可溶性淀粉、葡萄糖、乳糖以及不加碳源)、氮源(1%添加量,蛋白胨、氨水、大豆分离蛋白、黄豆粉、酵母提取物、硫酸铵、氯化铵、脱脂豆粉、玉米粉)、无机盐(0.1%添加量,KH2PO4、K2HPO4、Na2S2O3、MnSO4、Na2SO4、NaCl、ZnSO4、AgNO3、CaCl2、CoCl2、CuSO4、EDTA、FeCl3、FeSO4、MgSO4·7H2O)、诱导剂(吐温-80、玉米油、橄榄油、底物)各个单因素,对培养基中各个因素进行单因素优化,确定各个因素的最佳浓度。在单因素优化的基础上,进行正交实验,考查麦芽糖(A)、蛋白胨(B)、无机盐(MgSO4·7H2O和NaCl的浓度)(C,D)和玉米油(E)5个因素,每个因素选取4个水平:麦芽糖(A)和蛋白胨(B)的4个水平均分别为5、10、20、30 g·L-1;MgSO4·7H2O和NaCl的4个水平均分别为0.2、0.5、1、2 g·L-1;玉米油的4个水平分别为4、10、20、40 mL·L-1。
1.5.7 酶活性测定
脂肪酶活性单位定义为30 ℃、pH值为7.0条件下,以每1 min消耗1 μg 2-溴丙酸甲酯所需酶量为1个活性单位(U)。
相对脂肪酶活性。以初发酵培养基pH 值7.0,30 ℃发酵48 h为基础,50 mL发酵液离心得到菌体加10 mL磷酸缓冲液,加入100 μL底物,水浴摇床30 ℃反应4 h,气相检测剩余底物量,计算酯转化率,将该转化率定为脂肪酶活性100%。
2 结果与分析
2.1 菌株筛选结果
通过富集培养、初筛培养以及复筛培养后,总共获得65株产脂肪酶菌株,其中有11株菌株对2-溴丙酸甲酯有拆分作用,有1株菌株对于2-溴丙酸甲酯的拆分选择性比较高,将其命名为Fer-ly-16;其ees值大于85%。
2.2 催化水解反应
Fer-ly-16 菌株发酵液离心后得到全细胞,取全细胞作为酶催化剂,反应4 h,结果如图1所示。以全细胞作为催化剂,反应4 h以后,底物的2种构型有很大差距,其ees大约为85%,酯转化率约为40%。
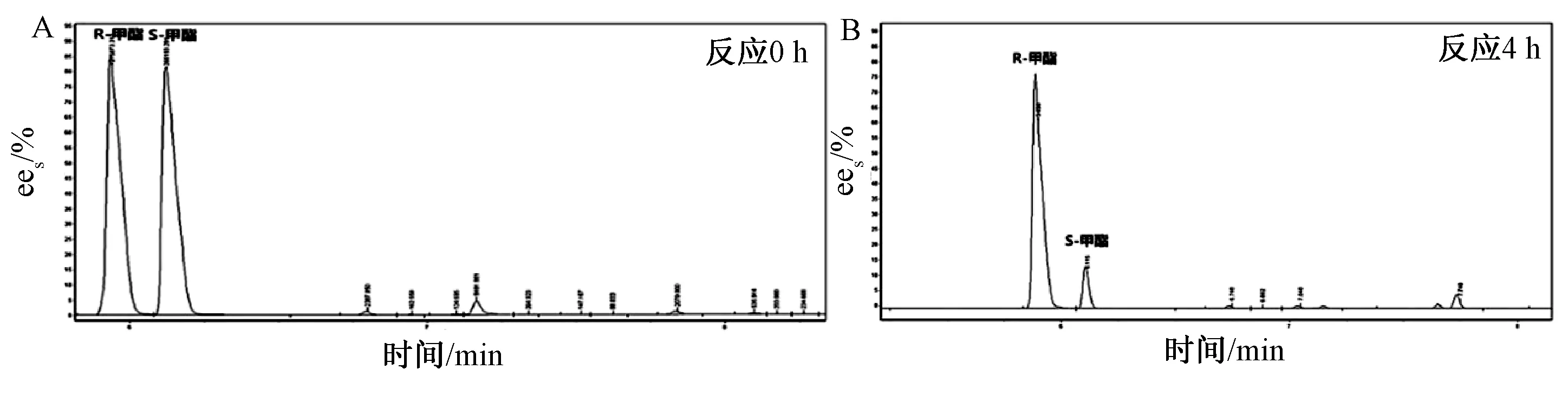
图1 全细胞催化拆分底物
2.3 菌种鉴定
2.3.1 菌落特征
Fer-ly-16单菌落背面为乳白色,正面凸起,表面粗糙,杆状,革兰阳性菌。生长曲线表明,0~3 h处于停滞期,4~10 h为指数生长期,10~16 h为平台期,17 h后进入衰亡期。
2.3.2 16S rDNA分子鉴定
测序得到其16S rDNA全长约为1 400 bp,序列比对结果表明,该菌株与Bacillussubtilis27R7-12、B.subtilissubsp. subtilis strain QB5413和B.subtilissubsp. subtilis strain QB5412的同源性高于99%。根据菌落形态、革兰氏染色结果、序列比对以及系统进化树结果(图2),Fer-ly-16菌株属于枯草芽孢杆菌。
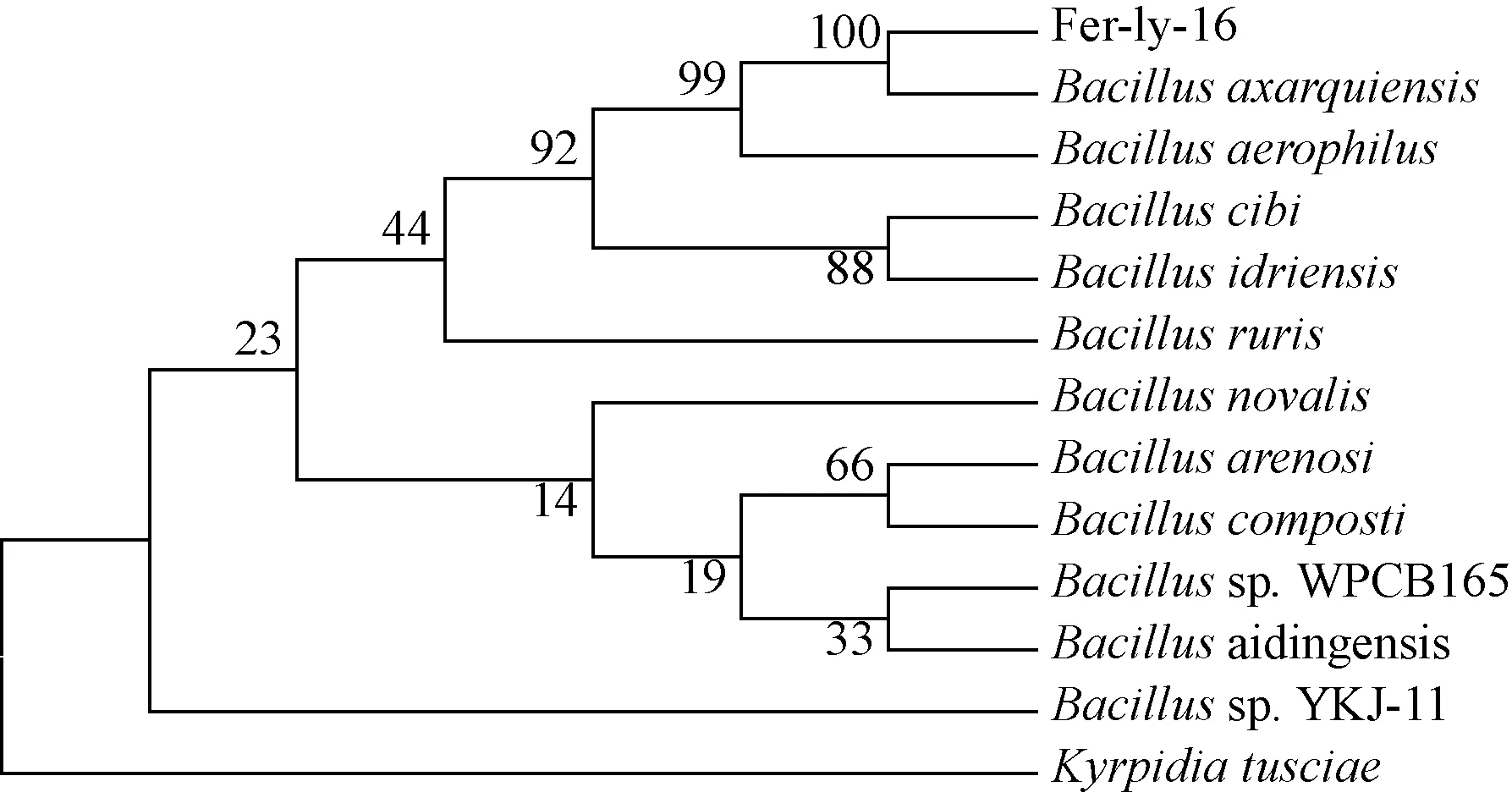
小数为枝长,枝上显示Bootstrap500个循环的置信度图2 基于16S rDNA序列的系统发育树
2.4 发酵培养基优化
2.4.1 碳源优化
从图3中看出,以麦芽糖为碳源时,其脂肪酶活性最大,而以壳聚糖为碳源时,其脂肪酶活性最低,表明Fer-ly-16菌株不适合以壳聚糖为碳源,最适碳源为麦芽糖。以麦芽糖为碳源,当麦芽糖浓度为15 g·L-1时,其脂肪酶相对活性最高,达到110%;麦芽糖浓度超过15 g·L-1时,相对酶活性逐渐降低,表明麦芽糖浓度的增加在一定程度上抑制了菌体的生长。
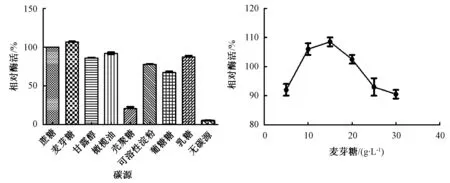
图3 不同碳源及最优碳源浓度对菌株Fer-ly-16发酵产酶的影响
2.4.2 氮源优化
由图4可以看出,以蛋白胨为氮源,菌株酶活性最大;而以氨水、硫酸铵、氯化铵为氮源时,菌株相对酶活性几乎为0。因此,Fer-ly-16菌株最适氮源为蛋白胨。蛋白胨浓度为20 g·L-1时,脂肪酶相对酶活性达到最大。推测高浓度的氮源可能会使菌体细胞发生破裂,从而使酶合成受到抑制,降低酶活性。
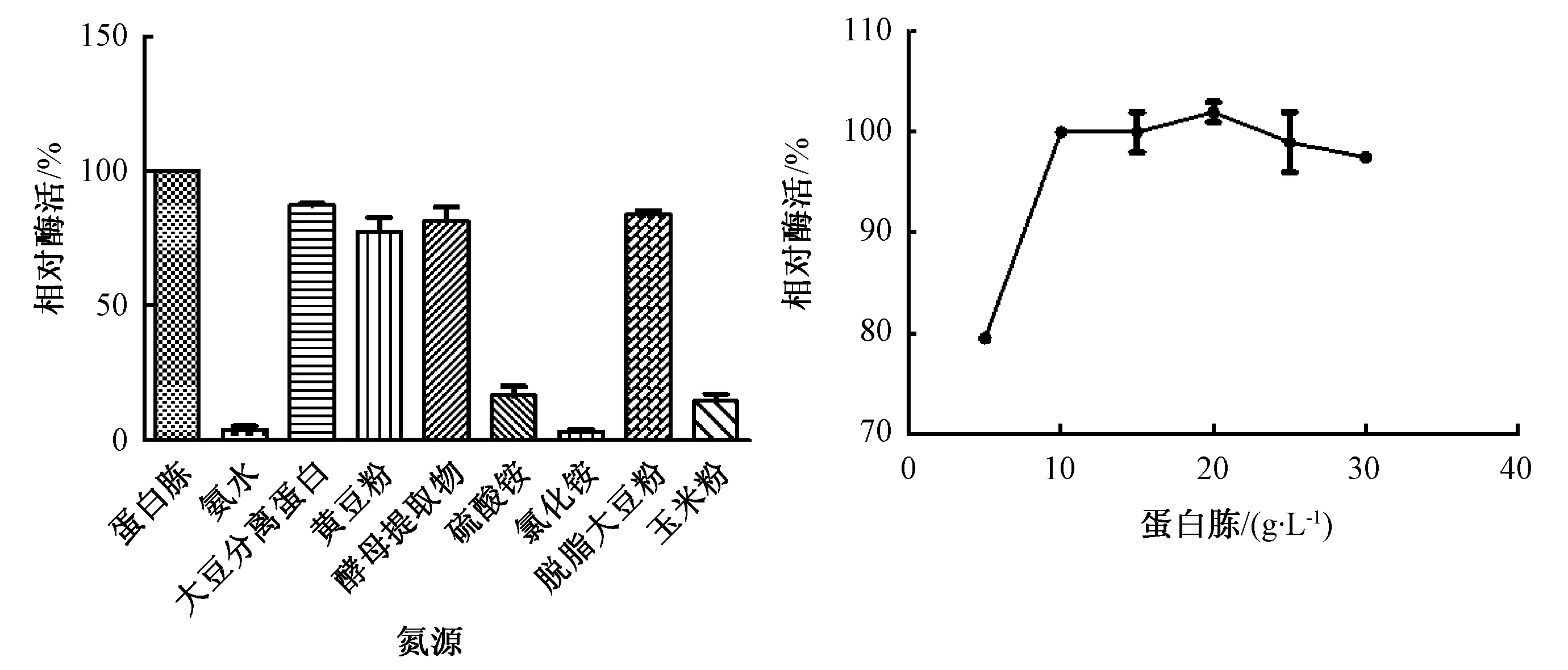
图4 不同氮源及最优氮源浓度对菌株Fer-ly-16发酵产酶的影响
2.4.3 无机盐优化
从图5可知,添加NaCl或MgSO4·7H2O的培养基,脂肪酶相对酶活比较高,分别为100%和110%。当培养基中添加ZnSO4和CoCl2时,这2种无机盐可能对细胞生长产生抑制作用,菌体的相对酶活性几乎为0。因此,Fer-ly-16菌株发酵培养基的最适无机盐为NaCl或MgSO4·7H2O。在最适无机盐离子的基础上,考查不同浓度的无机盐离子对脂肪酶相对活性的影响。MgSO4·7H2O和NaCl分别为0.2和1 g·L-1时,其脂肪酶活性达到最大值。
2.4.4 诱导剂优化
从图6可以看出,以玉米油为诱导剂时,其脂肪酶相对活性达到最大,以添加底物为诱导剂时,其脂肪酶相对活性几乎为0。因此,Fer-ly-16菌株发酵培养基的最适诱导剂为玉米油,当玉米油添加量为30 mL·L-1时,其脂肪酶相对活性最大。
2.4.5 正交实验结果
由表1可知,A3B4C2D3E2为最佳水平组合,即麦芽糖20 g·L-1,蛋白胨30 g·L-1,MgSO4·7H2O 0.5 g·L-1,NaCl 1 g·L-1,玉米油10 mL·L-1。极差分析表明,氮源对脂肪酶活性影响最大,其次是MgSO4·7H2O,影响最小的是碳源。取组合A3B4C2D3E2为最佳培养基组合,发酵培养48 h后,催化反应后相对酶活性为164%。
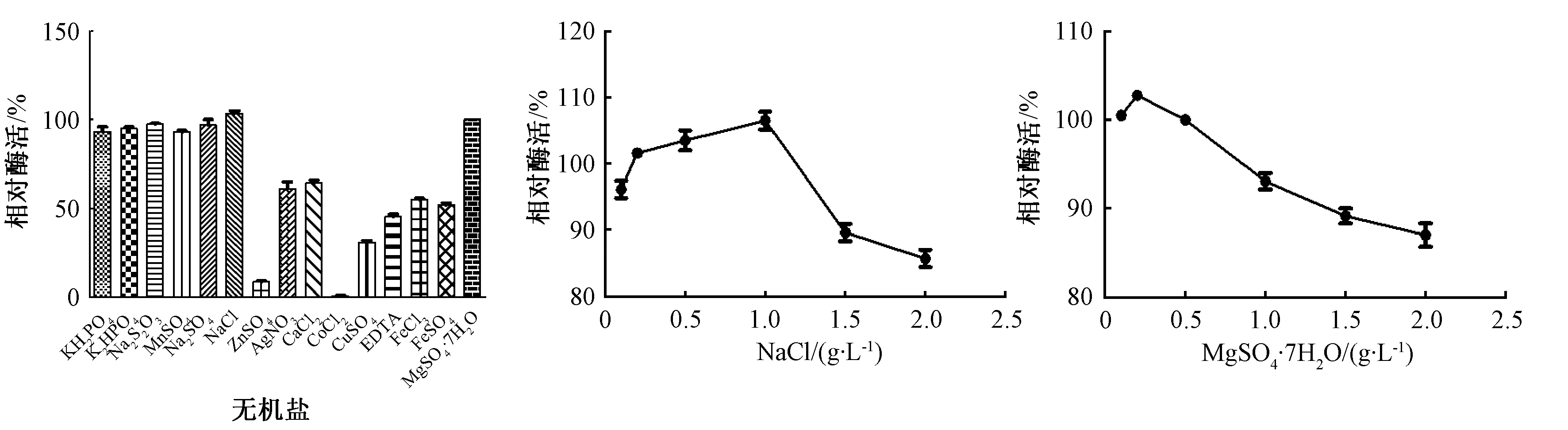
图5 不同无机盐及最优无机盐浓度对菌株Fer-ly-16发酵产酶的影响
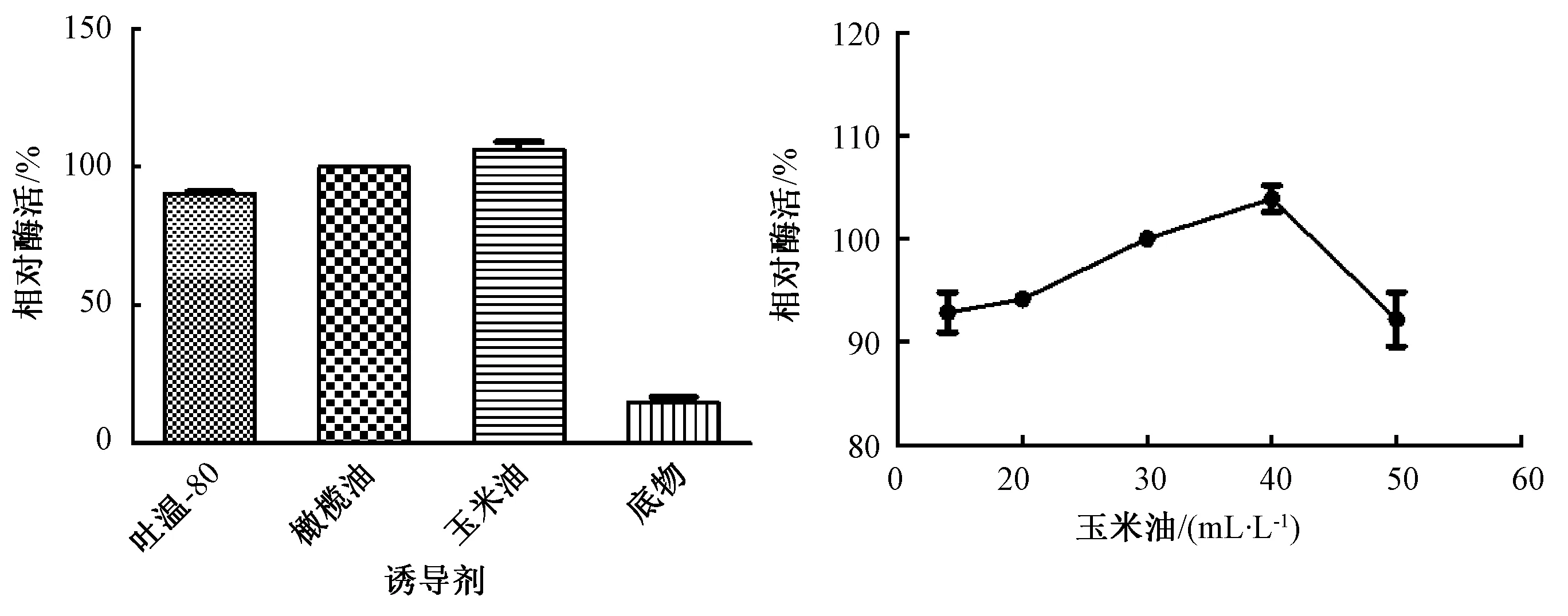
图6 不同诱导剂及最优诱导剂浓度对菌株Fer-ly-16发酵产酶的影响
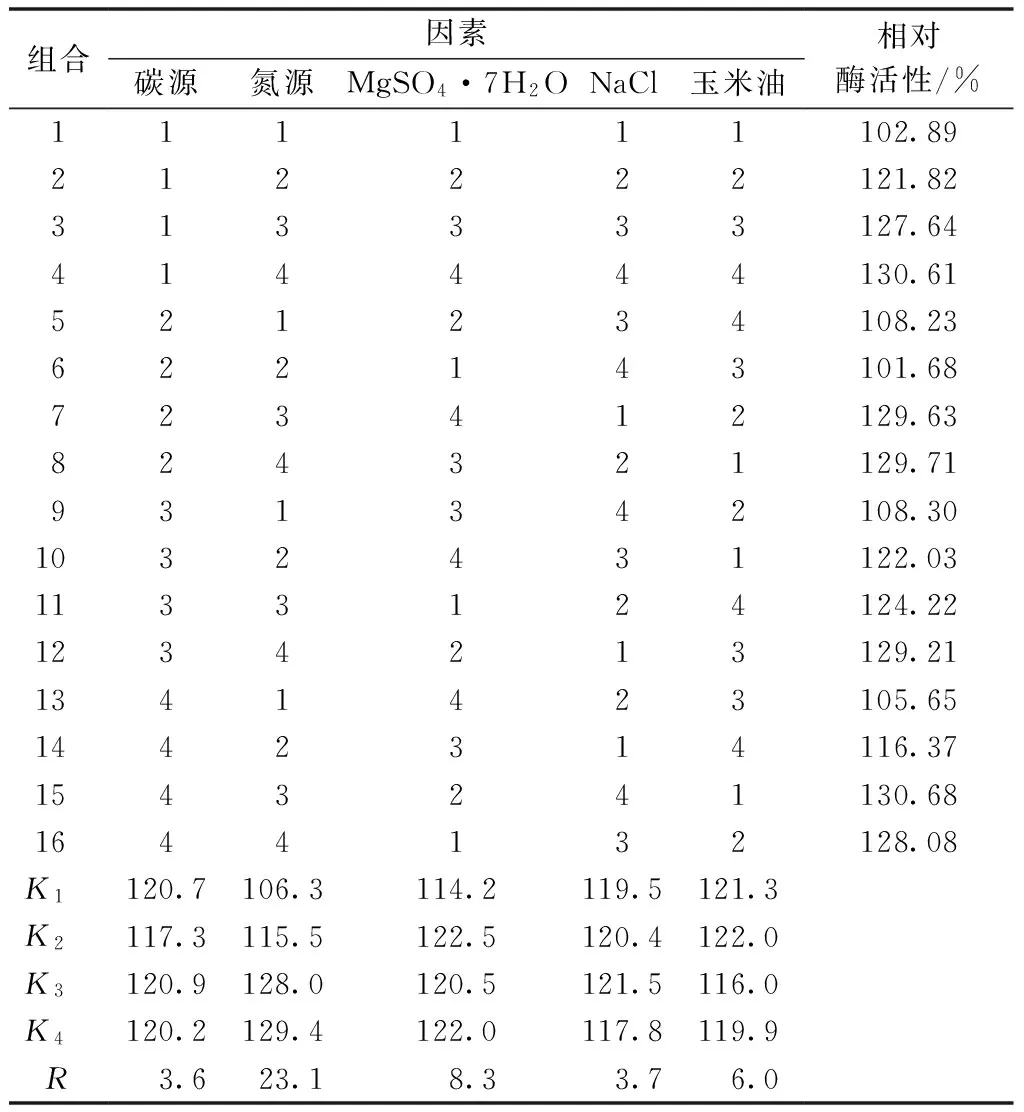
组合因素碳源氮源MgSO4·7H2ONaCl玉米油相对酶活性/%111111102.89212222121.82313333127.64414444130.61521234108.23622143101.68723412129.63824321129.71931342108.301032431122.031133124124.221234213129.211341423105.651442314116.371543241130.681644132128.08K1120.7106.3114.2119.5121.3K2117.3115.5122.5120.4122.0K3120.9128.0120.5121.5116.0K4120.2129.4122.0117.8119.9R3.623.18.33.76.0
3 小结
本研究筛选出1株可以高效水解拆分2-溴丙酸甲酯的菌株Fer-ly-16,经单菌落观察和16S rDNA分子鉴定可知,此菌株为枯草芽孢杆菌。30 ℃发酵48 h后,离心得到全细胞,该全细胞可在30 ℃下催化100 μL 2-溴丙酸甲酯,其ees达到85%,剩余底物为R-2-溴丙酸甲酯,并且可产生S-2-溴丙酸。
对菌株Fer-ly-16发酵培养基进行优化,培养基中氮源对脂肪酶活性影响最大。优化后的培养基为麦芽糖20 g·L-1,蛋白胨30 g·L-1,MgSO4·7H2O 0.5 g·L-1,NaCl 1 g·L-1,玉米油10 mL·L-1,此培养基得到的脂肪酶活性为基础培养基酶活性的1.64倍,具有较好的工业应用前景。
[1] 江紫薇, 谭琳, 谭济才, 等. 苯氧羧酸类除草剂的微生物降解研究进展[J]. 农药, 2012, 51(5): 323-326.
[2] ZAOUAK A, MATOUSSI F, DACHRAOUI M. Electrochemical degradation of a chlorophenoxy propionic acid derivative used as an herbicide at boron-doped diamond [J]. Desalination & Water Treatment, 2014, 52(7): 1662-1668.
[3] 郑卓. 手性农药与手性技术[J]. 精细与专用化学品, 2001 (23/24): 1-4.
[4] HAVALDAR F H, PATIL A R. Synthesis of biologically active 1-[2-(2-methyl-5-nitroimidazol-1-yl) acetyl]-3-substituted phenyl-4-carbaldehyde-1H-pyrazoles [J]. Asian Journal of Chemistry, 2008, 20(1): 97-101.
[5] 包文娟, 吴永果, 毛春晖, 等. 芳氧苯氧羧酸类旋光性除草剂的研究进展[J]. 精细化工中间体, 2007, 37(4): 36-38.
[6] SUN Z, PENG X, DONG X, et al. Highly selective synthesis of α-bromoesters using molecular bromine catalyzed by phosphorus [J]. Research Gate, 2012, 24(2): 929-930.
[7] 曹雪荣, 梁莹莹, 薛屏. 固定化柱状假丝酵母脂肪酶的制备与催化性能的研究[J]. 宁夏大学学报(自然科学版), 2010, 31(4): 351-355.
(责任编辑:侯春晓)
2017-03-09
魏盼盼(1992—),女,浙江余姚人,硕士研究生,主要从事酶工程研究工作,E-mail:weihangchen@163.com。
陈小龙(1970—),男,浙江仙居人,教授,博士,从事生物农药的结构修饰与生物催化制备手性农药研究工作,E-mail:richard_chen@zjut.edu.cn。
10.16178/j.issn.0528-9017.20170839
S482.4+1
A
0528-9017(2017)08-1420-05
文献著录格式:魏盼盼,陆跃乐,陈小龙. 手性拆分2-溴丙酸甲酯的菌株筛选及优化[J].浙江农业科学,2017,58(8):1420-1424,1428.
