氯硅烷残液酸性水解制备二氧化硅特性研究
2017-08-27徐卜刚李银光董森林
徐卜刚,陈 樑,李银光,赵 义,董森林
(昆明理工大学环境科学与工程学院,云南昆明650504)
氯硅烷残液酸性水解制备二氧化硅特性研究
徐卜刚,陈 樑,李银光,赵 义,董森林
(昆明理工大学环境科学与工程学院,云南昆明650504)
以氯硅烷残液为原料,盐酸为水解剂制备二氧化硅,探讨了盐酸浓度、反应温度、SiO2浓度对水解体系胶凝时间的影响,从而确定了适宜的水解条件:盐酸初始浓度为10%(质量分数)、二氧化硅质量分数为2%、反应温度为35℃。利用XRF、XRD、SEM、激光粒度分析仪、IR、TG-DSC-MS对所制备的SiO2的化学组成、相组成、形貌、粒径、化学结构、热稳定性进行测试和表征。结果表明,氯硅烷残液酸性水解制备的SiO2为非晶态,纯度达90%以上,平均粒径为34.5 μm,加热后质量损失率为1.9%,具有成为橡胶补强剤的潜力。
氯硅烷残液;酸性水解;胶凝;二氧化硅
由于能源危机的加剧,自2005年以来,光伏产业在中国迅速兴起。多晶硅作为光伏太阳能的基石,其需求量急剧增加,从而催生了多晶硅产业的快速发展。中国生产多晶硅的主流技术为改良西门子法[1],生产过程中主要的副产物为氯硅烷残液,其主要成分包括单硅氯硅烷(SiCl4、SiHCl2等)、双硅氯硅烷(Si2Cl6、SiH2Cl4等)、高沸物硅油和氯化物杂质等[2]。每生产1 t多晶硅将会产生15~20 t的SiCl4副产物[3],由此推断,氯硅烷残液的量不容小觑。由于其具有强烈的腐蚀性、高毒性,且极易与水发生水解反应生成硅酸和氯化氢,如果不能安全、妥善地处理,不仅会对周围的土壤、大气、水环境造成重大污染,而且还会危害人体健康。此外,截至2015年,多晶硅的价格从高峰期的380万元/t急剧降至目前的16万元/t[4]。因此,怎样使氯硅烷残液变废为宝成为多晶硅企业亟待解决的问题。
目前,国内外氯硅烷残液的处理方法包括水解[5]、过滤[6]、干燥[7]、燃烧[8]等。由于水解法工艺操作简单、安全、经济效益高,从而受到了中国大部分企业的青睐。氯硅烷残液中四氯化硅的质量分数可达90%[9],若利用盐酸作为水解剂,不但有利于盐酸的富集,而且生成的硅酸经洗涤、过滤、干燥等过程可制备SiO2产品。SiO2凭借其良好的补强性、增稠性、消光性等性能,被广泛地用于牙膏、橡胶、涂料、塑料、医药等领域[10-14]。然而氯硅烷残液水解过程中的胶凝现象,会大大增加水解液的过滤能耗,对企业无疑是一个重大挑战。因此,笔者以氯硅烷残液为原料,盐酸为水解剂,研究了胶凝的影响因素,确定了一个合适的水解条件,并对水解所制备的SiO2产品的性能进行测试与分析,希望能为氯硅烷残液的资源化利用提供一定的理论基础。
1 实验部分
1.1 实验原料
原料氯硅烷残液取自某多晶硅厂,其化学组成(质量分数):SiCl4,93%、SiH2Cl2,2.13%、SiHCl3,4.85%、HCl,0.02%;盐酸(AR,重庆川东化工有限公司);蒸馏水。
1.2 实验仪器
250 mL的三口烧瓶、恒压分液漏斗、H2010G型机械搅拌机、HH-2型恒温水浴锅、YHG-9245A型恒温干燥箱、Zetium型X射线荧光光谱仪、Empyrean型X射线衍射仪、MS-2000型激光粒度分析仪、TENSOR 27型红外光谱仪、VEGA3型扫描电镜、STA 449 F3型同步热分析仪、QMS 403 C型质谱仪、PGM-62X8型便携式多气体检测仪。
1.3 实验方法
将一定量的稀盐酸注入三口烧瓶中,再将其置于恒温水浴锅中,以300 r/min的搅拌速度搅拌。当加热至所需的反应温度时,氯硅烷残液通过恒压分液漏斗逐滴滴入三口烧瓶中。反应结束后,将水解得到的固体悬浮液移至试管。将试管置于与反应温度相等的恒温干燥箱中,观察水解液的胶凝时间(试管倾斜45°,水解液不流动为胶凝时间),从而确定出合适的水解条件。
2 结果与讨论
2.1 盐酸浓度、SiO2浓度及温度对水解液胶凝时间的影响
按比例分别配置质量分数为0、5%、10%、15%、20%、25%的盐酸作为水解剂。通过化学方程式(1)、(2)、(3)计算出获得2%(质量分数)的SiO2所需的氯硅烷残液的量,该组实验温度为35℃。

图1a为初始的盐酸浓度与胶凝时间的关系曲线(盐酸初始质量分数为0的实验,在实验范围时间为1 500 min内没有胶凝产生)。从图1a可见,当SiO2的浓度和温度一定时,随着初始反应盐酸浓度的增加,水解液的胶凝时间显著缩短。这是由于当反应体系中的溶胶表面吸附了一定量的H+时,通过分子间的振动及化学键的断裂,溶胶表面将生成过渡态[Si(OH)3]+,该过渡态将与其他的聚体(如单体、二聚体、多聚体)进行缩合反应,从而生成高聚物。高浓度H+的存在,增加了过渡态[Si(OH)3]+的浓度,加快了缩聚反应,导致水解液胶凝时间缩短[15]。
以20%的盐酸为水解剂,反应温度为35℃,在此条件下考察了SiO2浓度对胶凝时间的影响,结果见图1b。由图1b可知,SiO2浓度增大会导致胶凝时间缩短。这是因为随着滴加的残液量的增加,水解形成的Si—OH浓度增加,利于缩聚反应的进行。当SiO2质量分数大于2.5%时,该体系中的缩聚反应速度可能已经接近极限,导致水解液的胶凝时间基本保持不变。
以20%的稀盐酸为水解剂,SiO2的质量分数为2.5%,在此条件下考察了温度对胶凝时间的影响,结果见图1c。由图1c可见,水解反应温度越高,胶凝时间越短,这是由于体系的温度升高后,分子的平均动能增加,布朗运动的速度加快,这样单位体积内的单体和低聚物之间的碰撞几率大大提高。从而促进了反应体系的缩聚反应。
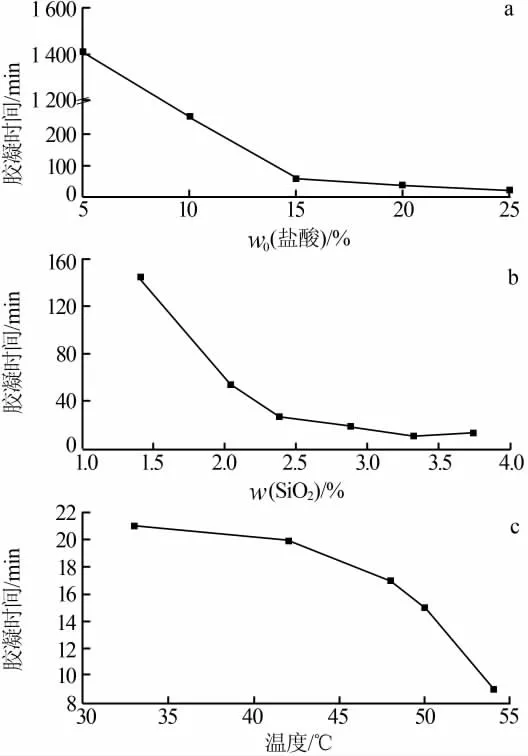
图1 初始盐酸浓度(a)、二氧化硅浓度(b)和温度(c)对水解液胶凝时间的影响
考虑到氯硅烷残液酸性水解制备SiO2产品回收盐酸的工业化应用,确定较为合适的水解条件:盐酸的初始浓度(质量分数)为10%、SiO2的质量分数为2%、反应温度为35℃。
2.2 样品的测试与表征
2.2.1 XRF和XRD分析
对样品进行XRF测定,可知SiO2的质量分数约为95.5%,Cl的质量分数约为3.5%,同时还含有少量的金属Cr、Mn、Zn等微量元素,这些微量元素可能来自原材料氯硅烷残液。图2为SiO2粉末的XRD谱图。由图2可见,并未发现狭窄尖锐的晶体衍射峰存在,仅在23°附近出现了一个较强且较宽的衍射峰,表明实验所制备的样品为非晶态的SiO2粉末[16]。
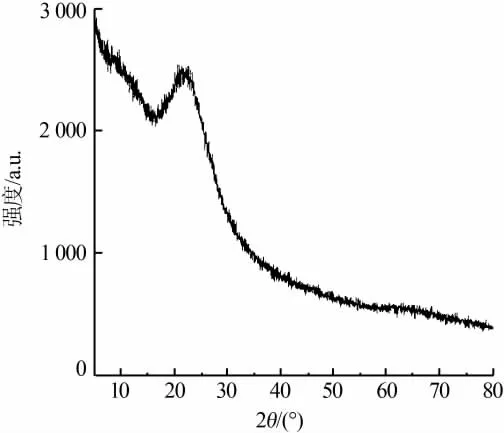
图2 SiO2样品的XRD谱图
2.2.2 SEM及红外分析
图3为SiO2粉末的SEM照片。由图3可以看出,SiO2样品的分散性较差、聚集严重、粒径分布不均匀。这可能是由于SiO2颗粒在形成的过程中,形成的一次颗粒小、表面积大、表面能高、处于能量的不稳定状态,很容易发生聚集而达到胶体稳定状态。

图3 SiO2样品的SEM照片
图4为SiO2样品的红外光谱图。根据相关文献[17-18]和理论推测可知,图4中457、795、1 080 cm-1处的吸收峰分别对应Si—O—Si键的弯曲振动、对称伸缩振动、反对称伸缩振动,968 cm-1处弱的吸收峰,对应Si—OH键的弯曲振动峰。1 641 cm-1处的吸收峰是 SiO2表面吸附水的弯曲振动吸收峰,3 441 cm-1处强而宽的吸收峰,对应的是硅羟基和结合水中—OH键的反对称伸缩振动峰,2 260 cm-1处的峰是由Si—H键的伸缩振动所造成的,Si—H键的存在是因为SiH2Cl2和SiHCl3中的Si—H键在酸性条件下水解速率缓慢,导致其在反应过程中未水解完全所引起的。其中,457、795、968、1 080 cm-1处的吸收峰为SiO2的特征吸收峰。
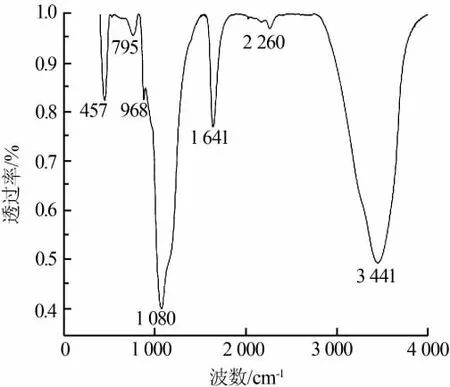
图4 SiO2样品的红外光谱图
2.2.3 SiO2粒径分布
将SiO2粉末分散在蒸馏水中超声1 h后,用激光粒度分析仪测定SiO2的粒径大小,结果见图5。由图5可见,SiO2样品的平均粒径为34.6 μm,约74%的粒径小于45 μm,这表明样品中的大部分粒径满足行业标准HG/T 3061—2009《橡胶配合剂沉淀水合二氧化硅》中橡胶补强剂的要求。
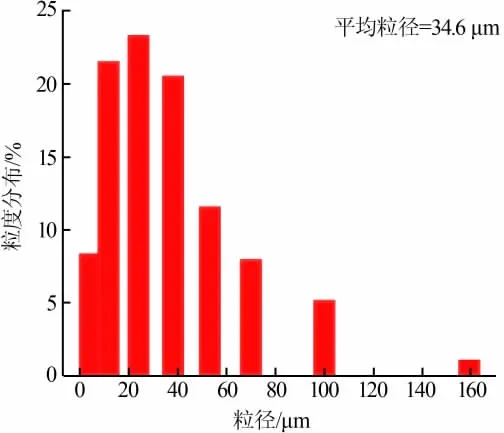
图5 SiO2样品的粒径分布
2.2.4 TG-DSC-MS分析
图6为二氧化硅样品的TG-DSC-MS曲线。由图6可见,TG曲线在 55~175.6℃质量损失率为0.41%,表示物理吸附水和结晶水的析出;H2O的MS曲线在 106.5~175.6℃区间的析出峰,证明该阶段有大量的H2O析出;当温度高于175.6℃时,二氧化硅的质量损失归因于连生的、邻位的、孤立的硅羟基的热分解[19]。连生羟基指的是2个羟基同时连接在同一个硅原子上的情况。相邻羟基是2个羟基分别连接在相邻的硅原子上的情况。孤立羟基,即羟基所连接的硅原子相邻的硅原子上无羟基连接的情况。而孤立的羟基比较稳定,在温度高于600℃下才会分解[19]。 由H2的MS曲线可知,在370.4~676.0℃区间是H2的主要析出阶段,该阶段产生的氢气来源于Si—H键的热分解。 由DSC曲线在175.6~ 1 500.0℃区间内缓慢的放热反应可知,试样在该温度段由非晶态向晶态过渡。
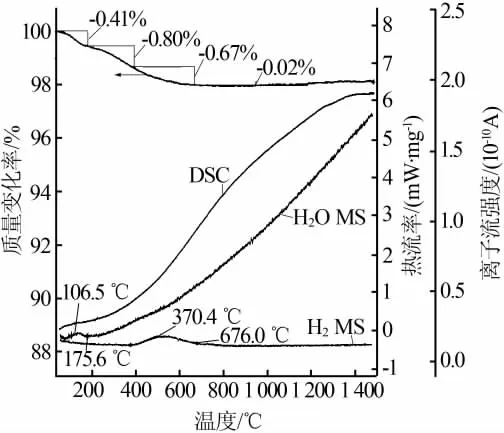
图6 二氧化硅样品的TG-DSC-MS曲线
3 结论
实验研究了盐酸浓度、SiO2浓度、温度对水解体系胶凝时间的影响,确定了适宜的水解条件:盐酸初始浓度为10%(质量分数)、SiO2的质量分数为2%、反应温度为30℃。通过实验分析可知,氯硅烷残液酸性水解制备的SiO2为非晶态,其纯度达90%以上,大部分的颗粒直径小于45 μm,加热后质量损失率为1.9%,具有成为橡胶补强剂的潜力。
[1] 刘秀琼,唐正林,多晶硅生产技术—项目化教程[M].北京:化学工业出版社,2013.
[2] 周迎春.多晶硅生产中氯硅烷残液的资源化处理与利用[J].中国化工贸易,2015,7(26):96.
[3] 姜利霞,万烨,司文学,等.一种用于处理冷氢化料的低能耗精馏工艺[J].化工管理,2014(12):91-92.
[4] 顾楠.促进硅产业协调发展[J].中国有色金属,2015(19):46-48.
[5] 唐前正,张新,李钊.改良西门子法多晶硅生产中残液及尾气处理工艺:中国,103112277[P].2009-12-11.
[6] Kohler B,Schulz E,Vendt B.Separation of metal chlorides from their suspensions in chlorosilanes:US,6602428[P].2003-10-05.
[7] Breneman W C.Process for the treatment of waste metal chlorides:US,0193958[P].2006-08-17.
[8] 姜静,刘毅,唐明元.多晶硅生产中含氯硅烷废气、废液的燃烧处理工艺:中国:105229593[P].2010-10-26.
[9] 黄国强,杨劲,王红星.四氯化硅残液处理方法的研究进展[J].化工进展,2012,31(8):1828-1833.
[10] 马慧斌,朱春雨,宁延生,等.用作牙膏磨擦剂和增稠剂的二氧化硅[J].无机盐工业,2005,37(2):7-9.
[11] 王明贤,支恒学,赵泽艳,等.四氯化硅滴定法制备白炭黑的实验研究[J].硅酸盐通报,2013(7):1269-1275.
[12] 王惠玲,闫岩,朱春雨.合成二氧化硅对硅橡胶性能的影响[J].无机盐工业,2007,39(2):55-58.
[13] 张周赫,张忆,李春山,等.白炭黑合成工艺研究[J].无机盐工业,2016,48(11):49-51.
[14] 刘希春,朱信明,刘琼琼,等.绿色轮胎给沉淀法白炭黑带来的机遇与挑战[J].无机盐工业,2016,48(12):1-5.
[15] 高朋召,王红洁,金志浩.SiO2溶胶-凝胶转变过程的动力学研究及应用[J].复合材料学报,2003,20(4):122-127.
[16] Yan F,Jiang J,Chen X,et al.Synthesis and characterization of silica nanoparticles preparing by low-temperature vapor-phase hydrolysis of SiCl4[J].Industrial&Engineering Chemistry Research,2014,53(30):11884-11890.
[17] Wilson M,Madden P A,Hemmati M,et al.Polarization effects,network dynamics,and the infrared spectrum of amorphous SiO2[J].Physical Review Letters,1996,77(19):4023-4026.
[18] Jal P K,Sudarshan M,Saha A,et al,Synthesis and characterization of nanosilica prepared by precipitation method[J].Colloid. Surface.A,2004,240(1):173-178.
[19] Kim J M,Chang S M,Kong S M,et al.Control of hydroxyl group content in silica particle synthesized by the sol-precipitation process[J].Ceramics International,2009,35(3):1015-1019.
联系方式:kmchenliang@hotmail.com
Study on properties of silica prepared by acid hydrolysis of chlorosilane residues
Xu Bugang,Chen Liang,Li Yinguang,Zhao Yi,Dong Senlin
(School of Environmental Science and Engineering,Kunming University of Science and Technology,Kunming 650504,China)
The silica were prepared by using silicon tetrachloride residue as raw material and hydrochloric acid as hydrolysis agent.The effects of hydrochloric acid concentration,the reaction temperature,and SiO2concentration on the gelation time of the hydrolysis system were investigated.The appropriate hydrolysis conditions,i.e.the initial hydrochloric acid concentration of 10%(mass fraction),SiO2mass fraction of 2%,and reaction temperature of 35℃were determined.The sample chemical composition,phase composition,morphology,particle size,chemical structure,and thermal stability were tested and characterized by XRF,XRD,SEM,laser particle size analyzer,IR,and TG-DSC-MS.Results indicated that SiO2prepared by the acid hydrolysis of chlorosilane was amorphous,with a purity of more than 90%,the average particle size of 34.5 μm,and the heating loss of 1.9%.The sample has a potential to be a rubber reinforcing agent.
chlorosilane residues;acid hydrolysis;gel;silica
TQ127.2
A
1006-4990(2017)08-0064-04
2017-02-10
徐卜刚(1991— ),男,硕士研究生,主要从事氯硅烷残液的资源化利用。
陈樑
