茶树CsASR基因的克隆及其表达分析
2017-08-27岳川曹红利郝心愿郭玉琼叶乃兴王新超杨亚军
岳川,曹红利,郝心愿,郭玉琼,叶乃兴,王新超*,杨亚军*
1. 福建农林大学园艺学院/茶学福建省高校重点实验室/中国乌龙茶协同创新中心,福建 福州 350002;2. 中国农业科学院茶叶研究所/国家茶树改良中心/农业部茶树生物学与资源利用重点实验室, 浙江 杭州 310008
茶树CsASR基因的克隆及其表达分析
岳川1,2,曹红利1,2,郝心愿2,郭玉琼1,叶乃兴1,王新超2*,杨亚军2*
1. 福建农林大学园艺学院/茶学福建省高校重点实验室/中国乌龙茶协同创新中心,福建 福州 350002;2. 中国农业科学院茶叶研究所/国家茶树改良中心/农业部茶树生物学与资源利用重点实验室, 浙江 杭州 310008
逆境胁迫影响茶树生长发育及茶叶品质,ASR(abscisic acid, stress, ripening-induced)基因在植物抗逆响应中具有重要功能。本研究以龙井43品种茶树为材料,从中克隆了CsASR基因的全长cDNA序列、基因组序列及其启动子序列,分析了该基因的生物信息学特征及在组织间和不同胁迫处理下的表达模式。结果显示,CsASR的cDNA序列全长875 bp,含有546 bp的ORF序列,编码181个氨基酸,蛋白质分子量19.89 kD,理论等电点 5.69;CsASR蛋白结构序列中 74.5%的序列为无序结构,是一种无序蛋白;CsASR的 C-端含有ABA/WDS功能结构域,主要定位于细胞质和细胞核中;茶树CsASR与海枣的ASR相似性最高,为87%,而在进化树中与枣的关系最近。CsASR基因含2个外显子,第1个外显子长363 bp,第2个外显子长183 bp,内含子较大为2 750 bp,内含子中含7种简单重复序列和2种DNA转座子序列。克隆获得起始密码子ATG上游2 554 bp的启动子区序列,该启动子上含有干旱、低温、高温以及ABA等相关的顺式作用元件。CsASR在根中的表达量最低;ABA抑制 CsASR的表达,而干旱、NaCl和低温胁迫能够显著上调 CsASR的表达。表明CsASR基因可能与茶树抗逆密切相关。
茶树;ASR基因;逆境胁迫;基因克隆
逆境胁迫,如干旱、低温等严重影响植物的生长。植物在遭受逆境胁迫时,能够诱导逆境响应基因表达,适应不利的环境条件。ASR(abscisic acid, stress, ripening-induced)基因是在植物中新发现的一种逆境响应特异基因。从Iusem等[1]于1993年发现ASR基因到目前为止,大量的研究显示,ASR基因在植物逆境胁迫响应和生长发育调控中都有重要的作用。ASR是一类由少数多基因家族编码的小蛋白(300个氨基酸以下),编码蛋白分子量在11.0~33.0 kD。其蛋白富含组氨酸、谷氨酸和赖氨酸,具有较高的亲水性,这对其在逆境胁迫下的作用发挥起关键作用[1-2]。它属于ABA/WDS蛋白家族中一类特异的蛋白亚家族,该家族蛋白与植物抵御渗透胁迫等逆境响应密切相关,ASR的 C-端含有保守的ABA/WDS功能结构域,是 ASR蛋白的重要结构特征。
鉴于ASR在植物中的重要功能,目前,多种植物中的 ASR基因已被鉴定并开展了较深入的研究。大部分植物中的 ASR基因家族成员主要在5个左右,如番茄中含有5个[3],苹果中有5个[4],玉米中最多为9个[5],而在拟南芥中没有发现 ASR同源基因。基因功能研究显示,ASR既可以作为转录因子在细胞核内转录激活基因表达,也能够在胞质中作为分子伴侣起作用[6-11]。大量研究表明,在拟南芥植物中过表达 ASR基因能够提高植物对低温、干旱、高盐等非生物及多种病害的抵御能力。Virlouvet等[5]研究发现,在缺水条件下 ZmASR1能够影响支链氨基酸的生物合成等代谢,进而提高玉米的籽粒产量。Saumonneau等[12]和 Jia等[6]的研究显示,ASR参与 ABA和糖信号介导的植物生长发育。Arenhart等[9,13-14]的一系列研究表明,OsASR5在水稻抵御铝毒害中具有重要的功能。Sun等[15]最新研究发现 1个在香蕉雌花中特异表达的MaASR基因,过表达该基因延迟转基因植株的开花时间。从以上研究结果可以看出,ASR在植物中具有广泛的功能,该基因在植物抗逆等生理活动中具有广阔的研究前景和应用价值。
然而,茶树中有关 ASR基因的信息未见报道。前期,我们从茶树冷驯化和低温胁迫等转录组数据库中筛选出大量与茶树抗寒等逆境响应相关的基因,其中获得 1条ASR的同源序列。在此基础上,本研究首先克隆了茶树CsASR基因的cDNA全长序列,并扩增获得了该基因的基因组序列,然后通过 Genome Walker扩增获得了它的启动子序列,对CsASR基因的基本生物信息学特征分析,检测了CsASR在不同组织和低温、干旱、ABA和盐胁迫下的表达模式。研究结果为茶树抗逆功能基因研究提供参考。
1 材料与方法
1.1 茶树总 RNA提取、cDNA合成及基因组DNA提取
参照文献[16]的方法,用0.5~1.0 g茶树样品为材料,提取总RNA,测定其RNA浓度及电泳检测完整性后,逐步稀释调整质量浓度到1 μg·μL-1,于-80℃保存备用。
按照SMART RACE试剂盒(Clontech,Mountain View,USA)的说明,分别用 1 μg茶树总 RNA 为模板,合成 5′-和 3′-的 cDNA链,用于RACE-PCR扩增全长;用1 μg茶树总 RNA为模板,根据 SuperScript Ⅲ试剂盒(Invitrogen,Carlsbad,USA)的操作说明,合成cDNA用于荧光定量PCR(qRT-PCR)和逆转录转录PCR(RT-PCR)。
按照天根植物DNA提取试剂盒(DP305-2)的操作说明提取茶树基因组 DNA,在Nanodrop2000中检测 DNA的纯度并测定浓度,通过1.0%琼脂糖凝胶电泳检测DNA的完整性,检测合格的DNA样品置于-80℃保存备用。
1.2 CsASR基因的全长cDNA克隆
将茶树转录组中的 ASR基因序列片段在NCBI中进行BLASTx比对分析,结果显示缺少 3′-端。以该序列为模板,设计 3′-RACE特异引物CsASR-3:AGACCACCAACGCCTAT GGAAGC,进行 RACE扩增。实验方法参照SMART RACE试剂盒的说明进行,50 μL反应体系,PCR条件为94℃ 30 s,68℃ 30 s,72℃ 2 min,35个循环。PCR产物经1.0%琼脂糖凝胶电泳检测,产物回收纯化后,连接到PMD18-T表达载体,转入大肠杆菌DH5α,于氨苄固体培养基中37℃培养过夜,随机挑取2个阳性克隆进行测序。测序结果与原片段进行拼接,初步获得全长cDNA序列,在ORF两端设计RT-PCR引物CsASR-F:CACAATGG CCGAAGAGAAGCA和CsASR-R:AAAGAG GTGGTGGTGCTTC,验证该序列的准确性,并最终获得该基因的全长cDNA序列。
1.3 CsASR全长基因组序列和启动子扩增
参照已获得的CsASR全长cDNA序列,用龙井 43茶树品种的 DNA为模板,利用PrimeSTAR HS试剂盒,以步骤 1.2中的RT-PCR引物扩增基因组全长序列,50 μL PCR反应体系。参考其他植物中ASR基因的全长,设置 PCR扩增程序为:98℃ 10 s,55℃ 10 s,72℃ 3 min,30 个循环后 72℃反应 5 min。PCR产物回收测序,获得目的基因的基因组序列。
以 CsASR基因组序列为模板,按照Clontech公司的GenomeWalker 2.0试剂盒操作步骤,先构建克隆启动子的DNA酶切文库,参照实验要求设计启动子扩增引物CsASR-P1:TGGTGGTGTCACCATATCCGGT GGTGG和CsASR-P2:CTCTTCGGCCATTG TGGTGCTGATCGG,采用试剂盒推荐的体系和程序进行PCR扩增。PCR产物电泳检测后,回收测序,获得基因的启动子序列。
1.4 CsASR基因的生物信息学分析
用 DNAStar软件包对序列进行拼接;用DNAMAN软件进行开放阅读框查询;核酸序列及氨基酸序列分别在 NCBI数据库中用BLASTn和BLASTx分析;将序列用ClustalW比对后,在CLC6.0中输出同源比对结果并在MEGA6.0软件中用邻近相连法构建系统进化树;用EXPASY(http://expasy.org/tools)中的TargetP、ProtParam、SingalP等工具对氨基酸序列进行生物信息学分析;NetPhos 2.0 server预测磷酸化位点;N-糖基化位点和蛋白激酶位点在PROSCAN. BASE (http://npsa-pbil.ibcp.fr)中预测;FoldIndex(http://bioportal.weizmann.ac.il/fldbin/findex)用于分析序列的可折叠特性;SWISS-MODEL模拟蛋白质三级结构,Pymol编辑输出。
基因的转录起始位点、外显子和内含子所在位点等信息在 Augustus(http://bioinf.uni-greifswald.de/augustus/submission)中预测,基因结构在GSDS(http://gsds.cbi.pku.edu.cn)中显示。内含子重复序列及转座子序列在RepeatMasker(http://www.repeatmasker.org)中进行预测分析,CpG岛在 MethPrimer(http://www.urogene.org/cgi-bin/methprimer/methprimer.cgi)中预测,获得的启动子序列先在NCBI中用BLASTn方法比对分析后,在PlantCARE(http://bioinformatics.psb. ugent.be/webtools/plantcare/html)中对启动子序列所含顺式作用元件进行预测分析。
1.5 CsASR基因的表达模式分析
以生长健壮的 2年生盆栽龙井 43茶树为材料,参照Yue等[17]的方法进行低温(4℃)、ABA(100 μmol·L-1)、高盐(250 mmol·L-1NaCl)和干旱(10% PEG-6000)处理。调节人工气候室温度并使之维持在(4±1)℃,将生长在另一温室(25±2)℃中的茶树迅速移入低温气候室中,进行低温处理,并于 0、2、8、24 h时分别从至少3株茶苗上取枝条顶端第2~3片成熟叶为材料;用超纯水配制 100 μmol·L-1浓度的ABA溶液,均匀喷洒茶树叶片上,分别在0、2、8、24 h时取枝条顶端第2~3片成熟叶为材料;用纯净水配制250 mmol·L-1的NaCl溶液,采用浇灌方式将溶液缓慢注入盆中,直至浇透,并有大量溶液从底部流出,来对茶苗进行盐胁迫处理,并于0、8、24 h时取枝条顶端第2~3片成熟叶为材料;将茶苗从土中取出,用自来水洗净根部土壤后,迅速置于纯净水配制的 10% PEG-6000溶液中,分别在 0、2、8 h时取样后,用自来水将根部PEG去除,并于纯净水中恢复,在恢复48 h时取样,用于检测目的基因在干旱胁迫后复水过程的表达模式。每个处理进行3次生物学重复。于2013年10月取生长健壮并有花芽开放的茶苗5盆,先取顶端第 2~3片成熟叶、顶芽下 1 cm茎段及全开的茶花,然后将茶苗从盆中取出,先后用自来水和纯净水冲洗除去泥土,迅速剪下幼嫩根。从5盆茶苗上取下的组织混匀后再分别分成3份。所有样品液氮速冻后保存于-80℃,提取RNA,检测基因的表达模式。
根据序列特异性,设计 qRT-PCR引物qASR-F:AAGCCCATCGATTCAGCTCC 和qASR-R:TTCCATAGGCGTTGGTGGTC,以茶树polypyrimidine tract-binding protein 1 (PTB1)基因[18]作为内参基因,按照 SYBR Premix Ex Taq试剂盒(TAKARA公司)的操作步骤,采用20 μL体系于ABI PRISM7500实时定量PCR仪上检测目的基因的表达水平。PCR主要程序为:95℃ 15 s,94℃ 5 s,60℃ 34 s,共 40 个循环,结果采用 2-ΔΔCT算法进行分析,并用SPSS17.0对数据显著性进行分析。
2 结果与分析
2.1 CsASR基因的cDNA全长克隆及生物信息学特征分析
RACE-PCR扩增获得茶树CsASR基因的3′-端638 bp序列(图1-A),与原目的片段拼接获得全长 cDNA序列。该 cDNA序列全长875 bp,其中 ORF序列长 546 bp(图 1-B),编码181个氨基酸,并提交GenBank(登录号为:KF880380)。
2.1.1 CsASR的理化性质预测分析
利用ProtParam对CsASR基因编码的蛋白的特征进行预测分析,结果显示,该蛋白质的相对分子量较小,仅为 19.89 kD,分子式为C866H1272N250O292S1;含酸性氨基酸(Asp+Glu)34个,碱性氨基酸(Arg+Lys)18个,理论等电点 5.69,属酸性蛋白;其半衰期较长,为30 h,不稳定系数为 35.17,表明该蛋白质的化学性质相对稳定。CsASR中富含甘氨酸(Gly,24个,占13.26%)、组氨酸(His,22个,占 12.15%)、谷氨酸(Glu,25个,占13.81%)、苏氨酸(Thr,18个,占9.94%)、赖氨酸(Lys,16个,占 8.84%)和丙氨酸(Ala,15个,占8.29%)等氨基酸,这与其他植物中报道的 ASR的氨基酸组成比例相似[19],与ASR蛋白功能密切相关。
2.1.2 CsASR的序列特征
CsASR的结构具有较强的可变性。利用FoldIndex在线预测软件对 CsASR的结构折叠性进行预测,结果显示,在序列中高达74.5%的氨基酸(即135个氨基酸位点)组成的结构属于无序结构(图 2),由其构成的结构具有较强的可变性,因此,CsASR是一个无序蛋白。
在NetPhos 3.1 Server中对CsASR所含磷酸化位点进行预测,结果显示,该序列含 25个磷酸化位点,其中6个丝氨酸(Ser)位点、12个Thr和7个络氨酸(Tyr)位点,约占全序列的13.8%,主要能够被蛋白激酶C(PKC)、酪蛋白激酶Ⅰ(CKI)、酪蛋白激酶Ⅱ(CKII)和 SRC等蛋白激酶磷酸化;而PROSCAN.BASE中分别预测到 PKC、CKII和酪氨酸激酶磷酸化位点各为1、2、2个。同时,CsASR还含有8个N-糖基化位点,分别为第 29、42、43、65、67、70、78、112号位点上的甘氨酸(Gly)。
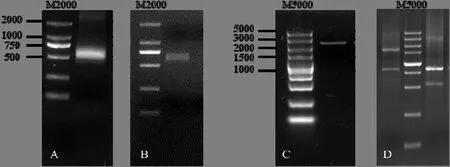
图1 CsASR克隆电泳图Fig. 1 Electrophoresis results of CsASR cloning
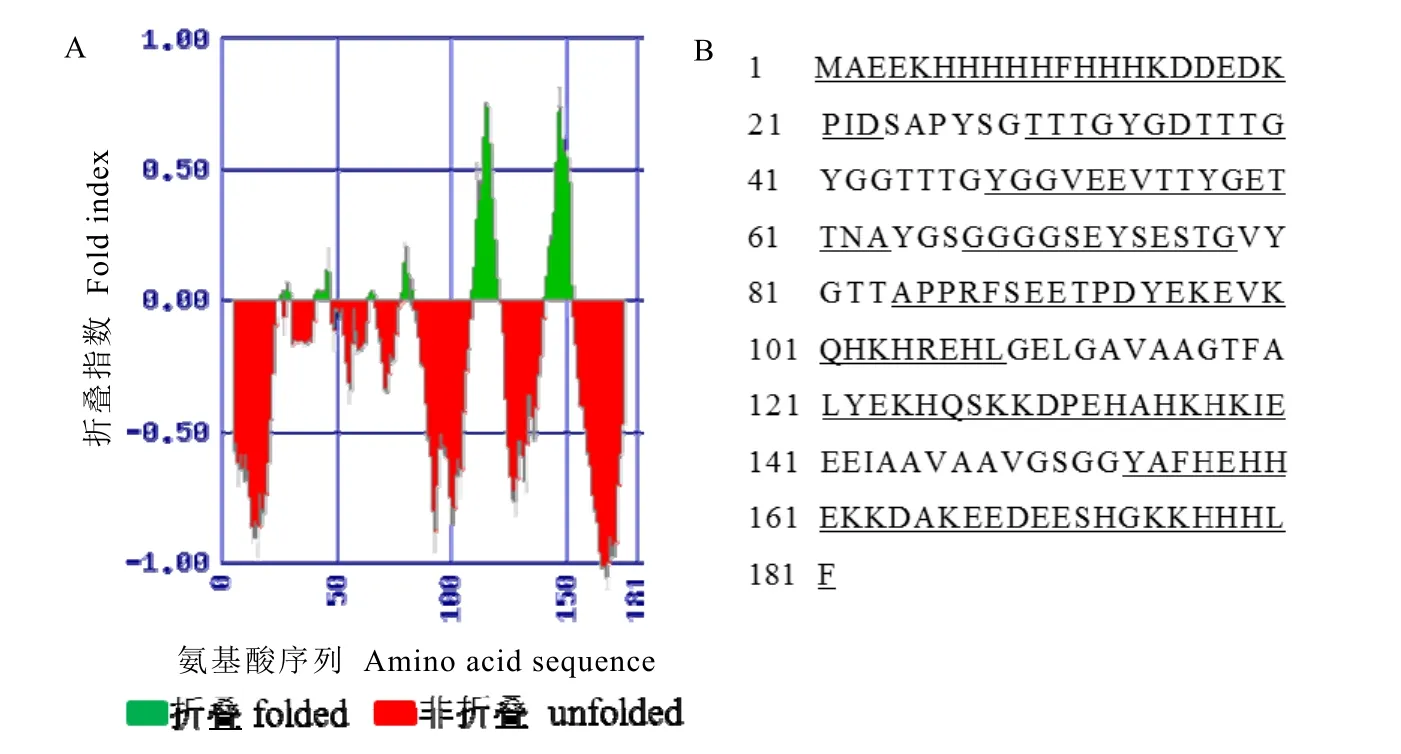
图2 CsASR序列的折叠性预测Fig. 2 The folding characteristics of the CsASR protein
2.1.3 CsASR的亚细胞定位预测分析
TargetP1.1中的预测结果显示,cTP、mTP、SP和 other的预测值分别为 0.123、0.118、0.102和 0.919,表明该基因定位在除叶绿体和线粒体外的其他亚细胞器的可能性较大;SignalP4.1中的预测结果显示,该序列中不含信号肽输出位点;WoLF PSORT预测的结果显示其定位在细胞质、细胞核、叶绿体和线粒体的K值分别为6、3、2和1,说明该基因定位在细胞质和细胞核等亚细胞器上的可能性最大;综合TargetP、SignalP和WoLF PSORT的预测结果,推测本研究获得的CsASR可能定位在细胞质和细胞核等亚细胞器中。
2.1.4 CsASR的序列联配及系统发育树分析
在 NCBI数据库中采用 BLASTX和BLASTP对该基因进行同源比对查找,结果显示,未有茶树等茶组植物中相关的序列与之匹配;且该基因与比对出的 ASR序列相似性较高,主要都在 50%以上,如与芭蕉(Musa balbisiana)、油棕(Elaeis guineensis)和蓖麻(Ricinus communis)的相似性分别为85%、84%和80%,其中与海枣(Phoenix dactylifera)的相似性最高,为87%。保守结构域预测显示,CsASR中的第94位至第170位氨基酸序列为ABA/WDS超家族的保守结构域,这是 ASR主要的特征功能域。
对来自不同物种中的 ASR氨基酸序列进行联配分析,结果显示,它们的 N-端序列保守性较低,但在N-端第4或第5个氨基酸后面均含有1个由6~8个组His构成的保守结构域,而该结构域后的序列相似性较低,氨基酸序列长度变异较大;ASR的 C-端序列保守性较高,含有约90个氨基酸序列长度的保守域,在该保守域中,含有ASR特异的保守功能结构域——ABA/WDS功能域以及1个富含His的功能域(图3-A)。在MEME中对来自不同物种中的ASR的保守序列进行预测,结果显示,在所预测的ASR序列中主要含有5个不同的保守结构域,即 M1-M5,且它们在氨基酸序列上的排列顺序均相似,其中M1和M2共同构成了 ABA/WDS保守功能结构域(图3-B),这是ASR的特异结构。
选取23种不同植物中的ASR构建进化树分析,结果显示,这些ASR可以聚为2类,即Group A和Group B,其中茶树CsASR聚在Group A中,且与枣(Ziziphus nummularia)的关系最近(图4)。
2.2 CsASR基因的全长基因组序列和启动子序列克隆及分析
以ORF两端的引物进行PCR扩增获得大小约 3 000 bp的条带(图 1-C),该片段序列测序后,获得长度为3 278 bp的序列(GenBank登录号:KY697275),在NCBI中进行BLASTn序列比对分析,结果显示,该基因能够与茶树等植物中的 ASR基因的 cDNA序列匹配。在AUGUSTUS中对基因的结构进行预测,结果显示该序列由1个内含子和2个外显子构成,转录的cDNA序列经比对结果为CsASR基因。2个外显子中,第1个外显子较大,长363 bp,第2个外显子只有183 bp,内含子较大,长2 750 bp(图5)。在多种植物中,ASR主要由2个外显子组成,但它们所含的内含子较小,一般在800 bp以下,苹果MdASR2的内含子最长,为1 587 bp,但比CsASR的内含子短(图5)。对CsASR的内含子分析显示,该序列不含 CpG岛;含有 7个不同类型的简单重复序列,分别是(TATC)n、(ATT)n、(AT)n、(AAAT)n、(T)n、(TTTTAT)n和(TTTAATT)n,占内含子序列长的12.15%,含2种DNA转座子DNA/TcMar-Stowaway(2058-2144)和 DNA/CMC-EnSpm(2082-2153)。
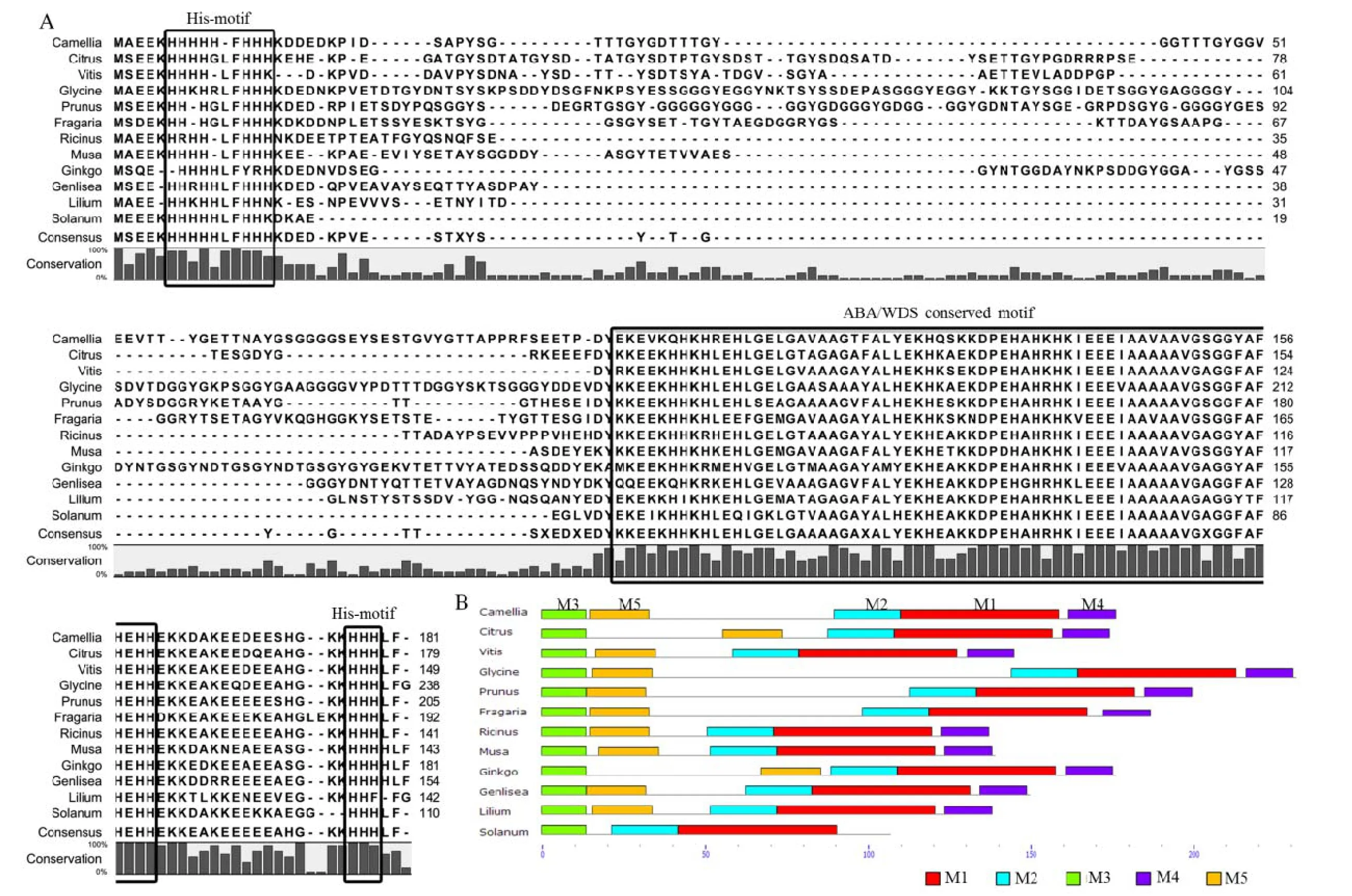
图3 不同植物中的ASR 序列联配(A)及MEME 预测保守域(B)结果分析Fig. 3 Alignment of ASR (A) and motif prediction analysis using MEME database (B)
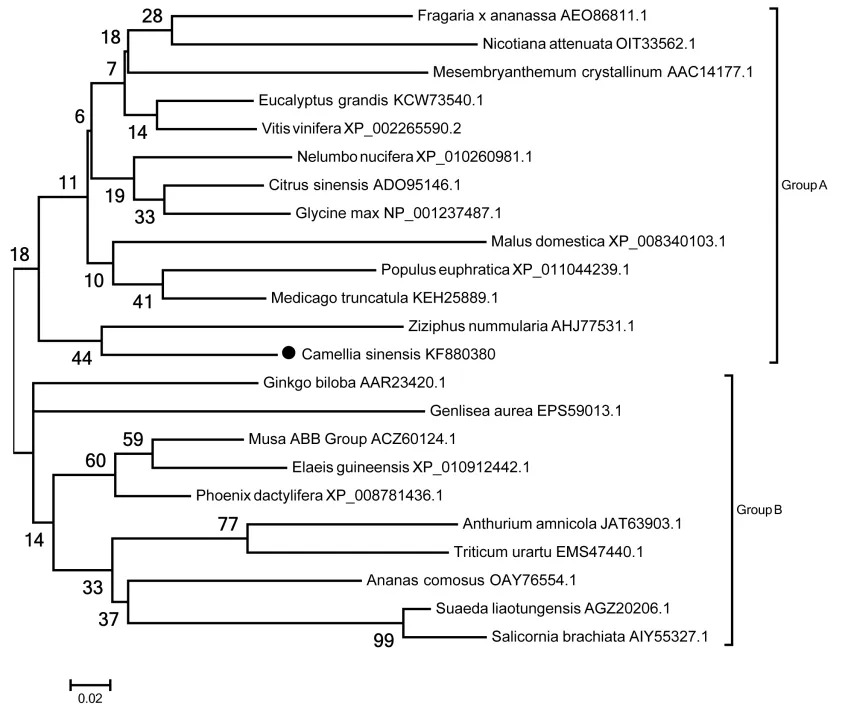
图4 CsASR的进化树分析Fig. 4 Phylogenetic tree analysis of CsASR

图5 ASR基因结构分析Fig. 5 Structure analysis of the ASR genes
通过GenomeWalker方法,在EcoR V和Pvu II的酶切文库中扩增出多条清晰片段(图1-D),将大小在800 bp以上的条带回收测序,测序结果拼接获得2 539 bp的片段,该序列与基因组序列拼接后,获得起始密码子ATG上游2 554 bp的启动子区(GeneBank登录号:KY697274)。在PLANTCARE中对该序列所含顺式作用元件进行预测,结果显示,CsASR启动子区含有多种与植物逆境胁迫相关的顺式作用元件,如干旱胁迫响应相关的 MBS、低温响应相关的 LTR、高温响应相关的 HSE等,其中发现2个与ABA响应相关的元件,分别在 ATG上游-1553和-2471;在该序列上还预测到多个与茉莉酸甲酯、乙烯、生长素等植物激素响应相关的元件(表 1);除了生物钟 circadian元件外,该启动子上还含有多个受光照调控的响应元件。从启动子区顺式作用元件分析结果表明,该基因与茶树的环境适应密切相关。

表1 CsASR启动子区与逆境响应相关的主要顺式作用元件预测Table 1 Prediction of the major stress-responsive cis-elements in the promoter ofCsASRgene
2.3CsASR基因的表达分析
采用qRT-PCR技术对CsASR基因的组织表达特异性及其在 ABA、干旱、高盐和低温胁迫下的表达进行了检测,结果显示,CsASR在 4种组织中具有表达,且在根中的表达最低,在茎和花中具有较高的表达量(图6-A);ABA处理后,CsASR的表达被显著抑制,在24 h的处理过程中其表达量均显著地低于对照;PEG模拟干旱胁迫处理后,CsASR被迅速诱导表达,8 h时表达量最高,达8.32,干旱恢复处理 48 h后该基因的表达量降低至4.52,但仍显著高于处理前的水平;NaCl处理能显著上调CsASR基因的表达,在 4 h和24 h时间点上检测的表达量均是处理前的 2倍以上;同样,低温胁迫条件下CsASR的表达随处理时间的延长逐渐升高,在 24 h达到最大,为3.17(图 6-B~图6-E)。表明该基因可能参与茶树抗逆响应。
3 讨论
ASR基因是一类受干旱诱导的基因。本研究中,我们首先克隆了茶树CsASR基因的全长 cDNA序列,该基因编码 181个氨基酸序列,分子量为 19.98 kD,其大小与多种植物中的ASR大小相当。ASR是植物特有的一类小分子蛋白,其蛋白质大小主要在 200个氨基酸以下[1]。从香蕉、番茄、二穗短柄草、苹果、谷子等植物中的ASR基因家族的编码蛋白大小的结果中可以看出,几种植物中已鉴定出的最小ASR仅编码101个氨基酸(谷子 ASR6,Si011429),番茄 ASR4最大,也仅编码297个氨基酸[3-4,20-22]。CsASR在C-端具有90个氨基酸左右的保守域,该保守域中包含了 ABA/WDS功能域,该功能域是干旱响应相关基因编码蛋白特有的一种结构域,所有的ASR等均含有此功能域[1]。CsASR的生物信息学预测显示,它既可以定位在胞质也可以在细胞核内,说明CsASR在胞内可能具有多种功能。在多种植物中的研究显示,ASR定位在细胞核内,具有转录因子的功能,参与相关基因的转录调控作用[6,8-9,12-13,23];在胞质中,ASR作为一种分子伴侣,在逆境胁迫下大量积累,能够维持细胞中蛋白质的稳定性及增加胞质浓度,进而提高对逆境的抵御能力[1,11,24]。CsASR稳定性较高,因此它可以在胞质中稳定存在并发挥相应的分子伴侣功能。同时其可折叠序列占比达74.5%,表明该蛋白的结构可以根据条件刺激发生改变进而在多种生理活动中起作用。因此,本研究获得的CsASR不仅可作为转录因子参与基因转录调控,还可能以分子伴侣的形式行使其功能,其功能还有待通过转基因等手段进行深入研究。
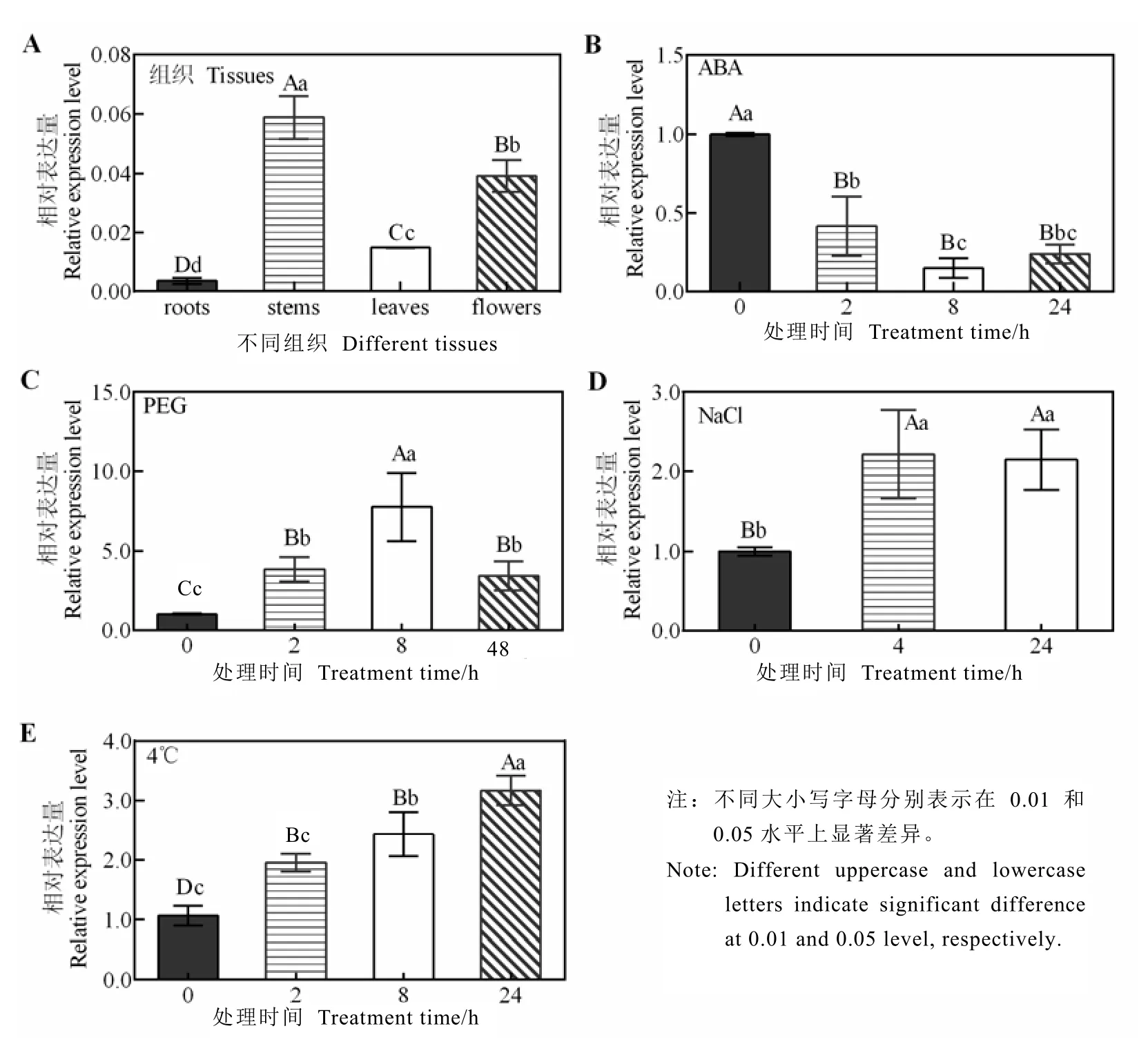
图6 CsASR的组织表达(A)及其在逆境胁迫中的表达(B-E)模式分析Fig. 6 Expression patterns of CsASR in tissues (A) and in response to stresses (B-E)
本研究中,还克隆了 CsASR基因的全长基因组序列。CsASR由1个内含子和2个外显子构成,其中第一个外显子较长,第二个外显子较短(图5)。由于其编码基因较小,植物中的 ASR基因主要由2个外显子组成,但有的木本植物中的ASR基因也含有3个外显子,如苹果ASR1和ASR3等,这可能与植物自身基因组大小及复杂度有关。我们发现,茶树CsASR的内含子显著大于其他植物中的ASR,其他植物中内含子多在 600 bp以下,最短的只有100 bp左右,而苹果中最长的ASR2的内含子也仅为1 587 bp,小于茶树2 751 bp的长度(图5)。重复序列分析发现内含子中有7种不同类型的重复序列元件占内含子长度的12.15%,同时还含有2个DNA转座子,从中可见茶树基因组之复杂。此外,我们还克隆获得了CsASR基因启动子序列2 554 bp,分析预测显示在该启动子序列上含有多种参与逆境胁迫响应的顺式作用元件,如干旱、低温和高温响应元件,同时还含有多种植物激素,如乙烯、生长素和茉莉酸甲酯等相关的顺式作用元件(表 1),表明该基因的表达受多种逆境胁迫调控。
本研究检测了CsASR在ABA、干旱、高盐和低温胁迫下的表达模式,证实该基因与茶树的逆境响应密切相关。ABA和低温刺激能够快速诱导植物进行响应,我们的结果表明在ABA和低温处理2 h后CsASR的表达水平就发生了显著变化。其中,CsASR基因的表达在ABA处理过程中呈下调的模式(图6-B),表明该基因在ABA响应中可能起负调控作用。与茶树中CsASR相似,水稻OsASR1、OsASR2和 OsASR3 的表达在 ABA(100 μmol·L-1)处理后在叶片中呈下调模式[25],谷子ASR6在叶片中的表达也被ABA抑制[21],而在小麦[8]、番茄和草莓[6]和辽宁碱蓬[19]等多种植物中的研究显示ASR的表达受ABA诱导,在 ABA调控的抗逆中起正调控作用。然而,CsASR在干旱、高盐和低温胁迫处理后,其表达被显著诱导(图 6-C~图 6-E),表明 CsASR可能参与了ABA介导的抗逆响应调控。干旱后复水响应也是植物抗旱机理研究中重要的内容之一,本研究发现干旱诱导复水期间 CsASR仍具有较高的转录水平,表明该基因在茶树干旱后恢复期间也可能发挥一定的功能。与其他处理不同,我们通过浇灌方式研究了盐胁迫CsASR在茶树叶片中的表达模式,并对该基因在 4 h和 24 h的表达量进行了分析,表明CsASR在茶树抵御盐胁迫中也可能发挥功能。将不同植物中的 ASR通过转基因到拟南芥等模式植物中均表明,过表达 ASR基因能够显著提高转基因植株的抗寒、抗旱、抗盐胁迫等的能力。Li等[24]对 OsASR5在水稻抗旱中的功能及作用机制进行研究,结果发现OsASR5能够增强水稻的抗旱能力,深入研究发现该基因能够参与 ABA和 H2O2介导的气孔开闭调节,同时作为分子伴侣在胞内能够与逆境响应相关的HSP40和含2OG-Fe (II)氧合酶结构域的蛋白质结合,参与植物抗旱响应。过表达ASR基因的植株中,ASR能够通过调控光合作用、呼吸作用、碳水化合物及植物激素等的代谢,调节植物体内的抗氧化系统、气孔开闭,参与植物响应干旱的信号转导等,促进植物对逆境胁迫的抵御能力[7,19-21,26-27]。另外,有研究发现 ASR基因在植物响应铝胁迫和抗病等方面也有重要的功能[4,9,13,28],同时 ASR基因与糖信号调控等也密切相关[12,29]。鉴于 ASR在植物抗逆中具有广泛的功能,而拟南芥中不含 ASR基因,因此,后续可以在拟南芥中对CsASR的功能进行鉴定,为茶树抗逆机理研究及高抗品种选育提供理论支撑。
[1] Gonzalez RM, Iusem ND. Twenty years of research on Asr(ABA-stress-ripening) genes and proteins [J]. Planta, 2014,239(5): 941-949.
[2] Frankel N, Carrari F, Hasson E, et al. Evolutionary history of the Asr gene family [J]. Gene, 2006, 378: 74-83.
[3] Golan I, Dominguez PG, Konrad Z, et al. Tomato abscisic acid stress ripening (ASR) gene family revisited [J]. PLoS One, 2014, 9(10): e107117.
[4] Huang K, Zhong Y, Li Y, et al. Genome-wide identification and expression analysis of the apple ASR gene family in response to Alternaria alternata f. sp. Mali [J]. Genome,2016, 59(10): 866-878.
[5] Virlouvet L, Jacquemot MP, Gerentes D, et al. The ZmASR1 protein influences branched-chain amino acid biosynthesis and maintains kernel yield in maize under water-limited conditions [J]. Plant Physiol, 2011, 157(2): 917-936.
[6] Jia H, Jiu S, Zhang C, et al. Abscisic acid and sucrose regulate tomato and strawberry fruit ripening through the abscisic acid-stress-ripening transcription factor [J]. Plant Biotechnology Journal, 2016, 14(10): 2045-2065.
[7] Tiwari V, Chaturvedi AK, Mishra A, et al. Introgression of the SbASR-1 gene cloned from a halophyte Salicornia brachiate enhances salinity and drought endurance in transgenic groundnut (arachis hypogaea) and acts as a transcription factor [J]. PLoS One, 2015, 10(7): e0131567.
[8] Hu W, Huang C, Deng X, et al. TaASR1, a transcription factor gene in wheat, confers drought stress tolerance in transgenic tobacco [J]. Plant, Cell & Environment, 2013,36(8): 1449-1464.
[9] renhart RA, Bai Y, Valter de Oliveira LF, et al. New insights into aluminum tolerance in rice: The ASR5 protein binds the STAR1 promoter and other aluminum-responsive genes [J].Molecular Plant, 2014, 7(4): 709-721.
[10] Kim IS, Kim YS, Yoon HS. Rice ASR1 protein with reactive oxygen species scavenging and chaperone-like activities enhances acquired tolerance to abiotic stresses in Saccharomyces cerevisiae [J]. Molecular and Cell, 2012,33(3): 285-293.
[11] Konrad Z and Bar-Zvi D. Synergism between the chaperone-like activity of the stress regulated ASR1 protein and the osmolyte glycine-betaine [J]. Planta, 2008, 227(6):1213-1219.
[12] Saumonneau A, Laloi M, Lallemand M, et al. Dissection of the transcriptional regulation of grape ASR and response to glucose and abscisic acid [J]. Journal of Experimental Botany, 2012, 63(3): 1495-1510.
[13] Arenhart RA, Lima JC, Pedron M, et al. Involvement of ASR genes in aluminium tolerance mechanisms in rice [J]. Plant,Cell & Environment, 2013, 36(1): 52-67.
[14] Arenhart RA, Schunemann M, Bucker Neto L, et al. Rice ASR1 and ASR5 are complementary transcription factors regulating aluminium responsive genes [J]. Plant, Cell &Environment, 2016, 39(3): 645-651.
[15] Sun P, Miao H, Yu X, et al. A Novel role for banana MaASR in the regulation of flowering time in transgenic Arabidopsis[J]. PLoS One, 2016, 11(8): e0160690.
[16] 岳川, 曹红利, 周艳华, 等. 茶树谷胱甘肽还原酶基因CsGRs的克隆与表达分析[J]. 中国农业科学, 2014, 47(16):3277-3289.
[17] Yue C, Cao H, Wang L, et al. Molecular cloning and expression analysis of tea plant aquaporin (AQP) gene family [J]. Plant Physiology and Biochemistry, 2014, 83:65-76.
[18] Hao X, Horvath D, Chao W, et al. Identification and evaluation of reliable reference genes for quantitative real-time PCR analysis in tea plant (Camellia sinensis (L.) O.Kuntze) [J]. International Journal of Molecular Sciences,2014, 15(12): 22155-22172.
[19] Hu YX, Yang X, Li XL, et al. The SlASR gene cloned from the extreme halophyte Suaeda liaotungensis K. enhances abiotic stress tolerance in transgenic Arabidopsis thaliana[J]. Gene, 2014, 549(2): 243-251.
[20] Wang L, Hu W, Feng J, et al. Identification of the ASR gene family from Brachypodium distachyon and functional characterization of BdASR1 in response to drought stress [J].Plant Cell Reports, 2016, 35(6): 1221-1234.
[21] Feng ZJ, Xu ZS, Sun J, et al. Investigation of the ASR family in foxtail millet and the role of ASR1 in drought/oxidative stress tolerance [J]. Plant Cell Reports,2016, 35(1): 115-128.
[22] Henry IM, Carpentier SC, Pampurova S, et al. Structure and regulation of the Asr gene family in banana [J]. Planta, 2011,234(4): 785-798.
[23] Cakir B, Agasse A, Gaillard C, et al. A grape ASR protein involved in sugar and abscisic acid signaling [J]. The Plant Cell, 2003, 15(9): 2165-2180.
[24] Li J, Li Y, Yin Z, et al. OsASR5 enhances drought tolerance through a stomatal closure pathway associated with ABA and H2O2signaling in rice [J]. Plant Biotechnology Journal,2017, 15(2): 183-196.
[25] Perez-Diaz J, Wu TM, Perez-Diaz R, et al. Organ- and stress-specific expression of the ASR genes in rice [J]. Plant Cell Reports, 2014, 33(1): 61-73.
[26] Zhang L, Hu W, Wang Y, et al. The MaASR gene as a crucial component in multiple drought stress response pathways in Arabidopsis [J]. Functional & Integrative Genomics, 2015,15(2):247-260.
[27] Yang CY, Chen YC, Jauh GY, et al. A Lily ASR protein involves abscisic acid signaling and confers drought and salt resistance in Arabidopsis [J]. Plant Physiology, 2005. 139(2):836-846.
[28] Liu HY, Dai JR, Feng DR, et al. Characterization of a novel plantain Asr gene, MpAsr, that is regulated in response to infection of Fusarium oxysporum f. sp. cubense and abiotic stresses [J]. Journal of Integrative Plant Biology, 2010, 52(3):315-323.
[29] Shkolnik D, Bar-Zvi D. Tomato ASR1 abrogates the response to abscisic acid and glucose in Arabidopsis by competing with ABI4 for DNA binding [J]. Plant Biotechnology Journal,2008, 6(4): 368-378.
Cloning and Expression Analysis of CsASR Gene in Tea Plant (Camellia sinensis)
YUE Chuan1,2, CAO Hongli1,2, HAO Xinyuan2, GUO Yuqiong1,YE Naixing1, WANG Xinchao2*, YANG Yajun2*
1. College of Horticulture, Fujian Agriculture and Forestry University/Key Laboratory of Tea Science in Universities of Fujian Province/Collaborative Innovation Center of Chinese Oolong Tea Industry, Fuzhou 350002, China; 2. Tea Research Institute of Chinese Academy of Agricultural Sciences, National Center for Tea Improvement, Key Laboratory of Tea Plant Biology and Resources Utilization,Ministry of Agriculture, Hangzhou 310008, China
Abiotic stress severely affects the growth and development of tea plant and the quality of tea. ASR(abscisic acid, stress, ripening) genes play crucial roles in the plant response to stresses. The full-length cDNA,genomic sequence and the promoter sequence of CsASR gene were cloned from tea cultivar Longjing 43 in this study,The bioinformatic and the expression analysis of CsASR in tissues under different stress treatments were performed.The results revealed that the full-length cDNA of CsASR was 875 bp, containing a 546 bp ORF encoding 181 amino acid. The predict protein molecular and theoretic isoelectric point of CsASR were 19.89 kD and 5.69. Most regionsof the amino acid sequence (74.5%) were predicted as the non-ordered regions, indicating that CsASR is a disordered protein. C-terminal of CsASR contained an ABA/WDS functional domain which was primarily located in both the cytoplasm and the nucleus. The homologous alignment and phylogenetic tree analysis showed that CsASR had the highest similarity (87%) with Phoenix dactylifera, and had the closest genetic relationship with Ziziphus nummularia.The genomic sequence of CsASR gene was comprised by two exons with 363 bp and 183 bp in length, respectively,and had a 2 750 bp intron which contained seven simple repeats and two DNA transposons. The promoter sequence of CsASR was 2 554 bp in length and was predicted to contain several stress-responsive elements related to drought,cold, high temperature stresses and ABA-signaling. The expression analysis showed that CsASR had the lowest level in roots, and its expression was repressed by ABA treatment. While the drought, NaCl and cold stresses could significantly up-regulate the expression of CsASR. The results revealed that CsASR might be closely related to stress response in tea plant.
tea plant, ASR gene, abiotic stress, gene cloning
S571.1;Q52
A
1000-369X(2017)04-399-12
2017-04-10
2017-05-14
国家自然科学基金(31600555)、福建省自然科学基金项目(2017J01616)、国家茶叶产业技术体系(CARS-23)
岳川,男,讲师,主要从事茶树种质资源利用与茶叶品质调控研究。*通讯作者
