杀虫剂对茶园3种常见刺吸式口器害虫的室内毒力评价
2017-08-27王瑶慕卫张丽霞许永玉林琎张正群
王瑶,慕卫,张丽霞,许永玉,林琎,张正群
山东农业大学,山东 泰安 271018
杀虫剂对茶园3种常见刺吸式口器害虫的室内毒力评价
王瑶,慕卫,张丽霞,许永玉,林琎,张正群*
山东农业大学,山东 泰安 271018
小贯小绿叶蝉(Empoasca onukii Matsuda)、黑刺粉虱(Aleurocanthus spiniferus Quaintance)和茶蚜(Toxoptera aurantii Boyer)是茶园常见的刺吸式口器害虫,严重影响茶叶的产量和品质,化学防治是其重要的防治措施。本研究测定了10类16种杀虫剂对3种害虫若虫的室内毒力,旨在筛选出高效药剂,为其防治提供参考和依据。室内毒力测定结果显示,唑虫酰胺、甲维盐、茚虫威和虫螨腈对小贯小绿叶蝉的毒力最高,LC50分别为0.23、0.52、0.94、5.24 mg·L-1;溴氰虫酰胺、氯虫苯甲酰胺、噻虫胺和螺虫乙酯4种药剂对黑刺粉虱若虫的活性高,药后 24 h的 LC50值分别为 0.15、0.26、0.41、0.66 mg·L-1;除了呋虫胺和茚虫威,其他14种杀虫剂均对茶蚜若虫具有较高毒力,24 h的 LC50值均在 10 mg·L-1以下。本研究结果对根据害虫种类有针对性地选择药剂进行防治,促进茶园农药减施有重要意义。
小贯小绿叶蝉;黑刺粉虱;茶蚜;杀虫剂毒力
小贯小绿叶蝉(Empoasca onukii Matsuda)、黑刺粉虱(Aleurocanthus spiniferus Quaintance)和茶蚜(Toxoptera aurantii Boyer)是我国茶园中常见的刺吸式口器害虫,主要以若虫和成虫吸食茶树养分、水分,导致枝叶凋萎、枯竭。另外,茶蚜和黑刺粉虱排泄“蜜露”,导致煤病,以黑刺粉虱尤为严重。这类害虫发生特点是种群数量大,繁殖速率快,在整个茶树生长季节持续为害,严重影响茶树生长及茶叶产量和品质[1]。
目前,茶园中防治这类害虫的措施主要有农业防治(如茶园间作)[2-3]、物理防治(主要是色板诱杀)[4]、生物防治(包括使用微生物制剂和保护天敌等)[5-6]以及化学防治等[7]。化学防治防效高、见效快、简便易行,是我国茶园病虫害防控的重要措施之一。我们在前期调查发现,当前茶园中防治害虫普遍使用的杀虫剂以菊酯类和烟碱类为主,主要有联苯菊酯、吡虫啉、啶虫脒等,品种少且更新过程慢,存在长期、连续使用同一类农药甚至同一种杀虫剂的状况。另外,对于茶园不同害虫的发生有针对性用药缺乏一定的指导,导致靶标害虫抗药性发展,防效显著降低,甚至使茶园中小型害虫更加猖獗[8]。
目前,多数研究集中于杀虫剂对单一茶园害虫的田间防效评价,鲜见室内系统评价杀虫剂对茶园主要吸汁害虫毒力的相关研究。在茶园农药减施和提高茶叶质量安全的大背景下,本研究分别评价了包括多种新型杀虫剂在内的16种化学药剂对我国茶园中3种吸汁害虫小贯小绿叶蝉、黑刺粉虱和茶蚜的毒力,旨在筛选出防治上述害虫的高效药剂,为其防治提供参考和依据。
1 材料与方法
1.1 材料
1.1.1 试虫
供试小贯小绿叶蝉(Empoasca onukii Matsuda)、黑刺粉虱(Aleurocanthus spiniferus Quaintance)、茶蚜(Toxoptera aurantii Boyer)均采自山东省泰安市泰山区道朗镇茶溪谷茶园(茶树品种为黄金芽),本茶园为有机认证茶园,从建园开始未使用任何杀虫剂。采用扫网法在茶园多点随机采集小贯小绿叶蝉若虫,摘取附着茶蚜和黑刺粉虱若虫的茶叶嫩梢和叶片,带回实验室在温度为 30℃、相对湿度为75%、L∶D=14 h∶10 h的人工培养箱中培养1 d。试验时选取小贯小绿叶蝉3龄若虫、附着黑刺粉虱1龄和2龄若虫的叶片、附着无翅若蚜的茶树嫩梢用于杀虫剂的毒力测定。
1.1.2 药剂
分别属于10个种类的16种杀虫剂原药用于本研究(表 1),使用时先将原药溶解于少量丙酮中,然后用0.1% T-80水溶液配制成母液,并稀释成系列浓度备用。
1.2 生物测定方法
1.2.1 杀虫剂对小贯小绿叶蝉的毒力测定
杀虫剂对小贯小绿叶蝉的毒力测定采用浸梢法[10],并稍作修改。将新鲜的茶树嫩梢(一芽二叶)用清水洗净,自然晾干后备用。根据预备试验的结果,将供试药剂先用少量丙酮溶解,然后分别用0.1% T-80水溶液配制成1 000 mg·L-1的母液,母液再用 0.1% T-80水溶液分别稀释成6个预先设定的浓度,充分搅拌混匀备用。将洁净晾干的茶树嫩梢放入药液中浸泡30 s,取出后置于滤纸上自然晾干,用润湿的脱脂棉包裹嫩梢下部保湿,放入洁净的玻璃管中。用毛笔小心地将活泼健康的小贯小绿叶蝉若虫接入玻璃管中,每个玻璃瓶内接种30头,玻璃管口用纱布封住,每处理重复 3次;对照用不含药剂的 T-80水溶液浸梢。将接虫后的玻璃管置于温度为 30℃、相对湿度为75%、L∶D=14 h∶10 h的人工气候箱里,24 h后检查死亡率,对照组的死亡率在 10%以下视为有效试验。以毛笔尖轻触虫体,试虫不动或虫体僵硬者视为死亡。
1.2.2 杀虫剂对黑刺粉虱的毒力测定
杀虫剂对黑刺粉虱的毒力测定采用浸虫浸叶法[11],并稍作修改。将供试药剂先用少量丙酮溶解,然后分别用0.1% T-80水溶液配制成1 000 mg·L-1的母液,母液再用0.1% T-80水溶液分别稀释成6个预先设定的浓度,充分搅拌混匀备用。黑刺粉虱体四周直立刺毛少于6对,且体躯周围白色蜡质圈较少的为1龄和2龄若虫,并用挑针剔除高龄若虫和蛹壳。将附着黑刺粉虱1龄和2龄若虫的茶树叶片放入药液中浸泡 20 s,取出后置于滤纸上自然晾干,放入洁净的玻璃培养皿中,每皿试虫大约50头,每处理重复 3次;对照用不含药剂的T-80水溶液浸虫浸叶。将培养皿置于温度为30℃、相对湿度为75%、L∶D=14 h∶10 h的人工气候箱里,24 h后检查死亡率;对照死亡率在10%以下为有效试验。虫体干瘪,针刺无液体流出,且易从叶片脱落视为死亡。
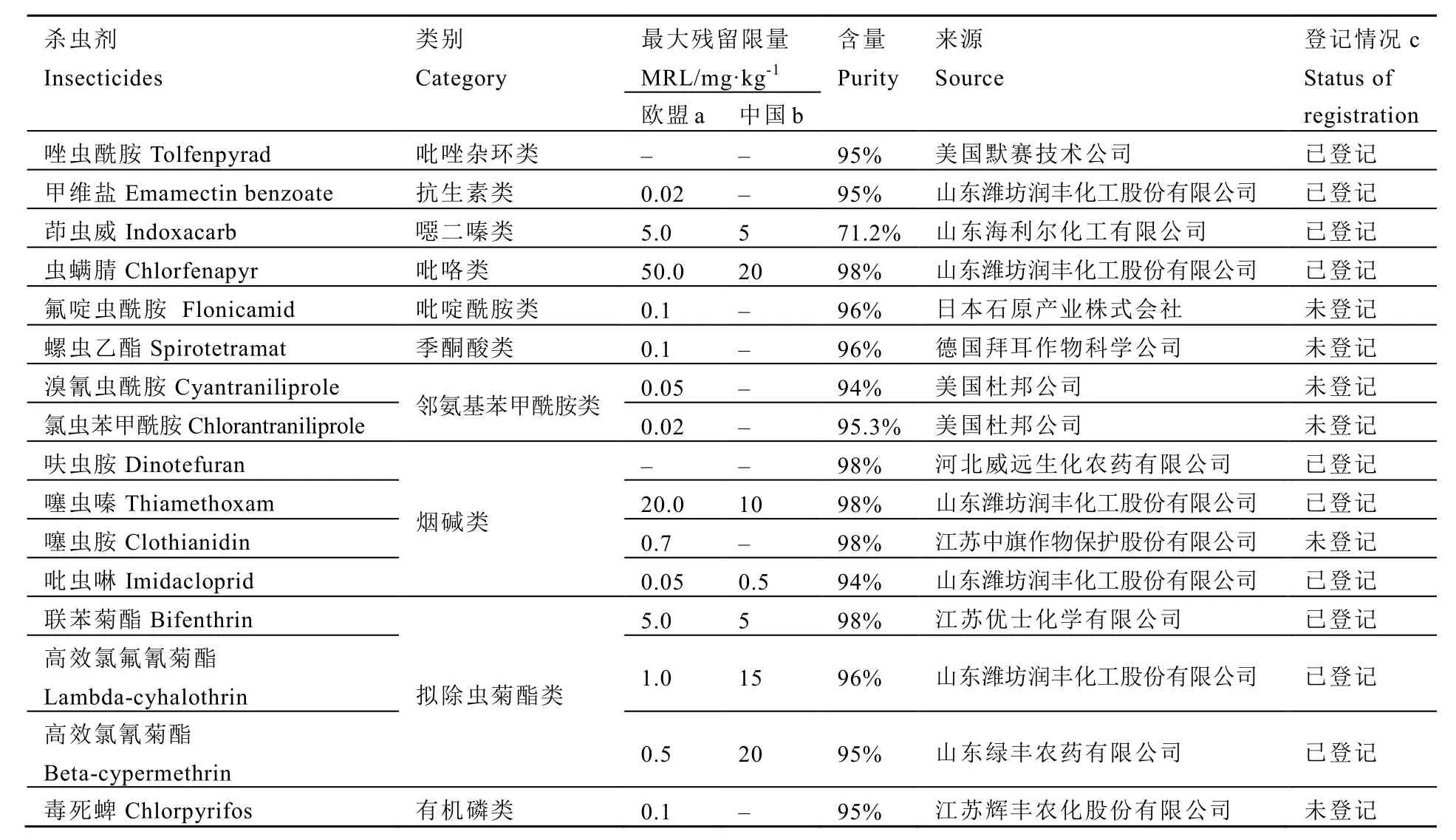
表1 试验中所测试的16种杀虫剂详情Table 1 Details of 16 insecticides used in this study
1.2.3 杀虫剂对茶蚜的毒力测定
参考 Cui等[12]的研究方法,采用浸虫浸叶法测定杀虫剂对茶蚜的毒力。采集附着有茶蚜的茶树嫩梢,剔除有翅蚜和僵蚜,每梢大约50头无翅若蚜。根据预备试验的结果,将供试药剂先用少量丙酮溶解,然后分别用 0.1%T-80水溶液配制成1 000 mg·L-1的母液,母液再用0.1% T-80水溶液分别稀释成6个预先设定的浓度,充分搅拌混匀备用。将附着无翅若蚜的茶树嫩梢放入药液中浸泡 5 s,取出后置于滤纸上自然晾干,用润湿的脱脂棉包裹嫩梢下部保湿,放入洁净的玻璃培养皿中,每处理重复3次;对照用不含药剂的T-80水溶液浸虫浸叶。将培养皿置于温度为 30℃、相对湿度为75%、L∶D=14 h∶10 h的人工气候箱里,24 h后检查死亡率;对照组的死亡率在 10%以下为有效试验。以毛笔尖轻触虫体,试虫不动或虫体僵硬者视为死亡。
1.2.4 数据统计分析
数据采用Excel 2010、DPS 7.05软件计算毒力回归方程、LC50值及95%置信限,以LC50值进行各种杀虫剂的毒力比较[13]。
2 结果与分析
2.1 杀虫剂对小贯小绿叶蝉的毒力
16种药剂中,吡虫啉对小贯小绿叶蝉的毒力最低,其 LC50为 336.62 mg·L-1;唑虫酰胺、甲维盐、茚虫威和虫螨腈对小贯小绿叶蝉的毒力较高,他们的LC50分别为0.23、0.52、0.94、5.24 mg·L-1,毒力分别是吡虫啉的1463.57、647.35、358.11和64.24倍;其次是呋虫胺、联苯菊酯和高效氯氟氰菊酯,LC50分别为 19.09、26.04、26.19 mg·L-1,分别是吡虫啉的17.63倍、12.93倍和12.85倍。一些新型杀虫剂如螺虫乙酯、溴氰虫酰胺、氯虫苯甲酰胺和噻虫胺对叶蝉的毒力较低,其 LC50分别为 147.64、159.53、173.01、174.84 mg·L-1(表 2)。
2.2 杀虫剂对黑刺粉虱的毒力
从表3可以看出,拟除虫菊酯类药剂联苯菊酯和高效氯氰菊酯对黑刺粉虱若虫的毒力最低,药后 24 h致死中浓度 LC50分别达到190.29、130.29 mg·L-1。新型杀虫剂溴氰虫酰胺、氯虫苯甲酰胺、噻虫胺和螺虫乙酯4种药剂对黑刺粉虱若虫的活性较高,药后 24 h的LC50值分别为 0.15、0.26、0.41、0.66 mg·L-1,其毒力分别是联苯菊酯的 1 268.6、731.88、464.12和 288.32倍。另外,有机磷类药剂毒死蜱和菊酯类药剂高效氯氟氰菊酯也表现出较高毒力,分别为0.55、0.60 mg·L-1,是联苯菊酯的345.98和317.15倍。烟碱类杀虫剂吡虫啉和噻虫嗪以及唑虫酰胺对黑刺粉虱 24 h LC50值分别为 1.34、3.88、7.66 mg·L-1,也具有较高活性。

表2 16种杀虫剂对小贯小绿叶蝉的室内毒力Table 2 Toxicities of 16 insecticides toEmpoasca onukiiMatsuda
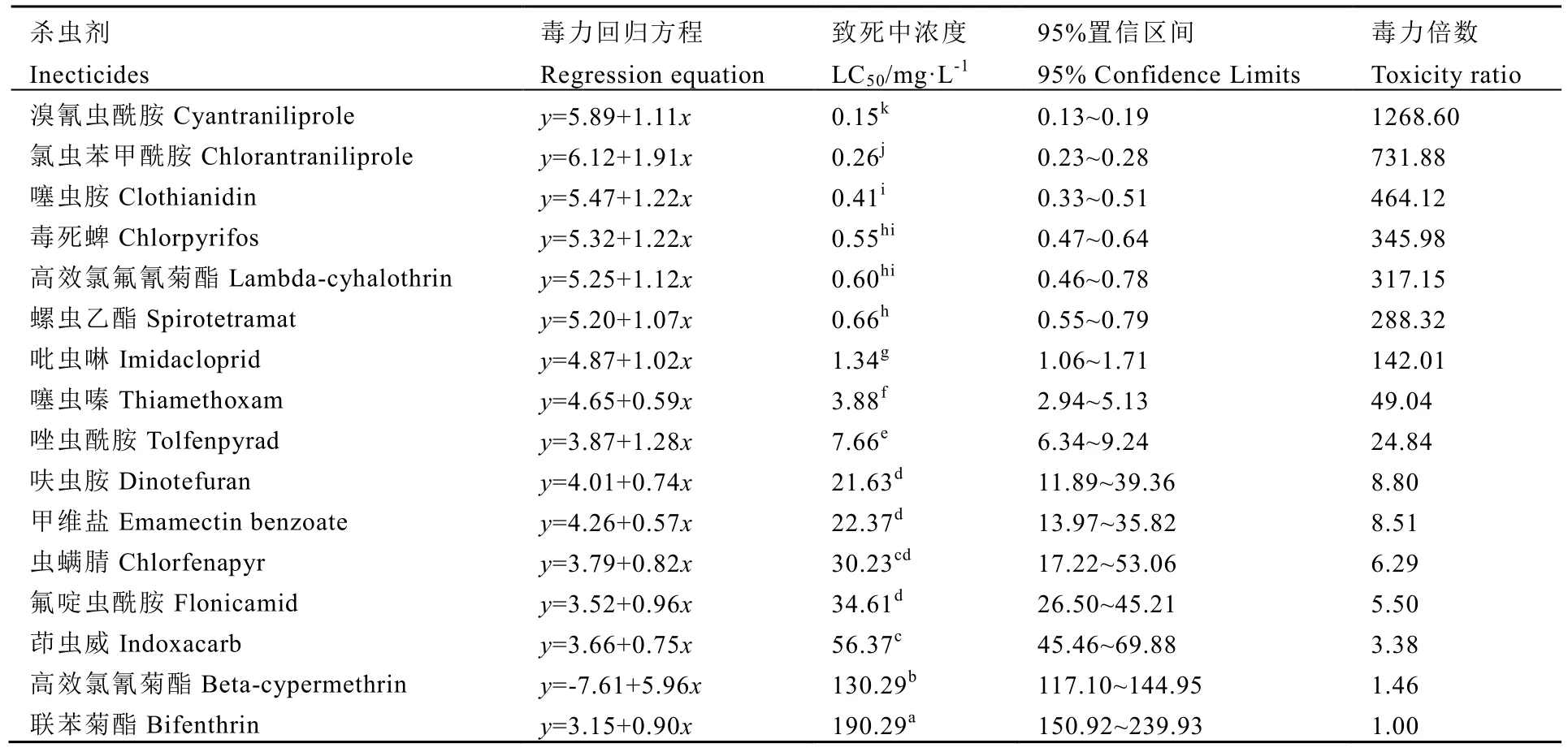
表3 16种杀虫剂对黑刺粉虱的室内毒力Table 3 Toxicities of sixteen insecticides toAleurocanthus spiniferusQuaintance
2.3 杀虫剂对茶蚜的毒力
从表4可以看出,对茶蚜毒力最高的药剂是唑虫酰胺,LC50值仅为 0.03 mg·L-1,是呋虫胺的 639.33倍。噻虫嗪、毒死蜱和噻虫胺也表现出非常好的杀虫活性,LC50值分别是0.06、0.06、0.08 mg·L-1,分别是呋虫胺毒力的 319.67、319.67和 239.45倍。高效氯氟氰菊酯、螺虫乙酯、吡虫啉、溴氰虫酰胺和甲维盐的活性也较高,其LC50分别是0.22、0.30、0.34、0.38、0.41 mg·L-1。呋虫胺和茚虫威对茶蚜的 LC50值分别为 19.18、10.02 mg·L-1,在16种杀虫剂中毒力最低。

表4 16种杀虫剂对茶蚜的室内毒力Table 4 Toxicities of sixteen insecticides toToxoptera aurantiiBoyer
3 讨论
唑虫酰胺、甲维盐、茚虫威和虫螨腈对小贯小绿叶蝉的LC50值均在10 mg·L-1以下,与Wei等[10]的研究结果一致。唑虫酰胺和虫螨腈脱去 N-乙氧基乙基的代谢产物均作用于昆虫线粒体,阻断昆虫呼吸作用使不能产生能量[14-15]。甲维盐和茚虫威作用于昆虫神经系统,扰乱昆虫体内神经冲动传递[16-17]。上述药剂都能在短期内杀死害虫,速效性好。并且田间防效证明,唑虫酰胺、茚虫威和虫螨腈等对小贯小绿叶蝉有较长的持效期[18],而甲维盐的持效期较短[19]。在我国,虫螨腈在茶叶中的最大残留限量(MRL)为20 mg·kg-1,茚虫威为5 mg·kg-1,唑虫酰胺和甲维盐在茶叶上的限量标准还未制定[9]。因此,综合考虑 LC50值和MRL值,上述杀虫剂可以替代吡虫啉等烟碱类杀虫剂(吡虫啉对叶蝉的毒力很低,在茶叶中的MRL值为0.5 mg·kg-1)用于茶园叶蝉防治。另外,虫螨腈和茚虫威之间存在交互抗性风险,在使用过程中注意杀虫剂的轮换使用,以延缓叶蝉对杀虫剂的抗性发展[10]。
黑刺粉虱若虫栖居于茶树中、下部叶背刺吸茶树汁液,并排泄蜜露诱发煤烟病,影响光合作用[20]。本试验结果表明,新型杀虫剂如溴氰虫酰胺、氯虫苯甲酰胺、噻虫胺和螺虫乙酯对黑刺粉虱若虫的毒力较高。4种杀虫剂对其他粉虱种类如烟粉虱 Bemisia tabaci Gennadius同样具有高活性。鱼尼丁受体抑制剂溴氰虫酰胺和氯虫苯甲酰胺对烟粉虱具有良好的触杀、胃毒活性并且没有交互抗性风险,和当前使用的烟碱类杀虫剂也不存在交互抗性[21-22]。噻虫胺和螺虫乙酯对粉虱若虫毒力最高,但对成虫的直接毒杀作用都不显著[23-24]。另外,毒死蜱和高效氯氟氰菊酯对黑刺粉虱同样具有较高毒力,有机磷杀虫剂毒死蜱在未来可能禁用,如果考虑防治成本和茶叶食品安全,可以适当选择高效氯氟氰菊酯(茶叶中的MRL值为15 mg·kg-1)防治黑刺粉虱。
16种杀虫剂中,唑虫酰胺对茶蚜的毒力最高,其 LC50值为 0.03 mg·L-1,其次是噻虫嗪、毒死蜱和噻虫胺。例如,唑虫酰胺对棉蚜(Aphis gossypii Glover)具有好的防治效果,施药后蚜叶率显著下降[25];烟碱类杀虫剂种类中,噻虫嗪和噻虫胺对棉蚜活性较高[26]。但是,烟碱类杀虫剂在茶园中使用可能带来诸多生态问题。例如,烟碱类杀虫剂能减少寄生蜂对蚜虫的寄生率,减弱茶园生态系统中害虫天敌的自然控制作用[27]。另外,烟碱类杀虫剂可能对茶园中蜜蜂等传粉昆虫存在较高的毒性和风险性[28]。
本研究结果为针对不同害虫选择合适药剂提供参考。另外,茶园中通常是 2种或 3种害虫同时发生,此时选择对不同害虫活性均较高的杀虫剂可减少施药次数和施药量。针对茶园中化学防治带来的生态问题[29-30],下一步的研究需要明确高效药剂对害虫天敌等有益生物的影响,结合田间药效试验,提高科学用药水平,使药剂防治和天敌利用协调起来,这对我国茶叶生产无公害化发展、促进农药减施有重要意义。
[1] 张汉鹄, 谭济才. 中国茶树害虫及其无公害治理[M]. 合肥: 安徽科学技术出版社, 2004.
[2] 宋同清, 王克林, 彭晚霞, 等. 亚热带丘陵茶园间作白三叶草的生态效应[J]. 生态学报, 2006, 26(11): 3647-3655.
[3] 彭晚霞, 宋同清, 邹冬生, 等. 覆盖与间作对亚热带丘陵茶园生态的综合调控效果[J]. 中国农业科学, 2008, 41(8):2370-2378.
[4] Bian L, Sun X L, Luo Z X, et al. Design and selection of trap color for capture of the tea leafhopper, Empoasca vitis, by orthogonal optimization [J]. Entomologia Experimentalis et Applicata, 2014, 151(3): 247-258.
[5] Pu X Y, Feng M G, Shi C H. Impact of three application methods on the field efficacy of a Beauveria bassiana-based mycoinsecticide against the false-eye leafhopper, Empoasca vitis (Homoptera: Cicadellidae) in the tea canopy [J]. Crop Protection, 2005, 24(2): 167-175.
[6] 陈李林, 林胜, 尤民生, 等. 间作牧草对茶园螨类群落多样性的影响[J]. 生物多样性, 2011, 19(3): 353-362.
[7] 熊兴平. 假眼小绿叶蝉防治研究进展[J]. 茶叶科学技术,2003(4): 1-5.
[8] 周铁锋, 杨青, 毛宇骁. 茶树害虫抗药性及抗性机制研究进展[J]. 安徽农业科学, 2015, 43(36): 199-200.
[9] 国家卫生和计划生育委员会, 中华人民共和国农业部, 国家食品药品监督管理总局. 食品安全国家标准 食品中农药最大残留限量: GB 2763—2016[S]. 北京: 中国标准出版社, 2017.
[10] Wei Q, Yu H Y, Niu C D, et al. Comparison of insecticide susceptibilities of Empoasca vitis (Hemiptera: Cicadellidae)from three main tea-growing regions in China [J]. Journal of Economic Entomology, 2015, 108(3): 1251-1259.
[11] Cahill M, Jarvis W, Gorman K, et al. Resolution of baseline responses and documentation of resistance to buprofezin in Bemisia tabaci (Homoptera: Aleyrodidae) [J]. Bulletin of Entomological Research, 1996, 86(2): 117-122.
[12] Cui L, Qi H L, Yang D B, et al. Cycloxaprid: A novel cis-nitromethylene neonicotinoid insecticide to control imidacloprid-resistant cotton aphid (Aphis gossypii) [J].Pesticide Biochemistry and Physiology, 2016, 132: 96-101.
[13] 唐启义, 冯明光. 实用统计分析及其 DPS数据处理系统[M]. 北京: 科学出版社, 2002.
[14] Yamaguchi K, Hikiji W, Takino M, et al. Analysis of tolfenpyrad and its metabolites in plasma in a tolfenpyrad poisoning case [J]. Journal of Analytical Toxicology, 2012,36(7): 529-537.
[15] Leeuwen T V, Pottelberge S V, Tirry L. Biochemical analysis of a chlorfenapyr-selected resistant strain of Tetranychus urticae,Koch [J]. Pest Management Science, 2006, 62(5): 425-433.
[16] Sandra B, Sigmund S, Tore H. Sensitivity assessment of caligus rogercresseyi to emamectin benzoate in chile [J].Aquaculture, 2008, 282(1/2/3/4): 7-12.
[17] Wing K D, Sacher M, Kagaya Y, et al. Bioactivation and mode of action of the oxadiazine indoxacarb in insects [J].Crop Protection, 2000, 19(8/9/10): 537-545.
[18] Wei Q, Mu X C, Yu H Y, et al. Susceptibility of Empoasca vitis (Hemiptera: Cicadellidae) populations from the main tea-growing regions of China to thirteen insecticides [J].Crop Protection, 2017, 96: 204-210.
[19] 张传根,程武俊,李东扬. 蛇床子素对茶尺蠖和假眼小绿叶蝉的控制效果评价[J]. 农药, 2014, 53(9): 690-692.
[20] 王吉锐,穆丽霞,杜予州,等. 中国茶树的粉虱新记录——粉背刺粉虱(半翅目:粉虱科)[J]. 茶叶科学, 2016, 36(4):427-431.
[21] Li B C, Degain B A, Harpold V S, et al. Baseline susceptibilities of B- and Q-biotype Bemisia tabaci to anthranilic diamides in Arizona [J]. Pest Management Science, 2012, 68(1): 83-91.
[22] Caballero R, Cyman S, Schuster D J. Baseline susceptibility of Bemisia tabaci, Biotype B (Hemiptera: Aleyrodidae) to Chlorantraniliprole in Southern Florida [J]. Florida Entomologist, 2013, 96(3): 1002-1008.
[23] 戈大庆, 姜兴印, 王燕, 等. 螺虫乙酯对 B型烟粉虱毒力及部分生物学参数的影响[J]. 植物保护学报, 2011, 38(4):351-356.
[24] 徐德进, 季英华, 顾中言, 等. 3种杀虫剂对南京地区Q型烟粉虱的室内毒力测定[J]. 江西农业学报, 2011, 23(12):79-82.
[25] 冯淑丽, 苗培增, 贾永庆. 15%唑虫酰胺防治棉蚜的效果试验[J]. 中国棉花, 2013, 40(10): 23, 27.
[26] Shi X B, Jiang L L, Wang H Y, et al. Toxicities and sublethal effects of seven neonicotinoid insecticides on survival,growth and reproduction of imidacloprid resistant cotton aphid [J]. Pest Management Science, 2011, 67(12):1528-1533.
[27] Frewin A J, Schaafsma A W, Hallett R H. Susceptibility of Aphelinus certus (Hymenoptera: Aphelinidae) to neonicotinoid seed treatments used for soybean pest management [J]. Journal of Economic Entomology, 2014,107(4): 1450-1457.
[28] Tan K, Chen W W, Dong S H, et al. A neonicotinoid impairs olfactory learning in Asian honey bees (Apis cerana)exposed as larvae or as adults [J]. Scientific Reports, 2015, 5:10989.
[29] 张春艳, 谭济才, 谭琳. 科学使用农药, 协调茶园天敌的保护与利用[J]. 茶业通报, 2005, 27(2): 73-75.
[30] Gurusubramanian G, Rahman A, Sarmah A, et al. Pesticide usage pattern in tea ecosystem, their retrospects and alternative measures [J]. Journal of Environmental Biology,2008, 29(6): 813-826.
Toxicity Assessment of Insecticides to Three Common Piercing-sucking Insects in Tea Plantations
WANG Yao, MU Wei, ZHANG Lixia, XU Yongyu, LIN Jin, ZHANG Zhengqun*
Shandong Agricultural University, Tai′an 271018, China
Matsuda (Empoasca onukii), Quaintance (Aleurocanthus spiniferus) and Boyer (Toxoptera aurantii)are three most common piercing-sucking insects in tea plantations, which severely reduce tea production and quality.Chemical control is one of the most important strategies in control of these tea pests. In order to screen high-efficient insecticides, the toxicities of 16 insecticides of ten different classes to the nymphs of three tea pests were evaluated under laboratory conditions. The results of toxicity tests showed that tolfenpyrad, emamectin, indoxacarb and chlorfenapyr showed the highest toxicities to the E. onukii nymphs, with the 24 h LC50values of 0.23, 0.52, 0.94 and 5.24 mg·L-1, respectively. Cyantraniliprole, chlorantraniliprole, clothianidin and spirotetramat were four most toxic compounds for the A. spiniferus nymphs, with the 24 h LC50values of 0.15, 0.26, 0.41 and 0.66 mg·L-1, respectively.Except for dinotefuran and indoxacarb, other fourteen tested insecticides showed high toxicities to the T. aurantii nymphs, with the 24 h LC50values below 10 mg·L-1. The results of this study laid a foundation for selecting and applying insecticides according to the target pests, and also promoting the reduction of pesticides used in tea plantations.
Empoasca onukii Matsuda, Aleurocanthus spiniferus Quaintance, Toxoptera aurantii Boyer, toxicity of insecticide
S435.711
A
1000-369X(2017)04-392-07
2017-04-07
2017-05-24
山东省现代农业茶产业体系专项资金(SDAIT-19-04)、泰安市大学生科技创新行动计划项目(2016D009)、“双一流”奖补资金资助
王瑶,女,硕士研究生,主要从事茶树病虫害防治方面的研究。*通讯作者:zqzhang@sdau.edu.cn
