EGCG纳米硒的稳定性及其对硒吸收利用的影响
2017-08-27王乐李欢李嘉豪陈暄黎星辉孙康
王乐,李欢,李嘉豪,陈暄,黎星辉,孙康
南京农业大学茶叶科学研究所,江苏 南京 210095
EGCG纳米硒的稳定性及其对硒吸收利用的影响
王乐,李欢,李嘉豪,陈暄,黎星辉,孙康*
南京农业大学茶叶科学研究所,江苏 南京 210095
使用维生素C(Vitamin C,Vc)作为氧化还原剂和(-)-表没食子儿茶素没食子酸酯(EGCG)作为分散剂,成功制备了纳米硒(EGCG-SeNPs)。使用透射电子显微镜(TEM)和激光粒度分析仪电动电势仪(Zetasizer)测定的 EGCG-SeNPs是平均直径为(35±0.12) nm、Zeta电位为-0.05 mV的球形颗粒。EGCG-SeNPs在 pH1.0的强酸或70℃高温环境下发生聚集,其颗粒大小增加大约10倍。而且,EGCG-SeNPs中的EGCG作为分散剂具有良好的稳定性。通过分别灌胃25、50、100 μg·kg-1(以含Se量计算)的亚硒酸钠和EGCG-SeNPs发现,肝脏和肾脏中的硒含量在 50、100 μg·kg-1的硒处理后均显著增加;在血清、肝脏和肾脏中,所有处理组的谷胱甘肽过氧化物酶(GPx)活性均显著增加,且具有剂量依赖效应。然而,在相同剂量的亚硒酸钠和EGCG-SeNPs处理组中,硒含量和 GPx活性之间没有显著差异。因此可以得出,Vc作为氧化还原剂制备的EGCG-SeNPs可能具有和亚硒酸钠相似的生物利用度。
(-)-表没食子儿茶素-3-没食子酸酯;硒;纳米颗粒;生物利用度;谷胱甘肽过氧化物酶活性
茶是由茶树(Camellia sinensis (L.) O.Kuntze)的叶片制成的,并且在很久之前就被认为是有益健康的饮料[1]。茶的健康作用主要来自于它的儿茶素,这是一组包含了(-)-表没食子儿茶素没食子酸酯(EGCG)、(-)-表没食子儿茶素、(-)-表儿茶素没食子酸酯、(-)-表儿茶酸、(+)-没食子儿茶素和(+)-儿茶素的多酚物质[2]。茶多酚对癌症等多种病症都有防治功能[3]。儿茶素在80℃和弱碱性条件下快速地差向异构化[4]。其中,EGCG已经广泛应用于纳米颗粒领域,例如被包裹在脂质纳米颗粒[1]、共轭金纳米颗粒[5]或者壳聚糖-聚天冬氨酸离子作用纳米颗粒[6]中。
硒(Se)是一种微量元素,具有降低癌症发病率[7]、预防心血管疾病[8]、治疗肌肉紊乱[9]和其他功能[10],已经被认为与人类的许多健康益处相关。硒在多种抗氧化酶的位点起催化作用,例如硫氧还蛋白还原酶和谷胱甘肽过氧化物酶(GPx)[11]。硒元素存在于植物和动物的组织中,主要有硒酸盐、硒代半胱氨酸和硒代蛋氨酸的 3种形式[12]。无论是低剂量的硒还是高剂量的硒,硒主要在肝脏和肾脏中积累[13]。谷胱甘肽过氧化物酶家族包含:普遍存在于各种细胞质中,尤其是红细胞、肝脏、肾脏和肺中高表达的 GPx1,存在于胃肠的上皮细胞和肝脏中的 GPx2,存在于血浆中的GPx3,存在于睾丸细胞内的GPx4和存在于嗅觉上皮细胞及胚胎中的GPx6。在谷胱甘肽过氧化物酶家族中,除GPx4和GPx6外,其余GPx蛋白活力对硒水平最为敏感,能够作为机体内硒水平的指标[14]。
通常,零价态的硒是以黑色或灰色形式存在的,没有生物活性。Zhang等[15]以亚硒酸钠为原料,加入蛋白质如牛血清白蛋白(BSA)为分散剂,谷胱甘肽(GSH)为还原剂,利用氧化还原体系在弱碱性条件下人工合成了零价的红色元素硒纳米颗粒(SeNPs)。SeNPs是一种红色元素胶体,可以保护乙醇减少氧化应激[16]、减少慢性炎症性关节炎[17]、减轻高血糖和高脂血症[18]等。此外,SeNPs能显著降低顺铂对抗氧化活性的抑制作用[19],并且对抗氧化性具有提高作用[20]。同时,已有研究报道,SeNPs和亚硒酸盐或半乙基硒代半胱氨酸具有相同的生物利用度,但毒性相对更低[15,21]。纳米硒不仅能够被分散,也可以被聚乙二醇[22]、多聚糖[23]、褪黑素[24]和三磷酸腺苷[25]等物质分散。尽管这些物质能够分散纳米硒,除BSA纳米硒外,其余均没有比较硒的生物利用度。然而,最近有文献报道聚乙酸/羟基乙酸共聚物包裹的纳米颗粒的分散剂会在胃酸中降解,而导致纳米颗粒的口服生物利用度降低[26]。因此,评价新制备纳米硒颗粒的生物利用度很重要。
在调节涉及结肠癌发生的遗传和表观遗传生物标志物的方式中,硒和绿茶的组合在抑制结肠直肠肿瘤形成方面比单独使用硒更有效[27]。儿茶素能够作为分散剂制备纳米银[28]、纳米金[29]和纳米碳管[30]。本研究团队曾经报道过 EGCG能够分散的纳米硒,由于该纳米硒在拟胃酸环境中大量聚沉,形成微米级颗粒,导致其口服生物利用度下降。本研究改进了 EGCG分散的 SeNPs的制备条件,并对EGCG纳米硒的稳定性及其对硒吸收利用的影响进行了评价。
1 材料与方法
1.1 试验材料
表没食子儿茶素没食子酸酯(EGCG)(纯度大于 99%)购买于杭州怡倍嘉茶叶发展公司。亚硒酸钠、Vc、还原型辅酶Ⅱ(NADPH)、甲酸、纯乙腈、谷胱甘肽还原酶购买于Sigma-Aldrich化学公司。还原型谷胱甘肽(GSH)购于背景索莱宝生物有限公司。所有试剂都为分析纯试剂。
1.2 EGCG-SeNPs的制备和表征
将适量EGCG溶于纯水中搅拌5 min。将适量Vc加入EGCG溶液中,同样搅拌5 min。然后将亚硒酸钠溶液(Se含量为10 mg·mL-1)加入到前溶液中并搅拌。Se、Vc和EGCG的终浓度分别为 5、25、20 mmol·L-1。将溶液立即调节至pH 2.5,几分钟后调节至pH 8.5。最终的亮红色溶液就是EGCG-SeNPs溶胶,4℃保存待用。颗粒的形态和大小用透射电镜(TEM,H-7650,日立,日本)依照 Sanna等[31]的方法进行检测,Zeta电位用激光粒度分析仪电动电势仪(Malvern Zetasizer Nano ZS,英国)在室温25℃下测定。
1.3 EGCG-SeNPs中EGCG的稳定性评估
用超高效液相仪(Waters,美国)分别测定刚制备的EGCG-SeNPs和放置于4℃冰箱中1个月的 EGCG-SeNPs(OM-EGCG-SeNPs)中的EGCG含量。标样的含量依次为2、10、20、100、200 mg·mL-1。将 EGCG 纳米硒离心(20 000 g,4℃)30 min,将上清液稀释1 000倍,然后通过 0.22 μm的膜。用 2%的甲酸和纯乙腈进行梯度洗脱:0~2 min,5%乙腈;3~5 min,5%乙腈;6~6.5 min,50%乙腈;6.6~8 min,5%乙腈;进样速度为0.350 mL·min-1,进样量为2 μL,检测波长 280 nm。
1.4 EGCG-SeNPs的酸碱度和热稳定性评价
在制备EGCG-SeNPs时,在将pH调节为2.5后,将部分EGCG纳米硒倒出,分别调节至pH1.0和pH5.0,剩下的依然调节至pH8.5。将一部分 pH8.5的样品留存待测,另一部分pH8.5的EGCG-SeNPs分别在70℃加热0、3、12 h,所有样品在4℃保存待用。用TEM表征不同样品的形态和大小;用光学图像识别EGCG-SeNPs的颜色变化;用多功能酶标仪(Cytation 3,Bio-Tex,意大利)测定不同条件下制备的 EGCG-SeNPs在不同波长下的吸收值。
1.5 动物处理
雄性的 ICR小鼠(18~22 g)购于常州卡文斯实验动物有限公司。缺硒饲料购买于南通特洛菲饲料科技有限公司。小鼠饲养在塑料笼中,塑料笼置于湿度为(50±10)%、温度(24±1)℃和 12 h光/暗循环的房间内,小鼠可以自由获得食物和水。喂食42只雄性ICR小鼠缺硒饲料5周,以建立缺硒小鼠模型。将缺硒小鼠随机分为 7组:(1)对照组(CK)灌胃盐水;(2)Se处理组灌胃含 25、50、100 μg·kg-1(以含 Se量计算)的亚硒酸钠溶液;(3)EGCG-SeNPs处理组灌胃给予含25、50、100 μg·kg-1(以含 Se 量计算)的 EGCG-SeNPs胶体。所有小鼠连续灌胃 7 d,并在最后一天的24 h后眼眶静脉取血、脱颈处死,备用。
1.6 硒含量和GPx活性分析
将从眼眶中取出的血液经离心(10 000 g,4℃,10 min),取出上清血清,并将血清和血细胞分开单独保存。解剖小鼠获得肝脏和肾脏,并在冰的生理盐水中洗净。所有样品保存在-20℃用作进一步的实验分析。用冰冷的磷酸盐缓冲液(PBS,0.15mol·L-1,pH7.2,1 mmol·L-1EDTA·Na2)将肝脏和肾脏的组织样品进行匀浆,然后将匀浆液离心(12 000 g,4℃)15 min,并取出干净的上清液储存在-20℃用作生化分析。采用 Bradford[32]的方法进行蛋白含量的测定,采用Smith等[33]的方法进行 GPx活性的测定。通过改进 Zinn等[34]的方法,使用微波消解系统(Ethos T,Milestone,意大利)和电感耦合等离子体发射光谱仪(Optima 2100DV,Perkin Elmer,美国)进行硒含量的测定。
1.7 数据分析
使用Graphpad Prism 5.0软件分析数据,并以平均值±标准差表示。采用ANOVA进行单因素方差分析。
2 结果与分析
2.1 EGCG-SeNPs的特性表征
TEM 图显示,新制备的 EGCG-SeNPs,其平均直径约(35±0.12) nm(图 1-a)。EGCG-SeNPs溶液的 Zeta电位为-0.05 mV(图 1-b),这表明分布在 EGCG溶液中的SeNPs倾向于相互排斥而不聚集。UPLC的结果显示 OM-EGCG-SeNPs和 EGCG-SeNPs中的 EGCG含量变化很小(图 1-c和图 1-d)。OM-EGCG-SeNP中的 EGCG的含量为(9.82±0.11) mg·mL-1,而 EGCG-SeNPs中的为(10.00±0.04) mg·mL-1。在 4℃冰箱中放置 1 个月后,EGCG-SeNPs中的 EGCG含量并没有发生显著降低。该结果表明,在先酸后碱的情况下,EGCG充当稳定剂而不是氧化剂,以维持SeNPs的稳定性。
2.2 pH和温度对EGCG-SeNPs的影响
TEM图显示,在不同 pH下制备的EGCG-SeNPs具有不同的形状和大小(图2-a、图2-b和图2-c)。在pH1.0时,EGCG纳米硒是丝状的,直径在300~400 nm;在pH5.0时,EGCG纳米硒是长方形的,直径在 200~250 nm;在 pH8.5时,EGCG纳米硒是六边形,近似于球形,直径约 40 nm。此外,随着 pH值的降低,红色也逐渐变浅(图 2-d)。EGCG-SeNPs的吸光值在不同pH条件下相差较大。EGCG-SeNPs在pH8.5条件下的吸光值远高于pH1.0和pH5.0两种条件(图2-e)。
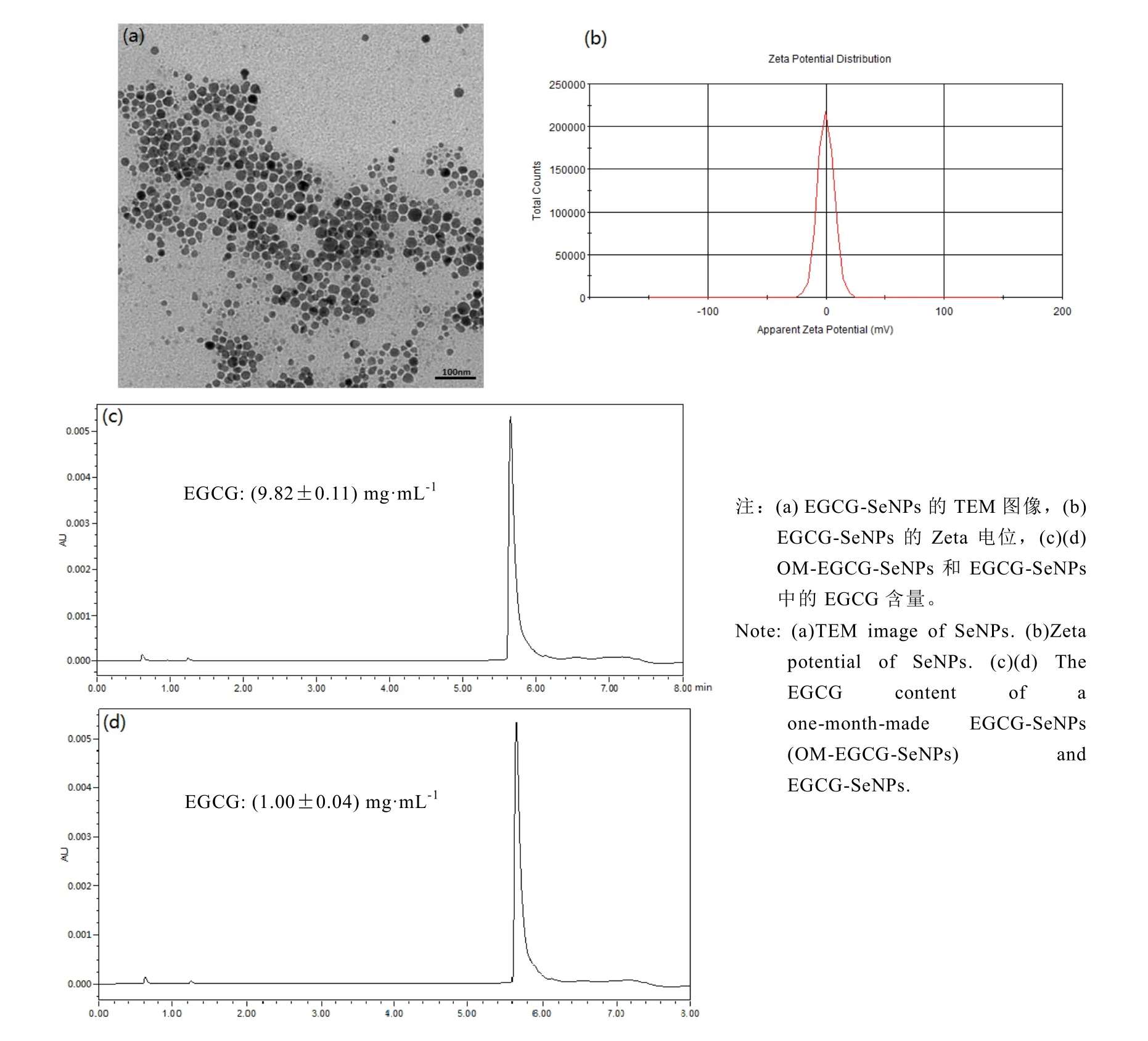
图1 EGCG-SeNPs的特征Fig. 1 Characteristics of EGCG-SeNPs

图2 EGCG-SeNPs的pH特性Fig. 2 pH property of EGCG-SeNPs
在pH8.5条件下,用70℃分别加热0、3、12 h后,EGCG-SeNPs也呈现了不同的形态和大小。(图 3-a、图 3-b和图 3-c)。在 75℃加热 0 h时(即不加热),EGCG纳米硒是六边形的,近似于球形,直径约在40 nm;在75℃加热3 h时,EGCG纳米硒富集成了模糊的球形,直径约在200 nm;在75℃加热12 h时,EGCG纳米硒继续富集成较为清晰的球形,直径约在 400 nm。这表明,持续高温加热能够使 EGCG纳米硒颗粒变大,发生聚沉。聚沉的 EGCG-SeNPs使得原本的红色胶体变得轻微浑浊(图 3-d)。不同加热时间处理的EGCG-SeNPs的吸光值变化不显著(图3-e)。
2.3 EGCG-SeNPs的口服利用度
灌胃硒可以增加组织中硒的水平[35],而且 GPx活力对组织内硒水平比较敏感[12]。因此,可通过测定组织硒水平和 GPx活力用于比较亚硒酸钠与EGCG-SeNPs的硒利用水平,从而评价 EGCG-SeNPs的硒吸收利用水平。如图 4 所示,在肝脏中,Selenite-50、SeNPs-50、Selenite-100和 SeNPs-100组的硒含量显著高于CK组(图4-a)。在肾脏中,所有处理组的硒含量都显著高于CK组(图4-b)。但在肝脏和肾脏中,亚硒酸钠处理组和 EGCG-SeNPs处理组的硒含量都不存在剂量依赖效应。并且,在肝脏和肾脏中,每对相同的硒浓度的亚硒酸钠和 EGCG-SeNPs组之间都没有出现显著差异,这表明亚硒酸钠和 EGCG-SeNPs之间的硒积累没有显著差异。
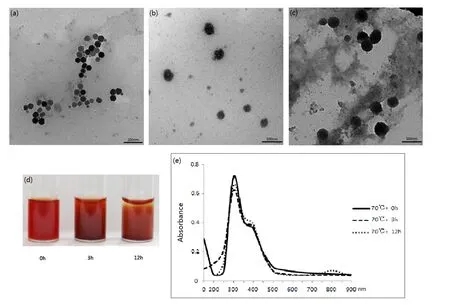
图3 EGCG-SeNPs的温度特性Fig. 3 Temperature property of EGCG-SeNPs
GPx可以保护生物体免受自由基的氧化损伤,并且是身体氧化应激的关键指示[36]。血清、肝脏和肾脏中的GPx活性如图5所示。在血清中(图5-a),与CK组相比,所有亚硒酸钠或EGCG-SeNPs组的GPx活性均显著增加,并且在每对亚硒酸钠和 EGCG-SeNPs组之间,都存在剂量依赖效应,即:随着亚硒酸钠和 EGCG-SeNPs给药浓度的增加,GPx活性显著增加。在肾脏中,在相同的硒浓度的亚硒酸钠和EGCG-SeNPs组之间的GPx活性没有表现出显著差异(图5-c)。GPx活性在肾脏和肝脏中的变化趋势和血清中的非常相似这些结果表明,EGCG-SeNPs具有与亚硒酸钠类似的生物利用度,并且给药的硒浓度越高,EGCG-SeNPs的生物利用度越高。
3 小结与讨论
本研究得出的结论是利用 Vc作为还原剂,EGCG作为分散剂,制备的EGCG-SeNPs对拟胃酸环境和高温有较强的稳定性,而且小鼠口服该纳米硒的硒吸收利用程度与口服亚硒酸钠相似。
在本研究中,EGCG-SeNPs最初在pH2.5下制备,然后调节至pH1.0、pH5.0和pH8.5。TEM图像显示EGCG-SeNPs在不同的pH中会呈现不同形状:丝状、矩形和六边形,且颗粒大小随着 pH的降低而增加(图 2)。研究表明,正电荷的铬硒纳米棒可以自组织成丝状纳米结构[37],这与EGCG-SeNPs在pH1.0时的形状相同。Sau等[38]发现,通过调节Vc的浓度可以产生不同结构的纳米晶体,如长方形,这和EGCG-SeNPs在pH5.0时的形状相同。

图4 肝脏和肾脏中的硒含量Fig. 4 Selenium content in liver and kidney

图5 血清、肝脏和肾脏中的GPx活性Fig. 5 GPx activity in serum, liver and kidney
此外,还有报道表明,EGCG-SeNPs在pH1.0时会发生广泛聚集并且失去纳米特征[39],这与本研究发现 pH1.0条件下纳米硒尺寸增加的结果相似。因此,EGCG-SeNPs在pH1.0的条件下,能够发生激烈的聚集,其颗粒尺寸大约增加10倍。在pH8.5的条件下,以70℃加热0、3、12 h后,EGCG-SeNPs分别呈现六边形、球形和球形,且随着加热时间的增加,颗粒大小明显增加。已有研究表明,纳米颗粒的热稳定性取决于其颗粒大小,相比于小直径的纳米颗粒,大直径的纳米颗粒在加热过程中更容易转变成纳米棒[40]。不难发现,在加热 3 h和12 h后,EGCG-SeNPs的平均直径分别从(35±0.12) nm增加到约200 nm和400 nm。这是因为持续高温破坏了 EGCG-SeNPs的稳定性,使得纳米颗粒从均匀的 EGCG分散体系中出来,相互聚集在一起。Su等[41]发现儿茶素在 70℃保存 3 h后其浓度会降低。在低温(25~100℃)的等温反应中,发现了 EGCG的同时降解和差向异构化[42]。EGCG-SeNPs在200~900 nm波长处的吸光度表明,随着pH值的降低,吸光度下降(图2-e)。其原因可能是解离 EGCG在酸性条件下能够进入 SeNPs系统。然而,EGCG-SeNP的吸光度在加热或不加热的那些之间没有显着的差异(图3-e)。由于 EGCG-SeNPs在没有足够氧气的密闭环境中加热,EGCG氧化不明显。因此,吸光度没有发生显著的变化。
之前的研究指出,EGCG在酸性条件下的质子化导致 SeNPs的大量聚集,而在谷胱甘肽体系的碱性条件下,虽能成功制备成EGCG-SeNPs,由于在拟胃酸环境中该颗粒发生聚集,3 min内形成微米级颗粒导致生物利用度显著降低[36]。然而,在这项研究中,EGCG-SeNPs在拟胃酸环境中或高温条件下尽管发生聚集,但是其纳米硒颗粒大小能够长时间保持在 300~400 nm,从而使得其硒的生物利用度与亚硒酸钠相比没有显著下降。另外,EGCG的氧化还原电位为+420 mV,Se4+/Se为+320 mV,这意味着 EGCG无法还原亚硒酸钠。因此,可以使用氧化还原电位为-166 mV的 Vc作为还原剂,将四价硒还原成零价硒。同时,作为含有四羟基的强酸性物质,Vc可以更容易地提供酸性环境,避免EGCG降解和异构化。Chen等[43]认为,添加Vc可以提高EGCG的稳定性,并且具有剂量效应。同时,Vc还可以提高作为儿茶素主要结构的二聚体的稳定性[44]。因此,作为还原剂,Vc可以通过减少多酚自由基和可溶性氧的体积来保护EGCG。
小鼠实验结果表明,肝脏和肾脏中,亚硒酸钠和 EGCG-SeNPs中的硒含量均明显高于CK 组(图 4-a和 4-b),这直接证明EGCG-SeNPs中的硒可以在体内积累和吸收。相同浓度下的亚硒酸钠和 EGCG-SeNPs处理后的硒含量没有显著差异,这说明二者有着相似的生物利用度。研究结果还显示,无论在血清、肝脏还是肾脏中,与CK组相比,随着硒含量的增加,所有亚硒酸盐或 EGCG-SeNPs处理组中的 GPx活性均显著升高。这一现象表明,SeNPs具有有效的生物利用度,且伴随剂量依赖性作用。可以推测,在酸性条件下制备的而不是之前在碱性条件下制备 SeNPs通过胃内给药在胃液中可以保持生物利用度。其原因可能是,EGCG在制备过程中发生了质子化,这使得其在 SeNPs的内部或表面没有发生去质子化。由于 EGCG在通过胃液时没有发生质子化,所以 EGCG-SeNPs的聚集速度非常缓慢。
综上所述,EGCG-SeNPs可以用Vc作氧化还原剂在先pH2.5后pH8.5的条件下成功制备。EGCG-SeNPs良好的理化性质保证了其动物实验中的良好用途,使得 EGCG-SeNPs的生物利用度不会降低。然而,关于EGCG-SeNPs的毒性需要进一步的探究以期获得更好的应用。
[1] Radhakrishnan R, Kulhari H, Pooja D, et al. Encapsulation of biophenolic phytochemical EGCG within lipid nanoparticles enhances its stability and cytotoxicity against cancer [J]. Chemistry and Physics of Lipids, 2016, 198:51-60.
[2] Li J, Wang X. Binding of (-)-epigallocatechin-3-gallate with thermally-induced bovine serum albumin/ι-carrageenan particles [J]. Food Chemistry, 2015, 168: 566-571.
[3] 邬新荣, 王岳飞, 张士康, 等. 茶多酚保健功能研究进展与保健食品开发[J]. 茶叶科学, 2010, 30(S1): 501-505.
[4] Ishino N, Yanase E, Nakatsuka S. Epimerization of tea catechins under weakly acidic and alkaline conditions [J].Bioscience, Biotechnology, and Biochemistry, 2010, 74(4):875-877.
[5] Mukherjee S, Ghosh S, Das D K, et al. Gold-conjugated green tea nanoparticles for enhanced anti-tumor activities and hepatoprotection—Synthesis, characterization and in vitro evaluation [J]. The Journal of Nutritional Biochemistry,2015, 26(11): 1283-1297.
[6] 洪志勇. EGCG-CS-PAA纳米粒的制备及其生物活性研究[D]. 杭州: 浙江工商大学, 2015.
[7] Lipinski B. Sodium selenite as an anti-cancer agent [J].Anti-Cancer Agents in Medicinal chemistry, 2017, 17(5):658-661.
[8] Alehagen U, Alexander J, Aaseth J. Supplementation with selenium and coenzyme Q10 reduces cardiovascular mortality in elderly with low selenium status. A secondary analysis of a randomised clinical trial [J]. PLoS One, 2016,11(7): e0157541. https://doi.org/10.1371/journal.pone.0157541.
[9] Passerieux E, Hayot M, Jaussent A, et al. Effects of vitamin C, vitamin E, zinc gluconate, and selenomethionine supplementation on muscle function and oxidative stress biomarkers in patients with facioscapulohumeral dystrophy:a double-blind randomized controlled clinical trial [J]. Free Radical Biology and Medicine, 2015, 81: 158-169.
[10] Hatfield D L, Tsuji P A, Carlson B A, et al. Selenium and selenocysteine: roles in cancer, health, and development [J].Trends in biochemical sciences, 2014, 39(3): 112-120.
[11] Amin K A, Hashem K S, Alshehri F S, et al. Antioxidant and hepatoprotective efficiency of selenium nanoparticles against acetaminophen-induced hepatic damage [J].Biological Trace Element Research, 2017, 175(1): 136-145.
[12] Whanger P D. Selenocompounds in plants and animals and their biological significance [J]. Journal of the American College of Nutrition, 2002, 21(3): 223-232.
[13] Loeschner K, Hadrup N, Hansen M, et al. Absorption,distribution, metabolism and excretion of selenium following oral administration of elemental selenium nanoparticles or selenite in rats [J]. Metallomics, 2014, 6(2):330-337.
[14] Papp LV, Lu J, Holmgren A, et al. From selenium to selenoproteins: synthesis, identity, and their role in human health [J]. Antioxid Redox Signal, 2007, 9(7): 775-806.
[15] Zhang J S, Gao X Y, Zhang L D, et al. Biological effects of a nano red elemental selenium [J]. Biofactors, 2001, 15(1):27-38.
[16] Kalishwaralal K, Jeyabharathi S, Sundar K, et al. Sodium selenite/selenium nanoparticles (SeNPs) protect cardiomyoblasts and zebrafish embryos against ethanol induced oxidative stress [J]. Journal of Trace Elements in Medicine and Biology, 2015, 32: 135-144.
[17] Malhotra S, Welling M N, Mantri S B, et al. In vitro and in vivo antioxidant, cytotoxic, and anti-chronic inflammatory arthritic effect of selenium nanoparticles [J]. Journal of Biomedical Materials Research Part B: Applied Biomaterials,2016, 104(5): 993-1003. doi: 10.1002/jbm.b.33448. Epub 2015 May 20.
[18] Al-Quraishy S, Dkhil M A, Moneim A E A.Anti-hyperglycemic activity of selenium nanoparticles in streptozotocin-induced diabetic rats [J]. International Journal of Nanomedicine, 2015, 10: 6741.
[19] Jafari Dehkordi A, Mohebbi A N, Aslani M R, et al.Evaluation of nanoselenium (Nano-Se) effect on hematological and serum biochemical parameters of rat in experimentally lead poisoning [J]. Human & Experimental Toxicology, 2017, 36(4):421-427. doi: 10.1177/0960327116651124. Epub 2016 Jun 1.
[20] 刘红芳, 邓泽元, 徐靓, 等. 乳酸菌源纳米硒对小鼠抗氧化性能的影响[J]. 食品工业科技, 2014, 23: 360-365.
[21] Zhang J, Wang X, Xu T. Elemental selenium at nano size(Nano-Se) as a potential chemopreventive agent with reduced risk of selenium toxicity: comparison with se-methylselenocysteine in mice [J]. Toxicological Sciences,2008, 101(1): 22-31.
[22] Zheng S, Li X, Zhang Y, et al. PEG-nanolized ultrasmall selenium nanoparticles overcome drug resistance in hepatocellular carcinoma HepG2 cells through induction of mitochondria dysfunction [J]. Int J Nanomedicine, 2012, 7:3939-3949. doi: 10.2147/IJN.S30940.
[23] Zhang Y, Wang J, Zhang L. Creation of highly stable selenium nanoparticles capped with hyperbranched polysaccharide in water [J]. Langmuir, 2010, 26(22):17617-17623.
[24] Wang H, Wei W, Zhang SY, et al. Melatonin-selenium nanoparticles inhibit oxidative stress and protect against hepatic injury induced by Bacillus Calmette-Gué rin/lipopolysaccharide in mice [J]. J Pineal Res, 2005, 39(2):156-163.
[25] Zhang Y, Li X, Huang Z, et al. Enhancement of cellpermeabilization apoptosis-inducing activity of selenium nanoparticles by ATP surface decoration [J]. Nanomedicine,2013, 9(1): 74-84.
[26] Jain AK, Goyal AK, Mishra N, et al. PEG-PLA-PEG block copolymeric nanoparticles for oral immunization against hepatitis B [J]. Int J Pharm, 2010, 387(1/2):253-262. doi:10.1016/j.ijpharm.2009.12.013.
[27] Hu Y, McIntosh G H, Le Leu R K, et al. Combination of selenium and green tea improves the efficacy of chemoprevention in a rat colorectal cancer model by modulating genetic and epigenetic biomarkers [J]. PLoS One,2013, 8(5): e64362.
[28] Loo YY, Chieng BW, Nishibuchi M, et al. Synthesis of silver nanoparticles by using tea leaf extract from Camellia sinensis [J]. Int J Nanomedicine, 2012, 7: 4263-4267.
[29] Nune SK, Chanda N, Shukla R, et al. Green nanotechnology from tea: phytochemicals in tea as building blocks for production of biocompatible gold nanoparticles [J]. J Mater Chem, 2009, 19(19): 2912-2920.
[30] Chen Y, Lee YD, Vedala H, et al. Exploring the chemical sensitivity of a carbon nanotube/green tea composite [J].ACS Nano, 2010, 4(11): 6854-62.
[31] Sanna V, Pala N, Dessì G, et al. Single-step green synthesis and characterization of gold-conjugated polyphenol nanoparticles with antioxidant and biological activities [J].International Journal of Nanomedicine, 2014, 9: 4935.
[32] Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Analytical biochemistry,1976, 72(1/2): 248-254.
[33] Smith A D, Levander O A. High-throughput 96-well microplate assays for determining specific activities of glutathione peroxidase and thioredoxin reductase [J].Methods in Enzymology, 2002, 347: 113-121.https://doi.org/10.1016/S0076-6879(02)47012-7.
[34] Zinn G M, Rahman G M M, Faber S, et al. Evaluation of dietary supplement contamination by xenobiotic and essential elements using microwave-enhanced sample digestion and inductively coupled plasma-mass spectrometry[J]. Journal of Dietary Supplements, 2016, 13(2): 185-208.
[35] Raspopov R V, Arianova E A, Trushina E N, et al. Zero valent seleniume nanoparticles bioavailability estimation in rats [J]. Voprosy Pitaniia, 2010, 80(4): 36-41.
[36] Kabel A M. Free radicals and antioxidants: role of enzymes and nutrition [J]. World Journal of Nutrition and Health,2014, 2(3): 35-38.
[37] Artemyev M, Kisiel D, Abmiotko S, et al. Self-Organized,Highly Luminescent CdSe Nanorod- DNA Complexes [J].Journal of the American Chemical Society, 2004, 126(34):10594-10597.
[38] Sau T K, Murphy C J. Room temperature, high-yield synthesis of multiple shapes of gold nanoparticles in aqueous solution [J]. Journal of the American Chemical Society, 2004, 126(28): 8648-8649.
[39] Wu S, Sun K, Wang X, et al. Protonation of epigallocatechin-3-gallate (EGCG) results in massive aggregation and reduced oral bioavailability of EGCG-dispersed selenium nanoparticles [J]. Journal of Agricultural and Food Chemistry, 2013, 61(30): 7268-7275.
[40] Zhang J, Taylor E W, Wan X, et al. Impact of heat treatment on size, structure, and bioactivity of elemental selenium nanoparticles [J]. International Journal of Nanomedicine,2012, 7: 815-825. doi: 10.2147/IJN.S28538.
[41] Su Y L, Leung L K, Huang Y, et al. Stability of tea theaflavins and catechins [J]. Food Chemistry, 2003, 83(2):189-195.
[42] Wang R, Zhou W, Jiang X. Reaction kinetics of degradation and epimerization of epigallocatechin gallate (EGCG) in aqueous system over a wide temperature range [J]. Journal of Agricultural and Food Chemistry, 2008, 56(8):2694-2701.
[43] Chen Z Y, Zhu Q Y, Wong Y F, et al. Stabilizing effect of ascorbic acid on green tea catechins [J]. Journal of Agricultural and Food Chemistry, 1998, 46(7): 2512-2516.
[44] Zhu Q Y, Hammerstone J F, Lazarus S A, et al. Stabilizing effect of ascorbic acid on flavan-3-ols and dimeric procyanidins from cocoa [J]. Journal of Agricultural and Food Chemistry, 2003, 51(3): 828-833.
The Evaluation of the Stability of EGCG-Selenium Nanoparticles and Its Effect on Selenium Absorption and Utilization
WANG Le, LI Huan, LI Jiahao, CHEN Xuan, LI Xinghui, SUN Kang*
Tea Research Institute, Nanjing Agricultural University, Nanjing 210095, China
(-)-epigallocatechin-3-gallate (EGCG) dispersed Selenium nanoparticles (EGCG-SeNPs) were prepared using vitamin C (Vc) and EGCG as the redox agent and dispersant. Characteristics of EGCG-SeNPs, which were determined using transmission electron microscope (TEM) and zetasizer, were spherical in shape with a mean diameter of (35±0.12) nm and -0.05 mV zeta potential. The particles were aggregated in strong acid and high temperature conditions (pH1.0 and 70℃), with the particle size increased by about 10 times. And, EGCG in EGCG-SeNPs had good stability as a dispersant. With the administration of 25, 50 and 100 μg·kg-1(Calculated with selenium content), selenium content in liver and kidney of 50 and 100 μg·kg-1sodium selenite and EGCG-SeNPs treated mice were significantly increased. Glutathione peroxidase (GPx) activity in serum, liver and kidney of all the treatment groups were significantly increased in a dose-dependent manner. However, there was no significant difference between sodium selenite and EGCG-SeNPs at the same dose on selenium content and GPx activity. Hence, it can be concluded that EGCG-SeNPs synthesized using Vc as the redox agent might have the similar bioavailability to sodium selenite.
(-)-epigallocatechin-3-gallate, selenium, nanoparticle, bioavailability, glutathione peroxidase activity
TS272;Q946.84+1
A
1000-369X(2017)04-373-10
2017-05-05
2017-05-26
江苏省自然科学基金(BK20160735)、江苏省博士后科学基金(1601078C)、现代农业产业技术体系建设专项资金(CARS-23)、江苏高校优势学科建设工程资助项目
王乐,女,硕士研究生,主要从事茶叶生物化学与综合利用研究。*通讯作者:sunkang@njau.edu.cn
