低氮对不同茶树品种叶绿素荧光特性的影响
2017-08-27林郑和钟秋生郝志龙游小妹陈志辉陈常颂单睿阳阮其春
林郑和,钟秋生,郝志龙,游小妹,陈志辉,陈常颂*,单睿阳,阮其春
1. 福建省农业科学院茶叶研究所,福建 福安 355015;2. 福建农林大学园艺学院,福建 福州 350002
低氮对不同茶树品种叶绿素荧光特性的影响
林郑和1,钟秋生1,郝志龙2,游小妹1,陈志辉1,陈常颂1*,单睿阳1,阮其春1
1. 福建省农业科学院茶叶研究所,福建 福安 355015;2. 福建农林大学园艺学院,福建 福州 350002
叶绿素荧光参数经常用来评价植物抗逆胁迫强弱,反应植物胁迫的生理状态等。为灵敏检测和判断茶树品种低氮胁迫的差异,科学指导施肥,本研究以前期筛选的相对氮高效茶树品种黄旦与相对氮敏感茶树品种本山为试验材料,检测不同供氮处理下叶绿素荧光参数及生物量的变化,结果发现低氮条件下茶树叶片氮含量显著偏低,但该条件下黄旦品种叶片氮含量明显高于本山品种;低氮条件下茶树叶片最小荧光 Fo、调节性能量耗散的量子产额Y(NPQ)、非光化学淬灭系数(NPQ)、非调节性能量耗散的量子产额Y(NO)等显著增加,黄旦品种在低氮条件下Fo、Y(NPQ)、Y(NO)及NPQ参数都要小于本山品种;而参数最大荧光(Fm)、光系统Ⅱ最大光合效率(Fv/Fm)、光化学淬灭系数(qP与qL)、实际光合效率Y(Ⅱ)显著下降,其中本山品种低氮下明显小于黄旦。总之,氮高效茶树品种黄旦能减缓低氮胁迫对植株造成的损害,并维持相对较高的光合效率,保证了低氮条件下有较高的产量。
低氮;茶树品种;光合效率;叶绿素荧光
进入21世纪以来,我国茶产业呈快速发展的势态。截止2016年底,我国茶园面积超过 266.67万 hm2,接近世界茶园的 50%,茶叶产量达到220多万t,均居世界第一位。目前很多茶农片面追求茶叶产量,毫无节制地施用大量氮肥,虽然提高了茶叶产量,但是也造成了氮素资源严重浪费、茶园氮利用率下降、生态环境条件恶化等不良后果[1]。随着茶树抗逆生理机制研究的深入,人们在重视氮肥增产效用的同时,越来越关注氮肥在调节作物抗逆中的作用,氮肥的合理施用一直是调控茶树生长发育的重要措施[2-3]。
氮素是蛋白质和核酸的重要组成元素之一[4-5],缺氮对茶树光合特性及叶绿素荧光有着显著的影响[6]。叶绿素荧光技术可以快速、灵敏和非破坏性地分析逆境因子对光系统Ⅱ的破坏影响,其中包括光能的吸收、捕获光的能力、能量的分配比率和电子传递分配等。与传统的气体交换参数相比,叶绿素荧光参数更能直接反映植物的“内在性”特征[7]。当外界条件发生变化时,叶绿素荧光参数可以在一定程度上反映出逆境因子对植物光系统的内在影响。叶绿素荧光参数作为光合作用的探针,已被应用到研究和探测植物体内光合器官转运光能状况、电子传递及植物对环境胁迫的响应机理等领域[8]。
尽管调制叶绿素荧光技术出现较晚,但由于其测定快速可靠、分析度灵敏且对检测的样品无损伤等特点,使其快速受到植物光合研究领域的科研人员的青睐[9]。调制叶绿素荧光成像不仅可以检测叶片光合作用的横向异质性,还可早期检测肉眼不可见的胁迫损伤,甚至是阐明损伤机理和调节机制。近年来,许多国内学者将叶绿素荧光技术应用于棉花[3]、玉米[4]、小麦[8,10]、甜菜[7]等作物的氮素营养研究中,发现施氮能增大光系统 II实际光量子产量Y(II)、光系统II最大光化学效率(Fv/Fm)、光化学猝灭系数(qP),而非光化学猝灭系数(qN)则随氮缺乏程度的加剧而升高。然而关于茶树叶片叶绿素荧光参数与氮素胁迫之间关系的研究鲜见报道。本研究利用IMAGING-PAM型便携式荧光仪(PAM,Germany),测定了不同浓度的氮胁迫对不同氮效率的茶树品种叶绿素荧光参数的影响,为今后茶园氮肥的施用提供理论依据。
1 材料与方法
1.1 试验材料培养
2016年 3月 5日开始进行茶树盆栽沙培试验,在福建省农业科学院茶叶研究所试验地完成。试验所采用前期初步筛选的相对耐低氮(黄旦)与氮较敏感品种(本山)为材料,盆栽于6 L的装满河沙的陶土花盆中,每盆2株,每处理20盆,于自然温、光条件下培养。营养液参照文献[2,11]配制,完全营养液配方见表 1。
移栽后预培养6周,然后进行试验处理,每次每盆各处理分别施含0、50、100、300、1 200、6 000 mmol·L-1N 的 NH4NO3营养液约500 mL,每周3次,处理18周后出现明显的症状,进行检测、取样工作。
1.2 测定方法
1.2.1 植株干重的测定
植株收获后,用自来水冲洗干净,然后分为根、茎、叶部分,每个处理6个重复,将鲜样先在105℃下先烘30 min,再在80℃下烘至恒重(约48 h),然而测定各部分的重量。

表1 完全营养液配方Table 1 Full nutrient solution formula
1.2.2 茶树叶片氮含量的测定
茶树叶片氮含量的测定:采用浓H2SO4-H2O2消煮,用凯氏定氮仪(FOSS)进行测定[12]。
1.2.3 叶绿素荧光参数测定
采用 IMAGING-PAM型调制叶绿素荧光仪,所有测定工作都在室温、植物暗适应 3 h后进行。经过充分暗适应后,植物体内电子门均处于开放状态,当打开测量光就得到初始荧光(Fo),此时增加一个饱和脉冲,所有的电子门就都将该用于光合作用的能量转化为荧光和热,此时得到的叶绿素荧光为最大荧光(Fm)。光照状态下打开饱和脉冲时,电子门被完全关闭,光合作用被暂时抑制,也就是说光化学淬灭被全部抑制,测得光下最大荧光(Fm′)与光下最小荧光值(Fo′)。但此时光下最大荧光值(Fm′)还是比最大荧光(Fm)低,也就是说还存在荧光淬灭,这些剩余的荧光淬灭即为非光化学淬灭[13]。PSII的实际光合效率:Y(II)=(Fm′-F)/Fm′[14];PSII 调节性能量耗散的量子产额Y(NPQ):Y(NPQ)=1-Y(II)-1/[NPQ+1+qL(Fm/Fo-1)][15]。参数 NPQ为非光化学荧光淬灭:(Fm-Fm′)/Fm′,反映 PSII耗散过剩光能进行自我保护的下调作用。PSII非调节性能量耗散的量子产额Y(NO):Y(NO)=1/[NPQ+1+qL(Fm/Fo-1)][16]。光化学淬灭系数qP反映的是 PSII反应中心的开放程度qP=(Fm′-F)/(Fm′-Fo′)。非光化学淬灭系数 qN:qN=(Fm-Fm′)/(Fm-Fo′),主要用于热耗散等。光化学淬灭系数qL反映的是PSII反应中心的开放程度:

1.3 数据分析
试验数据用 DPS数据处理系统进行差异显著性(LSD法)分析,所有分析试验均重复4~6次(不同盆中1株植株为1重复)。
2 结果与分析
2.1 不同供氮处理对叶片氮含量的影响
从图1可以看出,随着供氮浓度的增加,叶片氮含量依次增加。但供氮从300 μmol·L-1增加到 6 000 μmol·L-1时,黄旦叶片氮含量的变化趋势较本山的更加明显。相比发现,当供氮从100 μmol·L-1增加到 6 000 μmol·L-1时,黄旦叶片氮含量都要高于本山,特别在最高氮处理下,黄旦品种叶片氮含量增加明显高于本山品种。
2.2 不同供氮处理对生物量的影响
从图 2可看出,当供氮处理从 0增加到100 μmol·L-1时,茶树根、茎、叶干重都明显增加。当供氮从 300 μmol·L-1增加到 6 000 μmol·L-1,除本山品种叶干重 300 μmol·L-1到1 200 μmol·L-1显著增加外,其余茶树根、茎、叶干重未发生显著变化。此外大部分的荧光参数都在供氮浓度 300~6 000 μmol·L-1时无明显变化。基于此,本试验把供氮浓度为0、50、100 μmol·L-1称为低氮处理。图 2(B、C、F与G)中发现,本山茎、叶片在低氮处理的相同浓度下干重明显低于黄旦,当供氮处理从300 μmol·L-1增加到 6 000 μmol·L-1时,黄旦叶片干重都要高于本山。图2(D与H)中发现,供氮处理为 0增加到 50 μmol·L-1时,本山品种根冠比未发生明显变化,之后随着供氮处理增加,本山品种根冠比显著下降。而黄旦品种根冠比在供氮为 300 μmol·L-1时最大,其余各处理未发生显著变化。

图1 不同供氮处理对茶树叶片氮含量的影响Fig. 1 The effects of nitrogen supply on leaf N content in tea plants
2.3 不同供氮处理对荧光参数Fo、Fm和Fv/Fm的影响
从图3-A看出,当供氮浓度从为0增加到50 μmol·L-1时,本山品种的 Fo变化显著,当供氮浓度从 50 μmol·L-1增加到 300 μmol·L-1时,Fo依次显著下降,之后随着供氮浓度的增加,高浓度处理间没有发生显著变化。从图3-D中可以看出,黄旦品种的 Fo在供氮浓度为 0、50 μmol·L-1时,显著高于供氮浓度在300~6 000 μmol·L-1的处理,供氮高于 100 μmol·L-1后未发生显著变化。对比发现本山品种低氮条件下(供氮 0~100 μmol·L-1)Fo都略高于黄旦(图3-A与图3-D)。
当供氮从 0增加到 50 μmol·L-1时,本山品种最大荧光 Fm略有增加,之后随着供氮浓度的增加,Fm值依次显著增加。而当供氮浓度从 0增加到 100 μmol·L-1时,黄旦的最大荧光Fm随浓度的增加而显著增加,供氮大于300 μmol·L-1后差异不显著。总体看,本山品种的最大荧光Fm值在低氮处理时低于黄旦。
当供氮浓度从 0增加 100 μmol·L-1时,两品种的茶树叶片最大光合效率 Fv/Fm依次显著增加,之后两品种都未发生显著变化,且本山品种相同浓度的低氮处理下,Fv/Fm明显低于黄旦。
2.4 不同供氮处理对 Y(Ⅱ)、Y(NPQ)与 Y(NO)的影响
从图 4可看出,本山品种供氮浓度从 0增加 100 μmol·L-1时,叶片 PSⅡ实际光合效率Y(Ⅱ)依次显著增加,之后未见明显变化,而黄旦品种仅略有增加,未见显著变化,仅在供氮浓度为 1 200与 6 000 μmol·L-1时,才显著增加,总体看两品种的Y(Ⅱ)都随供氮浓度的增加而增加。
PSⅡ调节性能量耗散的量子产额Y(NPQ)在供氮浓度从 0增加到 100 μmol·L-1时,依次显著下降,之后未发生显变化。图4-A、图4-B、图 4-D、图4-E中发现,本山叶片的Y(Ⅱ)与Y(NPQ)参数变化幅度明显大于黄旦。不同供氮处理对叶片非调节性能量耗散的量子产额Y(NO)变化不明显,除本山在未供氮高于其他处理外,其余各处理不存在显著差异。
2.5 不同供氮处理对 NPQ、qN、qP与 qL的影响
从图5可看出,随着供氮浓度的增加,茶树叶片荧光参数 NPQ与 qN依次下降,本山在供氮处理 0~300 μmmol·L-1时,随浓度增加NPQ依次显著下降,而黄旦在供氮浓度从300 μmol·L-1到 1 200 μmol·L-1时随浓度增加显著下降。
当供氮浓度在 0~300 μmol·L-1时,随浓度增加,本山品种qN值显著下降,而黄旦品种未见显著变化。当供氮在 0~6 000 μmol·L-1时,黄旦品种的各处理间qN值未见显著变化,而本山显著增加。
对于荧光参数 qL,本山品种仅在未供氮时显著低于其他处理,而其余处理间未见显著变化,当供氮浓度在 0~6 000 μmol·L-1时,各处理间黄旦荧光参数qL未见显著变化。

图2 不同供氮处理对茶树生物量的影响Fig. 2 The effects of nitrogen supply on biomass accumulation in tea plant
3 讨论
茶树是喜氮(喜氨)类作物,施氮量对茶树生长发育有着显著的影响[2,6]。本研究表明,低氮下(供氮浓度为 0、50、100 μmol·L-1时相对于供氮浓度为 300、1 200、6 000 μmol·L-1时),茶树根、茎、叶干重都显著下降(图2),这与阮建云等[17]、苏有健等[18]在茶树低氮下的报道相一致。且本研究还发现低氮下,本山的根、茎、叶的干重都低于黄旦(图2),说明低氮下本山与黄旦相比更不易生长。这与李强等[4]在低氮与耐低氮玉米品种中的报道相一致。随着供氮浓度的增加,茶树叶片氮含量也显著增加,当供氮浓度从 300 μmol·L-1增加到 6 000 μmol·L-1时,黄旦叶片氮含量始终高于本山。这在小麦上耐低氮品种与氮敏感型的结果相类似[19]。
叶绿素荧光主要表现在光系统Ⅱ中对光能的吸收、传递、耗散和分配等[20-21],通过对作物荧光特性的检测可以反应作物的生长和胁迫的生理状态等[22]。本研究发现低氮处理下,Fo增加,Fm降低,说明反应中心受到了不易逆转的破坏或失活,这与玉米[4]、甜菜[7]、小麦[8,10]、棉花[3]、生菜[20]等作物缺氮的报道相一致。PSⅡ的最大光化学效率(Fv/Fm)是体现植物对光能的利用效率,是植物在胁迫条件下光合作用受到抑制程度的重要指标[7,22,24]。由于氮量供给不足,引起植株叶片蛋白含量的下降,导致光破坏的 PSⅡ反应中心不能被有效的修复,从而产生光抑制现象。增加供氮,这种抑制就消失(图3)。相似的结果在小麦[25]、棉花[26]、菜豆[27]的研究中也有发现,但也有一些研究中并未发现外界供氮对植株的光化学效率(Fv/Fm)产生影响[28-29]。本研究还发现,低氮下本山的Fv/Fm明显低于黄旦,说明低氮下,黄旦品种光系统受到破坏的程度较本山品种轻。这与氮高效与敏感品种在低氮下的报道相一致[4]。

图3 不同供氮处理对Fo、Fm与Fv/Fm的影响Fig. 3 The effects of nitrogen supply on Fo, Fmand Fv/Fm
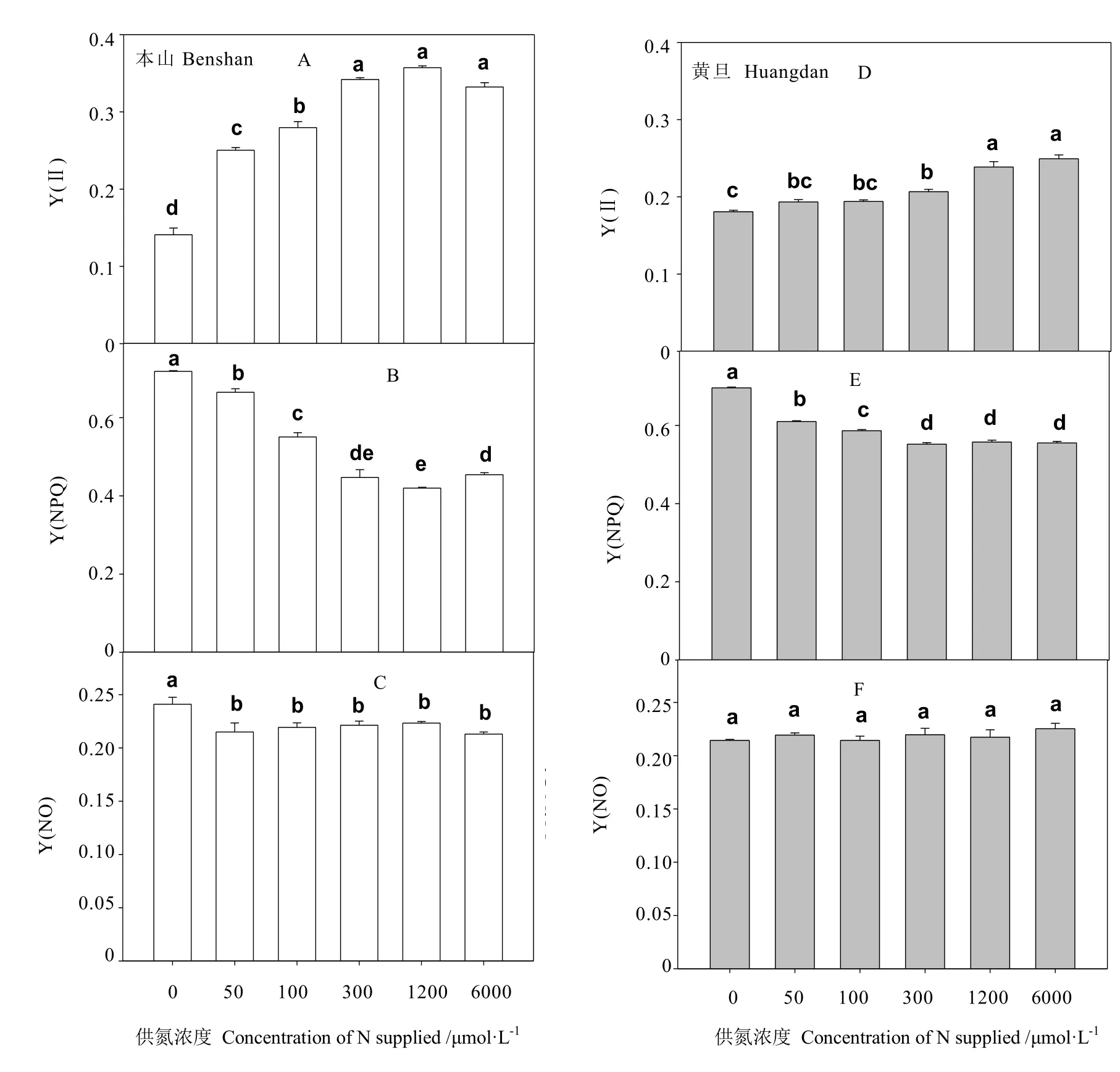
图4 不同供氮处理对Y(Ⅱ)、Y(NPQ)与Y(NO)的影响Fig. 4 The effects of nitrogen supply on Y(Ⅱ),Y(NPQ) and Y(NO)
研究发现,PSII的实际光合效率Y(Ⅱ)在低氮下都显著下降(图4),其中本山品种在低氮下Y(Ⅱ)明显低于黄旦,说明低氮下黄旦品种较本山实际光合效率更高。非调节性能量耗散的量子产额 Y(NO)与PSII调节性能量耗散的量子产额Y(NPQ)都在低氮下显著增加,其中本山品种低氮下,Y(NPQ)与 Y(NO)都要明显高于黄旦。本山品种在低氮下 Y(NO)、Y(NPQ)较高,则表明该品种在低氮下保护性的调节机制(如热耗散)和光化学能量转换不足以将叶片吸收的所有光能完全消耗[30],也就是说,入射光强超过了茶树品种能接受的程度,这时茶树可能已经受到损伤。
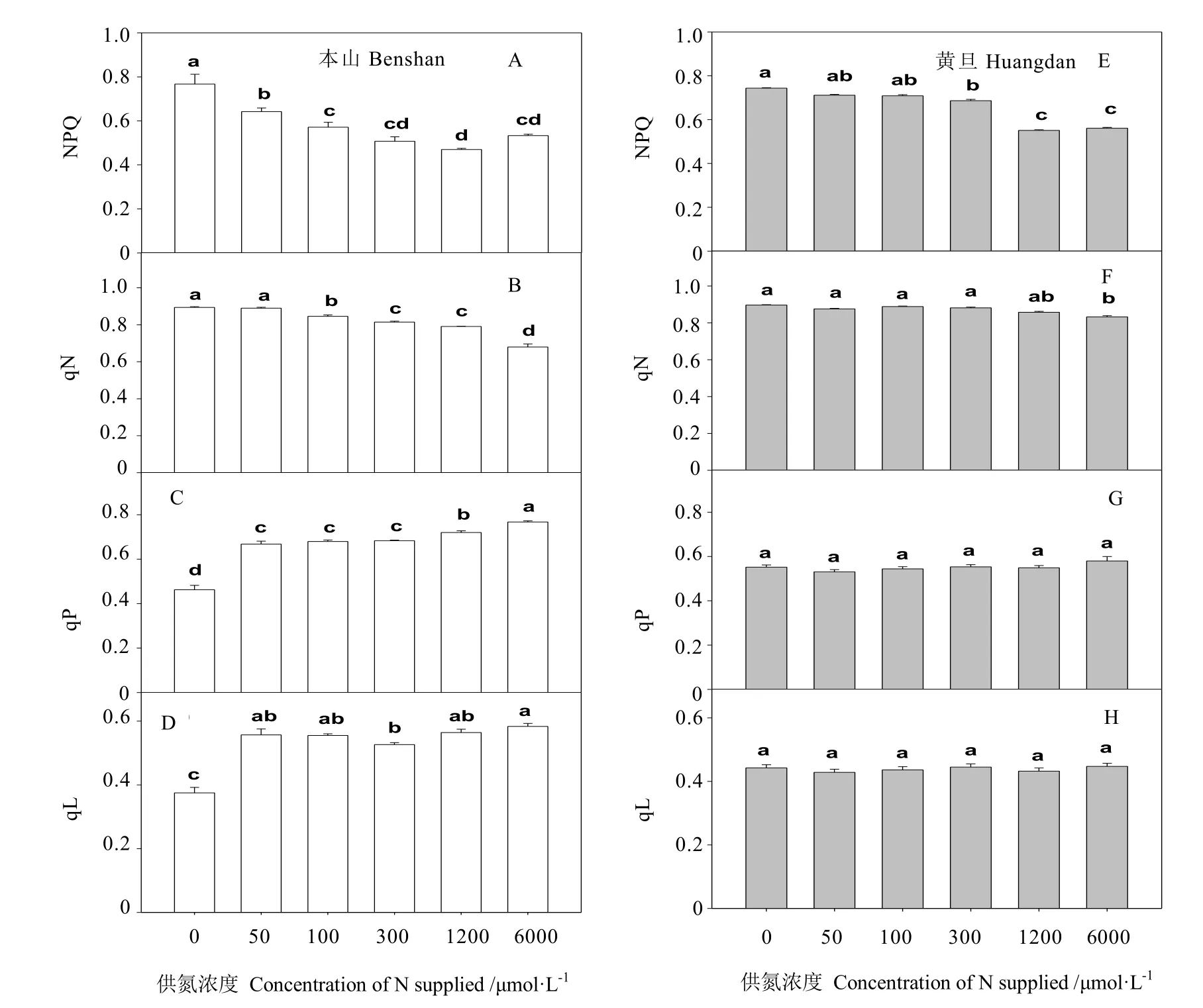
图5 不同供氮处理对NPQ、qN、qP及qL影响Fig.5 The effects of nitrogen supply on NPQ, qN, qP and qL
qP是光化学猝灭系数,它表示PSⅡ反应中心将吸收的光能转化为化学能,反映了植物的光合效率和光合活性的高低[31],NPQ是非光化学猝灭系数,是过剩光能的指示计[32],植物主要通过跨膜质子梯度介导的叶黄素循环来耗散多余光能,还能够反映类囊体膜的激发状态。低氮下茶树叶片qP的值下降,NPQ值显著增加,说明低氮下茶树叶片光合效率显著降低。这与黄檗缺氮[31]、小麦缺氮[10,33]、甜菜缺氮[7]等报道相一致。还发现本山品种低氮下,NPQ值显著大于黄旦,而qP值显著低于黄旦,说明黄旦品种低氮下的光合效率高于本山品种。这与前人在低氮下不同氮素效率的玉米[34-35]、水稻[36]等报道相一致。
qN是PSII天线色素吸收的光能,以热耗散的形式散发的部分光能,不能用于光电子传递,它是植物的一种自我保护机制,对叶绿体能量状态的改变非常敏感,而这种变化受多种因素影响[24],比如环境胁迫因子导致的气孔关闭,阻断了CO2到O2的电子流并引起PSII能量转化速率的下调[37]。因此,可以说qN是环境胁迫的指示计,并已经被证明为检测早期胁迫最敏感的参数。本研究发现,低氮下茶树叶片荧光参数qN都显著增加,说明低氮下茶树叶片 PSII天线色素吸收的光能不能完全用于光合电子传递,很大部分用于热耗散[24]。光化学淬灭系数qL反映的是PSII反应中心的开放程度大小,从图5可看出,低氮下本山品种的qL下降,且较黄旦品种低,说明低氮下本山品种 PSII反应中心的开放程度较小,损伤较大。
正常情况下,植物体叶绿素吸收的光能主要通过光合电子传递、叶绿素荧光发射和热耗散三种途径来消耗[2,38-39]。这3种途径之间存在着此消彼长的关系,光合作用和热耗散的变化会引起荧光发射的相应变化[3]。因此,可以通过对荧光参数 Fv/Fm、NPQ、qN、qP等的观测来探究和评价各茶树品种对低氮逆境的适应性,并可以作为快速筛选耐低氮茶树品种的参考指标。
[1] 林郑和, 陈荣冰, 陈常颂. 植物对氮胁迫的生理适应机制研究进展[J]. 湖北农业科学, 2011, 50(23): 4761-4764.
[2] Lin ZH, Zhong QS, Chen CS, et al. Carbon dioxide assimilation and photosynthetic electron transport of tea leaves under nitrogen deficiency [J]. Botanical Studies An International Journal, 2016, 57: 37. DOI:10.1186/s40529-016-0152-8.
[3] 郭文琦, 刘瑞显, 周治国, 等. 施氮量对花铃期短期渍水棉花叶片气体交换参数和叶绿素荧光参数的影响[J]. 植物营养与肥料学报, 2010, 16(2): 362-369.
[4] 李强, 罗延宏, 余东海, 等. 低氮胁迫对耐低氮玉米品种苗期光合及叶绿素荧光特性的影响[J]. 植物营养与肥料学报, 2015, 21(5): 1132-1141.
[5] 徐晓鹏, 傅向东, 廖红. 植物铵态氮同化及其调控机制的研究进展[J]. 植物学报, 2016, 51(2): 152-166.
[6] 林郑和, 钟秋生, 陈常颂, 等. 缺氮条件下不同品种茶树叶片光合特性的变化[J]. 茶叶科学, 2013, 33(6): 500-504.
[7] 于雪, 黄嘉鑫, 王玉波, 等. 氮肥对甜菜叶片叶绿素荧光动力学参数的影响[J]. 核农学报, 2014, 28(10):1918-1923.
[8] 王佩玲, 许育彬, 宋淑英, 等. 大气 CO2浓度倍增和施氮对冬小麦光合及叶绿素荧光特性的影响[J]. 西北植物学报, 2011, 31(1): 144-151.
[9] 王征宏, 赵威, 吕淑芳, 等. 仙客来叶绿素荧光特性对高温胁迫的响应[J]. 江苏农业科学, 2012, 40(8): 169-174.
[10] 谭雪莲, 郭天文, 张国宏, 等. 氮素对小麦不同叶位叶片叶绿素荧光参数的调控效应[J]. 麦类作物学报, 2009,29(3): 437-441.
[11] 林郑和, 钟秋生, 陈常颂. 茶树叶片 GDH、GS、GOGAT基因的克隆及荧光定量 PCR分析[J]. 茶叶科学, 2012,32(6): 523-529.
[12] 林郑和, 钟秋生, 陈常颂, 等. 不同氮浓度下茶树氮合成关键酶基因的表达分析[J].核农学报, 2014, 28(6): 985-989.
[13] 孟国花. 不同氮磷钾水平对盐胁迫下甜高粱生长的影响[D]. 济南: 山东师范大学, 2012.
[14] Guidi L, Degl IE. Ozone effects on high light-induced photoinhibition in Phaseolus vulgaris [J]. Plant Science,2008, 174(6): 590-596.
[15] Takahashi S, Milward SE, Yamori W, et al. The solar action spectrum of photosystem II damage [J]. Plant Physiology,2010, 153: 988-993.
[16] Xie X, Wang G, Pan G, et al. Variations in morphology and PSII photosynthetic capabilities during the early development of tetraspores of Gracilaria vermiculophylla(Ohmi) Papenfuss (Gracilariales, Rhodophyta) [J]. BMC Developmental Biology, 2010, 10: 43.
[17] Ruan JY, Gerendas J, Hä rdter R, et al. Effect of nitrogen form and root-zone pH on growth and nitrogen uptake of tea(Camellia sinensis) plants [J]. Annals of Botany, 2007, 99:301-310.
[18] 苏有健, 廖万有, 丁勇, 等. 不同氮营养水平对茶叶产量和品质的影响[J]. 植物营养与肥料学报 2011, 17(6):1430-1436
[19] 魏艳丽, 王彬龙, 李瑞国, 等.施氮对不同小麦品种干物质分配、氮素吸收和产量的影响[J].麦类作物学报, 2012,32(6): 1134-1138.
[20] 李曼, 王丽红, 周青. 双酚对番茄和生菜幼苗叶绿素荧光参数的影响[J]. 农业环境科学学报, 2014, 33(6):1089-1094.
[21] 宫兆宁, 范云豹, 刘辉, 等. 不同水氮梯度下典型挺水植物叶绿素荧光的响应特性[J]. 植物学报, 2016, 51(5):631-638.
[22] 王菲, 曹翠玲. 磷水平对不同磷效率小麦叶绿素荧光参数的影响[J]. 植物营养与肥料学报, 2010, 16(3): 758-762.
[23] 郝兴宇, 韩雪, 李萍, 等. 大气 CO2浓度升高对绿豆叶片光合作用及叶绿素荧光参数的影响[J]. 应用生态学报,2011, 22(10): 2776-2780.
[24] 尹海龙, 田长彦. 氮调控对盐环境下甜菜功能叶光系统Ⅱ荧光特性的影响[J]. 植物生态学报, 2013, 37(2): 122-131.
[25] Zhang LM, Shang ZP, Mao M C. Effects of long term application of nitrogen fertilizer on leaf chlorophyll fluorescence of upland winter wheat [J]. Chinese Journal of Applied Ecology, 2003, 14: 695-698.
[26] Zhang WF, Gou L, Wang ZL. Effect of nitrogen on chlorophyll fluorescence of leaves of high -yielding contton in Xinjiang [J]. Scientia Agricultura Sinica, 2003, 36:893-898.
[27] Lima JD, Mosquim PR, Matta FM. Leaf gas exchange and chlorophyll fluorescence parameters in Phaseolus vulgaris as affected by nitrogen and phosphorus deficiency [J].Photosynthetica, 1999, 37: 113-121.
[28] Ciompi S, Genti LE, Guidi L. The effect of nitrogen deficiency on leaf gas exchange and chlorophyll fluorescence parameters[J]. Plant Science, 1996, 118: 177-184.
[29] Cechin I. Photosynthesis and chlorophyll fluorescence in two hybrids of sorghum under different nitrogen and water regimes [J]. Photosynthetica, 1998, 35: 233- 240.
[30] 卢广超, 许建新, 薛立, 等. 低温胁迫对 4种幼苗的叶绿素荧光特性的影响[J]. 中国林业科技大学学报, 2014,34(2): 44-49.
[31] 周志强, 彭英丽, 孙铭隆, 等. 不同氮素水平对濒危植物黄檗幼苗光合荧光特性的影响[J]. 北京林业大学学报,2015, 37(12): 17-22.
[32] 王通明, 陈伟, 潘文杰, 等. 有机肥和化肥对烟叶气体交换、叶绿素荧光特性及叶绿体超微结构的影响[J]. 植物营养与肥料学报, 2015, 21(2): 517-526.
[33] 马冬云, 郭天财, 宋晓, 等. 施氮对冬小麦旗叶 RuBP羧化酶活性及叶绿素荧光参数的影响[J]. 西北植物学报,2010, 30(11): 2197-2202.
[34] 李耕, 高辉远, 刘鹏. 氮素对玉米灌浆期叶片光合性能的影响[J]. 植物营养与肥料学报, 2010, 16(3): 536-542.
[35] 路海东, 薛吉全, 马国胜. 低氮胁迫对不同基因型夏玉米源库性状和灌浆特性的影响[J]. 应用生态学报, 2010,21(5): 1277-1282.
[36] 魏海燕, 张洪程, 张群. 不同氮肥利用效率水稻基因型剑叶光合特征[J]. 作物学报, 2009, 35(12): 2243-2251.
[37] 钱永强, 周晓星, 韩蕾, 等. Cd2+胁迫对银芽柳PSⅡ叶绿素荧光光响应曲线的影响[J]. 生态学报, 2011, 31(20):6134-6142.
[38] Lin ZH, Chen LS, Chen RB, et al. CO2 assimilation,ribulose-1,5-bisphosphate carboxylase/oxygenase,carbohydrates and photosynthetic electron transport probed by the JIP-test of tea leaves in response to phosphorus supply [J]. BMC Plant Biology 2009, 9: 43. DOI:10.1186/1471-2229-9-43.
[39] 郭春芳, 孙云, 唐玉海, 等. 水分胁迫对茶树叶片叶绿素荧光特性的影响[J]. 生态学报, 2009, 17(3): 560-564.
Effects of Chlorophyll Fluorescence Parameters of Different Tea Cultivars in Response to Low Nitrogen
LIN Zhenghe1, ZHONG Qiusheng1, HAO Zhilong2, YOU Xiaomei1,CHEN Zhihui1, CHEN Changsong1*, SHAN Ruiyang1, RUAN Qichun1
1. Tea Research Institute, Fujian Academy of Agricultural Sciences, Fu'an 355015, China;2. College of Horticulture, Fujian Agriculture and Forestry University, Fuzhou 350002, China
Chlorophyll fluorescence parameters are often used to evaluate stress status and plant physical respo nse to stresses. To explore guidelines for nitrogen fertilization, nitrogen deficiency degree should be measured and estimated sensitively. Therefore, items including individual plant dry matter, nitrogen content and fluorescence parameters of leaves were measured among tea cultivars with different nitrogen use efficiencies. The dry matter of roots, stems, leaves and nitrogen content in leaves were declined sharply under low nitrogen stress. Compared with the low nitrogen sensitive tea cultivar ‘Benshan’, the root, stem and leaf dry weights (DW) of ‘Huangdan’ were higher under low nitrogen stress. Fo, Y(NPQ), non-photochemical quenching coefficients (NPQ) and Y(NO)increased under low nitrogen, and the fluorescence parameters of ‘Benshan’ under low nitrogen were higher than Huangdan. The maximum (Fm), primary maximum photochemical efficiency of PSⅡ(Fv/Fm), actual photosynthetic efficiency Y(Ⅱ) and coefficient of photochemical quenching (qP and qL) decreased under low nitrogen, and the fluorescence parameters of ‘Benshan’ under low nitrogen were lower than those of ‘Huangdan’. The relative highnitrogen-utility tea cultivar can reduce the damage caused by the low nitrogen stress and maintain a relatively high photosynthetic efficiency. Therefore, tea cultivar with relative high nitrogen-utility had higher yields than cultivar with low nitrogen-utility under low nitrogen stress.
low nitrogen, tea cultivar, photochemical efficiency, chlorophyll fluorescence
S571.1;S147.3
A
1000-369X(2017)04-363-10
2017-04-28
2017-05-19
国家自然科学基金(31570690)、国家茶叶产业技术体系(nycytx-23)、中国乌龙茶产业协同创新中心专项(闽教科〔2015〕75号)、福建省公益科研院所专项(2015R1012-4、2015R1012-10)、福建省自然科学基金(2016J01119)
林郑和,男,博士,主要从事茶树营养生理方面的研究。*通讯作者:ccs6536597@163.com
