茶树WRKY转录因子基因CsWRKY57的克隆及表达分析
2017-08-27郭俊红王伟东谷星郭莎莎高岳芳杨亚军肖斌
郭俊红,王伟东,谷星,郭莎莎,高岳芳,杨亚军,2,肖斌*
1. 西北农林科技大学园艺学院,陕西 杨陵 712100;2. 中国农业科学院茶叶研究所,浙江 杭州 310008
茶树WRKY转录因子基因CsWRKY57的克隆及表达分析
郭俊红1,王伟东1,谷星1,郭莎莎1,高岳芳1,杨亚军1,2,肖斌1*
1. 西北农林科技大学园艺学院,陕西 杨陵 712100;2. 中国农业科学院茶叶研究所,浙江 杭州 310008
WRKY转录因子是植物特有的一类转录因子,在植物生长发育及胁迫应答过程中均发挥重要的调控作用。为探究WRKY转录因子与茶树抗旱及耐盐性的关系,本研究基于茶树转录组数据库中的检索结果,以陕茶1号1年生茶树为试验材料,克隆获得了1个WRKY转录因子基因,命名为CsWRKY57。生物信息学分析表明,CsWRKY57基因cDNA全长为1 222 bp,编码303个氨基酸,预测分子量为33.5 kD,理论等电点为5.49;另外,蛋白比对分析显示,CsWRKY57包含1个典型的WRKY核心序列和1个C2H2型锌指结构,属于WRKYIIc家族。实时荧光定量PCR分析结果显示,CsWRKY57基因在高盐、干旱、ABA胁迫下均被诱导表达,且表现出先增加后降低的趋势,表明CsWRKY57基因参与了茶树体内干旱、高盐和ABA的调控途径。转录激活活性试验表明,CsWRKY57无转录激活活性,意味着CsWRKY57可能需要与其他元件结合才能启动基因的表达。
茶树;CsWRKY57;克隆;表达分析
植物在生长发育过程中,经常受到各种生物(如:虫害、病原菌等)和非生物(如:干旱、盐、高温等)的胁迫,与之进化形成的逆境胁迫响应机制是植物产生适应性和抗逆性的关键,而转录因子调控是其主要方式之一。其中,WRKY转录因子作为植物特有的一类转录因子家族,在植物响应逆境胁迫过程中发挥重要作用。最早,WRKY转录因子从甜土豆中被克隆[1],具有一段约 60个氨基酸组成的高度保守结构域,因其N端含有WRKY结构域的核心序列,C端含有C2H2或C2HC型锌指结构而得名。随着现代分子生物学技术的发展,越来越多的WRKY转录因子被鉴定,它们广泛参与了植物的生长发育、形态建成、生物调控途径,如AtWRKY71/EXB1通过调控RAX1、RAX2、RAX3基因的表达,在拟南芥侧枝形成过程中发挥重要作用[2];OsWRKY6通过调控OsICS1基因的表达,增加水稻体内SA的含量[3]。另外,有研究报道 VqWRKY52可以提高拟南芥抵抗白粉病的能力[4];OsWRKY4通过JA/ET信号调节途径控制一些与水稻纹枯病相关基因的表达,增强水稻对纹枯病的抵抗能力[5]。近年来,关于 WRKY转录因子参与植物非生物胁迫的研究已有报道,例如,Raineri等[6]通过研究水稻 OsWRKY47的突变体和 OsWRKY47过表达植株,发现OsWRKY47能够增加水稻的抗旱性;He等[7]研究发现小麦TaWRKY33基因参与小麦高温、低温、ABA和MeJA胁迫的调控途径;Jaffar等[8]的研究则证实菊花 CmWRKY10基因通过调控与干旱胁迫相关的一些基因的表达参与菊花干旱胁迫途径的调控。最近,有研究显示WRKY57转录因子参与了植物对生物和非生物胁迫的响应过程。如拟南芥中 AtWRKY57基因依靠JA信号调节途径降低对灰霉菌的抗性[9];同时,AtWRKY57基因功能缺失,可加速JA诱导的叶片衰老,表明AtWRKY57基因在叶片衰老过程中起负调控作用[10]。另外,有研究表明 AtWRKY57也参与了干旱胁迫调控途径,AtWRKY57通过提高ABA的含量增加拟南芥的抗旱性[11];而Jiang等[12]的研究进一步证实AtWRKY57通过降低失水率、增加脯氨酸含量等使水稻 AtWRKY57的过表达植株抗旱性增加。然而,其它物种中关于WRKY57转录因子的功能研究,尤其是在干旱和高盐胁迫下的分子调控机制尚未见报道。
茶树[Camellia sinensis (L.) O. Kuntze]在其生长发育过程中,容易遭受干旱和盐胁迫,从而导致茶叶产量和品质降低,进而造成严重的经济损失[13]。因此,明确茶树胁迫响应的分子调控机制,发掘茶树的抗性基因,对培育茶树抗逆新品种具有重要意义。本研究基于茶树转录组数据库中检索到的基因序列,以陕茶1号品种茶树叶片cDNA为模板,克隆获得了茶树转录因子编码基因 CsWRKY57的 cDNA全长,并初步分析了该基因的结构、进化关系及其在不同处理下的差异表达情况,验证了其编码蛋白的转录活性,以期为深入研究该基因在茶树逆境响应过程中的分子生物学功能提供理论参考。
1 材料与方法
1.1 植物材料与处理
试验材料为1年生陕茶1号品种茶树水培茶苗,预培养于西北农林科技大学科研温室(昼夜温度25℃/17℃,光周期14 h/10 h,相对湿度65%~75%)。选取生长健壮、无病原菌侵染、长势一致的水培茶苗同时进行干旱(20% PEG 6000)、高盐(300 mmol∙L-1NaCl)和外源脱落酸(100 µmol∙L-1ABA)处理,分别在处理后 0、1、2、4、8、12、24、48 h剪取茶苗幼嫩的叶片,液氮速冻,存于-80℃冰箱,备用。
1.2 总RNA的提取及cDNA第1链的合成
茶树叶片总RNA的提取采用CTAB法[14]提取,利用 5×All-In-One RT MasterMix(abm,加拿大),将提取的总RNA反转录成cDNA。
1.3 茶树CsWRKY57基因的克隆
根据在茶树转录组数据库中检索到的基因序列,分别设计 PCR上下游引物CsWRKY57 F和CsWRKY57 R(表1),以陕茶1号叶片的cDNA为模板,进行PCR扩增,PCR 反应程序为 94℃ 5 min;94℃ 30 s,56℃30 s,72℃ 2 min,35个循环,最后72℃延伸7 min。PCR扩增产物经1.0%的琼脂糖凝胶电泳检测后,按照Gel Extraction Kit(OMEGA,美国)说明书回收目的片段,连接到PGEM-T-Easy Vector(Promega,美国)(4℃,过夜)并转化至大肠杆菌菌株DH5α,选取阳性克隆送北京奥科鼎盛生物科技有限公司测序。
1.4CsWRKY57生物信息学分析
利用NCBI完成CsWRKY57的ORF查找和氨基酸序列的推导;用ProtParam tool完成蛋白分子量和理论等电点的分析;用MEGA7.0软件中的最大似然法(Maximum Likelihood Tree)构建系统进化树;用DNAMAN8.0完成多序列氨基酸的比对;用NetPhos 2.0 Server完成蛋白磷酸化位点预测;用 ProtScale Sever完成蛋白疏水性分析;用TMHMM Server完成蛋白跨膜区预测。

表1 引物序列Table 1 Primer sequences
1.5CsWRKY57实时荧光定量PCR分析

1.6 CsWRKY57转录激活活性验证
根据基因全长的 ORF序列以及酵母表达载体pGBKT7序列,设计带有酶切位点SmaI和 SalI的上、下游引物 jCsWRKY57 F和jCsWRKY57 R,以pGEM-T/CsWRKY57质粒为模板进行PCR扩增,将CsWRKY57基因克隆至酵母表达载体pGBKT7上。以pCL1载体为阳性对照,pGBKT7载体为阴性对照,将CsWRKY57/pGBKT7、pGBKT7和 pCL1质粒分别转化至MATa型Y2H酵母感受态中,将CsWRKY57/pGBKT7和 pGBKT7涂抹在SD/-Trp,pCL1涂抹在 SD/-Leu培养基上,30℃倒置培养 3 d,然后把长出的酵母菌落转到SD/-His-Ade上进行筛选,并用 X-α-Gal验证激活活性。
1.7 数据统计与分析
使用SPSS20.0对数据进行统计处理,采用Duncan’s新复极差法进行分析。
2 结果与分析
2.1 CsWRKY57基因克隆与序列分析
以陕茶 1号叶片 cDNA为模板,用CsWRKY57 F和CsWRKY57 R引物经PCR扩增得全长 1 222 bp的cDNA序列(图 1-A),其中包含912 bp完整的ORF,编码303个氨基酸,预测分子量为 33.5 kD,理论等电点为5.49。利用NCBI分析获得的氨基酸序列的结构域,在NCBI里经ORF Finder查找该序列的ORF,并经BlastX比对发现,该序列ORF完整,并与检索得到的结果一致(图1-B)。
2.2 茶树CsWRKY57蛋白的生物信息学分析
2.2.1 CsWRKY57蛋白系统进化树分析和多序列比对
选择14个与CsWRKY57同源性较高的蛋白序列,利用MEGA7.0软件,采用最大似然法(Maximum Likelihood)构建系统发育树。由图 2-A可知,茶树 CsWRKY57与烟草NaWRKY57和番茄 SlWRKY57亲缘关系最近。根据系统进化树的分析结果,从中选出部分蛋白的氨基酸序列,进行多序列比对(图2-B),结果表明,在保守氨基酸序列之间,N端均含有1个典型的WRKYGQK核心序列,C端均含有1个Cx4Cx23HxH型锌指结构,表明CsWRKY57属于WRKYIIc家族。
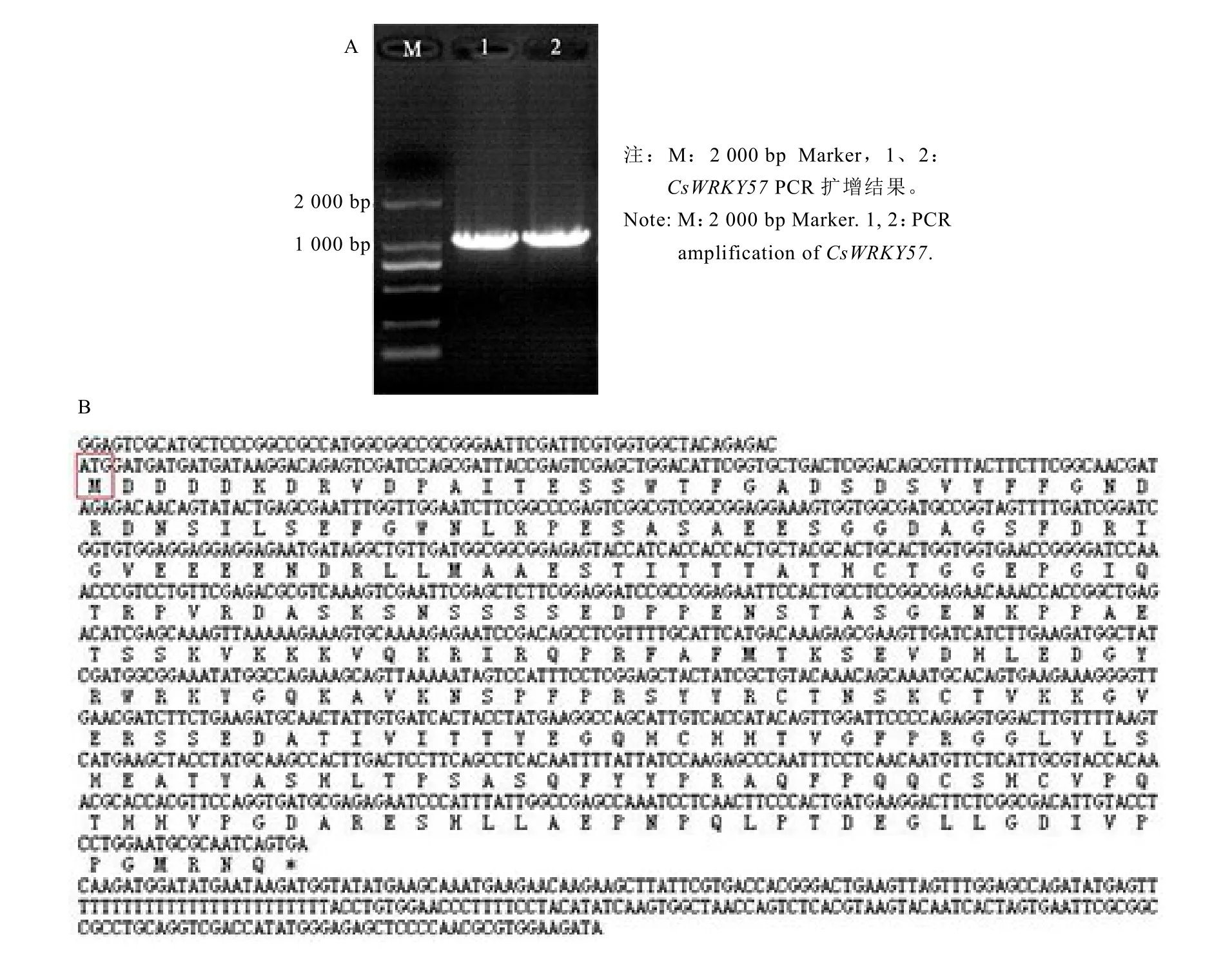
图1 茶树CsWRKY57基因的PCR扩增和氨基酸序列分析Fig. 1 PCR amplification and amino acid sequence analysis of CsWRKY57 in tea plant

图2 CsWRKY57系统进化树分析和同源氨基酸序列比对Fig. 2 Phylogenetic relationship and alignments of homologous amino acid sequences of CsWRKY57
2.2.2 CsWRKY57蛋白磷酸化位点预测
用 NetPhos 2.0 Serve预测蛋白的磷酸化位点,结果显示,CsWRKY57含有丝氨酸、苏氨酸和酪氨酸共42个磷酸化位点,其中以丝氨酸位点最多,有26个,苏氨酸和酪氨酸位点分别有 13个和 3个(图 3),由此推测CsWRKY57蛋白的活性可能受到磷酸化作用的调控。

图3 CsWRKY57磷酸化位点预测Fig. 3 Phosphorylation site prediction of CsWRKY57
2.2.3 CsWRKY57蛋白亲水/疏水性预测
利用 ProtScale Sever在线分析软件中的Hyhob/Kyte & Doolittle法预测该蛋白的亲水性和疏水性,预测结果显示(图 4-A),最大正值为1.400,最小负值为-2.800,总平均亲水性为-0.894,表明该蛋白属于亲水性蛋白。
2.2.4 CsWRKY57蛋白跨膜结构域预测
利用在线软件 TMPRED对 CsWRKY57编码的蛋白进行跨膜区预测,预测结果显示(图 4-B),该蛋白不存在跨膜螺旋区,不属于跨膜蛋白,这与疏水性结果区域分析一致(图 4-A)。

图4 CsWRKY57蛋白亲/疏水性分析和跨膜结构域预测Fig. 4 Hydrophilic/hydrophilicity analysis and prediction model for transmembrane domain of CsWRKY57 protein
2.3 茶树 CsWRKY57基因在不同胁迫下的差异表达分析
在ABA胁迫诱导下,茶树CsWRKY57基因表达量在短时间迅速增加,并在2 h达到高峰,约为胁迫前的 4倍(图 5),之后逐渐下降,表明ABA胁迫可以诱导CsWRKY57基因的表达。
在 PEG模拟干旱胁迫处理下,茶树叶片中CsWRKY57基因表达量在1~2 h内出现爆发性增加,并在 2 h达到最大,约为 0 h的 12倍(图 5),之后迅速下降。表明 CsWRKY57基因在干旱胁迫下,表达量总体呈现先急剧增加后急剧下降的趋势。
在高盐胁迫处理下,茶树叶片中CsWRKY57基因的表达量在 0~4 h内逐渐增加,在胁迫处理4 h时,CsWRKY57基因的表达量达到最大,约为对照的 5倍(图 5),之后迅速下降,说明该基因参与了茶树盐胁迫应答途径。
2.4 茶树CsWRKY57蛋白转录激活活性验证
通过 SmaI和 SalI双酶切和连接,将CsWRKY57构建到 pGBKT7载体上,构建酵母表达载体CsWRKY57/pGBKT7,pGBKT7为阴性对照,pCL1为阳性对照。试验结果表明(图6):阴性对照pGBKT7和CsWRKY57-pGBKT7不能在SD/-Ade-His二缺的板子上生长,而阳性对照pCL1可以在SD/-Ade-His二缺的板子上生长,并在含有 X-α-Gal的SD/-Ade-His二缺板子上显蓝色,表明CsWRKY57蛋白无转录激活活性。
3 讨论

图5 CsWRKY57基因在不同胁迫处理下的表达量Fig. 5 Expression analysis of CsWRKY57 under different stresses treatments

图6 CsWRKY57转录激活活性分析Fig. 6 Transcriptional activation analysis of CsWRKY57
转录因子调控是植物在各种环境胁迫下的重要调控方式之一,其中WRKY转录因子是植物特有的一类转录因子,广泛参与植物响应逆境和生长发育的过程[16]。本研究从茶树品种陕茶1号中克隆出1个茶树WRKY基因,序列分析表明该基因编码蛋白与烟草WRKY57和番茄WRKY57同源性最高。另外,CsWRKY57具有WRKY转录因子第II家族c亚族的典型特点:含有1个典型的WRKYGQK结构域和1个Cx4Cx23HxH型锌指结构,表明该基因属于WRKYIIc亚族。
近年来,关于WRKY转录因子家族基因的功能在多种植物中被鉴定。其中大量研究表明,WRKY转录因子参与了植物对干旱胁迫的响应,如 Tang等[17]的研究发现异源表达GsWRKY20能够显著增强拟南芥和紫花苜蓿的抗旱性;Yan等[18]研究报道则证实陆地棉GhWRKY17在转基因烟草中负调控烟草的抗旱性。本研究中,茶树在干旱胁迫处理下,CsWRKY57基因表达量出现爆发性增加,这与Jiang等[11]研究的AtWRKY57结果相一致,表明 CsWRKY57基因参与了茶树干旱胁迫响应的调控途径。另一方面,WRKY转录因子亦被证实在植物盐胁迫应答中扮演重要角色,如盐胁迫下 MtWRKY76表达量增加且其过表达植株抗盐能力显著高于野生型[19];AtWRKY25或 AtWRKY33过表达可以增加转基因拟南芥的耐盐性[20]。本研究发现,CsWRKY57的表达量在 NaCl处理下呈现出先增加后降低的趋势,表明 CsWRKY57基因亦参与了茶树对高盐胁迫的响应过程。此外,有研究表明外源ABA处理诱导黄瓜CsWRKY46基因的表达,进而增强黄瓜的耐寒性[21];而 Wang等[13]通过外源 ABA及其生物合成抑制剂证实茶树CsWRKY2作为 ABA信号途径的下游调控因子参与了茶树对干旱胁迫的应答过程。本研究亦发现外源 ABA处理可以显著诱导茶树CsWRKY57基因的表达,这与Wang等[13]的研究结果相似,意味着 CsWRKY57基因亦可能参与了茶树响应干旱和盐胁迫过程中的 ABA信号调控途径,但详细的分子调控机制需要进一步验证。
作为转录因子,转录激活相关基因表达是其行使功能的主要形式,亦有部分转录因子通过结合其他基因的启动子或形成同源二聚体发挥其功能。例如,Li等[22-23]的研究发现菊花 CmWRKY22、CmWRKY48具有转录自激活活性,而 CmWRKY17、CmWRKY21、CmWRKY40、CmWRKY42却不具有转录激活活性,说明WRKY转录因子家族并非全都具有转录激活活性。本研究中,我们验证了CsWRKY57蛋白的转录激活活性,结果显示,CsWRKY57蛋白无转录激活活性。Zhou等的研究发现 GmWRKY27通过形成二聚体而具有转录激活活性,因此笔者推测 CsWRKY57蛋白可能通过形成同源二聚体或与其他顺式作用元件结合[24],才可能具有转录激活活性,从而激活相关基因的表达,参与茶树体内相关的调节途径[25]。
总之,本研究从茶树品种陕茶1号中克隆出1个WRKY转录因子CsWRKY57基因,对其进行了系统的生物信息学分析,为之后研究该基因和蛋白的功能提供前期基础。同时,qRT-PCR分析表明,CsWRKY57基因参与了茶树对干旱和盐胁迫的响应,为培育抗盐抗旱的茶树新品种提供了一定的分子基础。转录激活活性试验表明,CsWRKY57蛋白无转录激活活性,因此,明确 CsWRKY57基因的转录调控机制是下一步研究工作的重点。
[1] Chi Y, Yang Y, Zhou Y, et al. Protein-protein interactions in the regulation of WRKY transcription factors [J]. Mol Plant,2013, 6(2): 287-300.
[2] Guo D, Zhang J, Wang X, et al. The WRKY transcription factor WRKY71/EXB1 controls shoot branching by transcriptionally regulating RAX genes in Arabidopsis [J].Plant Cell, 2015, 27(11): 3112-3127.
[3] Choi C, Hwang S H, Fang I R, et al. Molecular characterization of Oryza sativa WRKY6, which binds to W-box-like element 1 of the Oryza sativa pathogenesis-related (PR) 10a promoter and confers reduced susceptibility to pathogens [J]. New Phytologist, 2015,208(3):846-859.
[4] Wang X, Guo R, Tu M, et al. Ectopic expression of the wild grape WRKY transcription Factor VqWRKY52 in Arabidopsis thaliana enhances resistance to the biotrophic pathogen powdery mildew but not to the necrotrophic pathogen Botrytis cinerea [J]. Frontiers in Plant Science,2017, 8: 97.
[5] Wang H, Meng J, Peng X, et al. Rice WRKY4 acts as a transcriptional activator mediating defense responses toward Rhizoctonia solani, the causing agent of rice sheath blight[J]. Plant Molecular Biology, 2015, 89(1): 157-171.
[6] Raineri J, Wang S, Peleg Z, et al. The rice transcription factor OsWRKY47 is a positive regulator of the response to water deficit stress [J]. Plant Molecular Biology, 2015, 88(4):401-413.
[7] He G H, Xu J Y, Wang Y X, et al. Drought-responsive WRKY transcription factor genes TaWRKY1 and TaWRKY33 from wheat confer drought and/or heat resistance in Arabidopsis [J]. BMC Plant Biology, 2016, 16(1): 116-131.
[8] Jaffar M A, Song A, Faheem M, et al. Involvement of CmWRKY10 in drought tolerance of chrysanthemum through the ABA-signaling pathway [J]. International Journal of Molecular Sciences, 2016, 17(5): 693-706.
[9] Jiang Y, Yu D. The WRKY57 transcription factor affects theexpression of jasmonate ZIM-Domain genes transcriptionally to compromise Botrytis cinerea resistance[J]. Plant Physiology, 2016, 171(4): 2771-2782.
[10] Jiang Y, Liang G, Yang S, et al. Arabidopsis WRKY57 functions as a node of convergence for jasmonic acid- and auxin-mediated signaling in jasmonic acid-induced leaf senescence [J]. Plant Cell, 2014, 26(1): 230-245.
[11] Jiang Y, Liang G, Yu D. Activated expression of WRKY57 confers drought tolerance in Arabidopsis [J]. Mol Plant,2012, 5(6):1375-1388.
[12] Jiang Y, Qiu Y, Hu Y, et al. Heterologous expression of AtWRKY57 confers drought tolerance in oryza sativa [J].Frontiers in Plant Science, 2016, 7(145): 145.
[13] Wang Y, Shu Z, Wang W, et al. CsWRKY2, a novel WRKY,gene from Camellia sinensis, is involved in cold and drought stress responses [J]. Biologia Plantarum, 2016, 60(3):443-451.
[14] 杨桂燕, 贾彩霞, 孙宇栋, 等. 核桃 JrsHSP17.3基因克隆及温度胁迫响应模式分析[J]. 西北植物学报, 2015, 35(9):1752-1756.
[15] 钱文俊, 岳川, 曹红利, 等. 茶树中性/碱性转化酶基因CsINV10的克隆与表达分析[J]. 作物学报, 2016(3):376-388.
[16] Yamasaki K, Kigawa T, Seki M, et al. DNA-binding domains of plant-specific transcription factors: structure, function,and evolution [J]. Trends in Plant Science, 2013, 18(5):267-76.
[17] Tang L, Cai H, Zhai H, et al. Overexpression of Glycine soja WRKY20 enhances both drought and salt tolerance in transgenic alfalfa (Medicago sativa L.) [J]. Plant Cell,Tissue and Organ Culture (PCTOC), 2014, 118(1): 77-86.
[18] Yan H, Jia H, Chen X, et al. The cotton WRKY transcription factor GhWRKY17 Functions in drought and salt stress in transgenic Nicotiana benthamiana through ABA signalling and the modulation of reactive oxygen species production [J].Plant & Cell Physiology, 2014, 55(12): 2060-2076.
[19] Liu L, Zhang Z, Dong J, et al. Overexpression of MtWRKY76,increases both salt and drought tolerance in Medicago truncatula [J]. Environmental & Experimental Botany, 2016,123: 50-58.
[20] Jiang Y Q, Deyholos M K. Functional characterization of Arabidopsis NaCl-inducible WRKY25 and WRKY33 transcription factors in abiotic stresses [J]. Plant Molecular Biology, 2009, 69(1): 91-105.
[21] Ying Z, Yu H, Yang X, et al. CsWRKY46, a WRKY transcription factor from cucumber, confers cold resistance in transgenic-plant by regulating a set of cold-stress responsive genes in an ABA-dependent manner [J]. Plant Physiology & Biochemistry Ppb, 2016, 108: 478-487.
[22] Li P, Song A, Gao C, et al. The over-expression of a chrysanthemum WRKY transcription factor enhances aphid resistance [J]. Plant Physiology & Biochemistry, 2015, 95:26-34.
[23] Li P, Song A, Gao C, et al. Chrysanthemum WRKY gene CmWRKY17 negatively regulates salt stress tolerance in transgenic chrysanthemum and Arabidopsis plants [J]. Plant Cell Reports, 2015, 34(8): 1365-1378.
[24] Zhou Q Y, Tian A G, Zou H F, et al. Soybean WRKY-type transcription factor genes, GmWRKY13, GmWRKY21, and,GmWRKY54, confer differential tolerance to abiotic stresses in transgenic Arabidopsis plants [J]. Plant Biotechnol J,2008, 6(5): 486-503.
[25] 王涛. 青蒿AaGL2基因的克隆及转基因青蒿遗传分析[D].上海: 上海交通大学, 2012.
Cloning and Expression Analysis of WRKY Transcription Factor Gene CsWRKY57 in Tea Plant (Camellia sinensis)
GUO Junhong1, WANG Weidong1, GU Xing1, GUO Shasha1, GAO Yuefang1, YANG Yajun1,2, XIAO Bin1*
1. College of Horticulture, Northwest A&F University, Yangling 712100, China;2. Tea Research Institute of the Chinese Academy of Agricultural Sciences, Hangzhou 310008, China
The WRKY is one of the characteristic transcription factors in plants, which play important roles in plant growth, development and stress regulation. In order to study the relationship between WRKY transcription factors and stress tolerance of tea plant (Camellia sinensis), a WRKY transcription factor was cloned from tea cultivar‘Shanchayihao’ and named CsWRKY57, based on the searching result of tea plant transcriptome database.Bioinformatics analysis showed that the full-length sequences of CsWRKY57 was 1 222 bp encoding 303 amino acids.The molecular weight of CsWRKY57 was 33.5 kD and theoretical isoelectric point was 5.49. The BLAST results showed that CsWRKY57 contained one typical WRKY domain and one zinc finger motif (C2H2), suggesting that it was a member of the WRKYIIc family. In addition, quantitative real-time PCR (qRT-PCR) analysis showed that the expression of CsWRKY57 was induced by salt, drought and ABA stresses, and showed a tendency to increase first and then decrease, which implies that CsWRKY57 is involved in the process of tea plant responses to salt, drought and ABA.Furthermore, transcriptional activation activity assays indicated that CsWRKY57 didn't have transcriptional activation activity, which means that CsWRKY57 may be needed to combine with other elements to activate gene expression.
tea plant (Camellia sinensis), CsWRKY57, cloning, expression analysis
S571.1;Q52
A
1000-369X(2017)04-411-09
2017-05-05
2017-05-21
陕西省茶叶产业技术体系(K3330215131)、陕西省科技统筹创新(KTZB02-01)、中央高校基本科研业务费专项资金(No. 2452017074)
郭俊红,女,硕士研究生,主要从事茶树分子育种技术研究。*通讯作者:1647785720@qq.com
