花斑副沙鳅七种同工酶的组织特异性表达
2017-08-22赵田田蒲宗旺岳兴建
赵田田+蒲宗旺+岳兴建

摘要:采用聚丙烯酰胺垂直梯度凝胶电泳方法,对花斑副沙鳅(Parabotia fasciata Dabry)的鰓、心、肝胰脏、肠、肾、肌肉、眼、脑8种组织中的过氧化氢酶(CAT)、酯酶(EST)、乳酸脱氢酶(LDH)、苹果酸脱氢酶(MDH)、过氧化物酶(POD)、超氧化物歧化酶(SOD)和醇脱氢酶(ADH)进行了分析。结果表明,花斑副沙鳅的7种同工酶表达具有明显的组织特异性,8种组织中检测出3种CAT同工酶、8种EST同工酶、4种LDH同工酶、8种MDH同工酶、10种POD同工酶、10种SOD同工酶、10种ADH同工酶表达。其中,CAT-3、EST-7仅在肝胰脏表达,LDH-4、SOD-9、ADH-3僅在肾表达。
关键词:花斑副沙鳅(Parabotia fasciata Dabry);同工酶;表达;组织特异性
中图分类号:Q959.46+8:Q55 文献标识码:A 文章编号:0439-8114(2017)14-2736-07
DOI:10.14088/j.cnki.issn0439-8114.2017.14.035
Abstract: Seven isozymes including Catalase(CAT), Esterase(EST), Lactic acid hydrogen enzymes(LDH), Malate dehydrogenase(MDH), Peroxidase(POD), Superoxyde dismutase(SOD), Alcohol dehydrogenase(ADH) were examined in eight tissues (gill, heart, hepatopancreas, intestines, kidney, muscle, brain and eye) of Parabotia fasciata Dabry by vertical polyacrylamide gel gradient electrophoresis. The results showed that isozyme genes in P. fasciata apparently exhibited tissue specific expression to different degrees. The detected band number of CAT, EST, LDH, MDH, POD, SOD, ADH were 3, 8, 4, 8, 10, 10, 10, respectively. The isozyme CAT-3 and EST-7 were expressed only in hepatopancreas. The isozyme LDH-4, SOD-9 and ADH-3 were expressed only in the renal tissue.
Key words: Parabotia fasciata Dabry; isozyme; expression; tissue specificity
花斑副沙鳅(Parabotia fasciata Dabry)隶属鲤形目(Cypriniformes)鳅科(Cobitidae)沙鳅亚科(Botiinae)副沙鳅属(Parabotia Dabry de Thiersant),俗称黄鳅、黄沙鳅、伍氏沙鳅,为中国特有鱼类。广泛分布于黑龙江至珠江的各水系,长江上游主要分布在岷江、沱江、嘉陵江等长江干流水系,是一种以水生昆虫和藻类为食物的小型底栖鱼类[1]。近年来,由于过度捕捞、水利工程修建、水环境污染等环境的改变,野生资源量急剧下降[2]。目前对花斑副沙鳅的研究较少,且主要集中在发育生物学、繁殖生物学、年龄与生长、肌肉营养等方面[2-8],未见关于同工酶的研究报道。试验采用聚丙烯酰胺垂直平板电泳方法,对花斑副沙鳅的鰓、心、肝胰脏、肠、肾、肌肉、眼、脑8种组织中的过氧化氢酶(CAT)、酯酶(EST)、乳酸脱氢酶(LDH)、苹果酸脱氢酶(MDH)、过氧化物酶(POD)、超氧化物歧化酶(SOD)和醇脱氢酶(ADH)7种同工酶进行了电泳检测,分析花斑副沙鳅同工酶的组织表达情况,了解花斑副沙鳅的生化遗传特性,旨在为花斑副沙鳅的种质资源保护、人工选育、病理研究、环境生态影响评价等方面提供遗传学基础资料。
1 材料与方法
1.1 材料
参试花斑副沙鳅为长江上游鱼类资源保护与利用四川省重点实验室人工繁殖个体,取全长130~159 mm、体长110~135 mm、体质量13.9~26.5 g、体格健壮、体表无伤个体30尾用于试验。取样前清水中停饵暂养1 d。
1.2 方法
1.2.1 样品制备 花斑副沙鳅断鳃断尾放血,冰浴条件下迅速摘取鰓、心、肝胰脏、肠、肾、肌肉、眼、脑8种组织,滤纸吸去血渍,预冷生理盐水清洗组织,以样品∶缓冲液=1∶7的比例加入0.1 mol/L PBS缓冲液(pH 7.0)混合。冰浴匀浆后加入100 μL氯仿混匀;4 ℃冰箱中静置10 min;14 000 r/min低温离心15 min(2次),取上清液,分装,用于电泳分析或放入-80 ℃超低温冰箱里保存备用。
1.2.2 电泳与染色 按照文献[9]的方法进行聚丙烯酰胺垂直梯度凝胶电泳,浓缩胶浓度为4%,分离胶浓度为7.5%。电极缓冲液为Tris-Gly(pH 8.3)。加样前50 V电压下预电泳30 min,预电泳结束后每个加样孔加样15 μL。指示剂在浓缩胶时电泳电压为80 V,指示剂完全进入分离胶后电压升高至120 V,电流为15 mA;在冰柜中保持4 ℃进行电泳。待指示剂距凝胶底端2 cm处时停止电泳。取出凝胶用预冷去离子水洗净,放入染液进行染色。染液现配现用,染色流程参考有关方法[10-13],稍作改进。
1.2.3 同工酶命名 同工酶的缩写、命名参照胡能书等[14]和熊全沫[15]的方法,按照从阳极到阴极的顺序依次标记。具体为CAT(E.C.1.11.1.6)、EST(E.C.3.1.1.1)、LDH(E.C.1.1.1.27)、MDH(E.C.1.1.1.37)、POD(E.C.1.11.1.7)、SOD(E.C.1.15.1.1)和ADH(E.C.1.1.1.1)。
2 结果与分析
2.1 CAT(E.C.1.11.1.6)同工酶分析
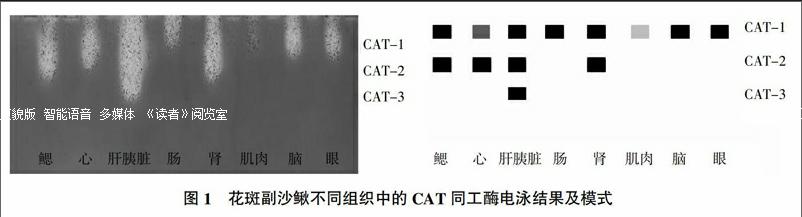
花斑副沙鳅8种组织里CAT同工酶的电泳结果及模式见图1,CAT同工酶表达及活性强弱比较见表1。从图1、表1可見,CAT同工酶在花斑副沙鳅8种组织中均有表达,除肌肉中活性稍弱外,其余各组织里的活性均较强。花斑副沙鳅不同组织中检测出的CAT同工酶酶带有3条,以肝胰脏中的酶带最多,检测出了3条。其中CAT-1在花斑副沙鳅8种组织中均有存在,且肝胰脏中的表达最强;CAT-2在鳃、心、肝胰脏和肾中存在,以肝胰脏中表达最强;CAT-3仅存在于肝胰脏中,说明肝胰脏具有较强的组织特异性。花斑副沙鳅不同组织里的CAT同工酶活性强弱排序为肝胰脏>鳃、肾>心>肠、眼、脑>肌肉。
2.2 EST(E.C.3.1.1.1)同工酶分析
花斑副沙鳅8种组织里EST同工酶的电泳结果及模式见图2,EST同工酶表达及活性强弱比较见表2。从图2、表2可见,EST同工酶在花斑副沙鳅8种组织中均有表达,其中在肝胰脏里的活性最强。花斑副沙鳅不同组织中检测出的EST同工酶酶带有8条,以肝胰脏中的酶带最多,检测出了8条;肌肉里酶带最少,仅有1条。EST-1、EST-3表达相同,仅在花斑副沙鳅的鳃、肝胰脏、肠中表达,以肝胰脏里的活性表达最强;EST-2存在于除肌肉外的其余各组织里,以肝胰脏中的活性最强;EST-4存在于花斑副沙鳅8种组织中,除肌肉里的活性较弱外,其余各组织里活性均较强;EST-5、EST-6在肝胰脏、肠、肾中的表达相同,除此之外,EST-5在鳃中也有表达,EST-6在眼、脑中也有表达;EST-7仅在花斑副沙鳅肝胰脏中有表达,且活性较弱;EST-8在肝胰脏、眼中有表达。花斑副沙鳅不同组织里的EST同工酶活性强弱排序为肝胰脏>肠>鳃>肾>眼>心>脑>肌肉。
2.3 LDH(E.C.1.1.1.27)同工酶分析
花斑副沙鳅8种组织里LDH同工酶的电泳结果及模式见图3,LDH同工酶表达及活性强弱比较见表3。从图3、表3可见,LDH同工酶在花斑副沙鳅8种组织中均有表达,其中在肾里活性最强,肝胰脏和眼中的活性最弱。花斑副沙鳅8种组织中检测出的LDH同工酶酶带有4条,以肾里酶带最多,检测到4条。LDH-1存在于除眼以外的其余各组织里,其中以鳃、心、肌肉里的活性最强,脑里的活性最弱;LDH-2广泛存在于8种组织中,除肝胰脏和眼外,其余组织里的活性均较强;LDH-3在鳃、心、肾、眼、脑中表达,在鳃、心、肾中优势表达;LDH-4仅在肾中表达,且活性极强,组织特异性明显。花斑副沙鳅不同组织里的LDH同工酶活性强弱排序为肾>鳃、心>肌肉>肠、脑>肝胰脏、眼。
2.4 MDH(E.C.1.1.1.37)同工酶分析
花斑副沙鳅8种组织里MDH同工酶的电泳结果及模式见图4,MDH同工酶表达及活性强弱比较见表4。从图4、表4可见,花斑副沙鳅MDH同工酶不同于其他同工酶,只在除肠外的其余7种组织中表达,以心脏里的活性最强。花斑副沙鳅不同组织中检测出的MDH同工酶酶带有8条,以眼中的条带最多,检测出8条。MDH-1在心、肾、肌肉、眼中表达,以心、肾里的活性最强;MDH-2在鳃、心、肾、肌肉、眼中表达,其中在心、肾中优势表达;MDH-3、MDH-4在除肠外的7种组织中均有表达,以心脏里的活性最强;MDH-5、MDH-6除活性不同外,表达相同,均在鳃、心、肝胰脏、肾、眼、脑中表达;MDH-7在心、肝胰脏、肾、眼、脑中表达,且活性均较强;MDH-8仅在肝胰脏、眼、脑中表达,且活性均较弱。花斑副沙鳅不同组织里的MDH同工酶活性强弱排序为心>肾>肝胰脏>眼>脑>鳃>肌肉。
2.5 POD(E.C.1.11.1.7)同工酶分析
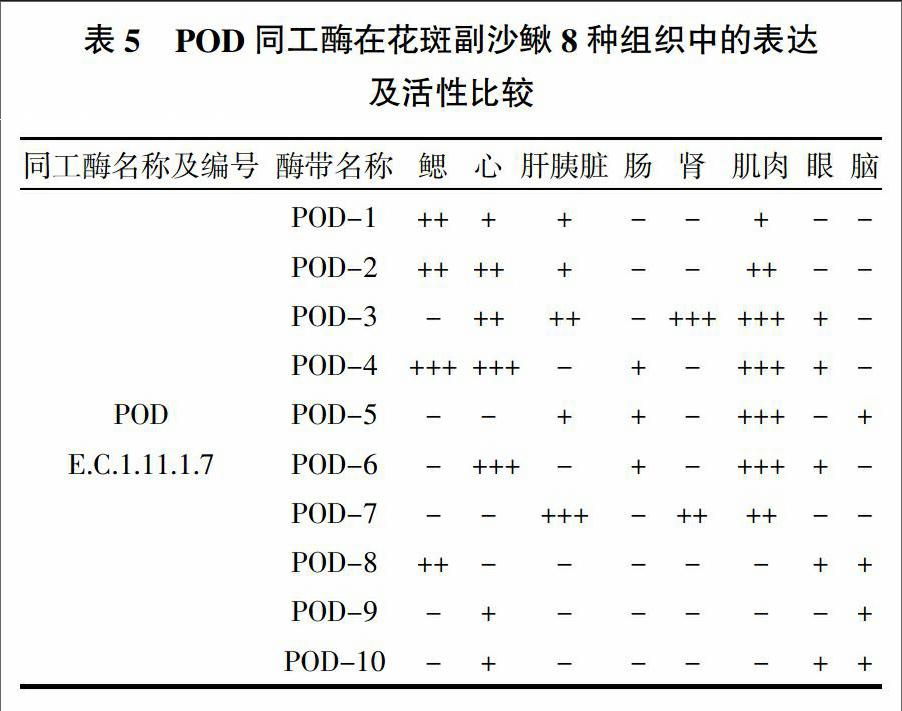
花斑副沙鳅8种组织里POD同工酶的电泳结果及模式见图5,POD同工酶表达及活性强弱比较见表5。从图5、表5可见,POD同工酶在花斑副沙鳅的8种组织里均有表达,以肌肉里的活性最强,肠里的活性最弱。花斑副沙鳅不同组织中检测出的POD同工酶酶带有10条,其中心、肌肉里酶带最多,都检测出7条,但肌肉里的活性高于心。POD-1、POD-2除活性有所差异外,在鳃、心、肝胰脏和肌肉中表达相同;POD-3在心、肝胰脏、肾、肌肉和眼中表达,在肾和肌肉里活性最强;POD-4在鳃、心和肌肉中活性强,在肠和眼里活性弱;POD-5在肝胰脏、肠、肌肉和脑中表达,肌肉里活性最强;POD-6在心和肌肉中活性较强;POD-7在肝胰脏中活性强;POD-8、POD-9、POD-10的活性均较弱,且仅在部分组织中表达。花斑副沙鳅不同组织里的POD同工酶活性强弱排序为肌肉>心>鳃>肝胰脏>肾>眼>脑>肠。
2.6 SOD(E.C.1.15.1.1)同工酶分析
花斑副沙鳅8种组织里SOD同工酶的电泳结果及模式见图6,SOD同工酶表达及活性强弱比较见表6。从图6、表6可见,SOD同工酶在花斑副沙鳅8种组织中均有表达,以肌肉里的活性最强,眼里的活性最弱。花斑副沙鳅不同组织中检测出的SOD同工酶酶带有10条,其中鳃里的酶带最多,检测出8条。SOD-1存在于除肌肉和脑之外的6种组织中,心、肠和肾里的活性略强于其他组织;SOD-2以肌肉里的活性最强;SOD-3在鳃、肌肉、眼和脑中表达,以鳃里的活性最弱;SOD-4存在于8种组织中,且活性均较强;SOD-5在肌肉中活性强;SOD-6在心脏里活性强;SOD-7在肠和肌肉中活性强;SOD-8在除眼之外的7种组织中表达,其中肾、肌肉和脑里的活性优于其他组织;SOD-9仅在肾中表达;SOD-10在鳃和肝胰脏中表达,肝胰脏里的活性高于鳃。花斑副沙鳅不同组织里的SOD同工酶活性强弱排序为肌肉>鳃、肾>肝胰脏>肠>心>脑>眼。
2.7 ADH(E.C.1.1.1.1)同工酶分析
花斑副沙鳅8种组织里ADH同工酶的电泳结果及模式见图7,ADH同工酶表达及活性强弱比较见表7。从图7、表7可见,ADH同工酶在花斑副沙鳅8种组织中均有表达,不同组织中检测出的ADH同工酶酶带有10条,其中肝胰脏、肾、肌肉和脑里均检测出6条,以肌肉里的活性最强。ADH-1在鳃、肝胰脏、肾和肌肉中表达,且活性均较强;ADH-2在除肠外的7种组织中表达,除眼和脑里的活性较弱外,其余组织里的活性均较强;ADH-3仅存在于肾中,且活性强;ADH-4在8种组织中表达,活性均较强;ADH-5在除肌肉外的7种组织中表达,以心脏里的活性最强;ADH-6在心、肠和肌肉中表达,以肌肉里的活性最强,肠里活性最弱;ADH-7在肌肉和脑中表达,以肌肉里活性最强;ADH-8在肝胰脏和肾中表达;ADH-9在肌肉、眼和脑中表达,其中肌肉里的活性略强于眼和脑;ADH-10在肝胰脏和脑中表达,且活性均较弱。花斑副沙鳅不同组织里的ADH同工酶活性强弱排序为肌肉>肾>肝胰脏>鳃、心>脑>眼>肠。
3 讨论
3.1 花斑副沙鳅同工酶表达的组织特异性
试验结果表明,花斑副沙鳅同工酶表达呈现明显的组织特异性,表现在不同组织同种同工酶带型不同,表达量有差异;同种组织里各种同工酶表达量与表现型不同;不同组织同工酶酶谱相似,但活性不同。不同组织同工酶的特异性表达是因为机体在发育过程中各组织分化后,为满足不同组织特定的生理功能而发生的基因差异性表达[16]。通过对花斑副沙鳅7种同工酶的比较,发现8种组织中,肝胰脏中的酶活性最强,肠中酶活性最弱。鳃中检测出了7种同工酶,其中EST、SOD同工酶活性最强。心、眼、脑、肾中各检测出了7种同工酶,其中均以MDH同工酶的活性最强。肝胰脏中检测出了7种同工酶,其中EST活性最强。肠中检测到除MDH同工酶以外的6种同工酶,其中EST同工酶活性最强。肌肉中检测出了7種同工酶,其中POD、ADH同工酶活性最强。花斑副沙鳅的CAT、EST、LDH、MDH、POD、SOD、ADH同工酶在各组织之间存在明显的组织特异性,其中CAT-3、EST-7只在肝胰脏中表达,这与肝胰脏作为机体代谢最旺盛的器官、具有解毒功能相符;LDH-4、SOD-9、ADH-3只在肾中表达,这与肾作为鱼类机体的造血器官相符。
花斑副沙鳅同工酶的表达特点与目前发现的各种硬骨鱼类多种同工酶表达具有一致的组织特异性,如鳤(Ochetobibus elongatus Kner)等20种鱼类的LDH同工酶[17],大鳞副泥鳅(Paramisgurnus dabryanus Sauvag)的LDH、EST同工酶[18,19],草鱼(Ctenopharyngodon idellus Cuvier et Valenciennes)的LDH、ADH、MDH、G3PDH、EST、POD同工酶[20],泥鳅(Misgurnus anguillicaudatus Cantor)的EST、SOD、G6PDH、ALP、ADH、POD、CAT同工酶[19,21,22],青鱼(Mylopharyngodon piceus Richardson)的α-AMY、EST、TDH、LDH、MDH、ME、POX、SOD、C6PDH同工酶[23],黄颡鱼(Pelteobagrus fulvidraco Richardson)的EST、SOD、MDH同工酶[24],奥尼罗非鱼(Tilapia nilotica×T. aurea L.)5种组织的EST、LDH、MDH、SOD同工酶[25],石鲽(Platichthys bicoloratus Basilewsky)的LDH、EST、SOD、PGM、SDH、GDH、G3PDH、MDH、ME、IDHP、PGDH、GPI、HK、ADH同工酶[26],青海湖裸鲤(Gymnocypris przewalskii Kessler)的LDH、MDH、ME、CAT、IDH、EST、ACP、POD、HK、PGM、GDH、SOD、GPI同工酶[27],黄河高原鳅(Triplophysa pappenheimi P. W. Fang)的LDH同工酶[28],波纹唇鱼(Cheilinus undulatus Püppell)的EST、LDH、MDH、ME同工酶[29],黑鲷(Sparus macrocephlus Basilewsky)的LDH、ADH、MDH、ME、SOD、POD、EST、GAD、FDH同工酶[16],鲤鱼(Cyprinus carpio L.)的LDH、MDH、EST、CAT、POD、G6PDH、IDH、ADH同工酶[30]。虽然上述鱼种均具有组织表达特异性,但不同鱼种各同工酶的组织特异性存在差异。少数鱼种的部分同工酶如青鱼GOT同工酶[23]、黄颡鱼LDH同工酶[24]无明显的组织差异,一些鱼种的同工酶不表达,如天门冬氨酸氨基转移酶(AST)在波纹唇鱼6种组织(肌肉、心脏、肝脏、肾脏、脑和脾脏)里未有表达[28]。花斑副沙鳅LDH也有明显的组织差异,GOT和AST还未检测出。
3.2 花斑副沙鳅不同组织同工酶表达特异性与功能的相关性
3.2.1 CAT、EST、POD、SOD与机体的解毒功能密切相关 CAT为二聚体酶,是一类催化H2O2分解成H2O和O2的酶,主要存在于生物体的肝细胞和红细胞内[27];花斑副沙鳅肝胰脏中CAT表达量最高,其次是肾、鳃,肌肉里表达量最低,这与肝胰脏作为鱼类解毒器官、肾脏作为鱼类重要的造血器官、鳃作为鱼类的呼吸器官而分布有丰富的毛细血管网、执行机体的氧化解毒等功能密切相关。CAT-1广泛分布于花斑副沙鳅的各种组织中,推测CAT-1是花斑副沙鳅CAT同工酶的基础酶。EST属于水解酶,也为二聚体酶,是一类催化酯类化合物水解的酶,在酶代谢和生物膜的结构方面发挥着重要的作用[24],与体内废物、毒素的代谢相关;花斑副沙鳅肝胰脏中EST表达量最高,与肝胰脏作为消化、吸收、排毒的主要器官相关;肠道作为消化吸收的主要场所,EST表达量也较高;肌肉里表达量最低,且酶带少、染色浅。EST-4在花斑副沙鳅8种组织中都有表达,可能是花斑副沙鳅维持生物膜功能结构、解毒的EST同工酶基础酶。POD是利用H2O2作为氧化供氢体的氧化酶,通过利用H2O2对酚类、胺类和嘌呤等有毒物质氧化,以减轻对机体的损伤;花斑副沙鳅肌肉中的POD表达量最高,表明花斑副沙鳅肌肉组织是H2O2氧化及免疫代谢的主要场所;心脏、肝胰脏里表达量也较高,与心脏肌肉代谢水平高、肝胰脏作为解毒的主要器官有关;肠道里表达量最低,因其功能与氧化还原相关性不大。SOD也为二聚体酶类,是广泛存在于生物体内的金属酶[21];SOD能清除体内产生的氧自由基·O2-,是机体防御氧化损伤的重要酶,与机体自身免疫疾病、辐射防护、机体衰老等密切相关;花斑副沙鳅肌肉中SOD表达量最高,这与肌肉高能量代谢水平相适应;鳃、肾中表达量也较丰富是因为鳃、肾与红细胞密切相连,与其能清除氧自由基、防御氧化损伤的功能相符。SOD-4广泛分布于花斑副沙鳅的8种组织中,且活性都非常强,可能是花斑副沙鳅免疫防御的SOD同工酶基础酶。
3.2.2 LDH、ADH、MDH与机体的能量代谢密切相关 LDH为四聚体酶,其4个亚基的合成分别由A基因和B基因决定[17],LDH作为参与糖酵解的关键酶,参与乳酸与丙酮酸的相互转化;花斑副沙鳅肾中的LDH表达量最高,与肾组织的造血、泌尿等代谢活动相关[25,28]。LDH-2在花斑副沙鳅8种组织中均有表达,是花斑副沙鳅的LDH同工酶基础酶。ADH为二聚体酶,广泛分布于人和动物的肝脏中,其存在意义就是适应厌氧酵解的需求[30];花斑副沙鳅肌肉中ADH表达量最高,与肌肉尤其是白肌在低氧条件下能将机体的丙酮酸转化成乙醇、防止机体丙酮酸积累过多而中毒有关。ADH-4广泛分布于花斑副沙鳅的8种组织中,是花斑副沙鳅的ADH同工酶基础酶。MDH也为二聚体酶,是糖代谢三羧酸循环过程中的重要酶,其主要功能是使苹果酸脱氢参与糖酵解后的有氧代谢[29],MDH在花斑副沙鳅可检测到8种,其中MDH1~MDH4为线粒体型(m-MDH),MDH5~MDH8为上清液型(s-MDH)[29];花斑副沙鳅MDH表达量在心、肝胰脏、肾等组织中较为丰富,这与心脏、肝胰脏、肾脏旺盛的代谢密切相关;肠中未检测到MDH的表达,可能是肠为主要的消化吸收场所、是非主要有氧代谢场所的缘故。
3.3 花斑副沙鳅EST、LDH与其他鱼类同工酶的比较
同工酶组织特异性明显,不同鱼类甚至不同个体的同工酶表达存在较大差异,这是鱼类物种与杂种鉴定、物种间亲缘关系与系统进化分析、物种倍性鉴定、基因连锁分析与基因作图、基因进化、个体发育过程中的基因表达与调控、群体遗传多样性等研究中常用的生化指标[31-33]。花斑副沙鰍8种组织中检测出的EST同工酶有8条酶带,以肝胰脏中活性最强,这与大多数的研究结果一致,泥鳅检测出5条酶带[22],大鳞副泥鳅检测出6条酶带[19],草鱼检测出7条酶带[20],,鱅(Aristichthys nobilis Richardson)检测出5条酶带、青鱼检测出6条酶带、鲢(Hypophthalmichthys molitrix Valenciennes)检测出6条酶带[33]。通过与其他鱼类相比,发现花斑副沙鳅EST同工酶酶带多,且表型复杂,反映出EST同工酶基因表达的多样性比较丰富;但不及乌鳢(Ophicephalus argus Cantor)的10条酶带。
在鱼类同工酶中,LDH是研究最广泛的同工酶,其组织特异性表达还反映了不同科属鱼类的亲缘关系[17,33,34]。花斑副沙鳅检测到4种LDH同工酶,而鳅科(Cobitidae)的高原鳅属(Triplophysa spp.)黄河高原鳅(Triplophysa pappenheimi P. W. Fang)、叶尔羌鼓鳔鳅(T. yarkandensis Day)则表达出5种LDH同工酶[28,35]。大鳞副泥鳅LDH同工酶在发育过程中有7种先后表达[18],通过LDH同工酶的表达,能够从属的水平上反映其系统关系;同时花斑副沙鳅LDH同工酶酶谱相对较简单,可能是因为花斑副沙鳅LDH同工酶基因的遗传多样性较低形成的。在花斑副沙鳅各组织中未检测到大鳞副泥鳅[18]、乌鳢[36]、岩原鲤(Procypris rabaudi Tchang)[37]等鱼种的LDH同工酶基因的表达;而白甲鱼(Onychostoma simus Sauvage et Dabry)[38]、四川裂腹鱼(Schizothorax kozlov Nikolsky)[39]中的表达条带多,这可能与鲃亚科(Barbinae)、裂腹鱼亚科(Schizothoracinae)的鱼类四倍体来源有关[38-41]。
参考文献:
[1] 丁瑞华.四川鱼类志[M].成都:四川科学技术出版社,1994.
[2] 伍远安,梁志强,袁希平,等.花斑副沙鳅肌肉营养成分分析与评价[J].淡水渔业,2011,41(1):87-91.
[3] 杨军山,陈毅锋.副沙鳅属系统发育分析[J].动物分类学报,2004, 29(2):173-180.
[4] 杨明生.花斑副沙鳅的胚胎发育观察[J].淡水渔业,2004,34(6):34-36.
[5] 杨明生,李建华,黄孝湘,等.澴河花斑副沙鳅的繁殖生态学研究[J].水利渔业,2007,27(5):84-85.
[6] 杨明生.花斑副沙鳅的年龄和生长特征[J].孝感学院学报,2009, 29(6):17-19.
[7] 杨明生,肖汉兵,曾令兵,等.温度对花斑副沙鳅仔鱼发育、摄食及不可逆点的影响[J].动物学杂志,2012,7(4):114-120.
[8] 李培伦,刘 伟,王继隆.汤旺河花斑副沙鳅繁殖季节性腺发育组织学观察[J].水产学杂志,2016,29(3):39-43.
[9] 朱蓝菲.鱼类同工酶和蛋白质的聚丙烯酰胺梯度凝胶电泳法[J].水生生物学报,1992,16(2):183-185.
[10] 张庆朝.鱼类乳酸脱氢酶同工酶聚丙烯酰胺凝胶电泳技术研究[J].生物技术,1994,4(5):38-40.
[11] 赵 赣,张守全.一种新的苹果酸脱氢酶同工酶染色法[J].江西农业大学学报(自然科学版),2000,22(4):589-590.
[12] 赵 赣,钱 芳.酯酶同工酶的一种新染色方法的初步研究[J].江西农业大学学报(自然科学版),2002,24(3):380-382.
[13] 赵 赣,曹永长,钱 芳,等.过氧化氢酶同工酶KMnO4染色法的初步研究[J].江西农业大学学报(自然科学版),2002,24(4):541-543.
[14] 胡能书,万国贤.同工酶技术及其应用[M].长沙:湖南科学技术出版社,1985.30-78.
[15] 熊全沫.鱼类同工酶谱分析(上)[J].遗传,1992,14(2):41-44.
[16] 杨从戎,苗 亮,李明云.黑鲷不同组织的9种同工酶谱[J].生物学杂志,2014,31(3):38-42.
[17] 朱蓝菲,陈湘粦,王祖熊.20种鲤科鱼类同工酶的表型分析及有关进化问题的探讨[J].水产学报,1983,7(2):145-152.
[18] 肖义军,高建民,傅文庆.大鳞副泥鳅LDH同工酶的发育遗传学研究[J].遗传,1996,18(6):6-8.
[19] 杜启艳,常重杰,谢龙旭,泥鳅和大鳞副泥鳅酯酶同工酶的比较研究[J].河南科学,2000,18(4):396-398.
[20] 李亚南.草鱼免疫器官和血液的六种同工酶生化与遗传特性分析[J].浙江大学学报(农业与生命科学版),2000,26(4):389-393.
[21] 吴艳丽,杜启艳.雌雄泥鳅不同组织同工酶特异性表达分析[J].西北农业学报,2008,17(6):36-40.
[22] 于淑池,邵杨勇.泥鳅不同组织同工酶的特异性表达分析[J].水产科学,2012,31(5):291-294.
[23] 姜建国,熊全沫,姚汝华.青鱼不同组织中同工酶的表达模式[J].水生生物学报,1997,21(4):353-358.
[24] 刘文彬,陈合格,张轩杰.黄颡鱼不同组织中同工酶的表达模式[J].激光生物学报,2003,12(4):274-278.
[25] 黄 海,尹绍武,张 本,等.奥尼罗非鱼5种组织中4种同工酶的研究[J].南方水产,2006,2(1):11-17.
[26] XU J,ZHANG Q,QI J,et al. Tissue expression and stock variation of isozymes of stone flounder(Kareius bicoloratus)[J].Journal of Ocean University of China,2007,6(2):153-160.
[27] 孟 鹏,史建全,祁洪芳,等.青海湖裸鲤同工酶表达的组织特异性分析[J].海洋水产研究,2008,29(5):112-119.
[28] 杨 成,李柯懋,唐文家,等.黄河高原鳅乳酸脱氢酶同工酶研究[J].水利渔业,2008,28(4):41-42.
[29] 区又君,齐旭东,李加儿.波纹唇鱼不同组织5种同工酶表达的差异[J].南方水产,2009,5(2):51-55.
[30] 杨 玲,卢 红,刘羽清,等.东平湖鲤8种同工酶的组织特异性研究[J].中国农学通报,2014,30(14):26-32.
[31] 王宏伟,王安利,王维娜,等.鱼类同工酶研究进展[J].动物学报,2001,47(S):101-105.
[32] 贺 刚,何 力,许映芳,等.湘西盲高原鳅群体同工酶分析[J].生态学杂志,2009,28(10):2037-2041.
[33] 姜建国,姚汝华.青草鲢鳙四种鱼同工酶的比较研究[J].遗传,1998,20(2):19-22.
[34] ALMEIDA-VAL V M F D,VAL A L. Evolutionary trends of LDH isozymes in fishes[J].Comparative Biochemistry & Physiology B Comparative Biochemistry,1993,105(1):21-28.
[35] 张伟信,李 海.塔里木河大狗头鱼乳酸脱氢酶(LDH)同工酶凝胶电泳分析[J].塔里木大学学报,1998(2):14-17.
[36] 李 霞,欧阳珊,吴小平,等.鄱阳湖乌鳢不同组织EST和LDH同工酶的研究[J].湖北农业科学,2010,49(1):153-155.
[37] 张 娟,王红叶,王玉凤,等.岩原鲤三种同工酶的组织特异性研究[J].湖北农业科学,2012,51(11):2307-2310.
[38] 王红叶,张 娟,蔡焰值,等.白甲鱼不同组织同工酶的组织特异性研究[J].湖北农业科学,2011,50(23):4912-4915.
[39] 胡思玉,彭 垠,赵海涛,等.四川裂腹鱼同工酶研究[J].湖北農业科学,2015,54(18):4540-4543.
[40] 昝瑞光,刘万国,宋 峥.裂腹鱼亚科中的四倍体-六倍体相互关系[J].遗传学报,1985(2):57-62,87-88.
[41] 昝瑞光.鱼类中的多倍性及其在鱼类演化中的作用[J].云南大学学报(自然科学版),1985(2):76-83.
