人参皂苷Rb3对肝糖异生作用机理的研究
2017-08-22孟凡丽
孟凡丽

摘要:为了探讨人参皂苷Rb3在降低血糖方面的分子调控机制,利用HepG2细胞为研究材料,系统分析了人参皂苷Rb3对肝糖异生关键酶PEPCK、G6Pase和转录因子FOXO1、HNF4α的影响。结果表明,人参皂苷Rb3可以显著抑制HepG2细胞肝糖异生途径关键转录因子FOXO1、HNF4α蛋白表达,从而抑制PEPCK和G6Pase酶活性及糖异生作用,该作用能够被AMPK抑制剂Compound C部分阻断,推测人参皂苷Rb3抑制肝糖异生作用是通过激活AMPK信号通路实现。AMPK信号转导通路作为重要的糖脂代谢靶点,在糖尿病及相关代谢类疾病的调控中发挥着重要的作用,为探讨人参皂苷Rb3治疗糖尿病的作用机制提供了新的理论依据。
关键词:人参皂苷Rb3;HepG2细胞;肝糖异生
中图分类号:R285.5 文献标识码:A 文章编号:0439-8114(2017)14-2717-05
DOI:10.14088/j.cnki.issn0439-8114.2017.14.030
Abstract: In order to investigate the effects of ginsenoside Rb3 on reducing the molecular mechanism of blood glucose, using HepG2 cells as research material, the influence of ginsenoside Rb3 on gluconeogenesis key enzymes of PEPCK, G6Pase, and transcription factor of FOXO1 and HNF4α was analyzed. The results showed that ginsenoside Rb3 could significantly inhibit HepG2 cell expression of hepatic gluconeogenic pathway of nuclear transcription factor FOXO1, HNF4α, and inhibited activity and gluconeogenesis of PEPCK and G6Pase and the effect could be partially blocked Compound C which was AMPK inhibitor, speculated that ginsenoside Rb3 inhibited gluconeogenesis was through activation of AMPK signaling pathway to achieve. The AMPK signal transduction pathway as an important target for lipid metabolism, plays an important role in the regulation of diabetes and related metabolic diseases, which provides a new theoretical basis for the mechanism of ginsenoside Rb3 in the treatment of diabetes.
Key words: ginsenoside Rb3; HepG2 cells; hepatic gluconeogenesis
糖尿病是一種世界性的疾病,主要病因为患者体内胰岛素分泌的绝对或者相对不足而引发高血糖和尿糖[1],长期高血糖还会导致心脑血管、肾、眼及神经组织的病变,给患者造成很大危害。近年来,随着人们生活水平的不断提高,糖尿病患者的数量呈快速上升趋势。因此,开展糖尿病调控机制及防治方面的研究刻不容缓。糖尿病的治疗方法很多,有胰岛素治疗、胰岛移植、基因治疗、口服降糖药物、“运动治疗”和“饮食治疗”等辅助治疗方法[2]。
口服降糖药物包括3类[3]:即促进胰岛素分泌类药物、增加胰岛素敏感性药物和α-葡萄糖苷酶的抑制剂类药物。
随着中药医学的发展,源于中药的降血糖药物种类也不断涌现,该类药物除了具有降血糖作用外,兼具有降血脂及改善血液黏度等作用。人参皂苷Rb3,是人参二醇型皂苷的成分之一,具有多种生物活性,如抗抑郁药[4]、抗细胞凋亡的影响[5]、抗氧化活性和微循环的改善[6]、降血糖[7,8]、抗肥胖[9]、保护血管内皮细胞[10]、神经保护作用[11]、心血管保护作用[12]等。前期研究发现人参皂苷Rb3能降低糖尿病小鼠血糖,增加血液中葡萄糖耐量和抗氧化,改善血脂紊乱,改善胰岛素敏感性和耐药性[8]。在前期研究的基础上,从分子水平研究人参皂苷Rb3降血糖机理,进行人参皂苷Rb3对肝糖异生AMPK影响主要的PEPCK、G6Pase关键酶和FOXO1、HNF4α转录因子研究,为人参皂苷Rb3降血糖机理研究提供理论依据。
1 材料与方法
1.1 材料
人参皂苷Rb3(纯度≥98.%HPLC),上海士瑞化工实业有限公司产品;HepG2细胞系,中国科学院上海细胞所;AICAR(AMPK激发剂)、胰蛋白酶、DMEM培养基,美国Sigma公司;PEPCK、G6Pase、FOXO1、HNF4α和二抗,Santa Cruz Biotechnology公司;二甲基亚砜(DMSO)、小牛血清白蛋白、蛋白酶抑制剂,cocktail Roche诊断所;MTT(噻唑蓝),天津市鲁鑫化工科技有限公司;Compound C(AMPK 选择性抑制剂)、葡萄糖试剂盒,北京北化康泰临床试剂有限公司;ECL试剂盒,广州宝泰克生物有限公司;X-胶片,Eastman Kodak Company公司。
1.2 细胞培养
将HepG2细胞系冻存管从液氮中取出于37 ℃水浴液化,然后转移细胞至无菌的10 mL离心管中,加3 mL培养基并将细胞混匀,1 000 r/min离心 5 min收集下层细胞系,用含15%的胎牛血清的DMEM培养基培养,次日换液。复苏后的细胞系改用含有10%胎牛血清的DMEM培养基正常培养,当有80%的细胞融合期时,加入0.25%胰蛋白酶处理,并按1∶3的比例进行传代培养。
1.3 MTT检测
采用MTT方法检测人参皂苷Rb3处理24 h后的HepG2细胞活力。人参皂苷Rb3参试浓度包括0、3.125、6.25、12.5、25和50 μmol/L作用。MTT处理细胞一定时间后,弃上清液并加入DMSO溶液以溶解蓝色结晶。利用酶标仪测定490 nm的吸光度,计算细胞的存活率,细胞存活率(%)=(处理组平均值OD/对照组平均值OD)×100。最后,确定对HepG2细胞无伤害的人参皂苷Rb3浓度,作为进行葡萄糖生成和糖异生试验分析中的最佳给药浓度。
1.4 葡萄糖生成检测
参照前人报道的方法[13]进行试验,设3个处理,即对照、浓度分别为12.5 μmol/L和25.0 μmol/L的人参皂苷Rb3,3个重复。将HepG2细胞培养至对数生长期,用24孔培养板每孔接种细胞悬液1 mL,用含10%胎牛血清DMEM培养基在37 ℃培养(CO2浓度为5%),处理24 h后;换用葡萄糖生成缓冲溶液于37 ℃(5%CO2含量)培养4 h。最后,将培养液转入EP管中,利用葡萄糖氧化酶法测定其中的葡萄糖浓度。
1.5 细胞试验
当HepG2细胞处于对数生长期时,细胞接种于6 孔板(密度5×104个/mL,3 mL每孔),用DMEM溶液培养(10%胎牛血清)培养。12 h后,放入含有25.0 μmol/L人参皂苷Rb3、1.0 mmol/L AICAR、10 μmol/L Compound C、25.0 μmol/L人参皂苷Rb3+1.0 mmol/L AICAR、25.0 μmol/L人参皂苷Rb3+和10 μmol/L Compound C不同处理DMEM培养基中。孵育24 h后,用蛋白提取试剂盒提取总蛋白和核蛋白。主要检测细胞系中的下列蛋白表达水平,包括PEPCK、G6Pase、FOXO1 和 HNF4α。
1.6 蛋白含量分析
HepG2细胞细胞用预冷的RIPA缓冲液处理,添加蛋白酶抑制劑和磷酸酶抑制剂。用Bradford法测定蛋白(Bio-Rad蛋白检测试剂盒)。扫描仪扫描X-胶片,利用Quantity One软件对结果进行分析。以目的蛋白OD与内参OD比值计算蛋白相对表达量。
1.7 统计学分析
运用方差分析,数据用Mean±SE表示,两组间比较采用t检验分析,所有数据用统计软件SPSS 13.0进行分析,P<0.05被认为差异显著。
2 结果与分析
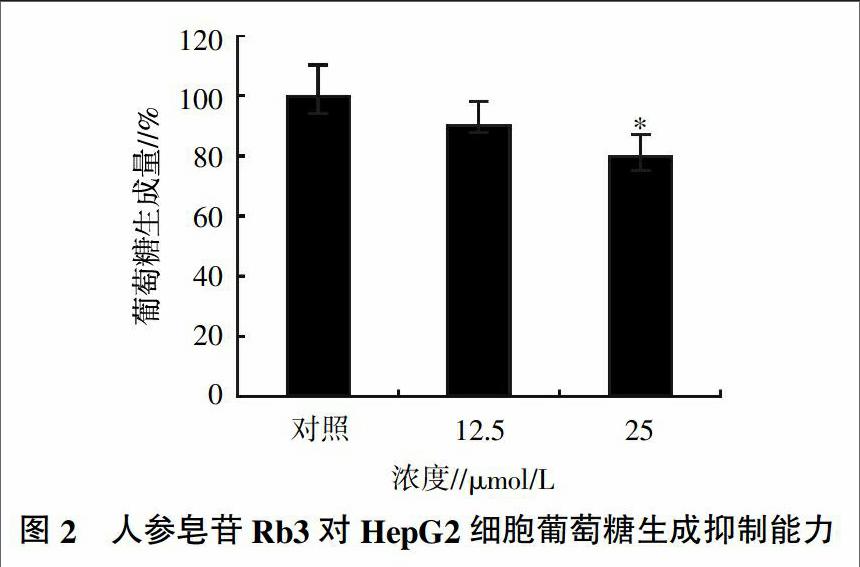
2.1 人参皂苷Rb3对HepG2细胞葡萄糖生成的影响
通过MTT法进行人参皂苷Rb3活性的检测分析,结果如图1所示。浓度为3.125、6.25、12.5、25 μmol/L人参皂苷Rb3给药24 h后,对细胞产生少量剂量的杀伤;而50 μmol/L的Rb3可导致HepG2细胞的明显伤害,表现出细胞的皱缩和凋亡现象。因此,合适的人参皂苷Rb3给药浓度为12.5、25 μmol/L。
用PBS漂洗下层的HepG2细胞,然后用蛋白酶将细胞裂解,并提取蛋白,最后在蛋白定量的基础上将测得的葡萄糖含量与提取的总蛋白含量相比,这个比值可以更为准确地体现人参皂苷Rb3对HepG2细胞中葡萄糖生成能力的抑制效应。结果(图2)表明,两个剂量的人参皂苷Rb3均对HepG2细胞系的糖异生具有一定的抑制效应,特别是25 μmol/L的剂量可产生显著的抑制作用(P<0.05)。
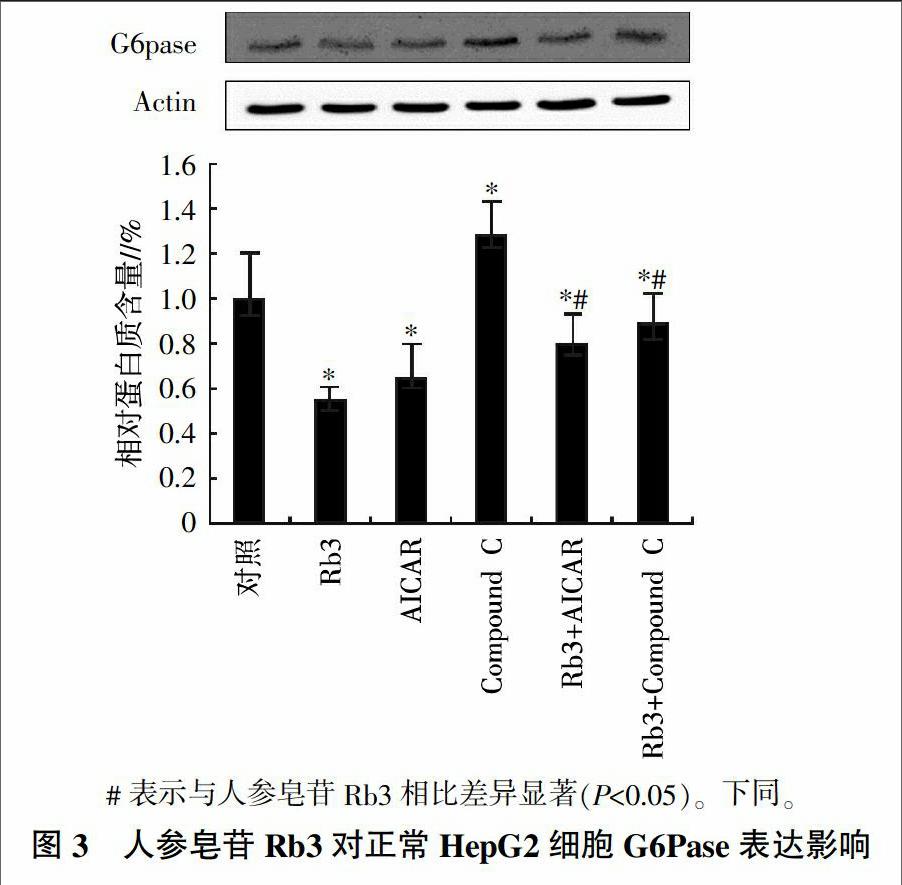
2.2 人参皂苷Rb3对HepG2细胞糖异生关键酶PEPCK和G6Pase的影响
为了进一步证实人参皂苷Rb3对糖异生抑制作用的分子机制,分析了HepG2细胞中糖异生关键酶PEPCK和G6Pase的表达情况。结果(图3、图4)表明,与对照相比,人参皂苷Rb3、AMPK激活剂AICAR以及这两者的联合使用均可显著抑制(P<0.05)PEPCK和G6pase的表达水平。而Compound C(AMPK的抑制剂)对PEPCK和G6pase的表达有上调的影响趋势(P<0.05);另外,人参皂苷Rb3与Compound C联合使用后,PEPCK和G6Pase的表达水平也显著低于对照组(P<0.05);不过,单独使用Compound C后细胞中的PEPCK和G6pase表达水平却显著高于单用人参皂苷Rb3的处理(P<0.05),说明人参皂苷Rb3对PEPCK及G6pase的抑制效应可以部分被AMPK抑制剂Compound C所阻断;综合来看,人参皂苷Rb3的抑制肝糖异生效应与其激活AMPK有关。
2.3 人参皂苷Rb3对HepG2细胞糖异生转录因子的影响
转录因子是真核基因表达调控的重要因子,为深入探讨人参皂苷Rb3对糖异生作用的分子机制,通过蛋白杂交试验分析了转录因子FOXO1和HNF4α(图5、图6)的表达特性。通过Western杂交对FOXO1表达水平的分析显示,人参皂苷Rb3及AMPK的激活剂AICAR对转录因子FOXO1均具有表达抑制的效应,二者联用后对FOXO1的表达也有显著的抑制效应(P<0.05),不过其抑制效应要显著低于单独使用两种药品时的效果,即人参皂苷Rb3和AICAR在抑制FOXO1的表达过程中未表现出协同效应;虽然AMPK的激活剂AICAR并没有增强人参皂苷Rb3对FOXO1表达的抑制效应,但AMPK的抑制剂Compound C和人参皂苷Rb3联用后FOXO1的表达水平却显著(P<0.05)高于人参皂苷Rb3的单独使用,即Compound C减弱了Rb3对FOXO1抑制效应的趋势。
对转录因子HNF4α的表达水平分析显示,人参皂苷Rb3和AICAR单用或联合使用后均可显著(P<0.05)抑制HNF4α的表达水平,且两种药剂联用后HNF4α的表达水平显著(P<0.05)低于人参皂苷Rb3单独使用时的表达水平,但较AICAR单用时略高,而且AMPK的抑制剂Compound C具有显著(P<0.05)减弱人参皂苷Rb3对HNF4α表达抑制的趋势。
3 讨论
肝癌细胞系HepG2是来源于人的肝细胞系,该类细胞具有正常肝细胞的基本生物学特性,常用于肝脏糖异生的体外生物学功能研究。HepG2细胞的葡萄糖合成量来反映糖异生情况及其对2型糖尿病治疗的作用。因此,利用HepG2细胞系常作为筛选糖尿病治疗的药物载体,是目前应用的比较广泛的降血糖效应研究手段[14]。
AMPK是细胞和系统的能量平衡调节因子,被缺氧、低糖和营养不足代谢产物激活[15],在骨骼肌、肝脏和脂肪组织激活AMPK可以提高代谢、改善胰岛素敏感性,并可能有利于糖尿病的治疗[16]。AMPK是一个有吸引力的药物靶点,在全身能量平衡的调节起着关键的作用。肝脏AMPK的激活导致增加脂肪酸氧化,同时抑制肝葡萄糖生产以及脂肪和胆固醇的合成[17]。研究发现,AMPK对于肝糖异生过程中几个关键酶(例如PEPCK和G6Pase)的表达具有调剂作用[8];转录因子CREB、HNF4α和FOXO1是AMPK调节通路上的关键调控因子,而AMPK可使TORC2(一种调控CREB活性的转导蛋白)发生磷酸化,从而抑制CREB的表达。AMPK还可通过对SHP、HNF4α和FOXO1的调控进而发挥来实现抑制糖异生的作用,这对于降低血糖均具有积极意义。
为了系统分析人参皂苷Rb3对AMPK的调控机制,本研究中使用了AMPK的抑制剂Compound C和激活剂AICAR,增加了正负对照组及处理的组合,试验处理设置更为系统科学[18]。研究结果发现,人参皂苷Rb3和AMPK的激活剂AICAR对HepG2细胞中的AMPK均具有活性作用,同时对于糖异生途径中的关键限速酶PEPCK和G6Pase具有显著的抑制作用,这可能是人参皂苷抑制肝糖异生的原因所在。另外,研究还发现人参皂苷Rb3与AICAR联合使用后对PEPCK的抑制作用显著增强,表现出较强的协同效应。AMPK抑制剂Compound C可以有效阻断人参皂苷Rb3对PEPCK和G6Pase的抑制作用,说明AMPK是人参皂苷Rb3作用的重要靶位点。另外,对糖异生途径中两个关键核转录因子FOXO1及HNF4α的表达水平分析显示,人参皂苷Rb3对其表达均具有显著的抑制效应,而且抑制作用可以被AMPK抑制剂Compound C部分阻断,推断人参皂苷Rb3对这两个转录因子的抑制作用可能与AMPK的激活有关。研究结果发现,在抑制FOXO1的表达水平方面,人参皂苷Rb3和AICAR并未表现出协同效应(图5);在调控HNF4α蛋白的表达过程中,两种药品的联合使用也表现出减弱了AICAR对HNF4α抑制作用的趋势(图6);由此推断,人参皂苷Rb3和AICAR在调控上述转录因子的过程中存在一定的相互干扰。这些结果表明,人参皂苷Rb3可以显著抑制HepG2细胞肝糖异生途径关键转录因子FOXO1、HNF4α蛋白表达,从而抑制PEPCK和G6Pase酶活性及糖异生,该作用能够被AMPK抑制剂Compound C部分阻断,推测人参皂苷Rb3抑制肝糖异生作用是通過激活AMPK信号通路实现。AMPK信号转导通路作为重要的糖脂代谢靶点,在糖尿病及相关代谢类疾病的调控中发挥着重要的作用,为探讨人参皂苷Rb3治疗糖尿病的作用机制提供了新的理论依据。
参考文献:
[1] 李 静.高危人群糖尿病的发病原因及预防措施研究[J].中国医药指南,2012,10(20):679-680.
[2] BUDINSKY,WOLFRAM R,OGUOGHO A,et al. Regular ingestion of opuntia robusta lowers oxidation injury[J].Prostaglandins Leukot Essent Fatty Acids,2001,65(1):45-50.
[3] 李 清,周金培,张惠斌.抗糖尿病药物研究进展[J].药学进展,2013,37(9):417-427.
[4] CUI J,JIANG L,XIANG H. Ginsenoside Rb3 exerts antidepressant-like effects in several animal models[J]. J Psychopharmacol,2012,26(5):697-713.
[5] LIU X,JIANG Y,YU X,et al. Ginsenoside-Rb3 protects the myocardium from ischemia-reperfusion injury via the inhibition of apoptosis in rats[J].Exp Ther Med,2014,8(6):1751-1756.
[6] SHI Y,HAN B,YU X,et al.Ginsenoside Rb3 ameliorates myocardial ischemia-reperfusion injury in rats[J].Pharm Biol,2011, 49(9):900-906.
[7] BU Q T,ZHANG W Y,CHEN Q C,et al. Anti-diabetic effect of ginsenoside Rb3 in alloxan-induced diabetic mice[J].Medicinal Chemistry,2012,8:934-941.
[8] MENG F L,SU X T,MENG F R,et al. Effects of Ginsenoside Rb3 on antihyperglycemia and antioxidation in diabetic mice[J].Journal of South China Agricultural University,2013,34(4):553-557.
[9] LIU R,ZHENG Y N,LIU W C. Inhibitory activity of ginsenoside Rb3 on pancreatic lipase[J].Nat Prod Res Dev,2011,23:522-525.
[10] PAN Y T,GUO C Y,MA X J,et al.The estrogen-like protective effect of ginsenoside Rb3 on oxidative stress and dysfunction of endothelial cells induced by oxidized low-density lipoprotein[J].Acta Pharmaceutica Sinica,2014,49(10):1406-1412.
[11] JIANG S,MIAO B,SONG X,et al. Inactivation of GABAA receptor reduces ginsenoside Rb3 neuroprotection in mouse hippocampal slices after oxygen-glucose deprivation[J].J Ethnopharmacol,2011,133(2):914-916.
[12] WANG Y H,DONG J H,LIU P,et al. Ginsenoside Rb3 attenuates oxidative stress and preserves endothelial function in renal arteries from hypertensive rats[J].Br J Pharmacol,2014, 171(13):3171-3181.
[13] LIU Z,LI Y,LI X,et al.The effects of dynamic changes of malonyl ginsenosides on evaluation and quality control of Panax ginseng C.A.Meyer[J].J Pharm Biomed Anal,2012,64-65(4):56-65.
[14] 李秀麗,贺嵩敏,朱 莹,等.HepG2细胞胰岛素抵抗模型的建立与鉴定[J].中国实验方剂学杂志,2013,19(5):203-207.
[15] RYU G R,LEE M K,LEE E,et al. Activation of AMP-activated protein kinase mediates acute and severe hypoxic injury to pancreatic beta cells[J].Biochem Biophys Res Commun,2009,386:356-362.
[16] DZIEWULSKA A,DOBRZYN P,DOBRZYN A. The role of AMP-activated protein kinase in regulation of skeletal muscle metabolism[J].Postepy Hig Med Dosw (Online),2010,64:513-521.
[17] KOO S H,FLECHNER L,QI L,et al. The CREB coactivator TORC2 is a key regulator of fasting glucose metabolism[J]. Nature,2005,437:1109-1111.
[18] LANGELUEDDECKE C,JAKAB M,KETTERL N,et al. Effect of the AMP-Kinase Modulators AICAR, Metformin and Compound C on Insulin Secretion of INS-1E Rat Insulinoma Cells under Standard Cell Culture Conditions[J].Cell Physiol Biochem,2012,29(1-2):75-86.
