不同变频组合电针预处理对急性脑缺血大鼠神经功能和脑皮质促红细胞生成素的影响
2017-08-22王静芝曾晓玲刘建民郑肇良
梁 超,姜 涛,王静芝,曾晓玲,刘建民,郑肇良
(1.海口市中医医院,海南 海口 570216;2.湖北中医药大学针灸骨伤学院,武汉 430000)
【针灸研究】
不同变频组合电针预处理对急性脑缺血大鼠神经功能和脑皮质促红细胞生成素的影响
梁 超1,姜 涛1,王静芝2,曾晓玲2,刘建民2,郑肇良1
(1.海口市中医医院,海南 海口 570216;2.湖北中医药大学针灸骨伤学院,武汉 430000)
目的: 观察不同频率电针预处理对大脑中动脉梗塞(middle cerebral artery occulation,MCAO)大鼠神经功能和脑皮质促红细胞生成素(EPO)表达影响。方法: SD大鼠按随机数字表法分为正常对照组、模型组、安慰针刺组、预处理1组、预处理2组、预处理3组每组各10只,不同频率电针头穴进行预处理后制备MCAO模型;参照Longa标准评估神经功能,免疫组化法检测EPO阳性细胞数目,实时荧光定量PCR检测EPOmRNA表达。结果:不同频率电针预处理后MCAO大鼠神经功能损伤明显减轻,其中以2Hz/100Hz的频率最为明显;各预处理组EPO阳性表达细胞数差异明显,2Hz/100Hz频率预处理后阳性细胞数目最多;电针预处理能促进EPOmRNA的表达增加,其中以2Hz/100Hz频率电针预处理组的表达最明显。结论: 不同变频组合电针头穴的预处理能减轻脑缺血后神经功能的损伤,这可能与调节缺血局部脑皮质EPO蛋白和基因的表达有关,不同频率电针其效应不同,其中以2Hz/100Hz频率电针的效果最显著。
MACO大鼠;电针频率;头穴;预处理;EPO
缺血性脑血管病是一种好发于中老年人的疾病,高发病率、高致残率使其备受关注。美国缺血性卒中和短暂性脑缺血发作患者卒中预防指南明确提出该病的积极预防意义远大于治疗[1~2]。针灸作为一种缺血预处理手段,被广泛应用于该病的研究中,能明显减轻缺血后神经元损伤,减轻炎症反应,帮助神经功能恢复[3~4]。本研究在之前基础上,观察不同时间电针预处理对局灶性脑缺血大鼠局部脑皮质中促红细胞生成素(Erythropoietin,EPO)表达变化及受损神经功能的影响,初步探讨电针预防急性脑血管病的相关机制。
1 材料
1.1 实验动物
健康成年SPF级SD大鼠60只(湖北省实验动物研究中心提供,许可证号SCXK(鄂)2015-0018),雌雄不拘,体质量(200±20) g。于实验前1周一次性购进,饲养于安静、温暖且避强光的环境中,室温(20±2)℃,自由饮水饮食。
1.2 主要试剂与仪器
1.2.1 主要试剂 兔抗大鼠EPO多克隆抗体、HRP标记山羊抗兔抗体、DAB显色剂、免疫组化试剂盒、浓缩型正常山羊血清(封闭)、荧光(Cy3)标记羊抗兔IgG(均购自武汉博士德生物工程有限公司)、DAPI、抗荧光淬灭封片剂(碧云天生物科技有限公司);Trizol(Aidlab)、DL2000 DNA Marker(TAKARA)引物合成(擎科科技有限公司)。
1.2.2 主要仪器 病理切片机(德国Leica RM 2016轮转式切片机)、荧光显微镜(NIKON Eclipse 80i生物显微镜)、微量移液器(北京大龙公司)、实时荧光定量PCR仪(ABI7900 / illumina eco)、荧光定量PCR管(EXTRAGENE / illumina)、分光光度计(上海舜宇恒科学仪器有限公司)、PH计(德国Metter-Toledo GmbH公司)、水平电泳仪(北京君意东方电泳设备有限公司)、紫外分析仪(北京君意东方电泳设备有限公司)。
2 方法
2.1 动物分组及处理
60只SD大鼠采用随机数字表法分为正常对照组、模型组、安慰针刺组及预处理1组、预处理2组、预处理3组各10只;正常对照组不予处理,正常给水给食;模型组按要求制备MCAO模型;安慰针刺组和预处理各组按治疗方法给予不同处理,治疗完成后制备MCAO模型。
2.2 动物模型制备
按Longa[5]线栓法制备MCAO模型。大鼠造模前禁食不禁水24 h,以10%水合氯醛0.3 ml/100 g腹腔注射麻醉;常规备皮消毒,颈部正中切口,钝性分离皮下筋膜和肌肉,暴露并分离出右侧颈总动脉(Common carotid arternal,CCA)、颈内动脉(Internal carotid artery,ICA)、颈外动脉(External carotid artery,ECA);电凝ECA的分支,结扎游离ECA主干,分离ICA主干至翼腭动脉(Pterygo palatine artery,PPA),并在其起始部和CCA的近心端各置一动脉夹;线栓从ECA残端小口进入,轻推经CCA分叉部沿ICA入颅,至大脑中动脉(Middle cerebral artery,MCA);尼龙线插入深度由CCA分叉部计约18 mm,栓塞60 min后拉出缝合切口并消毒,术后大鼠室温下禁食给水喂养,苏醒后进行神经功能障碍评分,评分在1级以上的大鼠为造模成功。
2.3 治疗方法
根据中国针灸学会制定的《头皮针穴名国际标准化方案》[6]选取双侧顶颞前斜线、顶颞后斜线,并结合《实验针灸学》[7]大鼠穴位图谱模拟人体经穴定位。顶颞后斜线:“百会”(顶骨正中点)至“曲鬓”(为耳缘直上与耳尖水平线的交点);顶颞前斜线:顶颞后斜线向前平移0.1 寸。选用30号1寸一次性无菌针灸针,分别从顶骨中点向耳根前与头皮呈15°夹角透刺0.5~0.8寸,快速捻转至针下沉涩感后,同侧头穴为一对。安慰针刺组采用套迭式顿头安慰针,底座固定于穴位处,左手固定针管,右手快速叩击顿头安慰针,局部皮肤针刺感,但不刺入皮肤,不予加电刺激;电针治疗采用LH202H型韩氏仪,疏密波,电流强度lmA,电针预处理1组、2组和3组分别选用频率为2 Hz/150 Hz、2 Hz/100 Hz和2 Hz/50 Hz,连续治疗10 d,每日1次,每次30 min。
3 指标及方法
3.1 神经功能缺损评分(NSS)
参照Longa神经功能评分标准评估:1级:左前肢不能充分伸展计1分;2级:向左环形运动,轻度局灶神经功能缺失计2分;3级:向左侧倒,中度局灶神经功能缺失计3分;4级:不能自然行走,重度局灶神经功能缺失计4分。
3.2 EPO阳性表达细胞数目
大鼠灌注后迅速取脑,剥离脑膜除去嗅球、延髓和小脑,在视交叉平面前后2mm处将脑冠状切开,分离右侧大脑皮层,仔细切取缺血区域大脑皮层组织块(即右侧顶颞叶皮层组织)约1 mm×1 mm×1 mm,按免疫组化S-ABC法操作(步骤按试剂盒说明),一抗(EPO抗体)稀释度为1∶200;以细胞浆出现棕黄色颗粒为阳性细胞;在高倍(×400)光学显微镜下,随机选取5个视野,计算阳性细胞数,并取平均值为EPO蛋白表达的阳性细胞数目。
3.3 EPOmRNA表达的检测
按上述方法取右侧顶颞叶皮层组织约1 mm×1 mm×1 mm,清洗后保存于-80℃冰箱;按照TRizol说明书的方法提取脑缺血组织中总RNA;在20μL反转录反应体系中,以1μL RNA为模板将mRNA反转录为cDNA;PCR反应以β-actin mRNA为内参,上游引物:5-CGTTGACATCCGTAAAG ACCTC-3’,下游引物:5’-TAGGAGCCAGGGCAGTAATCT-3’;EPO mRNA引物序列,上游引物:5-CACCCTGCTGCTTTTACTATCCTT-3’,下游引物:5-CATTGTGACATTTTCTGCCTCCT-3’;反应体系为20μL,扩增结束后,PCR产物的定量校正和判定分析采用β-actin mRNA作为内参,用β-actin mRNA的拷贝数作为校正基数,各样本中EPOmRNA的CT(cycle threshold)值,分别与对应样本中β-actin mRNA的CT值相减,即获得EPOmRNA的△CT值;分别以模型组的△CT值作为校正,得出-△△CT值,2-△△Ct公式计算出个样本中EPOmRNA的表达。
4 统计学方法

5 结果
表1图1显示,缺血后各组大鼠神经功能损伤评分均升高,模型组与安慰针刺组比较差异无统计学意义(P>0.05),预处理后NSS分值低于模型组和安慰针刺组,预处理2组分值最低(P<0.01),预处理1组和预处理3组分值间比较差异无统计学意义(P>0.05);安慰针刺组EPO阳性细胞数目与模型组的区别不大(P>0.05),各预处理组比安慰针刺组的细胞数目均多(P<0.05),预处理2组EPO 阳性表达最多(P<0.01),预处理1组和预处理3组间比较差异无统计学意义(P>0.05);安慰针刺组EPOmRNA表达量与模型组比较差异无统计学意义(P>0.05);不同电针频率预处理后其表达量各不相同,预处理3组表达量最少(P<0.05),预处理1组的表达量次之(P<0.05),预处理2组的表达量最多(P<0.01)。

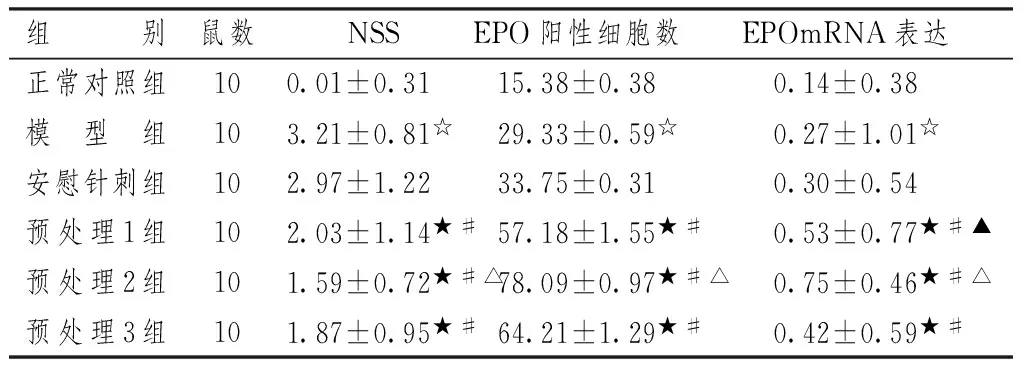
组别鼠数NSSEPO阳性细胞数EPOmRNA表达正常对照组100.01±0.31 15.38±0.380.14±0.38模型组103.21±0.81☆29.33±0.59☆0.27±1.01☆安慰针刺组102.97±1.2233.75±0.310.30±0.54预处理1组102.03±1.14★#57.18±1.55★#0.53±0.77★#▲预处理2组101.59±0.72★#△78.09±0.97★#△0.75±0.46★#△预处理3组101.87±0.95★#64.21±1.29★#0.42±0.59★#
注:与正常对照组比较:☆P<0.05;与模型组比较:★P<0.05;与安慰针刺组比较:#P<0.05;与预处理3组比较:▲P<0.05,△P<0.01

图1 各组大鼠缺血局部脑皮质EPO免疫组化图(10×40)
6 讨论
急性脑缺血属于中医学“中风”范畴。《灵枢·五乱》记载:“乱于头,则为厥逆,头重眩仆……气在于头者,取之天柱大杼”,这是头穴治疗中风最早的起源。根据“病变在脑,首选督脉”,头穴成为现代临床治疗该病的必选穴位。头穴电针对缺血性脑损伤早期具有改善脑电活动、氧的代谢及减轻神经功能障碍等作用[8-10],但不同电针频率其作用机制的侧重点也会不同。对于抑制神经元凋亡作用最好的频率为20 Hz/80 Hz,主要通过降低Bax mRNA表达来实现[11-12]。2 Hz/15 Hz-15 Hz/30 Hz则减轻炎症因子分泌,诱导胶质细胞增生效果明显[13-14]。而2 Hz/100 Hz在修复血管内皮损伤方面疗效显著[15]。本实验以往研究表明,该频率电针能调控缺血脑皮质EPO蛋白表达,增加血流量并促进微血管内皮细胞增殖[16];同样频率的头针也能产生类似效应以改善局部血流、减轻脑缺血损伤[17]。但该频率产生的血管新生效应是否与针刺预处理之间有关,是本研究观察的目的之一。
以往关于EPO的研究仅局限于贫血疾病[18],进一步研究发现部分中枢神经系统组织也可产生EPO及其受体,并对神经元具有广泛的促生长与保护作用,能明显减轻脑缺血再灌注损伤[19]。之前我们发现,电针头穴可增加EPOmRNA表达以激活相关分子信号通路促进神经功能恢复,增加血管内皮细胞数量[20]。现在经过电针预处理EPO含量也增加,但不同频率预处理EPO蛋白和基因表达不一样,以2 Hz/100 Hz表达最多,2 Hz/50 Hz和2 Hz/150 Hz的表达较少。EPO的这一表达趋势与神经功能损伤评分的分值变化一致,说明EPO在缺血脑皮质中的含量变化与神经功能的修复存在一定程度的关系[21]。
自“缺血预处理”概念提出后,针灸预防脑血管病一直是研究热点之一。电针预处理可以在缺血后24 h和48 h明显增加大鼠骨髓和外周血中EPCs含量[22],调控血脑屏障MMP-9阳性细胞及VEGFmRNA表达,以提高缺血耐受效应[23],促进MiRNA-290、MiRNA-494表达,降低AQP-4相对含量以减轻脑损伤[24-25]。本研究发现,不同频率电针预处理其神经损伤改善程度不同,2 Hz/100 Hz频率电针刺激后神经功能损伤评分最低,EPO蛋白阳性神经元数目最多,EPOmRNA表达最明显。
综上所述,不同频率电针头穴的预处理能促进缺血局部脑皮质EPO蛋白和基因的表达,增强缺血耐受效应,从而显著改善脑缺血大鼠受损的神经功能;相同穴位、电流强度、针刺时间的基础上,选择不同频率电针其神经保护效应不同,其中以2 Hz/100 Hz频率电针的效果最显著,但确切机制仍需继续深入探究。
[1] 杜万良,栾璟煜,王春育,等.美国缺血性卒中和短暂性脑缺血发作患者卒中预防指南[J]. 中国卒中杂志,2011,6(1):53-57.
[2] COUTTS SB, WEIN TH, LINDSAY MP,et al. Canadian Stroke Best Practice Recommendations: secondary prevention of stroke guidelines, update 2014[J].Int J Stroke,2015,10(3):282-291.[3] 韩雪梅,常颖,赵晴,等.针刺预处理对大鼠脑缺血耐受及促红细胞生成素的诱导作用[J].中国老年学杂志,2009,29(14):1762-1764.
[4] 刘建勋,林咸明.不同时程电针预处理对脑缺血大鼠血脑屏障功能的保护效应[J].上海针灸杂志,2014,33(12):1169-1172.
[5] E Z LONGA,P R WEINSTEIN, S CARLSON,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989, 20(1):84-91.
[6] 陆寿康,孔尧其.实用头针大全[M].上海:上海科学技术出版社,1993:26.
[7] 郭义.实验针灸学[M].北京:中国中医药出版社,2010:402.
[8] WT HSING,M IMAMURA,K WEAVER,et al.Clinical effects of scalp electrical acupuncture in stroke:a sham-controlled randomized clinical trial[J].J Altern Complement Med, 2012,18(4):341-346.
[9] ALYSSON BRUNO OLIVEIRA SANTOS,JUDYMARA LAUZI GOZZANI,TSA.Acupuncture as Adjuvant Therapy in Thalamic Syndrome: Case Report[J].Rev Bras Anestesiol,2011,61(1):88-94.
[10] 张晓明,懂德河,丁玲,等.电针对局灶性脑缺血再灌注大鼠神经功能障碍的影响[J].河南中医, 2012,32(5):573-575.
[11] 沈梅红,刘晓华,李缨,等.电针调节脑缺血再灌注大鼠大脑皮层Bcl-2和Bax mRNA的表达[J].辽宁中医杂志,2012,17(1):155-157.
[12] 张晓明,瞿涛,左朝,等.电针对局灶性脑缺血大鼠迟发性细胞凋亡的影响[J].湖北中医药大学学报, 2012,14(4):3-6.
[13] 肖贻财,吴新贵,周元成,等.不同电针频率对脑缺血大鼠脑星形胶质细胞的影响[J].广西中医药,2011,34(1):52-54.
[14] 金深辉,刘俊伟,罗亮,等.电针预处理对脑缺血再灌注大鼠皮质及纹状体IL-1β表达的影响[J].浙江中医杂志,2012,47(7):255-256.
[15] 崔晓,胡永善,吴毅,等.电针对脑缺血大鼠血管生成素及其受体表达的影响[J].中国康复医学杂志,2007,22(10):877-880.
[16] 梁超,陈邦国,李昂.电针对MCAO大鼠脑皮质EPO表达和脑血流量的影响[J].中国康复,2013,28(5):323-326.
[17] 梁超,王静芝,姜涛,等.不同时间头针对大脑中动脉梗塞大鼠缺血局部脑皮质微循环状态的影响[J].广州中医药大学学报,2015,32(5): 874-879.
[18] SANCHIS GOMAR F,PEREZ QUILIS C,LIPPI G.Erythropoietin receptor (EpoR) agonism is used to treat a wide range of disease[J].Mol Med,2013,30(19):62-64.
[19] TRINCAVELLI ML,DA POZZO E,CIAMPI O,et al.Regulation of Erythropoietin Receptor Activity in Endothelial Cells by Different Erythropoietin (EPO) Derivatives: An in Vitro Study[J].Int J Mol Sci,2013,14(2):2258-2281.
[20] 梁超,陈邦国,王静芝,等.不同时间头针对MCAO大鼠脑皮质JAK2/STAT5信号通路的影响[J].中国中医基础医学杂志,2016,22(8):1084-1087.
[21] ML,Da Pozzo E,Ciampi O,et al.Erythropoietin improves long-term neurological outcome in acute ischemic stroke patients: a randomized, prospective, placebo-controlled clinical trial[J]. Crit Care,2015, 25(19):49-58.
[22] 孙宏毅,罗勇,卢桃利,等.电针对局灶性脑缺血/再灌注大鼠外周血和骨髓内皮祖细胞的作用[J].针刺研究,2012,37(3):179-185.
[23] 林咸明,陈丽萍,姚旭.不同时程电针预处理对脑缺血再灌注大鼠血脑屏障基质金属蛋白酶-9、血管内皮生长因子的影响[J].针刺研究,2015,40(1):40-44.
[24] 郑仕平,韩为,储浩然,等.通督调神针灸预处理对脑缺血再灌注大鼠相关微小RNA调控机制的研究[J].针刺研究,2015,40(2):99-103.
[25] 林咸明,李金霞,妖旭.不同时程电针预处理对脑缺血再灌注大鼠血脑屏障水通道蛋白-4及紧密连接蛋白-5的影响[J].中华物理医学与康复杂志,2015,37(7):498-502.
海南省自然科学基金资助项目(20158371)-不同时间头针对MCAO大鼠缺血局部脑皮质微血管新生的影响研究
梁 超(1984-),女,湖北武汉人,主治医师,医学博士,从事针灸治疗神经系统疾病的临床与实验研究。
R245.9+7
B
1006-3250(2017)05-0686-03
2016-11-26
