动态浊度法测定注射用盐酸大观霉素中细菌内毒素的含量
2017-08-22陈莉张啸刘永革冯凤娇
陈莉,张啸,刘永革,冯凤娇
(1.苏州市药品检验检测研究中心,江苏 苏州 215104;2.山东鲁抗医药股份有限公司,山东 济宁272021;3.中国药科大学,江苏 南京 211198)
动态浊度法测定注射用盐酸大观霉素中细菌内毒素的含量
陈莉1,张啸2,刘永革2,冯凤娇3
(1.苏州市药品检验检测研究中心,江苏 苏州 215104;2.山东鲁抗医药股份有限公司,山东 济宁272021;3.中国药科大学,江苏 南京 211198)
目的:为建立注射用盐酸大观霉素细菌内毒素定量方法提供参考。方法:建立动态浊度法测定细菌内毒素标准曲线,验证可靠性,考察样品对细菌内毒素检查的干扰情况,确定样品的最大无干扰浓度,验证方法的精密性和准确性,并进行初步应用。结果:标准曲线可靠性验证中,相关系数r>0.99,标准曲线可靠。供试品用苯甲醇注射液溶解后稀释并添加内毒素标准品,制成供试品终浓度3.92 mg/mL及内毒素终浓度为0.25 Eu/mL的溶液,测得其回收率接近100%,供试品该浓度对内毒素测定的干扰较小。方法的精密度验证中,标准曲线各浓度点3次测量结果的变异系数均<10%,供试品加入标准曲线各浓度点的内毒素标准品后测定3次,结果的变异系数均<10%。准确率验证中,供试品中加入内毒素标准品终浓度为1.25,0.25,0.05 Eu/mL时回收率在91%~107%,加入内毒素终浓度为0.01 Eu/mL时回收率为73%和86%。另外,日常检测3批供试品的内毒素含量均小于限值,回收率在101%~103%。结论:动态浊度法可用于定量检测注射用盐酸大观霉素的细菌内毒素。
动态浊度法;注射用盐酸大观霉素;内毒素;定量
细菌内毒素是药品中最普遍和主要的致热原,可引起机体发热甚至休克[1]。为了保证注射用药品的安全性,各国药典均将内毒素检测列入检查项目,内毒素含量的控制也成为药品质控的重要对象之一[2]。
大观霉素是一种主要用于淋病奈瑟菌所致的尿道炎、前列腺炎、宫颈炎和直肠感染[3]的氨基苷类抗菌药,临床常用其盐酸盐。《中华人民共和国药典》(2015年版)收载有盐酸大观霉素及注射用盐酸大观霉素,其中对于致热物质的检查采用细菌内毒素检查法。
目前所使用的内毒素检查法多为凝胶法,但其是一种半定量测定方法,无法给出准确的含量,而为了更好满足药品检查和生产过程质控的严格要求,内毒素检测已逐渐向定量方向发展。动态浊度法是内毒素定量方法的一种,具有批量大,灵敏度高,检测范围宽等优点[4],能较为真实客观地反映药品的质量。相较与动态显色法,动态浊度法不易受样品干扰的影响,更适用于对鲎试剂有干扰的样品[5]。
本文参照《中华人民共和国药典》(2015年版)细菌内毒素检查法进行试验,采用动态浊度法检测注射用盐酸的细菌内毒素含量,并对方法进行验证及初步应用,为该品种建立合适的内毒素定量方法打下基础。
1 材料与仪器
1.1 供试品
注射用盐酸大观霉素:包含注射用盐酸大观霉素1瓶(2 g/瓶,批号:160304,160305,160306,山东鲁抗医药股份有限公司)和苯甲醇注射液1瓶(3.2 mL/瓶,批号:1512162311,辰欣药业股份有限公司)。
1.2 实验材料
Biotek Elx808酶标仪(美国Biotek公司);细菌内毒素工作标准品(湛江安度斯生物有限公司,批号:150601-201581规格:80 EU/支);动态浊度法鲎试剂(湛江安度斯生物有限公司,批号:1607150,规格:1.25 mL/支,灵敏度0.01 Eu/mL);动态浊度法鲎试剂(湛江安度斯生物有限公司,批号110604,规格:0.1 mL/支,灵敏度0.5 Eu/mL);细菌内毒素检查用水(BET水,湛江安度斯生物有限公司,批号:1701170,规格:5 mL)。
2 方法与结果
2.1 细菌内毒素限值的确定
《中华人民共和国药典》(2015年版)规定,注射用盐酸大观霉素内毒素的限值为每0.075 Eu/mg,试验中注射用盐酸大观霉素规格为2 g/瓶,则限值可表示为150 Eu/mg。
2.2 标准曲线的可靠性验证
取细菌内毒素工作标准品1支(80 Eu)加入0.8 mL BET水复溶,浓度为100 Eu/mL的储备液,将10 Eu/mL标准品用BET水稀释为1.25,0.25,0.05,0.01 Eu/mL的标准内毒素系列溶液。取无热原微孔板,每孔加入100 μL的BET水作为阴性对照和各浓度标准液,标准品为平行3个复孔,再加入100 μL的动态浊度鲎试剂并混匀,放入酶标仪中于37℃孵育70 min,每隔30 s检测样品在405 nm的吸光度。
以反应时间的对数LogT为纵坐标,内毒素浓度的对数LogC为横坐标,绘制标准曲线线性回归方程,
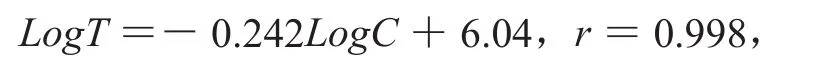
标准曲线的线性较好,且阴性对照的反应时间大于标准曲线最低内毒素浓度0.01 Eu/mL的反应时间,各平行孔的CV均<10%,标准曲线成立。
2.3 最大稀释倍数(MVD)计算
注射用盐酸大观霉素样品1瓶(2 g),用苯甲醇注射液3.2 mL复容后,经测定总体积为5.1 mL,即浓度为392 mg/mL,限值为0.075 Eu/mg,根据
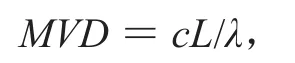
c为供试品浓度,L为限值,λ为标准曲线的最低浓度0.01 Eu/mL,则MVD=2 940(0.13 mg/mL)。
2.4 供试品干扰实验
根据MVD的结果,取批号为160304的供试品,用苯甲醇注射液复容后,用BET水依次稀释5倍(78.4 mg/mL),25倍(15.68 mg/mL),50倍(7.84 mg/mL),250倍(1.57 mg/mL)4个梯度,作为供试品溶液,以制备最终稀释分别为10倍(39.2 mg/mL),50倍(7.84 mg/mL),100倍(3.92 mg/mL)的供试品回收溶液,选择0.25 Eu/mL作为靠近曲线中点的内毒素浓度λm,将2倍于对应稀释浓度的供试品稀释液与0.5Eu/mL的内毒素标准液1:1稀释,制备内毒素终浓度为0.25 Eu/mL的供试品回收溶液,阴性对照和供试品回收溶液均做2个平行复孔,置酶标仪中孵育并检测,根据标准曲线计算细菌内毒素的含量和回收率。
表1结果显示,在动态浊度法中,供试品浓度为3.92 mg/mL(稀释100倍)时,其回收率平均值为100%,在50%~200%范围内,且接近100%,对检测结果干扰较小,因此采用100倍稀释液进行检验。

表1 动态浊度法供试品干扰试验结果
2.5 准确性验证
在供试品中加入内毒素标准品,使其终浓度分别为1.25,0.25,0.05,0.01 Eu/mL的标准内毒素,测定2个复孔,计算回收率。
检测结果显示,含有内毒素终浓度为1.25,0.25,0.05 Eu/mL的注射用盐酸大观霉素供试品的回收率在91%~107%,而内毒素终浓度为0.01 Eu/mL时,回收率较低,为73%和86%,但仍在50%~100%范围内,见表2,表明该方法准确性较好。

表2 动态浊度法检测供试品内毒素含量的准确性
2.6 精密性验证
用建立的方法检测标准内毒素的各个浓度(1.25,0.25,0.05,0.01 Eu/mL),每个浓度重复检测3次,计算变异系数;在供试品中加入内毒素标准品,使其终浓度分别为1.25,0.25,0.50,0.01 Eu/mL的标准内毒素,测定2个复孔,测定3次,计算结果及3次结果间的变异系数(CV)。
检测结果显示,4个浓度的标准内毒素检测结果的CV值均<10%,见表3;加入各浓度内毒素标准品的注射用盐酸大观霉素供试品检测结果的CV值均<10%,见表4。表明该方法精密性较好。

表3 动态浊度法检测内毒素标准品的精密性

表4 动态浊度法检测供试品内毒素含量的精密性
2.7 方法的初步应用
细菌内毒素标准品按“2.2”项方法制备细菌内毒素标准系列溶液;三批次注射用盐酸大观霉素样品按“2.4”项方法制备供试品溶液,并制备含标准内毒素的供试品溶液(添加的标准内毒素终浓度为0.25 Eu/mL),每个浓度设2个平行孔;另取2孔加入0.1 mL细菌内毒素检查用水作为阴性对照;再向上述各孔中分别加入0.1 mL动态浊度鲎试剂,混匀后放入酶标仪进行检测,经酶标仪的Gen软件处理数据,并自动计算出供试品的内毒素含量检测结果以及对应的回收率。
结果显示,对三批注射用盐酸大观霉素进行内毒素检测,均未检出内毒素,见表5,结果符合规定。
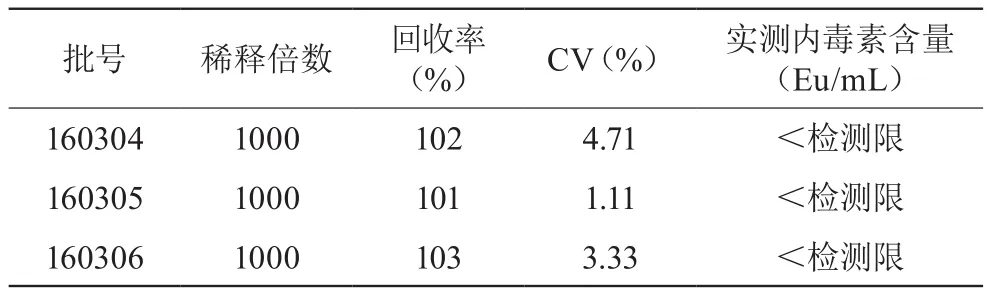
表5 动态浊度法检测三批次注射用盐酸大观霉素细菌内毒素含量的结果
3 讨论
盐酸大观霉素是临床治疗淋病的常用药物,其内毒素含量的准确测定不仅是限值的测定,对其质量控制具有重要意义。因此,本实验采用动态浊度法建立注射用盐酸大观霉素的内毒素定量方法,以期更好的满足质控的要求。
根据文献报导[6],在凝胶法中,该品种制剂注射用盐酸大观霉素对细菌内毒素检查试验具有一定的干扰,对此,本实验参照国内外文献资料[7-8],采用动态浊度法,首先考察样品对细菌内毒素检查的干扰情况。干扰实验结果表明,样品稀释至3.92 mg/mL,其回收率在100%左右样品,对检测结果的干扰作用较小,该浓度与文献报道中凝胶法测得的无干扰浓度3.333 mg/mL相一致[6],所以后续检测均采用此浓度作为供试品终浓度进行测定。随后对该方法的精密度进行了验证,结果表明内毒素标准品浓度在0.01~1.25 Eu/mL范围内,标准曲线线性关系良好,r>0.99。样品中加入各浓度的内毒素标准品,检测结果的变异系数均<10%,回收率在50%~200%,表明该方法具有较好的精密性。在方法的准确性验证中,当供试品中添加的内毒素标准品终浓度在1.25,0.25,0.05 Eu/mL时,回收率在91%~107%,准确性较好,但在内毒素终浓度在0.01 Eu/mL时回收率为73%和86%,回收率偏低,但仍在50%~100%范围内,说明该方法准确性总体较好。本文依旧采用0.01 Eu/mL作为标准曲线的最低浓度,是考虑到供试品中内毒素含量极低,几乎检测不到,所以需要更低的灵敏度来测定,测得的结果可作为样品质控的参考。而内毒素终浓度在0.01 Eu/mL时回收率偏低的原因,我们推测可能的原因为该内毒素浓度已为动态浊度法鲎试剂的灵敏度下限,导致测量准确度偏低。在方法的初步应用中,将三批样品稀释至终浓度为3.92 mg/mL时进行检测,检查结果均小于限值,结果均符合规定。
在动态浊度法中,样品的无干扰浓度与凝胶法一致,但是动态浊度法具有更高灵敏度,能够更为真实客观的反应样品中的内毒素含量,更适用于样品生产过程中的质控和对样品质量的监控。
因此,用动态浊度法检测注射用盐酸大观霉素制剂的细菌内毒素含量的方法是可行的,且具有灵敏度高,重现性好等优点,能很好地满足质控的要求,可为完善该品种的质量标准提供参考。
[1] 张璘,张继鹏,赵一欢,等.静注人免疫球蛋白细菌内毒素定量检测方法的探讨[J].微生物学免疫学进展, 2013, 41(2):28-32.
[2] 汪伟.注射用红花黄色素细菌内毒素检查法可行性研究[J].中国药师,2017,20(3):583-586.
[3] 何英,石仁琳.盐酸大观霉素、水剂青霉素治疗淋病100例疗效观察[J].世界最新医学信息文摘:连续型电子期刊,2015,15(13):110.
[4] 李展,张晗,周继春,等.动态比浊法检测盐酸法舒地尔注射剂细菌内毒素的含量[J].中国药事, 2015,29(7):742-744.
[5] 邓杰,张珂,袁涛,等.动态显色法检测白喉毒素突变体CRM197的细菌内毒素含量[J].中国生物制品学杂志,2013,26(12):1835-1839.
[6] 祝清芬,国明,程春雷.注射用盐酸大观霉素细菌内毒素检查法标准修订[J].中国药事,2010,24(1):92-93.
[7] Ma L, He YJ, Li Y, et al. Actions of four organic acids in radix isatidis on endotoxin-neutralization investigated by kinetic turbidimetric assay[J]J Tradit Chin Med, 2012,32(2):261-266.
[8] 劳海燕,林秋晓,杨敏,等.在线血液透析滤过液中细菌内毒素定量法研究[J].南方医科大学学报,2006, 26(2):242-244.
本文编辑:鲁守琴
Determination of Bacterial Endotoxin Content in Spectinomycin Hydrochloride for Injection by Kinetic Turbidimetric Assay
Chen Li1, Zhang Xiao2, LiuYong-ge2, Feng Feng-jiao3
(1. Suzhou Institute for Drug Control, Jiangsu Suzhou 215104, China; 2. Shandong Lukang Pharmaceutical Co., Ltd., Shangdong Jining, China; 3. China Pharmaceutical University, Jiangsu Nanjing 211198, China)
Objective:To provide a reference for developing a method for determination of bacterial endotoxin content in spectinomycin hydrochloride for injection. Methods:The standard curve for determination of bacterial endotoxin by kinetic turbidimetric assay was plotted and verfieid for reliability. The interference of samples to determination of bacterial endotoxin was investigated to determine the maximum sample concentration without interference. The method was verifed for precision and accuracy, and preliminarily applied. Results:In the reliability experiment of standard curve, all the r values of the curve were more than 0.99, indicating the validity of the standard curve. However, in the interference experiment, the samples were dissolved and diluted with benzil alcohol injection, added with standard endotoxin to prepare a solution at a fnal sample concentration of 3.92 mg/mL and a fnal endotoxin concentration of 0.25 Eu/mL. The recovery rate of endotoxin was nearly 100%, and the samples at the said concentration showed little interference to the determination of endotoxin. The coeffcients of variation of determination results of standard endotoxin at various concentrations in three tests as well as the test samples added with standard endotoxin at varoius concentrations in three tests were less than 10%. In verifcation for accuracy, the recovery rates of test samples added with standard endotoxin to fnal concentrations of 1.25, 0.25 and 0.05 Eu/mL were 91%~107%, while those at fnal endotoxin concentration of 0.01 Eu/mL were 73% and 86%. In addition, allthe endotoxin contents in three batches of samples were less than the limited value by routine test, with recovery rates of 101%~103%. Conclusion:Kinetic turbidimetric assay is applicable to the quantitative determination of bacterial endotoxin in spectinomycin hydrochloride for injection.
Kinetic Turbidimetric Assay; Spectinomycin Hydrochloride for Injection; Endotoxin; Quantitative Determination
R927.11
A
10.3969/j.issn.2096-3327.2017.06.014
2017 - 04 - 26
陈莉,女,博士,副主任药师。研究方向:药品检验。通讯作者E-mail:chenli7710@126.com
