阑尾切除术后腹腔感染的病原学
2017-08-17徐汉英肖艳平
徐汉英, 肖艳平, 肖 华
(1 邵阳市新宁县人民医院, 湖南 邵阳 422700; 2 长沙卫生职业学院招生和就业处, 湖南 长沙 410100; 3 湖南省肿瘤医院 中南大学湘雅医学院附属肿瘤医院, 湖南 长沙 410013)
·论著·
阑尾切除术后腹腔感染的病原学
徐汉英1, 肖艳平2, 肖 华3
(1 邵阳市新宁县人民医院, 湖南 邵阳 422700; 2 长沙卫生职业学院招生和就业处, 湖南 长沙 410100; 3 湖南省肿瘤医院 中南大学湘雅医学院附属肿瘤医院, 湖南 长沙 410013)
目的 了解阑尾炎患者行阑尾切除术后腹腔感染的病原学特点。方法 回顾性分析2013年1月—2015年12月某院行阑尾切除术患者的临床病历资料,对腹腔感染患者的病原学特点、治疗及预后情况进行分析。结果 共调查阑尾切除术患者431例,38例术后出现腹腔感染,发病率为8.82%。检出病原菌36株,其中革兰阴性菌34株(94.44%),主要为大肠埃希菌(29株,80.55%);革兰阳性菌2株(5.56%),金黄色葡萄球菌和鸟肠球菌各1株。29株大肠埃希菌对临床常用的抗菌药物如阿莫西林、哌拉西林、替卡西林、头孢呋辛、头孢他啶、头孢噻吩的耐药率为72.41%~93.10%,未检出对哌拉西林/他唑巴坦、美罗培南、亚胺培南及阿米卡星耐药的菌株。结论 大肠埃希菌是阑尾切除术后腹腔感染最主要的病原菌,且对大多常用抗菌药物的耐药率高,可选用哌拉西林/他唑巴坦、阿米卡星或碳青霉烯类抗生素进行治疗。
阑尾切除术; 腹腔感染; 病原学; 大肠埃希菌; 医院感染
[Chin J Infect Control,2017,16(7):647-649]
腹腔感染是阑尾切除术后常见而严重的并发症,诊治不及时可造成严重后果,可引起全身炎症反应综合征,甚至出现感染性休克和多器官功能衰竭,是患者出院后再次入院和死亡的主要原因[1]。早期诊断并使用敏感的抗菌药物和充分引流是治疗关键。但阑尾切除术后腹腔感染病原学和药敏试验结果分析的相关研究国内外报道尚罕见。本研究分析431例行阑尾切除术患者的临床病历资料,统计发生腹腔感染的病原学及药敏试验结果,以指导阑尾切除术患者围手术期合理使用抗菌药物。
1 资料与方法
1.1 资料来源 来源于新宁县人民医院普外科2013年1月—2015年12月行阑尾切除术患者的临床病历资料。
1.2 调查方法 采用回顾性调查方法进行调查。调查内容包括患者一般资料、病原学检查情况、抗菌药物治疗情况及预后等。
1.3 腹腔感染诊断标准及处理 腹腔感染诊断标准[2]:(1)术后出现发热、腹痛、腹胀或者明显腹膜炎体征,伴白细胞或中性粒细胞比率升高;(2)腹腔引流液或穿刺液细菌学培养阳性;(3)影像学检查如腹腔超声及CT等,或再次手术证实腹腔内感染病变的存在,如化脓性渗出、局部脓肿等。对于临床怀疑发生腹腔感染的病例及时收集腹腔引流液进行培养,分离致病菌。诊断腹腔感染均根据细菌培养及药敏试验结果使用敏感抗菌药物治疗,充分引流,形成的腹腔脓肿选择B超或CT引导下穿刺置管引流,如穿刺失败或引流不通畅时选择再次手术置管引流。
1.4 统计分析 数据录入Excel表格进行统计分析。
2 结果
2.1 一般资料 共调查2013年1月—2015年12月行阑尾切除术患者431例。其中男性247例,女性184例;年龄8~87岁,平均(44.5±10.3)岁;病程1~48 h;急性单纯性阑尾炎116例,化脓性阑尾炎272例,穿孔及坏疽性阑尾炎43例;363例行腹腔镜下阑尾切除术,68例行开腹手术。
2.2 病原菌分布 431例阑尾切除患者中有38例术后发生腹腔感染,发病率为8.82%。其中35例患者培养结果为阳性,阳性率为92.10%;共检出病原菌36株,其中1例(2.9%)患者送检的同一份标本中分离出2种病原菌。36株病原菌中革兰阴性菌34株(94.44%),主要为大肠埃希菌(29株,80.55%);革兰阳性菌2株(5.56%)。病原菌的具体分布见表1。
表1 阑尾切除术后腹腔感染患者病原菌分布
Table 1 Distribution of pathogens causing intra-abdominal infection in patients undergoing appendectomy

病原菌 株数构成比(%)革兰阴性菌3494.44 大肠埃希菌2980.55 铜绿假单胞菌38.33 产气肠杆菌12.78 睾丸酮丛毛单胞菌12.78革兰阳性菌25.56 鸟肠球菌12.78 金黄色葡萄球菌12.78合计36100.00
2.3 大肠埃希菌对常见抗菌药物的耐药情况 培养分离出的36株病原菌,对常用抗菌药物如青霉素类和头孢菌素类的耐药率较高。其中最常见的致病菌大肠埃希菌对临床常用的抗菌药物如阿莫西林、哌拉西林、替卡西林、头孢呋辛、头孢他啶、头孢噻吩的耐药率为72.41%~93.10%,未检出对哌拉西林/他唑巴坦、美罗培南、亚胺培南及阿米卡星耐药的菌株。具体见表2。
表2 29株大肠埃希菌对常见抗菌药物的耐药情况
Table 2 Resistance of 29 strains ofEscherichiacolito commonly used antimicrobial agents
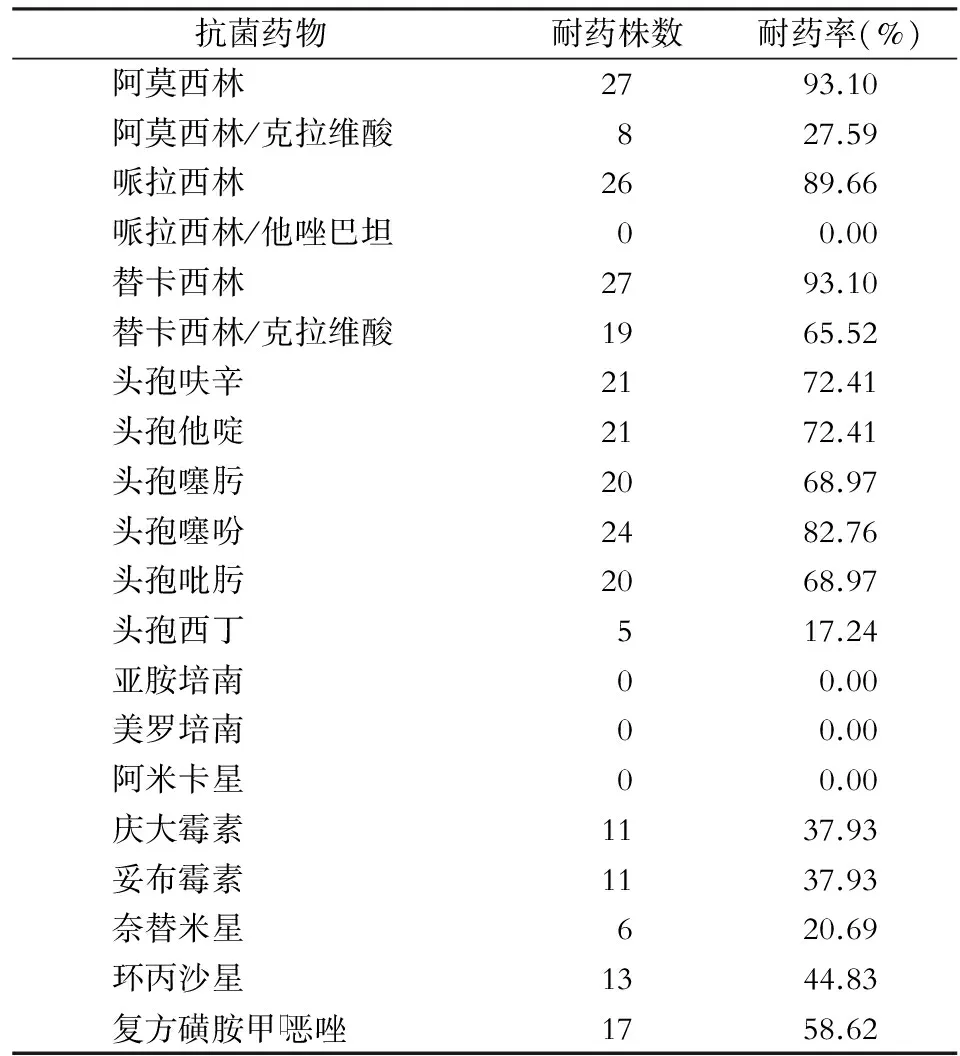
抗菌药物耐药株数耐药率(%)阿莫西林2793.10阿莫西林/克拉维酸827.59哌拉西林2689.66哌拉西林/他唑巴坦00.00替卡西林2793.10替卡西林/克拉维酸1965.52头孢呋辛2172.41头孢他啶2172.41头孢噻肟2068.97头孢噻吩2482.76头孢吡肟2068.97头孢西丁517.24亚胺培南00.00美罗培南00.00阿米卡星00.00庆大霉素1137.93妥布霉素1137.93奈替米星620.69环丙沙星1344.83复方磺胺甲口恶唑1758.62
2.4 治疗及预后 术中发现腹腔积脓的患者常规吸尽脓液并蘸干,其中96例因脓液较多行生理盐水+甲硝唑腹腔冲洗。术中留置腹腔引流管125例,术前30 min及术后3~5 d常规使用第三代头孢菌素联合甲硝唑静脉滴注,待患者体温及血常规检查正常、无明显腹膜炎体征后停用抗菌药物。 本研究中38例患者发生腹腔感染后均使用抗菌药物治疗。其中单用1种抗菌药物者10例(头孢菌素类/合成青霉素类为主),2种抗菌药物联用者10例(头孢菌素类/合成青霉素类/碳青霉烯类+喹诺酮类/甲硝唑/抗真菌药物等)。抗菌药物的使用时间为5~13 d。5例患者因未放置引流管或腹腔引流管已拔除,腹腔感染后形成腹腔脓肿,3例在超声引导下穿刺置管引流,1例再次手术置管引流,1例患者家属要求转上级医院行手术置管引流。术后住院时间为7~35 d,均治愈出院,围手术期无死亡病例。
3 讨论
腹腔感染是阑尾切除术后常见且较严重的并发症[1],研究表明阑尾穿孔是术后腹腔感染最重要的危险因素[3]。尚未穿孔急性阑尾炎切除术后腹腔感染的发病率约为1%,而穿孔后行手术治疗腹腔感染的发病率高达5%~10%[3-4]。本研究发现阑尾切除术后腹腔感染的发病率为8.82%,与Romano等[5]报道的结果一致,但高于国内张伟耀等[6]报道的1.90%,可能与化脓性阑尾炎及坏疽或穿孔患者的比例较高,以及手术方式等不同有关。阑尾切除术后应密切观察患者病情变化,当患者腹痛加重或者好转后再次出现发热、白细胞或者C反应蛋白(CRP)持续升高时应怀疑腹腔感染的发生。腹腔引流液行细菌培养及药敏试验,B超或CT扫描发现腹腔脓肿是诊断腹腔感染最常用的检查方法,也是指导下一步治疗的重要依据。一旦临床诊断为腹腔感染,合适的抗菌药物和充分的引流(影像学指引下穿刺置管或再次手术置管引流)是最主要的治疗措施。随着手术方式的改变和广谱抗菌药物的广泛使用,腹腔感染的病原菌及对常用药物的敏感性也发生了巨大变化。因此,有必要了解术后患者腹腔感染的病原菌分布和耐药性,以指导临床医生更加合理、规范的使用抗菌药物。
阑尾切除术后腹腔感染病原菌以革兰阴性菌为主(94.44%),其中又以大肠埃希菌最为常见(80.55%),与肖华等[7]报道胃癌根治术后腹腔感染的细菌谱一致,可能均为腹部手术且术中均开放胃肠道有关。本研究中分离出的29株大肠埃希菌对临床常用抗菌药物如阿莫西林、哌拉西林、头孢呋辛、头孢他啶及头孢噻吩的耐药率均达70%以上,对阿莫西林/克拉维酸及头孢西丁的耐药率比较低,分别为27.59%和17.24%;对哌拉西林/他唑巴坦、阿米卡星及碳青霉烯类的亚胺培南及美罗培南均100%敏感。近年来也有对亚胺培南等碳青霉烯类抗生素敏感性降低的肠杆菌科细菌出现[6],因此,临床上亦不能滥用此类抗生素,防止出现二重感染或产生耐药等。混合性细菌感染在老龄患者及免疫力低下的患者中也越来越常见,且多为条件致病菌,耐药率高,治疗困难。本研究中有1例(2.9%)患者在同一份送检标本中分离出大肠埃希菌和铜绿假单胞菌。因此,临床医生在治疗腹腔感染的过程中,发现应用单一抗菌药物效果不明显时,应考虑混合感染的可能。由于细菌培养及药敏试验通常需要3~5 d时间,因此,术后感染初期的治疗为经验性用药。因为腹腔感染的致病菌80%可能为大肠埃希菌,而研究也尚未发现对哌拉西林/他唑巴坦或阿米卡星耐药的菌株;因此,阑尾切除术后出现腹腔感染的病例,可优先选择哌拉西林/他唑巴坦或阿米卡星经验性治疗,待获得培养和药敏试验结果后再调整治疗方案。
[1] Moghadamyeghaneh Z, Hwang G, Hanna MH, et al. Unplanned readmission after appendectomy[J]. Am J Surg, 2016, 212(3): 493-500.
[2] Lo CH, Chen JH, Wu CW, et al. Risk factors and management of intra-abdominal infection after extended radical gastrectomy[J]. Am J Surg, 2008, 196(5): 741-745.
[3] Asarias JR, Schlussel AT, Cafasso DE, et al. Incidence of postoperative intraabdominal abscesses in open versus laparoscopic appendectomies[J]. Surg Endosc, 2011, 25(8): 2678-2683.
[4] Levin DE, Pegoli W Jr. Abscess after appendectomy: predisposing factors[J]. Adv Surg, 2015, 49: 263-280.
[5] Romano A, Parikh P, Byers P, et al. Simple acute appendicitis versus non-perforated gangrenous appendicitis: is there a difference in the rate of post-operative infectious complications?[J]. Surg Infect (Larchmt), 2014, 15(5): 517-520.
[6] 张伟耀, 周霞.腹腔镜阑尾切除术与开腹阑尾切除术的并发症大样本对比分析[J].中国全科医学, 2014, 17(3):322-324.
[7] 肖华, 欧阳永忠, 汤明, 等.胃癌根治术后腹腔感染的病原学分析[J/CD].中华实验和临床感染病杂志:电子版, 2013, 7(6):887-889.
(本文编辑:陈玉华)
Pathogenic characteristics of intra-abdominal infection after appendectomy
XUHan-ying1,XIAOYan-ping2,XIAOHua3
(1People’sHospitalofXinning,Shaoyang422700,China; 2DepartmentofAdmissionandEmployment,ChangshaHealthVocationalCollege,Changsha410100,China; 3HunanCancerHospital&AffiliatedCancerHospitalofXiangyaSchoolofMedicine,CentralSouthUniversity,Changsha410013,China)
Objective To understand the pathogenic characteristics of intra-abdominal infection after appendectomy in patients with appendicitis. Methods Clinical data of patients undergoing appendectomy in a hospital from January 2013 to December 2015 were analyzed retrospectively, pathogenic characteristics, treatment, and prognosis of patients with intra-abdominal infection were analyzed. Results A total of 431 patients undergoing appendectomy were investigated, 38 (8.82%) developed intra-abdominal infection. 36 strains of pathogenic bacteria were isolated, 34 (94.44%) of which were gram-negative bacteria, mainlyEscherichiacoli(n=29,80.55%); 2 (5.56%) strains were gram-positive bacteria, 1 of which wasStaphylococcusaureus, and the other wasEnterococcusavium. The resistance rates of 29 strains ofEscherichiacolito commonly used antimicrobial agents (amoxicillin, piperacillin, ticarcillin, cefuroxime, ceftazidime, and cefalotin) were 72.41%-93.10%, none of strains were found to be resistant to piperacillin/tazobactam, meropenem, imipenem, and amikacin. ConclusionEscherichiacoliis the most common pathogen causing intra-abdominal infection after appendectomy and it has high resistance rates to most commonly used antimicrobial agents, piperacillin/tazobactam, amikacin, and carbapenems are recommended for treating intra-abdominal infection after appendectomy.
appendectomy; intra-abdominal infection; pathogen;Escherichiacoli; healthcare-associated infection
2016-08-01
徐汉英(1972-),男(汉族),湖南省邵阳市人,副主任医师,主要从事胃肠外科学研究。
肖华 E-mail:huakexh2010@163.com
10.3969/j.issn.1671-9638.2017.07.013
R574.61
A
1671-9638(2017)07-0647-03
