Day 3非优质胚胎继续培养囊胚的应用价值研究
2017-08-16柴三明王志强倪亚莉
柴三明,王志强,张 霖,杨 杰,王 称,2,倪亚莉*
(1.甘肃省妇幼保健院生殖医学中心,甘肃 兰州 730050;2.甘肃省出生缺陷防控研究重点实验室培育基地,甘肃 兰州 730050)
·论 著·
Day 3非优质胚胎继续培养囊胚的应用价值研究
柴三明1,王志强1,张 霖1,杨 杰1,王 称1,2,倪亚莉1*
(1.甘肃省妇幼保健院生殖医学中心,甘肃 兰州 730050;2.甘肃省出生缺陷防控研究重点实验室培育基地,甘肃 兰州 730050)
目的通过分析第3天(day 3,D3)移植及冷冻后非优质胚胎继续培养的囊胚形成情况及其影响因素,探讨非优质胚胎继续培养囊胚在辅助生殖技术中的应用价值。方法374例体外受精-胚胎移植新鲜周期资料,首先以是否有囊胚形成分为有囊胎形成组278例和无囊胎形成组96例,比较2组临床及实验室指标之间的差异;比较不同年龄组、常规受精(in vitro fertilization,IVF)和卵胞浆内单精子注射(intra cytoplasmic sperm injection,ICSI) 2种授精方式、不同人绒毛膜促性腺激素(human chorionic gonadotropin,HCG)注射日雌二醇(estradiol,E2)水平、不同成熟卵子数等因素之间囊胚形成率及优质囊胚率的差异,分析影响D3非优质胚胎继续培养囊胚的临床及实验室因素;比较不同D3胚胎质量来源所形成囊胚的解冻妊娠率。结果374例患者共进行D3非优质胚胎继续培养1 938个,形成囊胚952个,囊胚形成率49.1%(952/1 938),优质囊胚率30.4%(590/1 938)。按年龄分为2组,年龄<35岁组囊胚形成率50.7%(875/1 727)和优质囊胚率31.6%(546/1 727)均明显高于年龄≥35岁组的36.5%(77/211)和20.8%(44/211),差异有统计学意义(P<0.05)。采用IVF受精后对非优质胚胎继续培养,其囊胚形成率51.2%(694/1 356)、优质囊胚率33.0%(447/1 356)均较采用ICSI授精后43.4%(136/316)和25.6%(81/316)高,差异有统计学意义(P<0.05)。随着HCG日E2水平的增加和成熟卵子数量的增多,囊胚形成率和优质囊胚率也随之增加。将D3非优质胚胎继续培养后所形成的优质囊胚经单囊胚冷冻后行解冻移植,其临床妊娠率虽然明显较同期D3为优质胚胎来源的囊胚解冻妊娠率低(42.5%vs57.5%)(P<0.05),但仍然获得了较好的临床妊娠率。结论非优质胚胎囊胚培养可在一定程度提高患者的卵子利用率,节约治疗成本,但根据患者年龄、受精方式、基础内分泌水平、成熟卵子数等自身条件的不同,其非优质胚胎继续培养的利用价值及应用效果也不尽相同。
生殖技术;囊胚;妊娠率
囊胚培养技术始于20世纪90年代,随着辅助生殖技术的不断发展,囊胚培养技术也随之不断改进与完善。由于囊胚培养相比卵裂期胚胎延长了体外培养时间,可在一定程度上对携带有遗传缺陷以及低发育潜能的胚胎进行初步的筛选和淘汰,而能够发育至囊胚的胚胎具有更高的发育潜能及临床种植能力,可获得更高的临床妊娠率[1]。在体外受精治疗不孕患者时,胚胎质量是影响临床治疗结局的极其重要的因素,早期胚胎质量的评估对其后续发育潜能具有十分重要的预测作用。目前国内大多数辅助生殖机构均采用早期胚胎的形态学评分评估胚胎质量并进行移植胚胎及冷冻胚胎的选择,对形态学评分较低的移植和冷冻后的剩余胚胎则进行继续培养,待发育至囊胚阶段后根据囊胚的形态学评分选择质量较好的囊胚进行选择性移植或冷冻,但第3天(day 3,D3)剩余胚胎囊胚培养的囊胚形成率、优质囊胚率、其在辅助生殖治疗中的应用价值及影响因素至今在生殖医学领域尚不能达成共识。本研究分析甘肃省妇幼保健院生殖中心数据资料,探讨D3非优质胚胎继续培养囊胚在辅助生殖技术治疗中的应用价值。
1 资料与方法
1.1 一般资料 选择2014年1—12月在甘肃省妇幼保健院接受辅助生殖治疗并在新鲜周期进行非优质胚胎继续培养的不孕患者374例,年龄20~40岁,平均(29.8±4.5)岁。不孕原因:输卵管因素302例,不明原因不孕72例。分组方法:①以是否有囊胚形成分为有囊胚形成组278例和无囊胚形成组96例,比较2组临床及实验室相关指标之间的差异;②以不同年龄、授精方式、不同人绒毛膜促性腺激素(human chorionic gonadotropin,HCG)日雌二醇(estradiol,E2)水平、不同成熟卵子数等因素进行分组,分析影响D3非优质胚胎囊胚培养的临床及实验室因素;③以不同D3胚胎质量进行分组,比较组间囊胚解冻移植妊娠率。
1.2 临床促排卵方案 所有患者均采用我中心常规短效长方案促排卵,患者于前次月经黄体中期开始采用皮下注射促性腺激素释放激素激动剂(GnRHa,Ipsen),达降调标准后给予重组卵泡刺激素(Gona-F,Serono)或国产卵泡刺激素(丽申宝,珠海丽珠药业)150~300 U/d 直到扳机日。当出现至少3个直径>18 mm的卵泡后于当晚21时肌内注射HCG 5 000~10 000 U,36 h后取卵。
1.3 授精
1.3.1 常规受精(in vitro fertilization,IVF) 本中心常规受精主要采用短时受精方式,即在肌内注射HCG后(40±1) h加精,加精3~6 h后反复吹打拆除颗粒细胞,判断卵母细胞成熟度并根据第二极体排出与否初步评估受精情况,对常规受精失败的卵母细胞实施补救性卵胞浆内单精子注射(intra cytoplasmic sperm injection,ICSI)。授精后16~18 h观察原核以确定是否受精并将受精卵移入卵裂期胚胎培养液(G-1TM,瑞典Vitrolife公司)继续培养。
1.3.2 ICSI 取卵后将卵子置于受精液中进行预培养,ICSI操作前拆除大部分颗粒细胞,观察卵母细胞成熟度并对所有成熟卵母细胞行ICSI操作[ICSI操作液(G-MOPSTM,瑞典Vitrolife公司),精子制动液(7%PVP,美国SAGE公司)]。
1.4 胚胎、囊胚培养及评分 参照Peter卵裂期胚胎评分系统[2]评估胚胎质量,将第3天发育到7~10个卵裂球的Ⅰ、Ⅱ级胚胎定义为优质胚胎,其余低评分胚胎为非优质胚胎。选择优质胚胎移植或冷冻保存,将剩余正常受精来源的非优质胚胎转入囊胚培养液(G-2,瑞典Vitrolife公司) 继续培养至第5天或第6天,参照Gardner囊胚评分标准[3]进行囊胚形态学评分。①首先根据囊胚腔的大小和是否孵化,分为6个时期:1期,早期有腔室囊胚,囊胚腔小于胚胎总体积的1/2;2期,囊胚腔体积大于或等于胚胎总体积的1/2;3期,完全扩张囊胚,囊胚腔完全占据了胚胎的总体积;4期,扩张囊胚,囊脏腔完全充满胚胎,胚胎总体积变大,透明带变薄;5期,正在孵出的囊胚,囊胚的一部分从透明带中逸出;6期,孵出的囊胚,囊胚全部从透明带中逸出。处于3~6期的囊胚,还需对内细胞团和滋养层细胞进行分级。②内细胞团:A级,细胞数目多,结合紧密;B级,细胞数目较少,结合较松散;C级,细胞数目极少。③滋养层细胞:A级,上皮细胞层由较多的细胞组成,结构致密;B级,上皮细胞层由不多的细胞组成,结构较松散;C级,上皮细胞层由稀疏的细胞组成。如某囊胚为4期囊胚,内细胞团评分为B,滋养层细胞评分为B,则该囊胚评分为4BB。将囊胚评分在4BB及以上者定义为优质囊胚。
1.5 统计学方法 应用SPSS 17.0统计学软件分析数据。计量资料比较采用t检验;计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 有囊胚形成组和无有囊胚形成组相关资料比较 按D3剩余胚胎继续培养后是否有囊胚形成进行分成2组。2组不孕年限、基础催乳素(basal prolactin, bPRL)、基础睾酮(basal testosterone,bT)、HCG日黄体生成素(luteinzing hormone,LH)、HCG日孕酮(progesterone,P)差异均无统计学意义(P>0.05);无囊胚形成组年龄、Gn时间、基础卵泡刺激素(basal follicle-stimulating hormone,bFSH)的含量多于或大于有囊胚形成组,14 mm以上卵泡数、获卵数、成熟卵子数、基础黄体生成素(basal luteinzing hormone,bLH)、基础雌二醇(basal estradiol,bE2),HCG日E2低于有囊胚形成组,差异均有统计学意义(P<0.05)。见表1。

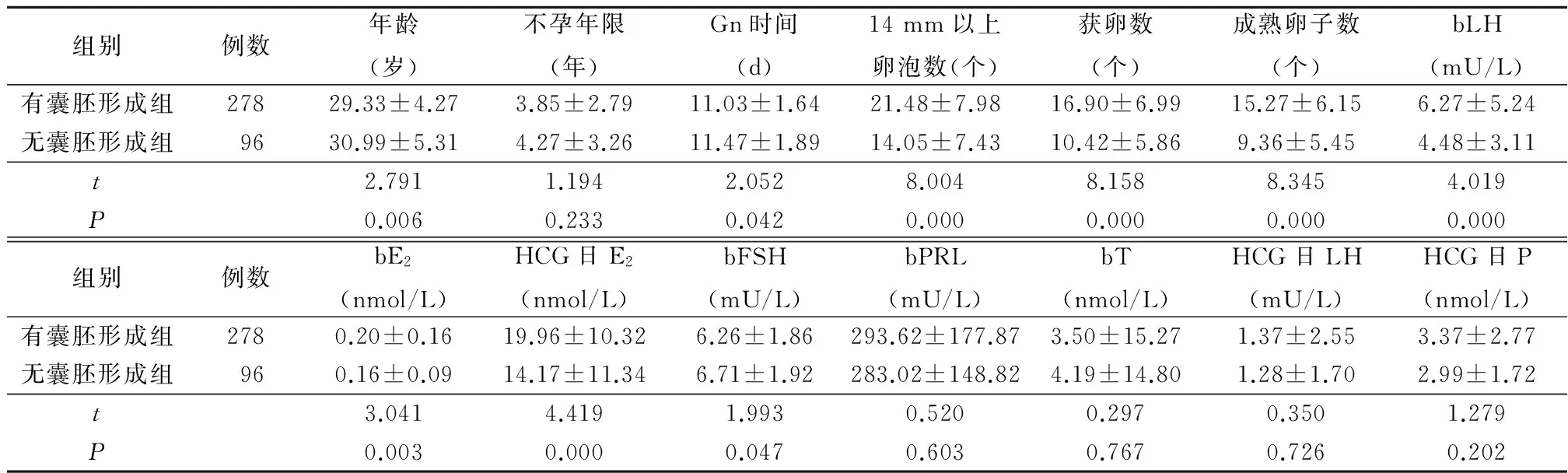
组别例数年龄(岁)不孕年限(年)Gn时间(d)14mm以上卵泡数(个)获卵数(个)成熟卵子数(个)bLH(mU/L)有囊胚形成组27829.33±4.273.85±2.7911.03±1.6421.48±7.9816.90±6.9915.27±6.156.27±5.24无囊胚形成组9630.99±5.314.27±3.2611.47±1.8914.05±7.4310.42±5.869.36±5.454.48±3.11t2.7911.1942.0528.0048.1588.3454.019P0.0060.2330.0420.0000.0000.0000.000组别例数bE2(nmol/L)HCG日E2(nmol/L)bFSH(mU/L)bPRL(mU/L)bT(nmol/L)HCG日LH(mU/L)HCG日P(nmol/L)有囊胚形成组2780.20±0.1619.96±10.326.26±1.86293.62±177.873.50±15.271.37±2.553.37±2.77无囊胚形成组960.16±0.0914.17±11.346.71±1.92283.02±148.824.19±14.801.28±1.702.99±1.72t3.0414.4191.9930.5200.2970.3501.279P0.0030.0000.0470.6030.7670.7260.202
2.2 不同年龄及受精方式囊胚形成情况比较 374例患者进行D3非优质胚胎培养1 938个,共形成囊胚952个,囊胚形成率49.1%(952/1 938),优质囊胚590个,优质囊胚形成率30.4%(590/1 938)。按年龄分为2组,年龄<35岁组其囊胚形成率和优质囊胚率均明显高于年龄≥35岁组,差异有统计学意义(P<0.05)。根据患者自身条件不同,采用了多种受精方式,其中以IVF(251例)和ICSI为主(74例),采用IVF受精后其囊胚形成率及优质囊胚率均较ICSI高,差异有统计学意义(P<0.05)。见表2。

表2 不同年龄及不同授精方式囊胚形成率比较Table 2 Comparison of blastocyst formation rates at different ages and different fertilization methods (个数,%)
2.3 不同E2水平和不同成熟卵数之间囊胚形成情况 根据HCG日E2水平分为≤12.81 nmol/L组、>12.81~18.30 nmol/L和>18.30 nmol/L组。≤12.81 nmol/L组囊胚形成率明显低于>12.81~18.30 nmol/L组和>18.30 nmol/L组,差异有统计学意义(P<0.05);> 12.81~18.30 nmol/L组与>18.30 nmol/L组之间囊胚形成率差异无统计学意义(P>0.05);3组间优质囊胚率差异也无统计学意义(P>0.05)。按照成熟卵子数分为≤4个、>4~15个,>15个3组,成熟卵子数≤4个组的囊胚形成率和优质囊胚率均较成熟卵子数>4~15个组和>15个组低,差异有统计学意义(P<0.05)。见表3。
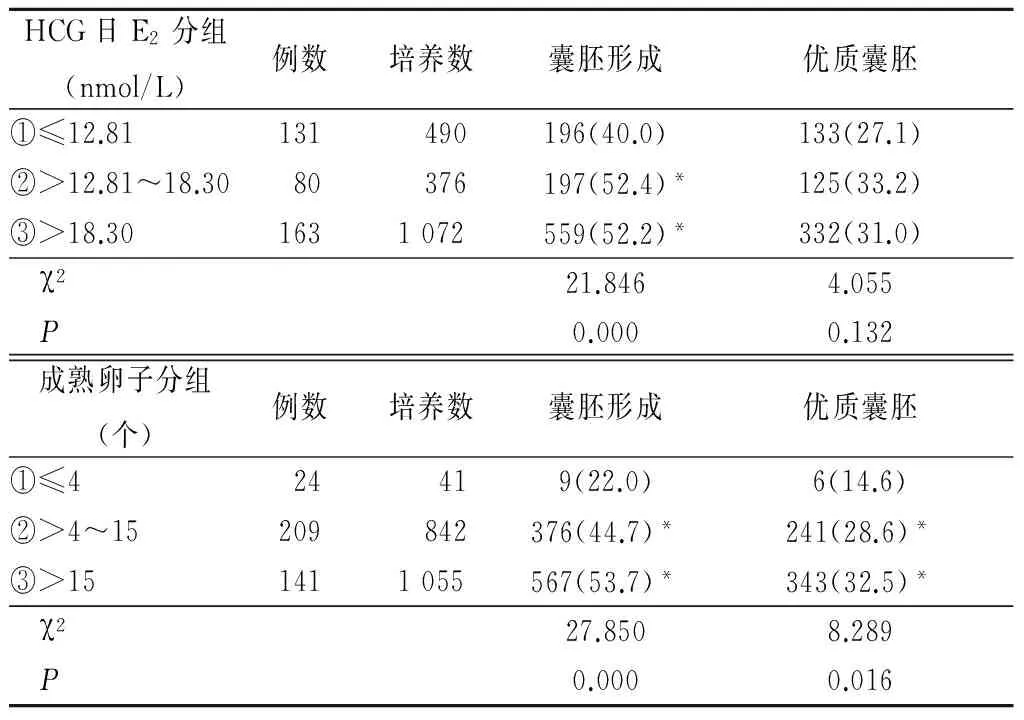
表3 不同E2水平及不同成熟卵数之间囊胚形成率比较Table 3 Comparison of blastocysts formation rates between different E2 levels and different mature eggs (个数,%)
*P<0.05与①比较(χ2检验)
2.4 不同来源囊胚解冻移植情况比较 将D3非优质胚胎继续培养后所形成优质囊胚单囊胚冷冻后行解冻移植,囊胚解冻后成功复苏88例作为D3非优质胚胎组;同期解冻移植来源于D3优质胚胎继续培养所形成的囊胚240例作为D3优质胚胎组。观察2组临床结局。相比D3优质胚胎来源的囊胚,D3非优质胚胎所形成囊胚的解冻妊娠率明显较低,差异有统计学意义(P<0.05)。见表4。

表4 不同D3胚胎质量来源的囊胚移植后临床结局比较Table 4 Comparison of clinical outcome after blastocysts transplantation from different D3 embryo quality (例数,%)
3 讨 论
在体外受精治疗中,胚胎质量是影响周期治疗结果的重要因素之一[4-5]。随着体外受精-胚胎移植技术的不断发展以及囊胚培养技术的不断提高,近年来许多辅助生殖机构已开展囊胚培养技术,尤其非优质胚胎的囊胚培养已经成为各生殖中心对移植冷冻后非优质胚胎的主要处理对策。许多研究表明,将非优质胚胎进行体外继续培养后,仍有一部分胚胎能发育为囊胚且在将这些囊胚进行移植后可使不孕患者成功妊娠,提高患者的胚胎利用率及累积妊娠率,降低患者的治疗成本[6-9]。本研究结果显示非优质胚胎体外继续培养后其囊胚形成率为49.12%,优质囊胚形成率为30.44%。略高于Zhu等[10]报道的囊胚形成率(43.59%)和优质囊胚率(24.25%),这可能与不同中心之间在临床超促排卵方案、实验室培养环境以及胚胎和囊胚评分系统的差异有关。非优质胚胎继续培养仍然能够获得较为理想的囊胚形成率及优质囊胚率,将在一定程度上为不孕患者提供更多移植机会,提高不孕患者的卵子利用率。
年龄是目前已知的预示女性生育能力的重要因素之一,女性年龄与卵母细胞的质量密切相关[11-12]。女性卵巢储备功能随着年龄的不断增长而逐渐降低,其自主排卵能力以及体外受精治疗成功率也随之下降。在IVF助孕周期中,随着女性年龄的不断增大,其周期获卵数不断减少,胚胎种植率也明显降低,提示其卵巢储备库卵母细胞数目和质量贮备能力均在逐渐衰竭[13-14]。本研究结果显示,年龄<35岁的患者,其非优质胚胎继续培养后的囊胚形成率和优质囊胚率均明显高于年龄≥35岁的患者。表明随着年龄的不断增加,其非优质胚胎的发育潜能也在不断降低。
本研究通过比较不同授精方式之间囊胚形成情况,发现采用IVF授精后非优质胚胎的囊胚形成率和优质囊胚率明显高于ICSI授精。这可能主要与2种不同授精方式的精卵结合机制有关,ICSI前卵母细胞脱颗粒、ICSI注射针对卵膜的穿刺、培养液随着注射操作进入胞浆等都可能对胚胎的后续发育潜能产生影响。此外,ICSI授精时授精者仅可通过精子形态学特征评估并选择精子进行注射,无法识别精子内部结构是否存在异常,而在进行IVF授精时卵周颗粒细胞可对精子进行进一步筛选,使得在IVF过程中最后发生精卵结合的精子其DNA完整性明显优于不能结合的精子。相关研究表明,精子DNA碎片增多虽然并不影响卵母细胞授精,但可明显降低其囊胚形成率,影响胚胎的后续发育潜能[15-17]。因此,相对于ICSI,常规IVF授精后的非优质胚胎具有更好的发育潜能,利用价值较高。
本研究通过比较有无囊胚形成2组间HCG日E2水平发现,有囊胚形成组HCG日E2水平明显高于无囊胚形成组(P<0.05)。此外,本研究还分析了HCG日E2水平与非优质胚胎囊胚形成情况的关系,发现HCG日E2水平≤12.81 nmol/L时,其囊胚形成率明显低于>12.81~18.30 nmol/L组及>18.30 nmol/L组;而>12.81~18.30 nmol/L组与>18.30 nmol/L组之间,囊胚形成率差异无统计学意义(P>0.05);3组间优质囊胚率差异差异也无统计学意义(P>0.05)。提示当HCG日E2低于一定水平时,其可能通过影响胚胎的后续发育潜能而降低囊胚形成率。但本研究显示不同HCG日E2水平时各组之间优质囊胚率差异无统计学意义(P>0.05),这可能与本研究样本量较小以及不同中心胚胎评估系统的差异所致,仍需进一步扩大样本加以探讨。
本研究通过分析成熟卵子与非优质胚胎囊胚形成情况的关系发现,随着不孕患者所获得的成熟卵子数不断增加,其非优质胚胎继续培养后囊胚形成率明显提高,但当所获成熟卵子数≤4个时,其优质囊胚率将会明显降低。提示对于周期所获成熟卵子数≤4个的患者,非优质胚胎囊胚培养并非最佳的胚胎处理手段,可根据患者实际情况进一步选择D3冷冻或继续培养囊胚,以求获得最佳的效果。
本研究通过比较不同来源囊胚解冻后单囊胚移植的临床妊娠率发现,D3非优质胚胎继续培养后其优质囊胚的解冻移植仍然能够获得较好的临床妊娠率,但相比D3优质胚胎来源的囊胚,其解冻移植后的临床妊娠率明显较低。表明D3非优质胚胎继续培养后优质囊胚解冻移植的临床妊娠率虽然低于D3优质胚胎来源的囊胚,但其仍然具有较高的利用价值,可作为D3移植后无更多可利用胚胎患者的胚胎处理方案,从而提高该部分患者的卵子利用率,降低患者的治疗成本。
综上所述,D3非优质胚胎继续培养后仍然具有形成囊胚和优质囊胚的潜能,但其囊胚形成率及优质囊胚率与患者自身条件的优劣有关。有关临床因素对D3非优质胚胎继续培养影响的相关研究较少。本研究结果显示,年龄、HCG日14 mm以上卵泡数、获卵数、成熟卵子数、基础LH、基础E2以及HCG日E2水平均与非优质胚胎继续培养后囊胚形成有关。因此,在实际临床工作中,应该根据患者临床及实验室因素综合考虑,评估非优质胚胎继续培养在不孕不育患者中应用的合理性。
[1] Glujovsky D,Farquhar C,Quinteiro Retamar AM,et al. Cleavage stage versus blastocyst stage embryo transfer in assisted reproductive technology[J]. Cochrane Database Syst Rev,2016,(6):CD002118.
[2] Brinsden PR. A textbook of in vitro fertilization and assisted reproduction[M]. New York:The Parthenon Publishing Group Inc,1999:1996.
[3] Gardner DK,Lane M,Stevens J,et al. Blastocyst score affects implantation and pregnancy outcome:towards a single blastocyst transfer[J]. Fertil Steril,2000,73(6):1155-1158.
[4] Niinimäki M,Veleva Z, Martikainen H. Embryo quality is the main factor affecting cumulative live birth rate after elective single embryo transfer in fresh stimulation cycles[J]. Eur J Obstet Gynecol Reprod Biol,2015,194:131-135.
[5] Li L,Liu JQ,Du HZ,et al. Effects of patient age,number and quality of embryo transferred on the outcome of in vitro fertilization-embryo transfer[J]. Nan Fang Yi Ke Da Xue Xue Bao,2010,30(8):1900-1902.
[6] Shaw-Jackson C,Bertrand E,Becker B,et al. Vitrification of blastocysts derived from fair to poor quality cleavage stage embryos can produce high pregnancy rates after warming[J]. J Assist Reprod Genet,2013,30(8):1035-1042.
[7] Ren X,Liu Q,Chen W,et al. Selection and vitrification of embryos with a poor morphological score:a proposal to avoid embryo wastage[J]. J Huazhong Univ Sci Technolog Med Sci,2012,32(3):405-409.
[8] Yin H,Jiang H,He R,et al. The effects of fertilization mode,embryo morphology at day 3,and female ageon blastocyst formation and the clinical outcomes[J]. Syst Biol Reprod Med,2015,61(1):50-56.
[9] Stecher A,Vanderzwalmen P,Zintz M,et al. Transfer of blastocysts with deviant morphological and morphokinetic parameters at early stages of in-vitro development:a case series[J]. Reprod Biomed Online,2014,28(4):424-435.
[10] Zhu HB,Zhang ZH, Fadlalla E,et al. Culturing surplus poor-quality embryos to blastocyst stage have positive predictive value of clinical pregnancy rate[J]. Iran J Reprod Med,2014,12(9):609-616.
[11] Erdem A,Erdem M,Biberoglu K,et al. Age-related changes in ovarian volume,antral follicle counts and basal FSH in women with normal reproductive health[J]. J Reprod Med,2002,47(10):835-839.
[12] Tsutsumi M,Fujiwara R,Nishizawa H,et al. Age-related decrease of meiotic cohesins in human oocytes[J]. PLoS One,2014,9(5):e96710.
[13] van Rooij IAJ, de Jong E,Broekmans FJM,et al.The limited value of follicle-stimulating hormone as a test for ovarian reserve[J]. Fertil Steril,2004,81(6):1496-1497.
[14] Jehan S, Syed S. Association of ovarian reserve with age,BMI and serum FSH level in subfertile women[J]. J Pak Med Assoc,2016,66(4):409-413.
[15] Ni W,Xiao S,Qiu X,et al. Effect of sperm DNA fragmentation on clinical outcome of frozen-thawed embryo transfer and on blastocyst formation[J]. PLoS One,2014,9(4):e94956.
[16] Wdowiak A,Bakalczuk S,Bakalczuk G. The effect of sperm DNA fragmentation on the dynamics of the embryonic development in intracytoplasmatic sperm injection[J]. Reprod Biol,2015,15(2):94-100.
[17] 王志强,杨杰,倪亚莉,等.精子DNA碎片与辅助生殖结局关系的研究进展[J].河北医科大学学报,2014,35(12):1485-1488.
(本文编辑:许卓文)
Study on application value of blastocysts derived from poor quality embryos on day 3
CHAI San-ming1, WANG Zhi-qiang1, ZHANG Lin1, YANG Jie1, WANG Cheng1,2, NI Ya-li1*
(1.ReproductiveMedicalCenterofGansuProvincialMaternityandChild-careHospital,Lanzhou730050,China; 2.CultivationBaseofKeyLaboratoryofGansuProvincialBirthDefectsPreventionandControl,Lanzhou730050,China)
Objective To explore the application value of blastocysts derived from poor quality embryos on day 3(D3) through its blastulation rate and high quality blastocyst formation rate. Methods Three hundred and seventy-four in vitro fertilization-embryo transplantation were divided into two groups with blastulation or not after further culture of poor quality embryos on D3. Women′s age, insemination methods, estradiol on the day of human chorionic gonadotropin injection and the number of mature oocytes were also analyzed. Results The blastulation rate of 1 938 D3 poor quality embryos from 374 patients was 49.1%(952/1 938) and the high quality blastocyst formation rate was 30.4%(590/1 938). The blastocyst formation rate of patients low than 35 years old was 50.7%(875/1 727) and the high quality blastocyst formation rate was 31.6%(546/1 727), which was statistically higher than the patients more than 35 years old 36.5%(77/211), 20.8%(44/211). In vitro fertilzation blastulation rate and high quality blastocyst formation rate was significantly higher than intra cytoplasmic sperm injection blastulation rate: 51.2%(694/1 356)vs43.0%(136/316), high quality blastocyst formation rate:33.0%(447/1 356)vs25.6%(81/316). Patients who have more mature oocytes and much higher estradiol on the day of human chorionic gonadotropin injection, they would have more blastocyst and high quality blastocyst. The clinical pregnancy rate after transplanted the blastocysts came from D3 poor quality embryos was 42.5%, which was significantly lower than the blastocysts from D3 high quality embryos(57.5%). Conclusion Further culture of D3 poor quality embryos can increase the utilization ratio of patients oocytes and decrease the costs of treatment. But according to the patient′s age, the mode of fertilization, the basal endocrine level, the number of mature eggs and other conditions, the utility value and application effect of non quality embryo continuous culture are not the same.
reproductive techniques; blastula; pregnancy rate
2017-03-21;
2017-05-05
甘肃省卫生行业科研计划项目(GSWSKY-2015-19);甘肃省国际科技合作专项(1504WKCA060);甘肃省重点实验室专项(1506RTSA158)
柴三明(1968-),男,甘肃秦安人,甘肃省妇幼保健院副主任医师,医学学士,从事生殖医学研究。
*通讯作者。E-mail:niyali@126.com
R339.2
A
1007-3205(2017)08-0901-06
10.3969/j.issn.1007-3205.2017.08.008
