基因组学研究Csu基因簇在生物被膜生成过程中的作用
2017-08-16李海涛张鲁涛王伯丽齐天杰李宏林
李海涛,张鲁涛,李 帅,王伯丽,齐天杰,李宏林
(河北医科大学第二医院呼吸内一科,河北 石家庄 050000)
·论 著·
基因组学研究Csu基因簇在生物被膜生成过程中的作用
李海涛,张鲁涛,李 帅,王伯丽,齐天杰,李宏林
(河北医科大学第二医院呼吸内一科,河北 石家庄 050000)
目的探讨基因组学研究Csu基因簇在多药耐药鲍曼不动杆菌生物被膜生成过程中的作用。方法选取我院临床检验科细菌室分离筛选的多重耐药鲍曼不动杆菌菌株,取该菌株致病力最强的快速生长期和生物被膜期,提取2个不同时期的mRNA进行基因组比对研究。将样本的基因序列与公共数据库进行比较,进行功能注释。结果同一菌株在菌体快速生长期和生物被膜期2种状态下基因表达差异有统计学意义(P<0.05)。生物被膜状态的菌体较快速生长期的菌体有106个基因的表达上调,其中CsuA/B/C/D基因簇表达呈显著升高,92个基因出现了表达的下调。结论CsuA/B/C/D基因簇在生物被膜生成和形态维持中发挥着极其重要的作用。细菌生物被膜形成过程中,菌体的初始黏附依赖于CsuA/B/C/D基因的显著表达。CsuA/B/C/D基因簇介导菌毛的生物合成,还介导菌体分泌表面活性物质和细胞外基质,这些是生物被膜形成早期阶段所必需的。
鲍氏不动杆菌;抗药性,多药;基因检测
目前最具威胁的院内感染致病菌包括屎肠球菌、金黄色葡萄球菌、肺炎克雷伯菌、鲍曼不动杆菌、铜绿假单胞菌和肠杆菌属,这些超级细菌对目前大多数可用的抗生素均耐药[1]。多药耐药的鲍曼不动杆菌目前已经成为医院院内感染的重要病原菌,常常会引起广泛的院内感染[2-3]。鲍曼不动杆菌可以长期存活,造成慢性定植和感染的反复发生,主要是由于细菌菌体生物被膜的形成。本研究应用高通量转录组基因测序方法,检测相关调控因子在生物被膜生成中的影响,探讨生物被膜独特的生长方式以及细菌菌体长期定植造成反复感染的机制,报告如下。
1 资料与方法
1.1 收集和筛选菌株 菌株来自河北医科大学第二医院临床检验科细菌室,对收集的菌株进行筛选和药敏检测,剔除非鲍曼不动杆菌及非多药耐药菌株,收集多重耐药鲍曼不动杆菌菌株。多重耐药鲍曼不动杆菌是指对5类目前应用的抗生素有3类或者3类以上耐药。
1.2 样本的制备 试验菌株选取分离筛选的多重耐药鲍曼不动杆菌菌株中数量最多的优势菌株Acinetobacter baumannii BJAB0868进行研究。取该菌株致病力最强的快速生长期和生物被膜期,提取2个不同时期的mRNA进行转录组基因比对研究。将多重耐药Acinetobacter baumannii BJAB0868接种于无菌血培养皿生长8 h,酶标仪测定600 nm吸光度值(检测OD600=0.4),获得快速生长期菌株。以无菌肉汤配制浓度为0.7 Mac的菌悬液,生长在50 mL微发酵罐中,持续在37 ℃恒温无菌培养箱内培养96 h,使得生物被膜均匀生长在微发酵罐下层表面。每个微发酵罐加入1%结晶紫2 mL,染色30 min。再用PBS清洗3次,无菌环境中常温风干,再加入2 mL 95%的乙醇,脱色15 min,用酶标仪测定600 nm吸光度值。均值为空白对照的2倍以上者为生物膜形成阳性。然后电子显微镜镜下观察生物被膜生长情况。
1.3 样本mRNA的提纯和提取 选取多重耐药Acinetobacter baumannii BJAB0868进行研究。取该菌株快速生长期和生物被膜期,提取2个不同时期的mRNA。应用RNAprotect Bacteria Reagent和RNeasy Mini Kit试剂盒。取2个样本的悬浮菌液,离心,收集菌体。用溶菌酶消化菌体,再加入裂解液,反复收集,提纯,剔除菌体中DNA和蛋白质。得到菌体总RNA,进一步提纯mRNA。样本RNA≥1 μg,应用Life-tech Ribominus系列试剂盒提取。
1.4 样本基因结果注释 将样本的基因序列与公共数据库进行比较,通过基因的相似性进行功能注释。基因相似性比对主要基于局部序列排比检索基本工具(Basic Local Alignment Search Tool,BLAST)算法。BLAST能够实现比较两段核酸或者蛋白序列之间的相似性的功能。
1.5 统计学方法 应用R version 3.3.0软件处理数据, 组间基因表达的比较采用Fisher精确检验。P<0.05为差异有统计学意义。
2 结 果
2.1 样本RNA数据的质控检测 对高通量测序所使用的mRNA数据进行质量评估:①污染评估,对比鲍曼不动杆菌公共数据库,是否污染其他物质RNA;②纯度评估,结果样本RNA纯度高,可进行后续研究。样本测序序列无明显污染其他物种序列(图1),其中横坐标表示测序位置,纵坐标为测序质量值,图中红色表示中位数,黄色是25%~75%区间,触须是10%~90%区间,蓝线是平均数。测序是双端测序,每条 read 长度 125 bp。随着测序的进行,酶的活性会逐步下降,因此到达一定测序长度后,碱基质量值也会随之下降。中位值均在 Q20 以上,因此该文库碱基质量良好,可用于后续分析。

图1 样本碱基质量分布图
Figure 1 The sample base mass distribution
2.2 2组样本基因表达比较 2种状态的菌体有198个基因表达差异有统计学意义(P<0.05)。生物被膜状态的菌体有106个基因较快速生长期菌体的基因表达上调,其中又有53个基因表达呈显著升高,但在快速生长期菌体的表达极少,甚至表达被完全抑制。此外,有92个基因出现了表达的下调(图2),CsuA/B/C/D基因表达是显著升高的。见表1。
在图2中,每一个点代表一个基因,横纵坐标分别表示log2(FPKM)值。其中红色表示上调基因,绿色表示下调基因,蓝色表示表达的基因差异无统计学意义。
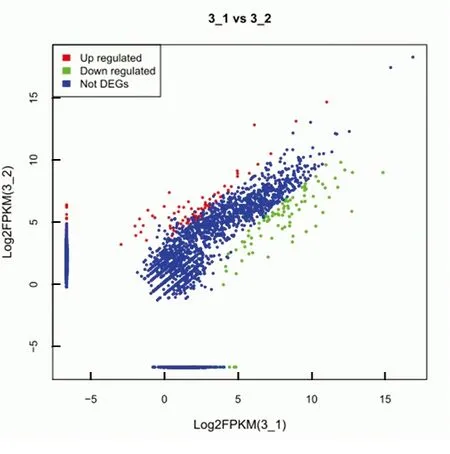
图2 基因表达量散点图
Figure 2 The difference in basic table scattering amount scattering

表1 表达显著升高的基因列表Table 1 The list of highly expressed genes
注:Fisher精确检验
3 讨 论
生物被膜是细菌微生物的聚合体,它可以不可逆地黏附在医疗器械或者人体组织的表面,包埋入自身分泌产生的细胞外基质中。主要包括细胞外多糖、蛋白质、细胞外核酸以及其他基质[4]。对于鲍曼不动杆菌来说,常常会形成难以清除的生物被膜,这是其慢性长期定植于人体组织和持续存在于各类患者体内置管中的重要原因[5]。此外,生物被膜还与菌株多药耐药特性有关,生物被膜内的菌体更耐不利的外环境和各种抗生素[6]。鲍曼不动杆菌对抗生素耐药主要是由于菌体生物被膜的生成[7]。
生物被膜的生成,主要经历3个阶段:初始黏附、细胞外基质分泌结构形成及生物被膜成熟[8]。此外,细菌生物被膜的形成需要复杂的信号因子调控以及多种蛋白参与其中[9]。生物被膜初始黏附,起始步骤就是需要黏附于一个生物或者非生物的表面,这是细菌侵犯机体造成感染的先决条件,也是细菌生物被膜形成的先决条件。细菌菌体的黏附主要靠蛋白和菌毛的介导,通过非特异电引力或者疏水作用促进细菌的黏附,此阶段是可逆的黏附[10]。随后,细菌分泌大量细胞外基质及信号调控因子,促使细菌与黏附表面之间形成不可逆的牢固结合[11]。在随后的生物被膜生长和形态维持过程中,信号因子的调控起着十分重要的作用,如群体感应系统会感应被膜内细菌释放的特定信号因子,这些信号因子及其特异的感应受体在菌体内部和菌落细菌之间进行信号交流,调控生物被膜菌落的基因和蛋白表达。在细菌启动初始黏附阶段,需要CsuA/B/C/D家族的显著表达,帮助促进菌体的初始黏附。此外,这些基因还会作为特殊的信号系统,调控细菌生物被膜的生长和形态维持。目前,多药耐药鲍曼不动杆菌以生物被膜形式广泛存在,难以清除;但是有关生物被膜形成能力与被膜维持所需相关基因调控仍不明确[12]。
细菌生物被膜的形成,使得菌体可以在不利的环境下长期存活,造成了鲍曼不动杆菌在人体组织慢性定植和感染反复发生。细菌的生物被膜状态,不单单只是细菌在不同生长阶段的简单混合物,而是具有自己独特蛋白质表型和特殊的生物学特性。生物被膜的生成、形态维持是通过特殊通路和信号因子启动以及复杂信号网络调控的。细菌从浮游状态到生物被膜内菌株固着状态是一系列复杂的过程,需要启动状态转换,形成足够密度的菌落、适宜的阳离子浓度、特殊的信号转导机制,启动其转换模式。但大多机制不明。
本研究结果显示,生物被膜状态下,CsuA/B/C/D基因表达是显著升高的。说明其在生物被膜生成和形态维持中发挥着极其重要的作用。细菌生物被膜形成中,菌体的初始黏附需要依赖CsuA/B/C/D基因的显著表达[13]。生物被膜在形成过程中,初始黏附以及随后发生的基质分泌、被膜逐渐成熟、形成不可逆黏附均需要复杂的信号网络调控,且这些基因表达需要时序性调控,其中CsuA/B/C/D基因会介导菌毛产生增加,帮助生物被膜黏附和成熟[14]。菌毛是细菌菌体表面类毛发样物质,它可以帮助菌体识别非生物表面、宿主黏膜受体及其他黏附表面[15-16]。若是使上述基因钝化或者失活,就会出现菌毛缺失、细菌生物被膜生成受限、菌体黏附受到抑制[17]。因此,CsuA/B/C/D基因的显著表达启动了菌体生物被膜形成的初始黏附,使得菌体可以不可逆地黏附于生物表面或医疗器械的表面,这是生物被膜生成的决定性因素,也是鲍曼不动杆菌长期存活、广泛传播的决定性因素。CsuA/B/C/D基因是菌毛生成增加的开启操纵子。
细菌生物被膜的生成依赖于菌毛的生物合成,需要CsuA/B/C/D基因介导,CsuA/B/C/D基因还介导菌体分泌表面活性物质和细胞外基质,这些是生物被膜形成早期阶段所必需的[18]。此外,Csu基因簇还与鲍曼不动杆菌致病力和毒力相关[19]。相比于浮游状态的细菌,生物被膜固着状态的菌株更加耐药,具有更强的致病力[15]。由于生物被膜的生成,被膜内菌落间、菌落内细菌间联系和信号交换更加频繁,细胞外DNA及基质间物质交换,使得生物被膜内的菌落更容易发生质粒或耐药基因的转移,生物被膜内的菌体耐药性更强[20-21]。因此,生物被膜使得鲍曼不动杆菌更加耐药,具有更强的致病力,能够生成更长时间,导致院内感染反复发生[22-24]。进一步地深入研究Csu基因簇在生物被膜形成和形态维持中的作用和机制,可以为今后治疗多耐药鲍曼不动杆菌定植提供新的方向。
[1] Santajit S,Indrawattana N. Mechanisms of antimicrobial resistance in ESKAPE pathogens[J]. Biomed Res Int,2016,2016:2475067.
[2] Peleg AY,Seifert H,Paterson DL. Acinetobacter baumannii:emergence of a successful pathogen[J]. Clin Microbiol Rev,2008,21(3):538-582.
[3] Antunes LC,Visca P,Towner KJ. Acinetobacter baumannii evolution of a global pathogen[J]. Pathog Dis,2014,71(3):292-301.
[4] Rodríguez-Bao J,Martí S,Soto S,et al. Biofilm formation in acinetobacter baumannii:associated features and clinical implications[J]. Clin Microbiol Infect,2008,14(3):276-278.
[5] Pletzer D,Mansour SC,Wuerth K,et al. New mouse model for chronic infections by gram-negative bacteria enabling the study of anti-infective efficacy and host microbe interactions[J]. Mbio,2017,28(1):14-17.
[6] Lee HW,Koh YM,Kim J,et al. Capacity of multidrug resistant clinical isolates of acinetobacter baumannii to form biofilm and adhere to epithelial cell surfaces[J].2008,14(1):49-54.
[7] Lin MF,Lan CY. Antimicrobial resistance in Acinetobacter baumannii:From bench to bedside[J]. World J Clin Cases,2014,2(12):787-814.
[8] Wang Y,Wilks JC,Danhorn T,et al. Phenazine-1-carboxylic acid promotes bacterial biofilm development via ferrous iron acquisition[J]. J Bacterial,2011,193(14):3606-3617.
[9] Gaddy JA,Actis LA. Regulation of Acinetobacter baumannii biofilm formation[J]. Future Microbiol,2009,4(3):273-278.
[10] Domenech de Cellès M,Salomon J,Marinier A,et al. Identifying more epidemic clones during a hospital outbreak of multidrug-resistant Acinetobacter baumannii[J]. PLoS One,2012,7(9):e45758.
[11] Espinal P,Martí S,Vila J. Effect of biofilm formation on the survival of acinetobacter baumannii on dry surfaces[J]. J Hosp Infect,2012,80(1):56-60.
[12] 刘原,柯蕊,杨妮,等.呼吸道分离鲍曼不动杆菌生物被膜形成能力与耐药性关系的研究[J].中国实验诊断学,2015,19(8):1243-1246.
[13] Tomaras AP,Dorsey CW,Edelmann RE,et al. Attachment to and biofilm formation on abiotic surfaces by acinetobacter baumannii:involvement of a novel chaperone usher pili assembly system[J]. Microbiology,2003,149(Pt 12):3473-3484.
[14] Tomaras AP,Flagler MJ,Dorsey CW. Characterization of a two component regulatorty system from Acinetobacter baumannii that controls biofilm formation and cellular morphology[J]. Microbiology,2008,154(Pt 11):3398-3409.
[15] Pakharukova N,Tuittila M,Paavilainen S,et al. Crystallization and preliminary X-ray diffraction analysis of the Csu pili CsuC-CsuA/B chaperone major subunit pre-assembly complex from Acinetobacter baumannii[J]. Acta Crytalloqr F Struct Boil Commun,2015,71(Pt 6):770-774.
[16] Perez LR. Acinetobacter baumannii displays inverse relationship between meropenem resistance and biofilm production[J]. J Chemother,2015,27(1):13-16.
[17] Liou ML,Soo PC,Ling SR,et al. The sensor kinase BfmS mediates virulence in Acinetobacter baumannii[J]. J Microbiol Immunol Infect,2014,47(4):275-281.
[18] Kostoulias X,Murray GL,Cerqueira GM,et al. Impact of a cross kingdom signaling molecule of candida albicans on Acinetobacter baumannii physiology[J]. Antimicrob Agents Chemother,2015,60(1):161-167.
[19] Cornejo-Jurez P,Vilar-Compte D,Pérez-Jimenez C,et al. The impact of hospital acquired infections with multidrug resistant bacteria in an oncology intensive care unit[J]. Int J Infect Dis,2015,31:31-34.
[20] Selasi GN,Nicholas A,Jeon H,et al. Differences in bifilm mass,expression of biofilm associated genes,and resistance to desiccation between epidemic and sporadic clones of carbapenem resistant acinetobacter baumannii sequence type 191[J]. PLoS One,2016,11(9):e0162576.
[21] Martins N,Picão RC,Adams-Sapper S,et al. Association of class 1 and 2 integrons with multidrug resistant Acinetobacter baumannii international clones and Acinetobacter nosocomialis isolates[J]. Antimicrob Agents Chemother,2015,59(1):698-701.
[22] Luo TL,Rickard AH,Srinivasan U,et al. Association of blaOXA-23 and bap with the persistence of Acinetobacter baumannii within a major healthcare system[J]. Front Microbiol,2015,6:182.
[23] De Gregorio E,Roscetto E,Iula VD,et al. Development of a real-time PCR assay for the rapid detection of Acinetobacter baumannii from whole blood samples[J]. New Microbiol,2015,38(2):251-257.
[24] 孙静娜,刘青松,刘泽世,等.多重耐药及泛耐药鲍曼不动杆菌外排泵基因adeB的研究[J].河北医科大学学报,2014,35(10):1166-1169.
(本文编辑:许卓文)
Genomics studies the role of the Csu cluster in the biofilm formation
LI Hai-tao, ZHANG Lu-tao, LI Shuai, WANG Bo-li, QI Tian-jie, LI Hong-lin
(TheFirstDepartmentofRespiratoryMedicine,theSecondHospitalofHebeiMedicalUniversity,Shijiazhuang050000,China)
Objective To study the role of Csu cluster in the biofilm formation of the multidrug resistant Acinetobacter baumannii by genomics. Methods The bacteria were selected from the clinical laboratory of our hospital. The rapidly growth period and biofilm stage were obtained. The mRNA of the two different stages were extracted and sequenced. Compared the gene sequence with the public database, we found the differences in gene expression. Results There were significant differences in the expression of genes between the two strains in the rapid growth phase and biofilm stage of the same strain. In the biofilm state, the expression of 106 genes was up-regulated in the cells with rapid growth phase, in which the expression of CsuA/B/C/D gene cluster was significantly increased, and the expression of 92 genes was down regulated. Conclusion The Csu cluster played an important role in biofilm formation and maintenance. In the formation of biofilm, the initial adhesion of the cells required significant expression of the Csu A/B/C/D. The Csu cluster mediated the biosynthesis of pili and the secretion of extracellular matrix, which were necessary for the early stages of the biofilm formation.
Acinetobacter baumannii; drug resistance, multiple; genetic testing
2017-04-07;
2017-05-05
河北省医学科学研究重点课题(ZL20140206,20130503)
李海涛(1983-),男,河北南宫人,河北医科大学第二医院副主任医师,医学硕士,从事呼吸疾病诊治研究。
R378.79
A
1007-3205(2017)08-0869-04
10.3969/j.issn.1007-3205.2017.08.001
