普通小麦-欧山羊草异附加系对干旱胁迫的生理生化响应
2017-08-16宋利强李俊明
赵 慧,宋利强,张 玮,李俊明,纪 军
(1.河北科技大学生物科学与工程学院,河北石家庄 050018; 2.中国科学院遗传与发育生物学研究所农业资源研究中心,河北石家庄 050021)
普通小麦-欧山羊草异附加系对干旱胁迫的生理生化响应
赵 慧1,宋利强2,张 玮2,李俊明2,纪 军2
(1.河北科技大学生物科学与工程学院,河北石家庄 050018; 2.中国科学院遗传与发育生物学研究所农业资源研究中心,河北石家庄 050021)
为探究异源染色体对小麦抗旱能力的影响,选取3个普通小麦-欧山羊草异附加系和3个普通小麦为试验材料,以聚乙二醇(PEG6000)模拟干旱胁迫,在苗期测定干旱胁迫下叶片丙二醛(MDA)积累量、可溶性蛋白含量和酶促防御系统(SOD、POD和CAT)活性变化。结果表明,随着干旱胁迫程度的加重和时间的延长,供试基因型所测定的五个生理指标的变化趋势较为一致。MDA含量都不断升高,三个普通小麦-欧山羊草异附加系(Ae9013、Ae9041和Ae9061)的MDA积累幅度较抗旱性最好的小麦对照晋麦47小,积累量也较少。三个异附加系的可溶性蛋白含量受干旱胁迫影响较小,虽有小幅度的下降,但保持着较高的含量。干旱胁迫下,各基因型的SOD、POD和CAT活力增加,在一定时间内,随着干旱胁迫的持续,晋麦47表现出先上升后下降的趋势,而Ae9013、Ae9041和Ae9061的SOD和POD活力随着胁迫程度的加重和时间的延长呈现不断上升趋势;Ae9013、Ae9041的CAT活力在15% PEG6000胁迫下不断增加,在25% PEG6000胁迫下先增加后下降,而Ae9061的CAT活力在高浓度PEG6000胁迫下仍持续增加。由此可见,普通小麦-欧山羊草异附加系具备更有效的酶促防御系统和渗透调节能力,说明U组染色体附加提高了小麦的抗旱能力。
小麦;欧山羊草;异附加系;干旱胁迫;酶促防御系统
小麦(TriticumaestivumL.)是我国北方干旱半干旱地区的支柱作物。在影响小麦生长的诸多因素中,干旱已成为最主要的环境胁迫因素之一[1],创制和筛选抗旱性强的小麦品种是应对干旱问题的有效手段,有利于保障我国粮食安全和生态环境的可持续发展。深入了解植物抗旱性的生理生化基础,对选择和培育抗旱性种质材料至关重要[2]。欧山羊草(AegilopsbiuncialisVis.)是小麦近缘种属之一,长期生长在高温和高光照的地中海和西亚地区[3],因其优良的抗旱性近年来备受关注[4-5],已通过远缘杂交选育出了一批抗旱能力显著提高的小麦-欧山羊草双二倍体和异附加系,但对其抗旱性提高的生理生化机制研究甚少。
小麦一生中会遇到各种逆境胁迫,长期的进化形成了天然的抵御逆境的响应机制,有效的抗氧化能力和渗透调节能力是其应对干旱胁迫的重要生理机制[6-7]。植物组织可溶性蛋白含量反映了细胞内蛋白质合成、变性及降解等情况,可作为一类重要的渗透调节物质在干旱胁迫下发挥作用。超氧化物歧化酶(superoxide dismutase,SOD)是抗氧化酶促防御系统中的核心酶类,干旱胁迫下小麦体内SOD活力升高,抗旱性强的品种在受到干旱胁迫后SOD活力上升幅度高于干旱敏感型[8-9]。过氧化物酶(peroxidase,POD)作为细胞内清除活性氧类物质(reactive oxygen species,ROS)的重要酶,和SOD协同作用抵御干旱胁迫[10]。干旱胁迫下形成的H2O2主要通过过氧化氢酶(catalase,CAT)催化分解[11]。干旱胁迫会引起CAT活力上升,并且抗旱品种的CAT活力要高于干旱敏感型[12]。由此可见,抗氧化酶促防御系统的活性依赖于基因型[13],抗旱性强的基因型的抗氧化酶促防御系统活力较高,植物组织清除活性氧的能力较强,膜脂过氧化产物丙二醛(molondialdehyde,MDA)的积累量较少[14-15],对细胞的伤害作用较轻,渗透调节能力较强,从而使细胞器和膜系统维持稳定,保持细胞水分代谢平衡。因此,研究干旱胁迫下小麦不同基因型的生理生化指标变化,有利于明晰其生理响应机制,并为小麦抗旱遗传育种工作筛选优异种质资源。
本研究以三个附加U组染色体的普通小麦-欧山羊草异附加系Ae9013、Ae9041和Ae9061为供试材料,以黄淮麦区旱地品种晋麦47和节水品种石4185作对照,利用聚乙二醇(Polyethylene glycol,PEG6000)模拟干旱胁迫,通过测定与抗旱相关的生理生化指标,评价欧山羊草U组染色体在提高小麦抗旱能力方面的贡献,并初步探索普通小麦-欧山羊草异附加系对干旱响应的生理生化机制,以期为小麦抗旱性遗传改良筛选优良种质材料。
1 材料与方法
1.1 试验材料
普通小麦-欧山羊草杂交后代株系3个,分别为Ae9013、Ae9041和Ae9061。前期细胞学鉴定结果表明,Ae9013附加一对7Ub染色体,Ae9041和Ae9061各附加一对6Ub染色体。普通小麦对照3个,分别为上述普通小麦-欧山羊草杂交后代的亲本中国春(Chinese Spring,CS)、旱地品种晋麦47(JM47)和节水品种石4185(S4185)。
1.2 种子萌发
各供试材料分别选取500粒完整种子,先用0.01%的升汞表面消毒10 min,再用蒸馏水冲洗数次,洗净后置于培养皿中,在25 ℃培养箱中培养。每天光照时长16 h,黑暗时长8 h。
1.3 幼苗培养
待小麦长至一叶一心时,选取长势一致的幼苗转移到生长钵中,用Hoagland营养液培养。生长条件为:温度22 ℃±2 ℃、湿度50%,每天光照时长16 h,黑暗时长8 h。每5天换一次营养液,待培养至五叶期开始干旱胁迫处理。
1.4 试验处理
利用PEG6000(Sigma)模拟干旱胁迫。用双蒸水和PEG6000配置三个梯度的处理液,即0(T0)、15%(T1)、25%(T2)。各胁迫处理持续6 d,分别在第3天和第6天选取供试材料的新鲜叶片进行各项生理生化指标测定,3次重复。需要说明的是,25% PEG6000胁迫6 d时,中国春和石4185叶片已衰老死亡,不再进行各项指标的测定。
1.5 测定项目及方法
1.5.1 测定项目
本研究测定的生理生化指标为MDA含量、可溶性蛋白含量及SOD、POD和CAT活力。
1.5.2 测定方法
样品准备:在小麦五叶期选取完全伸展的倒二叶中段(去除叶脉),称取0.3 g鲜重,剪碎后液氮迅速研碎,加入1.5 mL 0.1 mol·L-1(pH 7.8)的磷酸缓冲液,振荡混匀,在4 ℃、10 000 r·min-1离心20 min,上清液即为酶提取液。
对制得的酶提取液,依次按南京建成生物工程研究所的《考马斯亮蓝蛋白测定试剂盒》、《丙二醛(MDA)测定试剂盒》、《总超氧化物歧化酶(T-SOD)测定试剂盒》、《植物中过氧化物酶(POD)测定试剂盒》、《过氧化氢酶(CAT)测定试剂盒》说明书进行测定,3次重复,每次2个平行,取平均值。
1.6 统计分析
采用Excel 2003和SPSS 20.0软件进行数据统计分析和差异显著性检验。
2 结果与分析
2.1 MDA含量对干旱胁迫的响应
从图1可以看出,干旱胁迫条件下,各基因型叶片MDA含量不断增加,表明干旱胁迫破坏了质膜结构,膜脂过氧化程度因干旱胁迫逐渐加剧,不同基因型间的膜脂过氧化水平存在差异。

T0-3、T1-3、T2-3表示在PEG6000浓度分别为0、15%、25%条件下处理3 d;T0-6、T1-6、T2-6表示在PEG6000浓度分别为0、15%、25%条件下处理6 d;图注上方不同小写字母代表不同基因型之间的差异在0.05水平上显著。下同。
T0-3,T1-3 and T2-3:Three days under 0,15% and 25% PEG6000,respectively; T0-6,T1-6 and T2-6:Six days under 0,15% and 25% PEG6000,respectively;Different small letters above columns mean significant difference among different genotypes at 0.05 level.The same in other figures.
图1 干旱胁迫下各基因型叶片丙二醛含量的变化
Fig.1 Changes of molondialdehyde content in the leaves of tested genotypes under drought stress
正常水分条件下,各供试基因型的MDA含量较低(图1)。干旱胁迫3 d时,15%和25%两种PEG6000处理下亲本CS的MDA含量都表现出最大的增加幅度,JM47和S4185次之,三个普通小麦-欧山羊草后代MDA含量的增加幅度较小,尤以Ae9061的MDA含量最低。干旱持续至6 d时,15% PEG6000胁迫处理下,三个普通小麦对照品种的MDA积累量都高于普通小麦-欧山羊草异附加系后代,其中,与Ae9061的差异达到显著水平(P<0.05)。25% PEG6000胁迫下,JM47的丙二醛含量显著高于小麦-欧山羊草异附加系后代(P<0.05)。
干旱胁迫下,亲本中国春的MDA含量升高幅度最大,表明该基因型叶片膜脂过氧化程度高,细胞膜系统的结构受破坏严重,叶片功能损伤程度较重。尤其是在较重的干旱胁迫(T2-6)下,CS完全死亡。而附加欧山羊草U组染色体的异附加系后代则表现出很强的应对干旱胁迫的能力,特别是Ae9061,其MDA积累量较低,表明质膜较为稳定,受干旱胁迫的破坏程度较弱。
2.2 叶片可溶性蛋白含量对干旱胁迫的响应
由图2可知,正常水分条件下,6个供试基因型叶片可溶性蛋白含量无显著差异;随着干旱胁迫程度的加重和时间的延长,各基因型小麦叶片可溶性蛋白含量均呈下降趋势,但不同基因型因胁迫时间和胁迫程度下降的幅度存在差异。
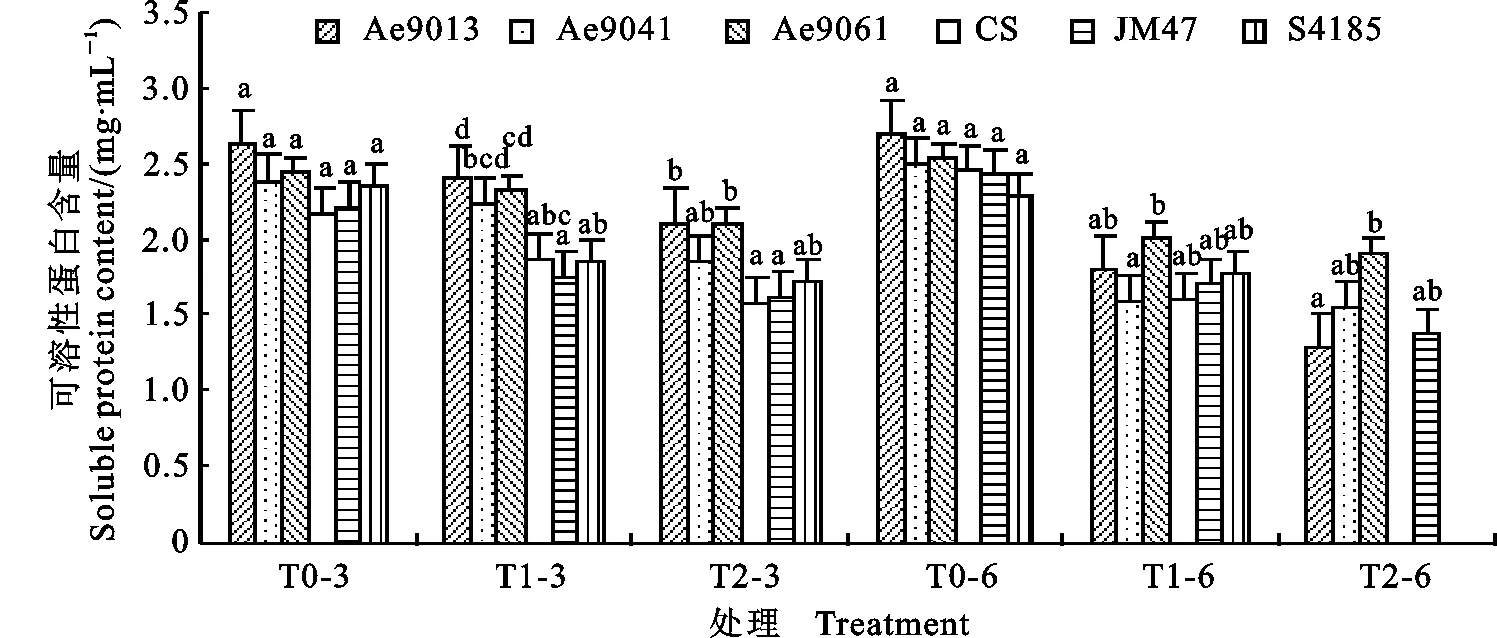
图2 干旱胁迫下各基因型叶片可溶性蛋白含量的变化Fig.2 Changes of soluble protein content in the leaves of tested genotypes under drought stress
干旱胁迫3 d时,15% PEG6000处理(T1-3)下,各基因型的可溶性蛋白含量下降,但Ae9013、Ae9041和Ae9061的可溶性蛋白含量显著高于旱地品种JM47(P<0.05),Ae9013和Ae9061的可溶性蛋白含量也显著高于节水品种S4185(P<0.05);25% PEG6000处理(T2-3)下,各基因型可溶性蛋白含量的下降幅度高于T1-3处理时下降幅度。其中,亲本CS下降幅度最大,其可溶性蛋白含量显著低于Ae9013和Ae9061(P<0.05);Ae9013和Ae9061的可溶性蛋白含量显著高于JM47(P<0.05),而与S4185差异不显著。两种不同程度干旱处理下,Ae9013和Ae9061的可溶性蛋白含量下降幅度都低于对照小麦品种S4185和JM47,且 Ae9061下降幅度最小。
干旱胁迫延长至6 d时,各基因型的叶片可溶性蛋白含量持续下降,两种干旱梯度处理下,Ae9061的可溶性蛋白含量最高,且下降幅度最小(T1-6为20.9%,T2-6为25.1%)。

图3 干旱胁迫下各基因型叶片SOD活力的变化Fig.3 Changes of SOD activity in the leaves of tested genotypes under drought stress
2.3 叶片保护酶系统对干旱胁迫的响应
2.3.1 干旱胁迫下叶片SOD活力的变化
图3展示了苗期各基因型叶片SOD活力的变化情况。总体来看,干旱胁迫下植物体内SOD受诱导后合成增加,但各基因型的SOD活力变化趋势不尽相同。Ae9013、Ae9041和Ae9061的SOD活力随着胁迫时间的延长和胁迫程度的加重不断升高,而CS、JM47和S4185的SOD活力变化较复杂。
干旱胁迫3 d时,各基因型SOD活力较对照都有上升,且随着胁迫程度的加重,除亲本CS外,SOD上升幅度增大。15% PEG6000胁迫下CS的SOD活力高于25% PEG6000胁迫,可能是由于较轻程度的水分缺失会使CS体内产生SOD来抵御胁迫,但较重的干旱胁迫超过其忍耐程度导致SOD合成下降。随着干旱胁迫时间的延长,PEG6000处理6 d时两种胁迫处理下各基因型的SOD活力较对照(T0-6)上升幅度较大,特别是三个小麦-欧山羊草异附加系的SOD活力上升迅速,变化幅度高于JM47和S4185,其中Ae9013上升幅度最大,其次是Ae9061。
2.3.2 干旱胁迫下叶片POD活力的变化
干旱胁迫下,各基因型的叶片POD活力较对照呈升高的趋势(图4)。干旱胁迫3 d时,除JM47外,其余基因型的POD活力随胁迫程度的加重而逐步升高,但基因型间差异未达到显著水平。随着胁迫时间的延长,除JM47外,其他5个基因型在15% PEG6000胁迫6 d(T1-6)时的POD活力都高于胁迫3 d时(T1-3);25% PEG6000胁迫6 d(T2-6)时,仍然存活的三个异附加系和对照JM47的POD活力都高于T2-3,且三个异附加系的POD活力上升幅度高于JM47。
2.3.3 干旱胁迫下叶片CAT活力的变化
由图5可知,各基因型的叶片CAT活力在干旱胁迫下呈现上升趋势,但持续的水分胁迫在不同的基因型中引发了各自不同的响应曲线。
干旱胁迫3 d时,除晋麦47和石4185外,其他基因型的CAT活力都随胁迫程度的加重而逐步升高,15% PEG6000胁迫下JM47上升幅度最大(68.1%),但与Ae9061无显著差异;25% PEG6000胁迫下,Ae9013、Ae9061和 Ae9041的CAT活力上升幅度高于三个小麦对照品种,以Ae9013最高,显著高于S4185(P<0.05)。
干旱胁迫6 d时,15% PEG6000胁迫下JM47的CAT活力上升幅度最大(78.7%),这与胁迫3 d时表现一致,说明CAT活力的增加是JM47耐旱性强的主要生理基础之一;CS的CAT活力最低,显著低于Ae9013(P<0.05)。25% PEG6000胁迫下Ae9061的CAT活力上升幅度最大(94.2%),较其他三个基因型(Ae9013、Ae9061和JM47)表现出显著提高的CAT活力(P<0.05),说明持续重度干旱胁迫下Ae9061通过增加CAT活力提升清除H2O2的能力,以适应干旱逆境。

图4 干旱胁迫下各基因型叶片POD活力的变化Fig.4 Changes of POD activity in the leaves of tested genotypes under drought stress
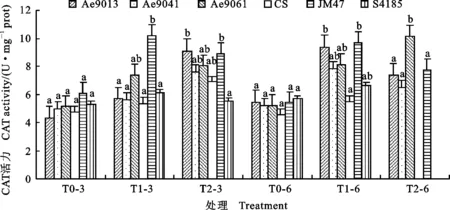
图5 干旱胁迫下各基因型叶片CAT活力的变化Fig.5 Changes of CAT activity in the leaves of tested genotypes under drought stress
3 讨 论
小麦的抗旱性是多水平、多指标的综合表现[16]。在评价小麦抗旱能力的诸多指标中,MDA积累、可溶性蛋白含量变化、SOD、POD、CAT等酶活性变化已成为研究热点,并作为抗旱能力的评价指标[17-18]。本研究中,各基因型叶片MDA在干旱胁迫下不断积累,这和前人研究结果一致[19-20],但三个普通小麦-欧山羊草异附加系的MDA积累量始终低于晋麦47和石4185,表明异附加系因干旱造成的膜脂伤害程度较低,质膜结构较为稳定,具有较强的抗旱能力。同时,可溶性蛋白作为重要的渗透调节物质,受干旱影响含量有下降趋势,但三个普通小麦-欧山羊草异附加系的可溶性蛋白含量降幅较小,表明它们受到干旱胁迫的影响较小,渗透调节能力较强,能有效地应对逆境胁迫。特别是在持续的干旱胁迫条件下,Ae9061叶片可溶性蛋白含量较高,且下降幅度最低,这表明Ae9061通过保持较高的可溶性蛋白含量来调节细胞水分代谢平衡,显示出较强的抵御干旱胁迫的能力。本研究还发现随着胁迫时间的延长和程度的加重,三个普通小麦-欧山羊草异附加系的SOD和POD活力明显高于抗旱对照品种晋麦47;25% PEG6000持续干旱胁迫引起Ae9013、Ae9041和晋麦47的CAT活力先升高后下降,而Ae9061的CAT活力依旧保持上升趋势,显示了Ae9061具有突出的催化H2O2降解的能力。因此,普通小麦-欧山羊草异附加系较当前生产上应用的节水耐旱品种具有更强的抗旱能力。
综合本研究结果,普通小麦-欧山羊草异附加系在遭遇干旱胁迫后酶促保护系统活力大幅增强,较好地维持了细胞内活性氧的产生与清除的平衡,膜系统受自由基损害较轻,膜脂过氧化程度和可溶性蛋白降解程度较低。即普通小麦-欧山羊草异附加系通过较高活性的酶促防御系统和较强的渗透调节能力来积极应对干旱胁迫。可见,附加欧山羊草U组染色体的普通小麦-欧山羊草后代具有较强抗旱能力。其中,普通小麦-欧山羊草异附加系Ae9061在干旱胁迫来临时表现出最高的可溶性蛋白含量和最低MDA含量,特别在受旱严重时,SOD、POD和CAT活力上升幅度较大,抵御干旱胁迫的能力突出,可作为小麦抗旱遗传育种的种质资源。
[1]ARAUS J L,SLAFER G A,REYNOLDS M P,etal.Plant breeding and drought in C3cereals:What should we breed for? [J].AnnalsofBotany,2002,89(7):925.
[2]CHAVES M M,MAROCO J P,PEREIRA J S.Understanding plant responses to drought-from genes to the whole plant [J].FunctionalPlantBiology,2003,30(3):240.
[3]BAALBAKI R,HAJJ-HASSAN N,ZURAYK R.Species from semiarid areas of Lebanon:Variation in quantitative attributes under water stress [J].CropScience,2006,46(2):800.
[4]MOLNAR I,GASPAR L,SARVARI E,etal.Physiological and morphological responses to water stress inAegilopsbiuncialisandTriticumaestivumgenotypes with differing tolerance to drought [J].FunctionalPlantBiology,2004,31(12):1156.
[5]ZHAO H,ZHANG W,WANG J,etal.Comparative study on drought tolerance of wheat and wheat-Aegilopsbiuncialis6Ubaddition lines [J].JournalofFood,Agriculture&Environment,2013,11(3&4):1050.
[6]CHAVES M M,MAROCO J P,PEREIRA J S.Understanding plant responses to drought-from genes to the whole plant [J].FunctionalPlantBiology,2003,30(3):251.
[7]JALEEL C A,MANIVANNAN P,KISHOREKUMAR A,etal.Alterations in osmoregulation,antioxidant enzymes and indole alkaloid levels inCatharanthusroseusexposed to water deficit [J].ColloidsandSurfacesB:Biointerfaces,2007,59(2):151.
[8]SAIRAM R K,SRIVASTAVA G C.Water stress tolerance of wheat (TriticumaestivumL.):Variations in hydrogen peroxide accumulation and antioxidant activity in tolerant and susceptible genotypes [J].JournalofAgronomy&CropScience,2001,186(1):67.
[9]BANO A,ULLAH F,NOSHEEN A.Role of abscisic acid and drought stress on the activities of antioxidant enzymes in wheat [J].PlantSoilEnvironment,2012,58(4):184.
[10]ALI A,ARSHAD M,NAQVI S M S,etal.Exploitation of synthetic-derived wheats through osmotic stress responses for drought tolerance improvement [J].ActaPhysiologiaePlantarum,2014,36(9):2463.
[11]GUPTA S D.Reactive Oxygen Species and Antioxidants in Higher Plants [M].New York:Science Publishers,2011:129.
[12]HUSEYNOVA I M,ALIYEVA D R,MAMMADOV A C,etal.Hydrogen peroxide generation and antioxidant enzyme activities in the leaves and roots of wheat cultivars subjected to long-term soil drought stress [J].PhotosynthesisResearch,2015,125(1-2):279.
[13]HUSEYNOVA I M,NASRULLAYEVA M Y,RUSTAMOVA S M,etal.Differential responses of antioxidative system to soil water shortage in barley(HordeumvulgareL.) genotypes [J].AdvancesinBiologicalChemistry,2014,4(6):356.
[14]TURKAN I,BOR M,OZDEMIR F,etal.Differential responses of lipid peroxidation and antioxidants in the leaves of drought-tolerantP.acutifoliusGray and drought-sensitiveP.vulgarisL.subjected to polyethylene glycol mediated water stress [J].PlantScience,2005,168(1):229.
[15]AL-GHAMDI A A.Evaluation of oxidative stress tolerance in two wheat (Triticumaestivum) cultivars in response to drought [J].InternationalJournalofAgricultureandBiology,2009,11(1):11.
[16]WANG W,VINOCUR B,ALTMAN A.Plant responses to drought,salinity and extreme temperatures:towards genetic engineering for stress tolerance [J].Planta,2003,218(1):2.
[17]ARAGHI S G,ASSAD M T.Evaluation of four screening techniques for drought resistance and their relationship to yield reduction ratio in wheat [J].Euphytica,1998,103(3):293.
[18]SANCHEZ-RODRIGUEZ E,RUBIO-WILHELMI M,CERVILLA L M,etal.Genotypic differences in some physiological parameters symptomatic for oxidative stress under moderate drought in tomato plants [J].PlantScience,2010,178(1):39.
[19]SAIRAM R K,CHANDRASEKHAR V,SRIVASTAVA G C.Comparison of hexaploid and tetraploid wheat cultivars in their responses to water stress [J].BiologiaPlantarum,2001,44(1):91.
[20]OZFIDAN C,TURKAN I,SEKMEN A H,etal.Abscisic acid-regulated responses of aba2-1 under osmotic stress:the abscisic acid-inducible antioxidant defence system and reactive oxygen species production [J].PlantBiology,2012,14(2):343.
Physiological and Biochemical Responses ofTriticumaestivum-AegilopsbiuncialisAddition Lines to Drought Stress
ZHAO Hui1,SONG Liqiang2,ZHANG Wei2,LI Junming2,JI Jun2
(1.College of Biological Science and Engineering,Hebei University of Science and Technology,Shijiazhuang,Hebei 050018,China; 2.Center for Agricultural Resources Research,Institute of Genetics and Developmental Biology,Chinese Academy of Sciences,Shijiazhuang,Hebei 050021,China)
ThreeTriticumaestivum-Aegilops.biuncialisUbaddition lines and three common wheat genotypes (controls) were tested in polyethylene glycol-simulated drought stress to investigate the effect of alien chromosome on drought resistance of wheat at seedling stage. Similar trends in the changes of molondialdehyde content (MDA),soluble protein content,and the activity of enzymatic defensive system were observed in the six tested genotypes with the ever increasing of drought stress intensity and duration. The MDA accumulated continuously in all tested genotypes under drought stress,yet the MDA accumulation in the alien addition lines Ae9013,Ae9041 and Ae9061 were much lower than that in wheat controls. The soluble protein content of alien addition lines was less affected by drought stress,which was higher than that of the wheat controls. The activities of SOD,POD and CAT were increased in all tested genotypes under drought stress. The activities of the enzymatic defense system in the most drought resistant wheat control Jinmai 47,however,were increased firstly and declined slightly along with the lasting of drought stress process. The CAT activities in Ae9013 and Ae9041 were increased continuously under 15% PEG6000 stress,and increased and then decreased under 25% PEG6000 stress. In contrast,the CAT activity of Ae9061 was increased continuously under severe stress gradients. In summary,the three alien addition lines had stronger enzymatic defense system and higher osmotic adjustment potential,which means that U chromosome addition enhanced the drought resistance of common wheat.
TriticumaestivumL.;Aegilopsbiuncialis; Addition line; Drought stress; Enzymatic defensive system
时间:2017-07-07
网络出版地址:http://kns.cnki.net/kcms/detail/61.1359.S.20170707.1816.022.html
2017-02-03
2017-04-03
河北省科技计划项目(15222914);河北科技大学博士科研启动基金项目(QD201419);植物细胞与染色体工程国家重点实验室开放课题(2012-PCCE-KF-01);国家小麦产业体系项目(CARS-03)
E-mail:applecong@126.com
纪 军(E-mail:jijun@sjziam.ac.cn)
S512.1;S311
A
1009-1041(2017)07-0940-07
