小麦白斑突变体I30的特征特性及遗传分析
2017-08-16李倩倩赵秋实蒋宏宝耿皆飞刘录祥张晓燕谢彦周王成社
李倩倩,赵秋实,蒋宏宝,耿皆飞,刘录祥,张晓燕,谢彦周,王成社
(1.西北农林科技大学农学院,陕西杨凌 712100;2.中国农业科学院作物科学研究所,北京 100081)
小麦白斑突变体I30的特征特性及遗传分析
李倩倩1,赵秋实1,蒋宏宝1,耿皆飞1,刘录祥2,张晓燕1,谢彦周1,王成社1
(1.西北农林科技大学农学院,陕西杨凌 712100;2.中国农业科学院作物科学研究所,北京 100081)
类病斑突变体是研究植物程序性死亡和抗病性的理想材料。为了丰富小麦斑点突变体的研究,对叠氮化钠诱变小麦品种陕农33产生的稳定遗传的白斑突变体I30进行了特征特性研究和遗传分析。结果表明,突变体I30从三叶期开始表现白色块斑和长条纹。锥虫蓝染色和DAB染色显示,I30斑点处出现细胞死亡和H2O2积累现象。透射电子显微镜观察表明,I30的叶绿体形状发生改变,数目减少,基粒垛叠高度无序,部分甚至降解。农艺性状调查结果表明,I30的株高、单株有效穗数、穗粒数、穗长和结实率与野生型间无显著差异,但千粒重、穗粒重、单株产量、旗叶长度和宽度显著低于野生型。遗传分析表明,I30由1对隐性核基因控制。利用BSA + 660K基因芯片技术,将该基因定位于小麦6D染色体上,位于SSR分子标记Xcfd190和6DS-5之间,遗传距离分别为6.4 cM和9.1 cM。
小麦;突变体;特征特性;农艺性状;基因定位
斑点突变是一种特殊的叶色突变,通常称之为类病斑突变(lesion mimic mutant)[1],通常伴随叶绿体的降解、光合作用的减弱、光合色素含量的变化,直接减少了植株的光合面积,影响作物产量。研究表明,许多斑点突变体在抗病性方面强于其亲本,对真菌病原体的抗性尤为如此[2-3]。类病斑突变体的表型类似过敏反应(hypersensitive response,HR)[4],即植物在没有任何逆境和病原菌侵染的条件下,叶片自发表现出病斑,这种病斑与植株受病原菌侵染产生的病斑相似,所以称之为类病斑突变体或类病变突变体[5]。类病斑突变体斑点的颜色有白色、黄色、灰白色和褐色,形状大多都是圆点,也有无规则的条纹斑。根据斑点处是否坏死把类病斑突变体分为类病斑坏死突变体和普通斑点叶突变体[6]。存在坏死症状的斑点突变体是研究植物抗病性机制和细胞程序性死亡的理想材料[5]。类病斑突变的产生主要与过敏反应导致程序性细胞死亡(PCD)和活性氧累积有关[4,7-8],也与活性氧累积过程的中间产物(reactive oxygen intermediates,ROIs)、水杨酸(salicylicacid,SA)、茉莉酸(jasmonic acid,JA)和乙烯(ethylene,ET)相关[2]。此外,植物生长过程的环境条件,如光照[9]、湿度[10]、温度[11]和营养状况也对类病斑的产生有影响。
类病斑突变体最早在玉米中发现[12],随后在拟南芥[13]、大麦[14]、水稻[15]等作物上也有报道,对小麦类病斑突变体的研究相对较晚。水稻作为模式植物,被发现的类病斑基因较多,多数已经被成功定位和克隆,如 spl5[16]、 spl7[17]、 spl11[18]、 Oslsd1[19]和 spl28[20]。近几年,小麦类病斑基因的报道也逐渐增多。Li等[21]用Ning 7840/Chokwang的重组自交系将控制Ning 7840黄色病斑性状的隐性基因lm定位在小麦1BL染色体上。Yao等[22]用2个正常的亲本Yanzhan 1/Zaosui 30杂交,得到1个类病斑突变体,该突变体的单株产量和千粒重均比亲本低,由2对命名为 lm1和 lm2的隐性基因控制。Wang等[23]在F1群体中得到1个白斑突变体lm3,该突变体表现为小而离散的白斑,对白粉病有较好的抗性,该基因已经定位到 3BL上。Kamlofski等[24]用化学诱变剂EMS(甲基磺酸乙酯)得到突变体HLP (hypersensitive-like phenotype),该突变体生长到第5或6叶时出现小而散的白色病斑,农艺性状与其亲本无显著差异,但对条锈病抗性较好。斑点叶突变体C591(M8)为显性突变体,当斑点蔓延至整个叶片和叶鞘时其叶绿素含量显著低于野生型,但其产量与野生型无显著差异[25]。Kinane等[26]研究发现,斑点突变体M66的产量虽低,但抗病性广且强。类病斑突变体的表型可以从类似过敏反应到大量的叶绿体缺失或坏死[21]。AIM9是一个叶片萎黄的类病斑突变体,通过透射电镜对其叶绿体结构观察发现,该突变体的叶绿体形状由椭圆形变成了圆形,并发生了不可逆的向心运动[27]。杜丽芬等[28]发现,小麦斑点突变体LF2010在三叶期就表现黄色非坏死斑点,斑点受光照和温度诱导;遗传分析表明,LF2010由1对隐性核基因控制。虽然小麦类病斑突变体的研究已经取得一定的进展,但还不能满足小麦育种研究的需要。
突变体I30是由叠氮化钠诱导小麦品种陕农33获得的1个突变体,具有白斑叶特点,遗传特性稳定。本研究拟对其形态特征、生理和遗传特性进行分析,旨在为其突变基因及其性质的进一步利用奠定基础。
1 材料与方法
1.1 材 料
试验材料为稳定遗传的突变体I30及其野生型陕农33、中国春。于2014年10月种植于西北农林科技大学北校区试验田,行长1.2 m,行宽0.3 m,株距10 cm,各种植3行。
1.2 表型观察
田间条件下,全生育期内对突变体I30与陕农33的表型进行观察并拍照。对突变体I30白斑出现的时间、部位、颜色、形状和大小进行详细记录。
1.3 测定项目与方法
1.3.1 叶片细胞活性的检测
小麦幼苗在光照培养箱中长至三叶期时,随机选取已经表现斑点性状的突变体和陕农33第1叶片,浸泡在煮沸的锥虫蓝染液[29]中,染色 10 min,室温放置 14 h,再用 2.5 g· mL-1水合氯醛(10 mL水中加入25 g水合氯醛)脱色 3~4 d,观察叶片是否被染成蓝色并拍照。染色后的叶片在50%甘油中保存。重复3次。
1.3.2 叶片中H2O2的检测
参考Thordal-Christensen等[30]的方法检测类病斑突变体叶片中H2O2的积累。将温室中表现类病斑的突变体I30的叶片及陕农33的叶片浸泡在1 mg· mL-1的DAB( pH 3.8)中,置于25 ℃下光照8 h后,取出叶片置于96 %的乙醇中煮沸10 min,脱色后将叶片浸泡在新鲜的乙醇中4 h(25 ℃) ,观察叶片中是否出现红褐色沉淀并拍照记录。重复3次。
1.3.3 叶绿体的超微结构观察
在小麦抽穗期气温较低的清晨,分别选取突变体I30含有白斑的叶片及其陕农33的旗叶,参考侯典云[31]的方法制备透射电镜样品、观察叶绿体超微结构。
1.3.4 光合色素含量和光合参数的测量
选取分蘖期、起身期和抽穗期突变体I30及陕农33的旗叶,采用95%的酒精研磨过滤法[32]测定光和色素含量。采用便携式光合测定仪LI-6400测量抽穗期突变体I30和陕农33的净光合速率(Pn)、气孔导度(Gs)、胞间二氧化碳浓度(Ci)和蒸腾速率(Tr)。
1.3.5 农艺性状分析
成熟期随机选取10株突变体I30和陕农33,考察其株高、旗叶长和宽、有效穗数、结实率、穗长、穗粒数、穗粒重、有效分蘖数和千粒重等农艺性状。所有试验数据均采用SPSS 17.0软件进行显著性差异分析。
1.3.6 突变体I30的抗病性分析
选取大小一致的10粒I30和陕农33种子,在培养箱(20 ℃,光照12 h)中培养,当生长到2叶期时,用已经感染白粉病的小麦苗作为病源人工抖接混合白粉菌,在培养箱中培养9~12 d使其充分发病,观察发病情况。
1.4 遗传分析与基因定位
2015年10月分别将突变体I30与中国春、陕农33杂交的F1种子播种于田间并观察其表型。于2015年11月观察F1自交所得F2的表型,统计F2群体的分离比例。从I30与中国春杂交得到的F2群体中选取12株正常植株和12株突变植株,CTAB法[33]提取基因组DNA,并用1%的琼脂糖凝胶电泳检测是否存在DNA降解和RNA污染。把DNA浓度稀释到100 ng· μL-1,等量混合构成正常池和突变池[34],进行660K基因芯片检测。利用Joinmap 4.0和Map Draw V2.1[35]制作遗传图谱。
2 结果与分析
2.1 叶片的表现特征
从三叶期开始,突变体I30的叶片表面先出现形状无规则的白色条纹斑,部分叶片是白色条纹,有些是2~3 cm长的斑块,主要集中在叶基部和中部,叶尖不表现。越冬前随着温度的降低白斑处呈萎蔫状,生长后期白斑延伸到叶鞘和茎秆(图1)。该突变体的病斑表现为条纹斑和斑块,与前人报道的斑点突变类型不同,说明I30突变体可能是一个新的白斑突变类型。
2.2 叶片的细胞活性分析
由图2可知,突变体I30经锥虫蓝染色后,白斑部位明显呈深蓝色,说明突变体I30斑点处的细胞膜被破坏,细胞死亡(图2a)。陕农33经DAB染色后着色很浅,而突变体I30经DAB染色后叶片产生明显的棕红色,斑点所在处颜色更深(图2b),表明突变体I30叶片中H2O2积累较多。H2O2积累过多可能是导致细胞死亡的原因。
2.3 叶片叶绿体超微结构比较
图3显示,陕农33的叶绿体是正常的椭圆形,具有高度分化的基粒类囊体、清晰的片层结构和连接片层的基质类囊体膜(图3a)。突变体I30白斑部位的叶绿体完全降解,只存在较少的线粒体(图3c)。突变体I30绿色部位叶绿体的形态表现不一,部分叶绿体形态较为正常,但是其形状发生改变;有类囊体基粒片层结构,但类囊体排列紊乱(图3d);部分叶绿体形状由椭圆形变为圆形,类囊体基粒层结构不清晰甚至降解(图3b)。说明突变体I30绿色部分的叶绿体也受到了不同程度的影响。
2.4 叶片光合色素含量及其光合参数比较
由表1可知,突变体I30在3个调查阶段的叶绿素a、叶绿素b和总叶绿素含量均低于陕农33,总叶绿素含量较陕农33在分蘖期、拔节期、抽穗期分别降低了25.6%、13%、0.5%,在分蘖期差异极显著。

a:I30苗期;b:陕农33苗期;c:I30拔节期;d:陕农33拔节期;e:I30灌浆期;f:陕农33抽穗期;g:I30茎秆;h:陕农33茎秆;i:陕农33(左)和I30(右)叶片;箭头指向白斑部位。
a:Seedling stage of I30; b:Seedling stage of Shaannong 33; c:Jointing stage of I30; d:Jointing stage of Shaannong 33; e:Grain filling stage of I30; f:Heading stage of Shaannong 33; g:Stems of I30; h:Stems of Shaannong 33; I:Leaf blade of Shaannong 33(left) and I30(right);The white parts are pointed with arrows.
图1 不同的生育阶段突变体I30和陕农33的表型
Fig.1 Phenotype of mutant I30 and Shaannong 33 at different growth stages

a:锥虫兰染色;b:DAB染色;WT:野生型。
a:Trypan staining; b:DAB staining; WT:Wild type.
图2 突变体I30和陕农33叶片的组织化学染色
Fig.2 Histochemical staining of the mutant I30 and Shaannong 33
抽穗期对突变体I30和陕农33光合参数的检测结果(表2)表明,与陕农33相比,突变体I30的净光合速率降低了27.48%,差异显著;胞间CO2浓度增加7.22%,差异显著;气孔导度下降4.49%,蒸腾速率提高1.85%,差异均不显著。说明突变体I30的光合特性与其野生型有较大差异。
2.5 主要农艺性状比较
从表3可知,突变体I30和陕农33的株高、有效穗数、穗长、穗粒数、有效分蘖数和结实率之间无显著性差异,但在旗叶长度和宽度、穗粒重、单株产量和千粒重之间存在显著差异。结合2.4结果,说明I30突变体的白斑主要影响了叶片的大小和光合能力,进而影响植株的光合产物积累和作物的产量形成。
2.6 抗病性比较
由图4可知,突变体I30和陕农33的叶片均感染了白粉菌,但是突变体I30叶片上的病斑较少,说明突变体I30的白粉病抗性强于其野生型。
2.7 突变体I30的遗传分析及基因定位
由表4可知,I30×中国春和I30×陕农33两个组合的正反交F1表现一致,说明该突变基因是核基因变异;F1未表现突变性状,表明该突变基因属于隐性突变;F2群体中突变型与野生型的分离比符合3∶1的比例,说明该突变性状由一对基因决定。由此可见,I30突变体的白斑性状是由一对隐性核基因控制的。
染色体定位结果表明,突变基因 I30位于小麦于6D染色体上。用18对均匀分布6D染色体上的SSR引物对2个亲本和混合池进行多态性筛选。结果发现,有5个SSR标记(Xcfd33、Xbarc196、Xbarc273、Xgwm325和Xbarc175)在亲本间存在多态性。用I30×中国春的214 株F2单株验证这些标记,结果表明, I30基因位于Xbarc196和Xgwm325之间(图5),遗传距离分别为11.6 cM和12.1 cM。 由于这两个标记在6D染色体的短臂上,由此推断 I30基因也位于6D染色体的短臂上。在Xbarc196和Xgwm325两个标记之间进一步搜索和设计SSR标记,加密到遗传距离6.4 cM(Xcfd190)和9.1 cM(6DS-5)。遗传图谱见图6,最终得到的8个遗传标记引物见表5。

a:陕农33;e:a的放大部分;c:I30的白斑部位;b和d:I30的正常部位。CP:叶绿体;PG:质体小球;CW:细胞壁;G:基粒;S:基质;ST:基质类囊体;Mt:线粒体。
a:Shaannong 33; e:An enlarged image showing partial of a; c:White stripe of I30; b and d:Green parts of I30; CP:Chloroplast; PG:Plastoglobule; CW:Cell wall; G:Grana; S:Stroma; ST:Stroma thylakoid; Mt:Mitochondrion.
图3 突变体I30和陕农33的叶绿体观察
Fig.3 Chloroplast ultrastructure of mutant I30 and Shaannong 33
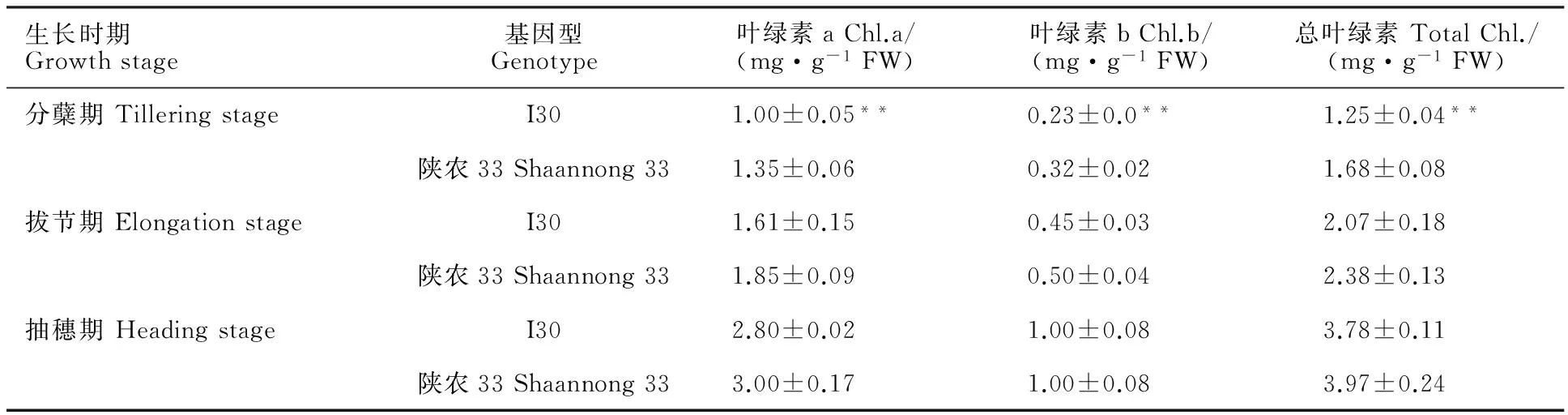
表1 不同生长时期突变体I30和陕农33的叶绿素含量Table 1 Chlorophyll content of mutant I30 and Shaannong 33 at different growth stages
数据为3次重复平均值±标准差。**:突变体与野生型之间存在极显著差异(P<0.01)。下同。
Data are shown as mean±SD of 3 replicates. **:Highly significant difference between mutant and the wild type at 0.01 level.The same below.
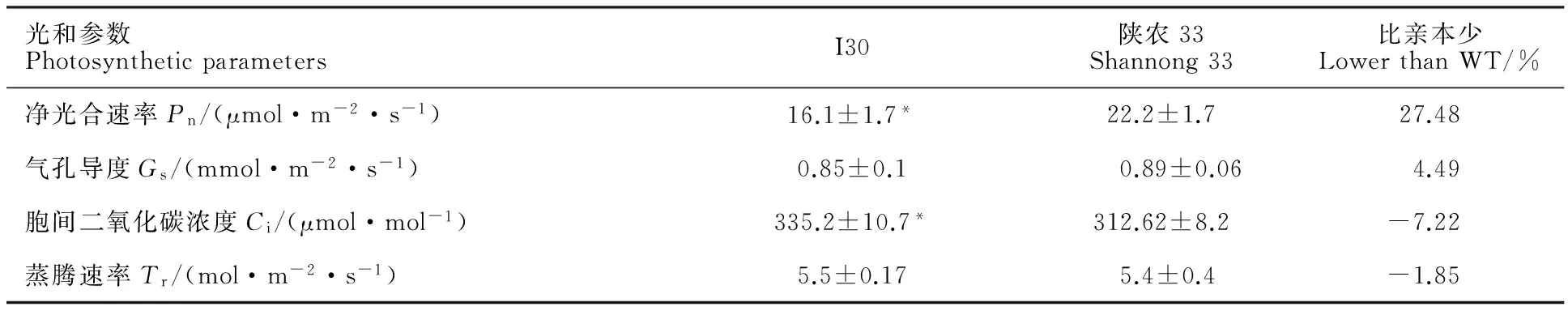
表2 突变体I30和陕农33的光合参数比较Table 2 Comparation of photosynthetic parameters of mutant I30 and Shaannong 33
*:突变体与野生型之间存在显著差异(P<0.05)。下同。
*:Significant differences between mutant and the wild type at 0.05 level.The same in table 2.

表3 突变体I30和陕农33农艺性状的比较Table 3 Comparison of main agronomic traits of the mutant I30 and Shaannong 33

图4 突变体I30和陕农33的白粉病抗性检测Fig.4 Resistance to powdery mildew of mutant I30 and Shaannong 33
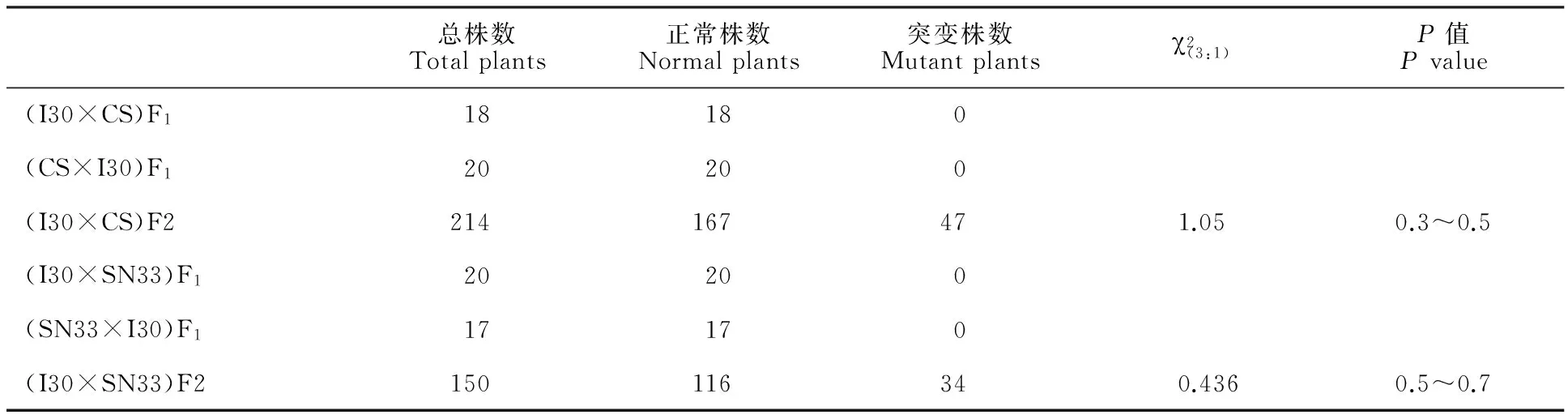
表4 突变体I30与中国春(CS)及陕农33(SN33)杂交后代遗传分析Table 4 Genetic analysis of the hybrid generations of mutant I30 crossed with Chinese Spring(CS) and Shaannong 33(SN33)

M:Marker;1:I30;2:中国春;3:突变型混池;4:野生型混池;5~9:F2群体的突变型植株;10~14:在F2群体中野生型植株。
M:Marker; 1:I30; 2:Chinese Spring;3:Mutant pool; 4:Wild type pool; 5-9:The mutant type plants in F2population;10-14:The wild type plants in F2population.
图5 部分材料标记Xgwm325的PCR扩增结果
Fig.5 PCR products amplified with Xgwm325 from part of materials

表5 定位 I30基因所用到的SSR分子标记Table 5 SSR markers used for mapping I30
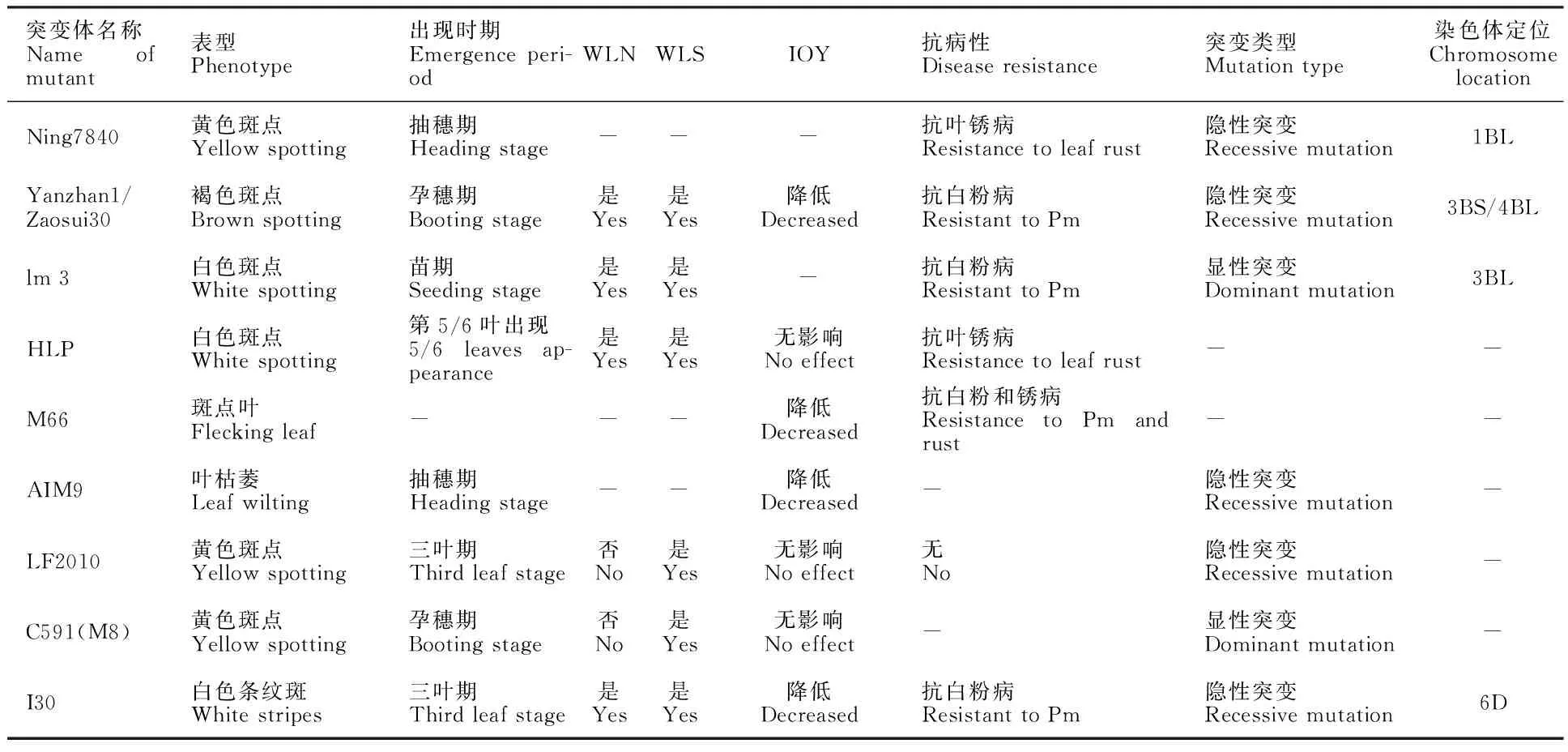
表6 小麦类病斑突变体的研究情况汇总Table 6 Summary of wheat lesion mimic mutants
WLN:病斑处是否存在坏死;WLS:病斑是否扩散;IOY:对产量的影响;Pm:白粉病;- :未报道。
WLN:Whether the lesion is necrotic; WLS:Whether the lesion spreads; IOY:Influence on the yield; Pm:Powdery mildew;-:Not reported.

图6 突变基因I30 在小麦6D染色体上的遗传连锁图Fig.6 Genetic linkage map of I30 on wheat chromosome 6D
3 讨 论
3.1 I30是一个新的类病斑突变基因
本研究中,突变体I30的白斑呈不规则条状或块状,这与水稻条纹斑突变体lms1[36]的表型相似,而与其他小麦类病斑突变体LF2010[28]、HLP[24]、Yanzhan/Zaosui30[22]、C59l(M8)[25]、lm3[23]、M66[26]、Ning7480[21]等均为斑点叶突变和AIM9[36]为严重叶绿体缺失不同(表6)。此外,遗传分析及基因定位表明,突变基因 I30位于小麦6DS染色体。而其他已定位的小麦类病斑突变基因分别定位于3BS( lm1)、4BL( lm2)、3BL( lm3)、1BL( Ning7840)。因此,推断突变体I30是一种新的小麦条纹类病斑突变体, I30是一个新的类病斑突变基因。此外,突变体I30在白粉病抗性方面优于其野生型,可以作为育种中间材料,但是对其他病害的抗性和抗病机制还有待进一步研究。
3.2 I30突变体是研究小麦光合作用的重要材料
本研究中,突变体I30从苗期开始出现白色条纹斑(图1),一直延续于整个生育期,而且在生长后期,白斑扩散到叶鞘和茎秆,属于扩散型类病斑突变体[4,36]。白斑的出现使叶片的绿色面积减少,直接影响了突变体I30的叶绿素含量和光合作用。与野生型相比,突变体I30的叶绿素a、叶绿素b和叶绿素总量在各个生长阶段均下降,尤其是苗期,与亲本间存在极显著差异,说明突变基因影响了小麦苗期叶绿素的合成和积累。在拔节期和抽穗期,叶绿素含量与亲本没有显著差异,可能是因为小麦拔节期生长速度较快,突变体的白斑在叶片中所占比例较小所致。
植物的气孔导度与光合速率呈正相关关系。在本试验中,突变体的气孔导度与野生型无显著差异,但是净光合速率减少了27%,说明本试验中光合作用的减弱不是气孔导度导致的。Farquhar等[37]研究认为,应结合胞间二氧化碳浓度(Ci)来分析光合速率的变化原因;当Pn、Ci同时降低时,是气孔导度的降低使光合速率下降;而Pn下降、Ci升高时,导致光合速率降低的是叶肉细胞光合活性下降。本试验中,突变体I30的Pn下降、Ci升高,说明光合作用的减弱不是气孔因素导致的,而是叶肉细胞光合活性的下降。
绿色植物获取能量的主要途径是叶片光合作用。研究认为,在一定范围内,净光合速率与叶绿素含量呈正相关[38]。本研究中,突变体I30叶绿素含量较野生型降低,导致净光合速率下降27.48%。研究认为,叶绿体类囊体基粒片层垛叠越多,叶绿体的光合作用越强[39]。突变体I30的白斑部位叶绿体结构完全降解,没有片层结构,导致其光合作用降低,这与前人研究结果一致。突变体I30特定部位叶绿体的缺失,类囊体片层结构的破坏可能是导致其出现白斑的主要原因。叶色突变体可以用于叶绿体合成相关新基因的定位和克隆,从而为进一步探究小麦叶色形成的分子机制、叶绿体发育与叶绿素生物合成、光合作用机制提供基础材料,为以后利用基因工程技术进行小麦高光效育种奠定基础。
4 结 论
小麦白斑突变体I30是一类新的小麦类病斑突变体;突变体I30的白斑性状受1对隐性核基因控制,位于小麦6D染色体上;白斑处出现细胞坏死和活性氧累积,产量与野生型相比显著下降。
[1]GREENBERG J T,GUO A,KLESSIG D F,etal.Programmed cell death in plants:A pathogen-triggered response activated coordinately with multiple defense functions [J].Cell,1994,77:551.
[2]李小白,王雪艳,舒小丽,等.植物类病斑突变体的信号途径与抗病性研究进展[J].核农学报,2009,23(4):635.
LI X B,WANG X Y,SHU X L,etal.Research advances on signal transduction of plant lesion mimic mutants and its disease resistance [J].JournalofNuclearAgriculturalSciences,2009,23(4):635.
[3]DIETRICH R A,DELANEY T P,UKNES S J,etal.Arabidopsis mutants simulating disease resistance response [J].Cell,1994,77:565.
[4]王忠华.植物类病变突变体的诱发与突变机制[J].细胞生物学杂志,2005,27(5):530.
WANG Z H.Induction and mutation mechanism of plant lesion mimic mutants [J].ChineseJournalofCellBiology,2005,27(5):530.
[5]孙惠敏,张春娇,李保同,等.水稻类病斑突变体的研究进展[J].上海农业学报,2014,30(3):142.
SUN H M,ZHANG C J,LI B T,etal.Advances of study on rice lesion mimic mutants [J].ActaAgriculturaeShanghai,2014,30(3):142.
[6]黄奇娜,杨 杨,施勇烽,等.水稻斑点叶变异研究进展[J].中国水稻科学,2010,24(2):108
HUANG Q N,YANG Y,SHI Y F,etal.Recent advances in research on Spotted-Leaf mutants of rice(OryzaativaL.) [J].ChinaRiceScience,2010,24(2):108.
[7]姜 丽,刘国庆,韩建民,等.植物类病变坏死突变体及其基因的研究进展[J].中国生物工程杂志,2003,23(1):36.
JIANG L,LIU G Q,HAN J M,etal.The progess on the studies plant lesion mimic mutants and genes [J].JouralofChineseBiotechnology,2003,23(1):36.
[8]LORRAIN S,VAILLEAU F,BALAGU C,etal.Lesion mimic mutants:Keys for deciphering cell death and defense pathways in plants? [J].TrendsinPlantScience,2003,8(6):263.
[9]FUSET,IBA K,SATOH H,etal.Characterization of a rice mutant having an increased susceptibility to light stress at high temperature [J].PhysiolPlant,1993,89(4):799.
[10]JAMBUNATHAN N,SIANI J M,MCNELLIS T W.A humidity-sensitiveArabidopsiscopine mutant exhibits precocious cell death and increased disease resistance [J].ThePlantCell,2001,13:2225.
[11]HU G,RICHTER T E,HULBERT S H,etal.Disease lesion mimicry caused by mutations in the rust resistance gene rp1[J].ThePlantCell,1996,8:1367.
[12]JOHAl G S,HULBERT S,BRIGGS S P.Disease lesion mimic mutations of maize:A model for cell death in plants [J].BioEssays,1995,17:685.
[13]BOWLING S A,CLARKE J D,LIU Y D,etal.The cpr5 mutant ofArabidopsisexpresses both NPRl-dependent and NPRl-independent resistance [J].ThePlantCell,1997,9:1573.
[14]WOLTER M,HOLLRICHER K,SALAMINI F,etal.Themloresistance alleles to powdery mildew infection in barley trigger a developmentally controlled defense mimic phenotype [J].Molecular&GeneralGenetics,1993,239:122.
[15]TAKAHASHI A,KAWASAKI T,HENMI K,etal.Lesion mimic mutants of rice with alterations in early signaling events of defense [J].PlantJournal,1999,17(5):535.
[16]CHEN X,HAO L,PAN J,etal. SPL5,a cell death and defense-related gene,encodes a putative splicing factor 3b subunit 3(SF3b3) in rice [J].MolecularBreeding,2012,30(2):939.
[17]YAMANOUCHI U,YANO M,LIN H,etal.A rice spotted leaf gene Spl7,encodes a heat stress transcription factor protein [J].ProceedingsoftheNationalAcademyofScienceoftheUnitedStatesofAmerica,2002,99:7530.
[18]ZENG L R.Spotted leaf 11,a negative regulator of plant cell death and defense,encodes a U-Box/Armadillo repeat protein endowed with E3 ubiquitin ligase activity [J].ThePlantCell,2004,16(10):2795.
[19]WANG L J,PEI Z Y,TIAN Y C,etal.OsLSD1,a rice zinc finger protein,regulates programmed cell death and callus differentiation [J].TheAmericanPhytopathologicalSociety,2005,18(5):375.
[20]QIAO Y L,JIANG W Z,LEE J H,etal.SPL28 encodes a clathrin-associated adaptor protein complex 1,medium subunit l1(AP1M1) and is responsible for spotted leaf and early senescence in rice(Oryzasativa) [J].NewPhytologist,2010,185:258.
[21]LI T,BAI G.Lesion mimic associates with adult plant resistance to leaf rust infection in wheat [J].TheoreticalandAppliedGenetics,2009,119(1):13.
[22]YAO Q,ZHOU R,FU T,etal.Characterization and mapping of complementary lesion-mimic genes lm1 and lm2 in common wheat [J].TheoreticalandAppliedGenetics,2009,119(6):1005.
[23]WANG F,WU W,WANG D,etal.Characterization and genetic analysis of a novel light-dependent lesion mimic mutant,lm3,showing adult-plant resistance to powdery mildew in common wheat [J].PlosOne,2016,11(5):e155358.
[24]KAMLOFSKI C A,ANTONELLI E,BENDER C,etal.A lesion-mimic mutant of wheat with enhanced resistance to leaf rust [J].PlantPathology,2007,56(1):46.
[25]NAIR S K,TOMAR S.Genetical and anatomical analyses of a leaf flecking mutant inTriticumaestivumL. [J].Euphytica,2001,121(1):53.
[26]KINANE J T,JONES P W.Isolation of wheat mutants with increased resistance to powdery mildew from small induced variant populations [J].Euphytica,2001,117(3):251.
[27]LUO P G,REN Z L.Wheat leaf chlorosis controlled by a single recessive gene [J].JournalofPlantPhysiologyandMolecularBiology,2006,32(3):330.
[28]杜丽芬,李明飞,刘录祥,等.一个化学诱变的小麦斑点叶突变体的生理和遗传分析[J].作物学报,2014,40(6):1020.
DU L F,LI M F,LIU L X,etal.Physiological characteristics and genetic analysis on a spotted-leaf wheat derived from chemical mutation[J].ActaAgronomicaSinica,2014,40(6):1020.
[29]YIN Z C,CHEN J,ZENG L R,etal.Characterizing rice lesion mimic mutants and identifying a mutant with broad-spectrum resistance to rice blast and bacterial blight [J].MolecularPlant-MicrobeInteractions,2000,13(8):875.
[30]THORDAL-CHRISTENSEN H,ZHANG Z G,WEI Y D,etal.Subcellular localization of H2O2in plants:H2O2accumulation in papillae and hypersensitive response during the barley powdery mildew interaction [J].ThePlantJournal,1997,11(6):1192.
[31]侯典云.小麦返白系叶绿体基因组分析及叶绿体超微结构和差异表达蛋白质研究[D].杨凌:西北农林科技,2009:32.
HOU D Y.Genomic analysis and ultrastructure and differential expression proteins study of chloroplast in wheat albinism line [D].Yangling:Northwest A&F University,2009:32.
[32]高俊凤.植物生理学实验指导[M].北京:高等教育出版,2006:75.
GAO J F.Experimental Guide of Plant Physiology [M].Beijing:Higher Education Press,2006:75.
[33]ROGERS S O,BENDICHA J.Extraction of DNA from milligram amounts of fresh,herbarium and mummified plant tissues [J].PlantMolecularBiology,1985,5(2):69.
[34]MICHELMORE R W,PARAN I,KESSELI R.Identification of markers linked to disease-resistance genes by bulked segregant analysis:A rapid method to detect markers in specific genomic regions by using segregating populations [J].ProceedingsoftheNationalAcademyofSciences,1991,88(21):9828.
[35]刘仁虎,孟金陵.MapDraw在Excel中绘制遗传连锁图的宏[J].遗传,2003,25(3):317.
LIU R H,MENG J L.MapDraw:A microsoft excel macro for drawing genetic linkage maps based on given genetic linkage data [J].Heraditas,2003,25(3):317.
[36]马健阳,陈孙禄,张建辉,等.一个水稻类病条纹斑突变体的鉴定和遗传定位[J].中国水稻科学,2011,25(2):150.
MA J Y,CHEN S L,ZHANG J H,etal.Identification and genetic mapping of a lesion mimic stripe mutant in rice [J].ChineseJournalRiceScience,2011,25(2):150.
[37]FARQUHAR G D,SHARKEY T D.Stomatal conductance and photosynthesis [J].AnnualReviewofPlantPhysiology,1982,33:318.
[38]汪 斌,兰 涛,吴为人,等.水稻叶绿素含量的QTL定位[J].遗传学报,2003,30(12):1127.
WANG B,LAN T,WU W R,etal.Mapping of QTLs controlling chlorophyll content in rice [J].ActaGeneticaSinica,2003,30(12):1127.
[39]ANDERSON J M,GOODCHILD D J,BOARMAN N K,etal.Composition of the photosystems and chloroplast structure in extreme shade plant [J].BiochimBiophyActa,1973,325:573.
Characteristics and Genetic Analysis of Wheat Mutant I30 with White Stripe Pattern
LI Qianqian1,ZHAO Qiushi1,JIANG Hongbao1,GENG Jiefei1,LIU Luxiang2,ZHANG Xiaoyan1,XIE Yanzhou1,WANG Chengshe1
(1.College of Agronomy,Northwest A&F University,Yangling,Shaanxi 712100,China; 2.Institute of Crop Sciences,Chinese Academy of Agricultural Science,Beijing 100081,China)
Lesion mimic mutant is an ideal material for research on plant programmed cell death and disease resistance. In order to enrich the research on wheat spotted mutants,a stable inherited white stripe mutant I30 was generated from Shaannong 33 by chemical mutagen sodium azide,and its characteristics and genetic analysis were conducted. The mutant I30 showed white spots and long stripes from the 3rd leaf stage to maturity stage. Trypan blue staining and DAB staining showed that I30 appeared cell death and the accumulation of H2O2. Observation of the chloroplasts structure of I30 with transmission electron microscopy indicated that the shape of chloroplast changed,and the number was decreased and grana stacks in the stroma were highly disordered,and even partly degraded. It was demonstrated that there was no significant difference between I30 and wild type in plant height,effective spikes per plant,spike grain number,ear length and seed setting rate,but the 1 000-grain weight(TKW),grain weight per spike,grain yield per plant,flag leaf length and width of I30 were significantly lower than those of the wild type. Genetic analysis showed that the mutant trait was controlled by a pair of recessive gene. The gene was located on the short arm of chromosome 6D revealed by BSA with 660K gene chip technology,situating between the SSR markers Xcfd190 and 6DS-5,the genetic distances were 6.4 cM and 9.1 cM,respectively.
Wheat(TriticumaestivumL.); Mutant; Characteristics; Agronomic trait; Gene mapping
时间:2017-07-07
网络出版地址:http://kns.cnki.net/kcms/detail/61.1359.S.20170707.1815.006.html
2017-03-02
2017-03-28
国家重点研发计划项目(2016YFD0102101);陕西省科技统筹创新工程计划项目(2015KTZDNY01-01-02);西北农林科技大学南阳小麦试验示范站建设项目;西北农林科技大学唐仲英育种基金项目
E-mail:18829841624@163.com
王成社(E-mail:wangcs2008@126.com)
S512.1;S330
A
1009-1041(2017)07-0871-09
