气相色谱—质谱联用技术分析大气细颗粒物对小鼠肺组织代谢轮廓的影响
2017-08-14史纯珍毛旭韩茜樊冲金萌
史纯珍+毛旭+韩茜+樊冲+金萌

摘 要 建立了基于气相色谱质谱联用技术(GCMS)分析大气细颗粒物(PM2.5)滴注对小鼠肺组织代谢轮廓的影响的研究方法。通过分析肺组织细胞内代谢物的变化,研究不同浓度PM2.5对小鼠肺组织代谢的毒性机制。鼻腔分别滴注0、7.5、20.0和37.5 g/L的PM2.5悬液,提取肺组织胞内物质,预处理后进行GCMS分析,结合主成分分析法(PCA)、偏最小二乘判别分析法(PLSDA)进行数据解析,通过PLSDA得分图可将不同PM2.5染毒浓度下的肺组织胞内物质明显区分。运用PLSDA载荷图及模型的变量重要性因子(VIP)值,发现了7种代谢物可作为区别不同浓度PM2.5下代谢组的潜在生物标志物,分别为丙氨酸、缬氨酸、亮氨酸、鸟氨酸、延胡索酸、柠檬酸、嘌呤(p<0.01)。代谢途径分析结果表明,PM2.5滴注使小鼠肺组织受到氧化损伤,氧化应激反应增强,抑制了三羧酸循环(TCA循环)及嘌呤代谢。本研究为深入解析PM2.5致毒机理提供了新的方法及理论依据。
关键词 大气细颗粒物; 代谢轮廓; 主成分分析; 毒性机理
1 引 言
大气细颗粒物(PM2.5)是指空气动力学直径小于2.5 μm的颗粒物,含有有机/无机碳(OC/EC)、硫酸盐、硝酸盐、重金属和多环芳烃(PAHs)等多种有害物质[1,2]。PM2.5颗粒随呼吸进入人体肺泡后,可破坏肺泡组织,导致矽肺病,其携带的重金属、PAHs等可进入血液系统,危害人体健康[3]。在中国城市环境中,PM2.5中的PAHs及其衍生物是导致人体患肺癌的主要原因[4]。目前,研究PM2.5的健康效应主要采用流行病学及毒理学研究方法。流行病学研究证实,PM2.5的污染程度会影响人群的发病率和死亡率,大气中PM2.5浓度每升高10 μg/m3,人群呼吸系统疾病的死亡率从2.1%升高到3.75%[5]。PM2.5可在肺部沉积,导致慢性阻塞性肺疾病(Chronic obstructive pulmonary diseases, COPD)或肺癌[6]。目前,定量分析PM2.5剂量效应关系的研究都是基于环境流行病学研究数据,而毒理学研究结果可为流行病学研究所发现的颗粒物健康效应提供机理解释[7]。PM2.5的成分复杂,并随着时空变换而不断变化,其损伤程度和机制也会相应改变,这类研究是当今PM2.5研究中的热点。
代谢组学是研究健康效應的有力工具,其揭示的小分子代谢产物变化是机体内基因、蛋白质、酶等功能变化的一系列事件的最终结果,直接反映了生物体系的最终状态,可反映机体特定病理生理状态下整体代谢物质的变化,为疾病诊断、揭示致病机理提供新的研究思路[8,9]。Belén等[10]采用直接输注电喷雾电离四极杆飞行时间质谱(DIESIQTOFMS)和气相色谱质谱联用(GCMS)检测肺癌(LC)组和对照组的支气管肺泡灌洗液(BALF)代谢物差异,采用偏最小二乘法(PLSDA)分析和筛选生物标志物,发现肺癌导致谷氨酸盐和谷氨酰胺代谢途径的变化,并评估及验证了其潜在的生物标志物。Izabella等[11]对在空气污染中暴露的人肺灌洗液进行多平台代谢组学研究,结果表明,结合GCMS、液相色谱质谱联用(LCMS)、核磁共振(NMR)可检测出支气管液(BW)和支气管肺泡灌洗液中的82种代谢物,其中46种代谢物显示出由于生物柴油暴露导致的代谢差异。
王晓飞等[12]利用LCMS的代谢组学技术,分析了经PM2.5悬液气管滴注暴露后成年雄性大鼠睾丸代谢组的全局变化,采用偏最小二乘判别分析(PLSDA)和非参数检验进行统计分析,最终鉴定了56种差异代谢物,并发现PM2.5暴露会引起大鼠睾丸的氨基酸和核苷酸代谢紊乱、脂类代谢异常和类固醇激素代谢失衡。但该研究未对大鼠肺脏进行PM2.5毒理研究。Wang等[13]利用超高效液相色谱质谱联用技术(UPLCMS)对成年大鼠以1 mg/kg/周的剂量进行PM2.5悬液滴注,连续滴注3月后解析肺组织代谢物,发现31种代谢物含量升高、19种代谢物含量降低,通过代谢途径分析推测PM2.5可干扰助氧化抗氧化平衡,并与磷脂、甘油磷酸、鞘脂和嘌呤的变化密切相关。但该研究主要针对单一浓度下的PM2.5对大鼠肺组织的健康效应,并未研究PM2.5浓度变化对其影响。本研究通过采集PM2.5样品,并配制成不同浓度悬浮液(7.5、20.0和37.5 g/L),对小鼠进行鼻腔滴注,通过对实验组与对照组的代谢物进行主成分分析(PCA)、偏最小二乘判别分析(PLSDA),研究其对小鼠肺组织的浓度效应关系,寻找不同浓度PM2.5影响肺组织代谢的潜在生物标志物,及其对相关代谢的影响。
2 实验部分
2.1 仪器与试剂
TH150C型智能中流量空气总悬浮微粒采样器(武汉市天虹仪表公司); Trace130型气相色谱质谱联用仪(美国Thermo Fisher Scientific公司); QL861 型旋锅混合器(海门市其林贝尔仪器制造有限公司); TB215D型(十万分之一)电子天平(美国DENVER公司); 114 型低温高速离心机(德国Sigma公司); SANYO MDF382型超低温冰箱(日本SANYO公司)。
乙醚、氯化钠(分析纯,国药集团化学试剂有限公司); 乙腈(美国Thermo Fisher Scientific公司); 分析纯甲氧基胺、吡啶、甲基三甲基甲硅烷基三氟乙酰胺(MSTFA)、二十二烷、庚烷,均购于上海阿拉丁生化科技股份有限公司。实验用水为超纯水。清洁级雄性KM小鼠购自北京维通利华实验动物技术有限公司,5周龄,体重38~42 g (动物生产许可证号:SCXK(京)20160011)。动物实验环境:SPF级动物实验室,控制室内温度18~22℃,相对湿度40%~50%,小鼠给予标准饲料和饮用水,于室内保持12 h光照、12 h避光循环饲养。
2.2 PM2.5采集与制备
2.2.1 PM2.5采集 本研究采用TH150C型智能中流量空气总悬浮微粒采样器与PM2.5切割器配合采样,采样滤膜为洁净的玻璃纤维滤膜。样品采自北京工商大学东校区(北京市海淀区阜成路11号),连续采样15 d,每天采样时间24 h。
2.2.2 采样滤膜处理及PM2.5悬液制备 采样后的滤膜,将有尘面两次对折剪成小块,用超纯水低温超声处理3次,每次20 min,6层纱布过滤去掉滤膜,滤液冷冻真空干燥,待其水分完全蒸发,可得到灰色絮状物,称重,低温保存,备用。测定时用生理盐水分别配制成7.5、20.0和37.5 g/L悬浮液,4℃保存,测定前超声振荡使悬液混匀后进行测定。
2.3 动物实验
28只雄性ICR小鼠随机分成4组(n=7):对照组(生理盐水组)、低剂量组(7.5 g/L)、中剂量组(20 g/L)、高剂量组(37.5 g/L)。采用鼻腔滴入式气管滴注法,用乙醚将小鼠麻醉,用丝线挂住小鼠上门齿,使其自然悬挂在自制泡沫架上,用移液枪吸取悬浮液并注入鼻腔中,每天滴注一次,滴注量3 mL/kg(60 μL/只),连续滴注3天,滴注后立即恢复自由饮食。于第三次滴注24 h后处死,采集肺组织。
将肺组织剪成小碎片后置于玻璃匀浆管中,加入2倍质量的生理盐水,将玻璃匀浆管插入冰水混合物中,上下转动研磨数十次(6~8 min),充分研碎,使组織匀浆化。将制备好的匀浆于4℃ 3000 r/min离心10 min,收集上清液,80℃保存。
2.4 GCMS分析
GCMS的样品制备过程包括去蛋白化、甲氧基化和最终衍生化三个基本步骤。将肺组织匀浆样品从80℃冰箱取出后,冰上解冻,移取100 μL样品于1 mL离心管中,加入300 μL预冷的乙腈沉淀蛋白,旋涡3 min,氮气吹干,加入50 μL 15 mg/mL甲氧基胺的吡啶溶液,混匀,80℃水浴振荡反应15 min。再加入衍生化试剂MSTFA 50 μL,振荡30 s,80℃水浴振荡反应15 min; 加入0.1 g/L二十二烷(内标L)的庚烷溶液150 μL。混匀后离心,取上清液到微量进样管,供GCMS分析。
气相色谱条件:TGWAX毛细管柱(30 m×0.25 mm×0.25 μm); 进样口温度,250℃; 升温程序:起始温度50℃,保持1 min,以5℃/min升温至300℃,保持5 min; 载气(He); 流速1.0 mL/min; 进样量1.0 μL; 分流比20:1。质谱条件:电子轰击(EI)离子源; 电子碰撞能70 eV; 离子源温度280℃; 传输线温度250℃; 质量扫描范围m/z 50~600。全扫描方式扫描; 溶剂延迟8 min; 调谐文件为标准调谐。
2.5 数据处理
采用NIST软件对总离子色谱图进行质谱峰的定性和定量分析,获得代谢物的相对含量(与内标峰的比值)。然后将数据导入SIMCAP进行PCA、PLSDA; 应用SPSS软件(Version 24.0, IBM)进行显著性分析。通过得分图、载荷图、F检验和模型的变量重要性因子(Variable importance factor, VIP)考察不同浓度含量差异并试图揭示其生物学效应。
3 结果与讨论
3.1 方法学考察
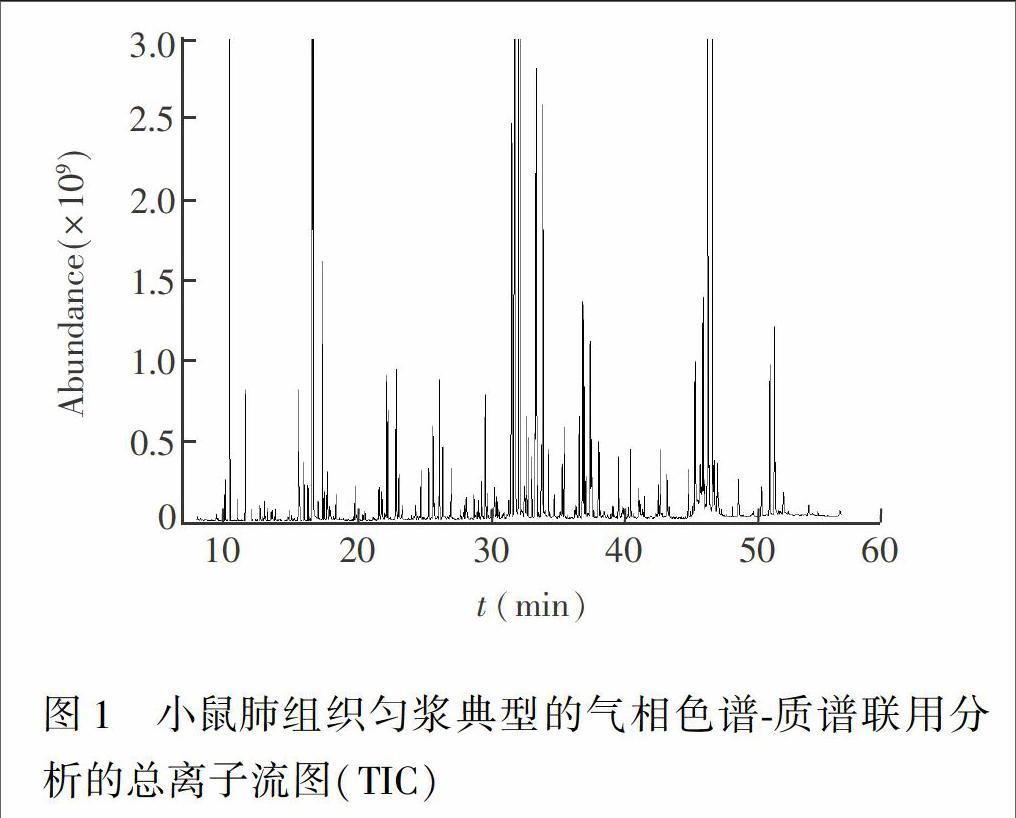
3.1.1 精密度与重复性 图1为所获得的GCMS生物体液(肺组织匀浆)分析的总离子流(TIC)图,其中各种代谢物,如氨基酸、有机酸、糖类、 (GCMS)脂肪酸、固醇等依次从GC色谱柱上洗脱。在分析样品之前,首先对分析方法进行考察,包括进样精密度、制备重复性、样本稳定性、线性和检测限。分别对同一制备好的肺匀浆样本连续进样6次,计算主要共有峰的峰面积相对标准偏差(RSD),发现主要共有峰的峰面积RSD<5%。对同一样本平行制备6份,计算主要共有峰的RSD,肺组织匀浆的RSD<10%。
3.1.2 样品稳定性 为保证实验的重复性,生物样品采集后需要在80℃低温保存。然而,在反复的冻融过程中,代谢物的组成或浓度可能会发生变化。为了考察样品在反复冻融后的稳定性,将80℃冻存的样品取出800 μL,室温下解冻,取出200 μL进行样品制备。将剩余的600 μL样品继续于80℃冻存,第二天使用同样方法进行代谢物提取,并进行测定。以此类推,共进行4次冻融。计算共有峰面积的RSD。实验结果发现,共有峰面积的RSD<15%。
3.1.3 代谢物谱分析与物质鉴定 代谢物的物质鉴定主要基于NIST质谱数据库,在数据库匹配中,匹配度(Match)表示所检物质的质谱图与库中标准物质的质谱图的相似程度,而可能性(Probability)表示该物质可被认为是候选物质的几率。依据匹配度>900,且可能性>80%,共检出32种代谢物。
3.2 代谢物相关性分析
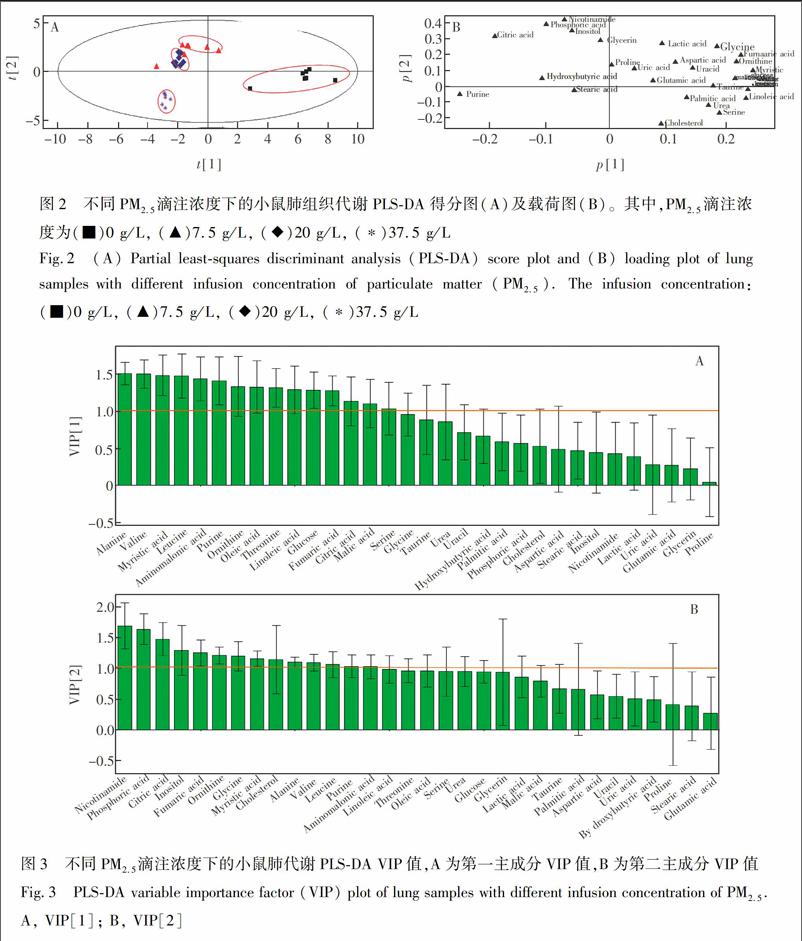
3.2.1 肺组织匀浆代谢物谱数据处理 应用PCA和PLSDA法对样本进行数据分析,图2为不同PM2.5滴注浓度下的小鼠血清代谢PLSDA得分图和载荷图。
由图2A可见,小鼠肺组织在不同浓度的PM2.5滴注下,代谢轮廓呈现明显差异,中浓度(20 g/L)和高浓度(37.5 g/L)组有个别样品存在重叠,但仍可区分,且对照组与实验组差异明显。随着滴注浓度增大,小鼠死亡率升高。说明小鼠的耐受性降低,当滴注浓度为37.5 g/L时,小鼠耐受性接近极值,其代谢轮廓也与低、中浓度组及对照组差异明显。
图2B为小鼠肺组织的PLSDA载荷图,图中每个点代表胞内一个代谢物变量,离原点较远的点为潜在的生物标志物[14]。图3为PLSDA的VIP图,VIP因子可以用来反映代谢物对肺组织代谢差异的贡献。结合载荷图、以及第一主成分和第二主成分的VIP值,在0.95的置信区间内,VIP>1的代谢物有:鸟氨酸、延胡索酸、柠檬酸、丙氨酸、缬氨酸、亮氨酸、嘌呤7种代谢物,说明当滴注不同浓度PM2.5悬液时,这些代谢物在肺组织代谢通路中受到影响。
3.2.2 肺组织匀浆代谢物含量的改变 使用F检验统计分析法检查上述备选的潜在生物标志物在对照组和不同PM2.5浓度差异的显著性,结果表明,对这些代谢物分别进行spss数据分析一般线性模型多变量F检验, p<0.01,说明这些代谢物在不同PM2.5浓度组中差异极其显著,具有统计学意义。最终确定与PM2.5滴注密切相关的关键代谢物为鸟氨酸、延胡索酸、柠檬酸、丙氨酸、缬氨酸、亮氨酸、嘌呤。
3.3 代谢物含量变化
由图4A可知,丙氨酸、缬氨酸、亮氨酸、鸟氨酸的相对浓度均随PM2.5滴注浓度的增加而减少,可能表示支链氨基酸代谢紊乱,肺组织细胞处于氧化应激状态,TCA循环受到抑制。由图4B可知,延胡索酸浓度下降,延胡索酸是TCA循环的重要中间体,其浓度下降代表TCA循环受到抑制[15]。柠檬酸先增加后减少,可能是由于细胞内活性氧(ROS)含量的升高破坏了TCA循环而造成[16]。
随着PM2.5染毒浓度的升高,氧化应激反应逐渐增强,嘌呤含量明显升高(图4C)。嘌呤的代谢产物为尿酸,由图4D可见,嘌呤含量逐渐升高,而尿酸含量相应减少,因此PM2.5染毒浓度增加使小鼠肺组织的嘌呤代谢受到了抑制。而尿酸是人体的嘌呤核苷降解途径中的最终酶催化产物[17]。有研究表明,尿酸尿囊素转换是血小板浓缩液中氧化损伤的一项生物标志物; 尿酸作为过量的活性氧ROS的淬灭剂,其含量的提高有利于减少生物损伤[18,19]。而通过PM2.5滴注的小鼠出现嘌呤含量升高而尿酸减少,因此可推断其受到了一定程度的氧化损伤。
4 结 论
本研究利用基于GC/MS的代谢组学方法研究了不同PM2.5染毒浓度对小鼠的肺组织代谢谱的变化。多元统计分析表明,滴注不同浓度PM2.5的小鼠肺代谢谱存在显著差异。筛选出7种关键代谢产物,丙氨酸、缬氨酸、亮氨酸、鸟氨酸、延胡索酸、柠檬酸水平随滴注浓度增加而降低,嘌呤含量呈增加趋势。结合代谢途径分析,发现PM2.5滴注时小鼠肺组织受到氧化损伤,氧化应激反应增强,削弱了肺细胞TCA循环,嘌呤代谢受到抑制。此研究为深入解析PM2.5致毒机理提供了新的视角及理论依据。
References
1 BI TingTing, CHEN ShiJie, ZHAO XiaoHong, ZHOU YanLi, LAO WenYan. Chinese Bull. Life Sci., 2016, 28(3): 409-414
毕婷婷, 陈世杰, 赵晓红, 周艳丽, 劳文艳. 生命科学, 2016, 28(3): 409-414
2 HUANG ChuChu, LI Qing, ZHANG GuoXia, WANG Zheng. Chinese J. Anal.Chem., 2016, 44(7): 1047-1052
黄楚楚, 李 青, 张国霞, 汪 正. 分析化学, 2016, 44(7): 1047-1052
3 YANG YiJian. J. Toxicol., 2005, 19(2): 146-148
杨轶戬. 毒理学杂志, 2005, 19(2): 146-148
4 Bai H Z, Zhang H J. J. Environ. Sci. Heal. A , 2017, 52(4): 303-312
5 Schwartz J. Am. J. Epidemiol., 2000, 151(5): 440
6 PAN Lu, NI Yang, XU JunHui, LI HongYu, DONG Wei, YANG Di, LIU Yue, ZHU Yi, SHAN Jiao, YANG Xuan, CHEN YaHong, GUO XinBiao, DENG FuRong. J. Environ Heal., 2016, 33(1): 1-4
潘 璐, 倪 洋, 許珺辉, 李宏宇, 董 伟, 杨 迪, 刘 越, 朱 益, 单 娇, 杨 玄, 陈亚红, 郭新彪, 邓芙蓉. 环境与健康杂志, 2016, 33(1): 1-4
7 YOU Yan, BAI ZhiPeng. Asian J. Ecotoxicol., 2012, 7(2): 123-132
游 燕, 白志鹏. 生态毒理学报, 2012, 7(2): 123-132
8 NIU YanJie, JIANG YinLing, XU ChangJiang, WANG XiangYing, LIU YouRu, ZHAO Heng, HAN BaoHui, JIANG LiYan. Chinese J. Lung Cancer, 2012, 15(4): 195-201
牛艳洁, 江银玲, 许长江, 王向迎, 刘友如, 赵 珩, 韩宝惠, 姜丽岩. 中国肺癌杂志, 2012, 15(4): 195-201
9 Huang Q, Yin P Y, Wang J, Chen J, Kong H W, Lu X, Xu G W. J Chromatogr. B, 2011, 897: 961-967
10 Belén C L, Tamara G B, Jesús G G, Antonio P V, José Luis G A. J. Proteomics, 2016, 145: 197-206
11 Izabella S, Masoumeh K, Sandra G F, Wu J, Jon U, Jenny A. Bosson, A B, Jamshid P, Thomas S A F, BehndigJ T, Malin L N. Anal. Bioanal. Chem., 2016, 408: 4751-4764
12 WANG XiaoFei, JIANG ShouFang, ZHANG WeiBing, ZHANG LingYi, LIU Ying, DU XiaoYan, ZHANG Jie, SHEN HeQing. Chinese J. Anal. Chem., 2017, 45(5): 633-640
王曉飞, 蒋守芳, 张维冰, 张凌怡, 刘 颖, 杜晓妍, 张 洁, 申河清. 分析化学, 2017, 45(5): 633-640
13 Wang X F, Jiang S F, Liu Y, Du X Y, Zhang W B, Zhang J, Shen H Q. Sci. Total Environ., 2017, 592: 41-50
14 CHEN ShengLan, ZHAO XiaoYan, REN LuJing, JI XiaoJun, HUANG He. Chinese J. Anal. Chem., 2016, 44(5): 685-692
陈胜兰, 赵晓艳, 任路静, 纪晓俊, 黄 和. 分析化学, 2016, 44(5): 685-692
15 GU JinNing, NIU Jun, PI ZiFeng, YUE Hao, WU SuiSheng, LIU ShuYing. Chinese J. Anal. Chem., 2013, 41(3): 371-376
谷金宁, 牛 俊, 皮子凤, 越 皓, 吴绥生, 刘淑莹. 分析化学, 2013, 41(3): 371-376
16 WANG GuiMing, SHI DongDong, PENG ZhangXiao, LU YangFang, GU Xue, WANG Yan, YAN Chao. Chinese J. Anal. Chem., 2015, 43(5): 682-688
王桂明, 史栋栋, 彭章晓, 鲁阳芳, 谷 雪, 王 彦, 闫 超. 分析化学, 2015, 43(5): 682-688
17 WANG EnPeng, SUN Yan, YUE Hao, CHEN HuanWen, WANG Yang, CHEN ChangBao, LIU ShuYing. Chinese J. Anal. Chem., 2016, 44(9): 1410-1418
王恩鹏, 孙 岩, 越 皓, 陈焕文, 王 洋, 陈长宝, 刘淑莹. 分析化学, 2016, 44(9): 1410-1418
18 Abonnenc M, Crettaz D, Marvin L, Grund B, Sonego G, Bardyn M, Tissot J D, Prudent M, Rochat B, Lion N. Metabolomics, 2016, 12(12): 188
19 Alvarez L B, Macarron V J. RheumatoLogy (Oxford), 2010, 49(11): 2010-2015
