基于对荧光铜纳米簇合成的抑制检测三聚氰胺
2017-08-14欧丽娟罗建新孙爱明陈思羽王凌云
欧丽娟+罗建新+孙爱明+陈思羽+王凌云
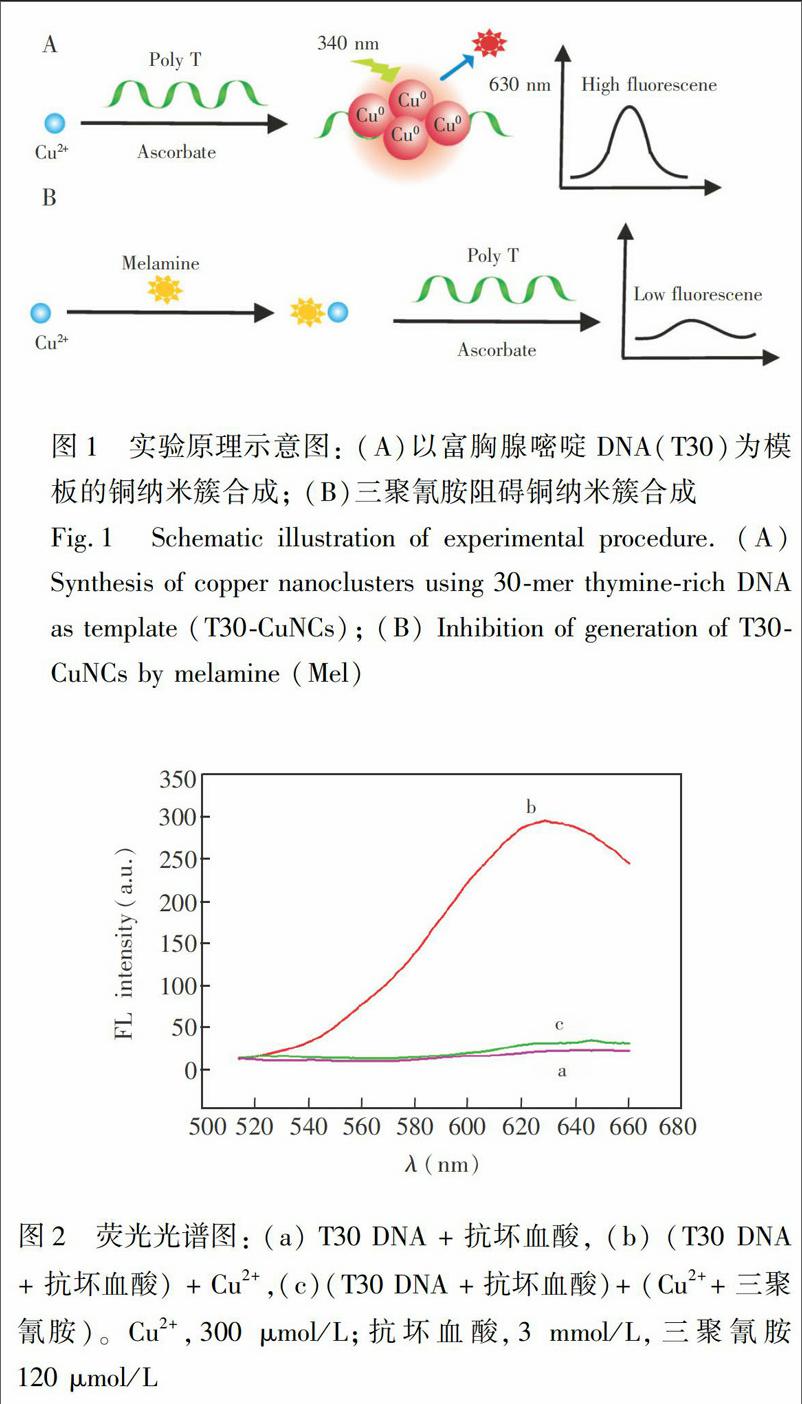

摘 要 三聚氰胺能与铜离子(Cu2+)形成配合物,对荧光铜纳米簇的合成有明显抑制作用,且其抑制程度与三聚氰胺浓度在一定范围内呈线性关系。基于此构建了一种简单、快速检测三聚氰胺的方法。以聚T单链DNA为模板合成的铜纳米簇作为荧光探针,当三聚氰胺存在时,Cu2+与三聚氰胺生成配合物,阻碍铜纳米簇的合成,导致荧光强度降低。在优化的实验条件下,三聚氰胺浓度在5~120 μmol/L范围内呈良好的线性关系,检出限为1.5 μmol/L,牛奶样品中三聚氰胺加标回收率为96.3%~104.4%。与传统纳米金/银、量子点等方法相比,本方法具有简单、快速、灵敏等优点。
关键词 铜纳米簇; 铜-三聚氰胺配合物; 荧光; 非标记
1 引 言
三聚氰胺是一种低毒性的氮杂环有机化工原料,常用于制造三聚氰胺树脂,是建筑业常用的防火材料。由于其分子中含氮量为66%,且无味,掺杂后不易被发现,一些不良企业为降低成本,在乳制品和饲料中添加三聚氰胺,以提高食品检测中蛋白质含量指标。然而,三聚氰胺会与尿酸结合生成难溶于水的结石[1],导致肾积水、肾结石等肾脏膀胱疾病,甚至死亡。因此,发展快速、准确、灵敏的三聚氰胺的测定方法对保障乳制品安全具有重要的实际意义。
传统的三聚氰胺检测方法包括高效液相色谱法[2]、气相色谱-质谱联用法[3]、电位滴定法[4]、酶联免疫吸附分析法[5]等,上述方法一般需要专业的操作人员,且存在选择性低或者精确度不高的不足,难以满足实际食品监管中快速、高效、低成本的检测要求。近年发展的新方法, 如纳米材料比色法[6~8]、荧光探针法[9]、分子印迹聚合物法[10]和表面增强拉曼散射技术[11,12]等,与传统方法相比,具有检出限低、灵敏度高的优势,但是预处理过程繁琐耗时,需要衍生或者昂贵的仪器。
最近,Qing等[13]发现,富含胸腺嘧啶T的单链DNA可作为合成铜纳米簇的有效模板。聚T为模板合成的铜纳米簇荧光强度高,而且尺寸和荧光强度可以通过聚T单链DNA的长度来调节;此外,基于聚T单链DNA 的铜纳米簇的合成在几分钟内即可完成,比其它金属纳米簇的合成快速、简捷。如随机dsDNA-铜纳米簇合成中,为了保证双链DNA模板的有效杂交,耗时需1 h以上[14];DNA-银纳米簇的合成需要在黑暗中反应24 h[15];BSA-金纳米簇的合成需要2 d[16]。
三聚氰胺可以通过芳香环上的氮原子与Cu2+形成配合物[17]。基于此,本研究提出了一种检测三聚氰胺的方法。利用聚T单链DNA为模板合成的铜纳米簇作为荧光探针,由于三聚氰胺与Cu2+发生配位反应,阻碍了铜纳米簇的合成,导致铜纳米簇荧光信号减弱。此方法用于三聚氰胺的检测快速、操作简单、成本低,并成功用于实际牛奶样品中三聚氰胺的检测,在食品安全监管等方面具有良好的应用前景。
2 实验部分
2.1 仪器与试剂
含30个碱基的聚胸腺嘧啶寡聚核苷酸链(T30)由上海生工生物工程公司合成。3-(N-吗啉基)-丙磺酸(MOPs)、抗坏血酸、CuSO4·5H2O、NaCl 和三聚氰胺(北京鼎国生物技术公司);其它试剂均为分析纯;实验用水为超纯水(>18.25 MΩ·cm)。
Cary Eclipse荧光分光光度计(美国安捷伦公司),激发波长340 nm,扫描范围500~660 nm,激发狭缝设定为5.0 nm,发射狭缝设定为10.0 nm。
2.2 荧光铜纳米簇的制备
T30DNA为模板的铜纳米簇的制备参照文献[13]的方法稍作修改,简述如下:将5 μmol/L T30-DNA、MOPs缓冲液(10 mmol/L MOPs,150 mmol/L NaCl,pH 7.6)、3 mmol/L抗坏血酸溶液混合均匀后,加入300 μmol/L CuSO4溶液,避光反应1 min,得到荧光铜纳米簇。
2.3 三聚氰胺的检测
将300 μmol/L CuSO4溶液与不同浓度的三聚氰胺溶液混匀,室温下孵育20 min。反应后的溶液加入到含有5 μmol/L T30-DNA、MOPs缓冲液、3 mmol/L抗坏血酸溶液的体系中,室温下避光反应1 min,立即进行荧光检测。
3 结果与讨论
3.1 实验原理
三聚氰胺可以通过芳香环上的N与Cu2+形成配合物[17],基于此,本研究构建了检测三聚氰胺的策略,如图1所示。以含30个碱基的聚胸腺嘧啶的单链DNA为模板,以抗坏血酸为还原剂, Cu2+被还原为Cu0,并富集在T30单链DNA上,生成具有强荧光的铜纳米簇,并作为信号报告探针(图1A)。当三聚氰胺存在时,与Cu2+发生配位反应,不利于Cu2+被还原为Cu0簇拥在单链DNA上,从而阻碍铜纳米簇的合成,导致合成铜纳米簇的荧光强度大大降低(图1B),荧光强度降低的程度与三聚氰胺的浓度相关,基于此可以实现三聚氰胺的检测。
3.2 三聚氰胺对荧光铜纳米簇合成的影响
為了考察三聚氰胺是否能够间接抑制CuNCs的合成,测定了三聚氰胺存在与否时CuNCs的荧光光谱。如图2a所示, Cu2+不存在时,无荧光信号,说明未合成CuNCs;Cu2+存在时,630 nm出现强的荧光发射峰(图2b),证明在抗坏血酸作用下,Cu2+被还原为Cu0,聚集在T30单链DNA上,生成CuNCs,产生强的荧光信号。当加入120 μmol/L三聚氰胺后,荧光强度大大降低(图2c),说明三聚氰胺与Cu2+形成配合物,阻碍了铜纳米簇的合成,导致体系的荧光强度降低。以上结果表明,可以利用三聚氰胺对铜纳米簇荧光强度的减弱程度检测三聚氰胺。
3.3 实验条件优化
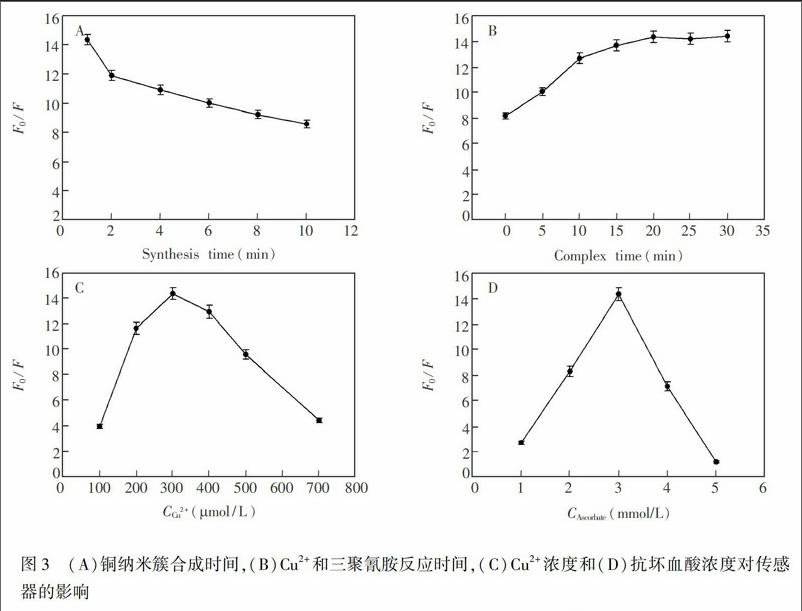
铜纳米簇的合成时间对荧光检测三聚氰胺有重要影响。研究表明,随着铜纳米簇合成时间的延长,不加三聚氰胺时的空白荧光信号值F0基本趋于平稳,但是加三聚氰胺的响应荧光信号强度F有略微的增加,导致F0/F逐渐降低,降低了信噪比(图3A)。因此,实验选用铜纳米簇合成时间为1 min。
三聚氰胺與铜离子发生配位反应,继而阻碍铜纳米簇的合成,导致荧光强度降低。因此,配位反应时间也是一个重要因素。从图3B可见,随着络合时间延长,F0/F逐渐增加, 20 min达到最大并趋于平稳。故选取三聚氰胺与Cu2+的配位反应时间为20 min。
Cu2+被还原为Cu0结合在单链DNA上,形成荧光铜纳米簇[14]。低浓度的Cu2+不利于合成铜纳米簇。但是高浓度的Cu2+可与抗坏血酸产生氧的自由基降解DNA链,导致模板浓度降低,从而使铜纳米簇荧光强度降低[18]。因此,Cu2+的浓度对铜纳米簇的荧光信号有重要影响。从图3C可见,Cu2+浓度在100~700 μmol/L范围内时,F0/F先增加,于300 μmol/L达到最大值,继续增大Cu2+浓度,F0/F反而降低。故选择最佳Cu2+浓度为300 μmol/L。
抗坏血酸浓度也是影响铜纳米簇合成的一个重要参数。从图3D可知,随着抗坏血酸浓度的增加,F0/F逐渐增大,在3 mmol/L处达到最大。故选取3 mmol/L作为最佳抗坏血酸浓度。
3.4 传感器的分析性能
在最佳的实验条件下,对不同浓度的三聚氰胺进行了检测。图4A为630 nm处荧光强度与三聚氰胺浓度的校正曲线图。结果表明,随着三聚氰胺浓度升高,荧光信号逐渐降低,在5~120 μmol/L范围内呈良好的线性关系,线性相关系数为R2=0.998,检出限为1.5 μmol/L (S/N=3),远低于国家规定的三聚氰胺限量值1 mg/kg[19]。与文献报道的纳米金、纳米银等方法[6,7,8,11,12]相比, 本方法检出限更低,并且方法操作简单、快速。
为了证明本方法对三聚氰胺检测的特异性,考察了牛奶中存在的常见金属离子(Ca2+,Fe3+,Zn2+)及氨基酸(甘氨酸Gly,赖氨酸Lys,组氨酸His)等其它可能产生干扰的物质(葡萄糖Glc,苯胺Ani)的影响。从图4B可见,只有三聚氰胺会导致铜纳米簇荧光显著降低,大多数干扰物质的加入对铜纳米簇荧光没有影响。尽管L-组氨酸的咪唑环也可与Cu2+发生配位反应,导致铜纳米簇荧光减弱,但是响应信号远小于三聚氰胺。
3.5 实际牛奶样品分析
采用本方法检测了牛奶样品中三聚氰胺。牛奶样品处理方法同文献[20]:在牛奶样品中加入三氯乙酸,超声提取20 min,15000 r/min离心两次。上清液过滤后,用NaOH溶液调至pH 7.0,采用本法进行检测。结果表明,牛奶样品中未检测出三聚氰胺。加标回收实验结果见表1。样品的加标回收率在96.3%~104.4%之间,表明本方法具有良好的可靠性和准确性,可用于实际样品中三聚氰胺的检测。
4 结 论
基于三聚氰胺与Cu2+络合形成配合物,阻碍铜纳米簇的合成,从而降低铜纳米簇的荧光,建立了一种检测三聚氰胺的灵敏方法。本方法成本低、无需标记,操作简单、快速、灵敏度高、特异性好,可用于牛奶样品中三聚氰胺检测,具有良好的的应用前景。
References
1 Langman C B, Alon U, Ingelfinger J. Pediatr. Nephrol., 2009, 24(7): 1263-1266
2 Zhong Y B, Zhang L J, Zhang H C, Liu J X, Wang J P. Chromatographia, 2011, 73(11): 1211-1215
3 Braekevelt E, Lau B P Y, Feng S, Menard C, Tittlemier S. A. Food Addit. Contam. A, 2011, 28(1): 698-704
4 YUAN Li-Yong, MA Chao-Wei, DU Ya-Hui, Henan Chemical Industry, 2004, 1(4): 42-43
袁立勇, 马朝卫, 杜亚辉. 河南化工, 2004, 1(4): 42-43
5 Liu J X, Zhong Y B, Liu J, Zhang H C, Xi J Z, Wang J P. Food Control, 2010, 21(12): 1482-1487
6 Zhou Q Q, Liu N, Qie Z W. J. Agr. Food Chem., 2011, 59(22): 12006-12011
7 Ping H, Zhang M W, Li H K. Food Control, 2012, 23(1): 191-197
8 Xavier S S J, Karthikeyan C, kumar G G. Anal. Methods, 2014, 6(8): 8165-8172
9 Zhou Y Y, Yang J, Liu M. J. Luminescence, 2010, 130(5): 817-820
10 Sun K J, Deng Q L, Guo T. RSC Adv., 2015, 5(114): 94084-94090
11 Zhang X F, Zou M Q, Qi X H. J. Raman Spectrosc., 2010, 41(12): 1655-1660
12 Lang T T, Panga S, He L L. Anal. Methods, 2015, 7(15): 6426-6431
13 Qing Z H, He X X, Qing T P, Wang K M. Anal. Chem., 2013, 85(24): 12138-12143
14 Zhou Z, Du Y, Dong S. Anal. Chem., 2011, 83(13): 5122-5127
15 Xie J, Zheng Y, Ying J Y. J. Am. Chem. Soc., 2009, 131(3): 888-889
16 He H, Xie C, Ren J C. Anal. Chem., 2008, 80(15): 5951-5957
17 Zhu H, Zhang S X, Li M X, Shao Y H, Zhu Z W. Chem. Commun., 2010, 46(13): 2259-2261
18 Rotaru A, Dutta S, Jentzsch E, Gothelf K, Mokhir A. Angew. Chem. Int. Edit., 2010, 49(33): 5665-5667
19 Regulation of the Ministry of Health of the Peoples Republic of China. Ministry of Industry and Information Technology of the People's Republic of China. Ministry of Agriculture of the Peoples Republic of China. State Administration for Industry and Commerce. General Administration of Quality Supervision, Inspection and Quarantine of the Peoples Republic of China. No. 1519, Limit Value of Melamine in Food, 2011
關于三聚氰胺在食品中的限量值的公告. 中华人民共和国卫生部, 中华人民共和国工业和信息化部, 中华人民共和国农业部, 国家工商行政管理总局, 国家质量监督检验检疫总局公告, 第10 号, 2011
20 OU Li-Juan, LIU Hong-Wei, LIU Kai-Jian. Chinese J. Anal. Chem., 2014, 42(8): 1205-1209
欧丽娟, 刘宏伟, 刘开建. 分析化学, 2014, 42(8): 1205-1209
