桃红肉性状分子标记的有效性检测
2017-08-13丁体玉曹珂赵佩
丁体玉 曹珂 赵佩


摘要 [目的]检测桃红肉性状分子标记在自然群体上应用的有效性。[方法]以109份桃种质为试材,检测位于LG4上的2个SNPs标记SNP_IGA_386619和SNP_IGA_387198以及LG5和LG3上的SSR分子标记WPS23和UDP96-008的分型与种质果肉红色素的相关性。[结果]秩和检验表明,标记SNP_IGA_386619的3种分型与种质红色素多少的相关性达到显著水平(P=0.007<0.05);而标记SNP_IGA_387198、WPS23、UDP96-008的分型结果与红色素多少未达到显著相关,P值分别为0.561,0.865和0.079。[结论]SNP_IGA_386619标记可用于红肉桃的分子标记辅助育种,但依据分型结果判定自然群体红色素的多少仍存在准确性较低的问题,尚需继续开发更加准确的广适性红肉性状分子标记,加速其分子辅助育种进程。
关键词 桃;红色素;秩和检验;分子标记辅助育种
中图分类号 S662.1 文献标识码 A 文章编号 0517-6611(2017)03-0161-06
Abstract[Objective] To detect the effectiveness of molecular markers associated with bloodflesh in peach applied in nature population. [Mehtod]Two SNPs (SNP_IGA_386619 and SNP_IGA_387198 on peach LG4) and two SSR markers (WPS23 on peach LG5 and UDP 96-008 on peach LG3) were used to analyze the relationship between their genotypes and the content of red pigment in 109 peach germplasms. [Result]Ranksum test results showed that there had obvious correlation between the genotypes of SNP_IGA_386619 and the content of red pigment in 109 peach germplasms (P=0.007<0.05). However,the correlation between the genotype of SNP_IGA_387198,WPS23 UDP96008 and the content of red pigment in fruit showed no significance, the values of P were 0.561,0.865 and 0.079,respectively.[Conclusion]The marker SNP_IGA_386619 can be used for molecular markers assisted breeding bloodflesh peach,but it is difficult to identify bloodflesh peach according to present molecular markers from different peach germplasms. More efforts should make for developing precise molecular marker associated with bloodflesh trait to accelerate the molecularassisted selection in peach.
Key words Peach;Red pigment;Ranksum test;Molecular markers assisted breeding
紅肉桃是我国一种特色的种质资源,类型各异,根据肉色类型可分为环形红、紫红、鲜红和斑红,其以独特的感官魅力受到消费者的喜爱。研究表明,花色素苷的积累是桃呈现红色的主要原因,其主要成分包括矢车菊素-3-葡萄糖苷和矢车菊素-3-芸香糖苷[1],其中以矢车菊素-3-葡萄糖苷含量最高。近年的研究表明,红肉桃的抗氧化活性可与蓝莓等相媲美,食用红肉桃可以预防多种心脑血管疾病和癌症,是一种重要的功能性水果[2-4]。
对红肉桃进行准确的表型评价是红肉桃育种亲本选择的基础,而对红肉性状遗传模式的解析又影响到评价方法的准确性,不同研究结果间存在一定差异,如Werner等[5]研究认为‘Harrow Blood是bf(bloodflesh)型的隐性单基因控制的红肉桃,而Shen等[6]研究认为‘WuYueXian属于DBF(dominant bloodflesh)控制的单基因显性遗传模式的红肉桃。也有不少研究认为,桃红肉性状并不仅是由单基因控制的[7-10],而且是一个复杂的数量性状。因此,目前多依据《桃种质资源描述规范与数据标准》[11],根据桃果实在食用成熟期时果肉中红色素占全果的比例将桃种质分为无(无红色素)、少(0<红色所占比例<1/4)、中(1/4<红色所占比例<3/4)、多(红色所占比例≥3/4)4种类型。
近年来,分子标记辅助育种在农作物上的成功应用为果树分子育种展现了光明的前景。在桃上,为获得与红肉性状紧密连锁的标记,不少研究者开展了连锁分析工作。Quilot等[7]利用‘Prunus davidiana clone P1908和‘Summergrand的杂交群体,将红肉性状定位在LG3(Linkage group,LG),与简单重复序列(Simple Sequence Repeats,SSR)标记UDP96-008连锁。Gillen等[8]利用‘Harrow Blood(‘哈露红)בOkinawa的F2群体,将红肉隐性基因bf定位在LG4上端。沈志军等[9]利用‘Sanguine ChanasבO′Henry的F2群体,构建了包含85个SSR标记和24 个SNP标记的遗传连锁图谱,并將bf基因定位于第4连锁群的SNP_IGA_386619和 SNP_IGA_387198之间,对应桃基因组的Scaffold_4:4212145~4523432 bp。Zhou等[10]利用‘DHP(‘大红袍)בSG(‘曙光)的F1群体构建连锁图谱,将红肉显性基因BL定位在LG5上端,此BL基因(NAC)与SSR标记WPS23连锁,它能区分‘DHPבSG杂交后代的红肉单株和非红肉单株。
由于不同研究者利用的遗传群体不同,得到的标记与性状连锁距离的远近不同,甚至位于不同的染色体,在对这些标记进行应用时,往往在与所定位群体的亲本材料类似的红肉种质上具有较高的表型预测准确性。为了检测已报道的这些分子标记在大量自然群体中应用时准确性的差异,该研究在连续多年评价种质果实红色素的基础上,分析与桃红肉性状相关的分子标记SNPIGA386619、SNPIGA387198、WPS23和UDP96008[7,9-10]与果肉中红色素多少的相关性,探讨其应用价值,为加快红肉桃分子育种提供理论依据。
1 材料与方法
1.1 材料
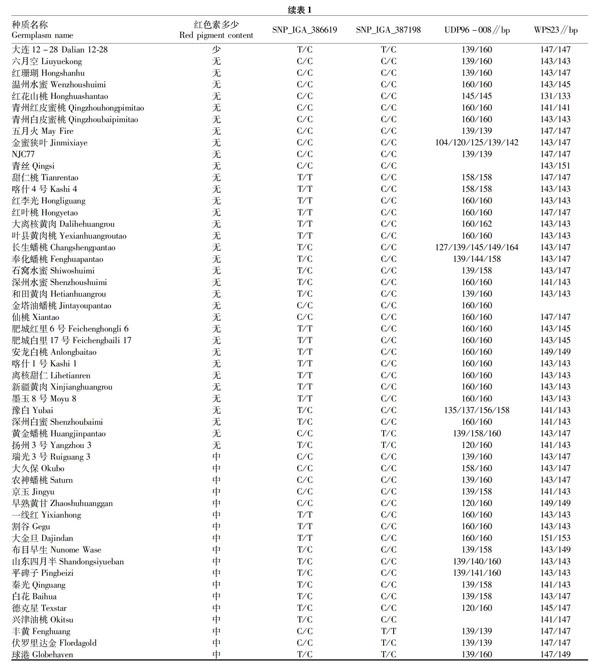
试验所用109份桃种质来自国家果树种质郑州桃资源圃,种质名称见表1。2015年9月取桃新梢嫩叶,带回实验室装至2 mL离心管内,液氮速冻,-80 ℃保存备用。为正确评价种质表型数据,依据《桃种质资源描述规范与数据标准》[11]和课题组多年的经验,首先将109份种质分为红肉桃和非红肉桃,其中红肉桃种质有8份,红色素评价为极多,非红肉桃种质红色素评价为多、中、少、无,分别有10、18、39、34份种质(表1)。
1.2 种质叶片DNA的提取和PCR扩增
采用上海生工植物DNA提取试剂盒(Sangon,上海)提取桃幼嫩叶片的DNA,1%的琼脂糖凝胶电泳检测DNA完整性,核酸蛋白分析仪测定DNA浓度,超纯水稀释至50 ng/μL,-20 ℃保存备用。
已报道的与红肉性状相关的分子标记所用引物序列信息见表2。其中用于鉴定SNP的引物由金唯智(苏州)生物科技有限公司合成,进行SSR标记扩增所需的FAM荧光引物由北京阅微基因技术有限公司合成。
聚合酶链式反应(Polymerase Chain Reaction,PCR)体系为30 μL,包括75 ng的基因组DNA,10×Ex Taq Buffer(Mg2+plus),2.5 mmol/L的dNTPs,TaKaRa Ex Taq(5 U/uL),正向引物和反向引物各10 μmol/L。PCR程序如下:94 ℃4 min;94 ℃45 s、退火30 s,72 ℃45 s,36个循环;72 ℃10 min。
1.3 基因分型检测
对于SNP标记,首先利用上下游引物进行PCR扩增,产物送至北京六合华大基因科技有限公司进行Sanger测序,Chromas Pro 2.33统计目标种质SNPs位点的分型结果。SSR标记的分型则由实验室进行PCR后,将产物送至北京阅微基因技术有限公司,利用ABI 3730xl测序仪进行毛细管电泳,根据电泳结果判断条带大小。
1.4 數据统计分析
Excel 2010统计数据并进行整理,SPSS 19.0软件对数据做非参数统计的秩和检验(Kruskal-Wallis法)[12]。
2 结果与分析
2.1 标记SNP_IGA_386619、SNP_IGA_387198的分型检测
利用定位于LG4上的标记SNP_IGA_386619和SNP_IGA_387198[9]的引物在供试种质中进行扩增,产物进行Sanger测序以检测目标条带的SNP型。其中标记SNP_IGA_386619在109份种质的基因分型为T/T、T/C和C/C(表3),具体分型结果见表1。在该研究中,由于果实中红色素含量的分类是有等级顺序的(极多、多、中、少、无),因此需采用单向有序列表的秩和检验的统计方法分析基因型与表型的相关性。由表3可知,对于标记SNP_IGA_386619,秩和检验得到Hc=10.060,P=0.007,小于阈值0.05,据此认为此标记的3种分型对种质红色素多少的区分达到显著水平。
SNP_IGA_387198标记对109份种质的分型分别为T/T、T/C、C/C(表4),具体分型结果见表1。对表4的数据用秩和检验得Hc=1.156,P=0.561>0.05,即该标记的3种分型与种质红色素多少的相关性未达到显著水平。
2.2 标记WPS23、UDP96-008的分型检测
在供试的109份种质中,WPS23标记仅在金塔油蟠桃未扩增出条带,其他种质均有扩增,且发现种质‘大红袍和‘曙光的分型分别为143/145、143/147,与Zhou等[10]的研究结果一致。该标记的分型结果可将109份种质分为18类,去除仅有1个种质的分型,主要的分型为10种(表5),具体分型结果见表1。对表5的数据用秩和检验得Hc=4.638,P=0.865>0.05,即该标记的10种分型与种质红色素多少的相关性未达到显著水平。
UDP96-008标记[7]对青丝和兴津油桃没有扩增出目的条带,其余种质均有扩增,根据该标记的分型可将109份种质分为23类(去除仅含有1个种质的分型),主要的分型为8种(表6),具体分型结果见表1。对表6的数据用秩和检验得Hc=12.731,P=0.079>0.05,表明该标记的8种分型对种质表型的区分未达到显著水平。
3 结论与讨论
目前利用红肉桃种质资源开展种质创新与新品种选育研究,已经成为国内外桃研究领域的主要方向[13]。但由于桃世代周期长,利用传统的育种方法培育1个新品种需要10多年的时间,因此分子标记辅助育种就显得尤为重要[14]。该研究利用前人发掘的4个与桃红肉性状相关的分子标记,分析其在不同种质上的有效性,为亲本选择奠定理论基础,具有一定的积极意义。
表型性状的准确鉴定是分子标记辅助选择的前提,但对于判断红肉桃的标准一致存在争议。花色素苷积累是红肉桃呈现红色的主要原因[15]。赵玉等[15]通过测定花色素苷的含量,提出红肉桃的判定标准,即将200 mg/kg定为红肉桃划分的临界点。而在《桃种质资源描述规范与数据标准》[11]中则是通过与参考品种比对的人工观察法描述种质红色素的多少,是以红色素所占比例来分级。该研究在对分子标记的准确性判定时,对种质的分类采用了后者,这是尽量与原始参考文獻,即最初通过连锁分析鉴定这些分子标记时对种质的红肉性状判定方法保持一致。从研究中看出,标记SNP_IGA_387198、WPS23和UDP96-008与种质红色素多少的分级关系未达到显著水平,标记SNP_IGA_386619与种质红色素多少的分级关系达到显著水平,但是在生产上这样的分级方法是否仍显简单,还需要在后续的试验中依据种质花色素苷含量的测定,从而更加准确地评价分子标记的适用性。
同时,也应该看到,所鉴定标记之所以不同与其来源的杂交群体亲本的花色素苷合成途径存在差异有关。因此,将这些标记应用在自然群体上时,正确率出现大幅度的降低。如果可根据不同种质花色素苷合成途径对供试材料进行分群,必然能够提高所评价标记的通用性。但这要求对不同种质果实发育时期花色素苷的含量和种类进行详细测定,从而增加研究的工作量。另外,也可以根据系谱关系对杂交群体亲本材料进行归类,然后分别选择不同的标记在不同的自然群体中进行标记验证。然而,在实践中,很难获知每份材料尤其是地方品种详细的系谱关系,自然无法对资源圃的种质进行正确分群。因此,在该研究中,在无法按不同来源对种群进行分类的情况下,去讨论各标记的适用性,也只能一概而论,即忽视花色素苷合成代谢机制的差异,只考虑红色素的多少,这是造成某一种质类型特定的标记在检测其他类型种质时效率较低的客观原因。
参考文献
[1] ORAZEM P,STAMPAR F,HUDINA M.Fruit quality of redhaven and royal glorypeach cultivars on seven different rootstocks[J].J Agric Food Chem,2011,59(17):9394-9401.
[2] KONG J M,CHIA L S,GOH N K,et al.Analysis and biological activities of anthocyanins[J].Phytochemistry,2003,64(5):923-933.
[3] CEVALLOSCASALS B A,BYRNE D H,OKIE W R,et al.Selecting new peach and plum genotypes rich in phenolic compounds and enhanced functional properties[J].Food chemistry,2006,96(2):273-280.
[4] VIZZOTTO M,CISNEROSZEVALLOS L,BYRNE D H,et al.Large variation found in the phytochemical and antioxidant activity of peach and plum germplasm[J].Journal of the American society for horticultural science,2007,132(3):334-340.
[5] WERNER D J,CRELLER M A,CHAPARRO J X.Inheritance of the bloodflesh trait in peach[J].Hort Science,1998,33(7):1243-1246.
[6] SHEN Z J,CONFOLENT C,LAMBERT P,et al.Characterization and genetic mapping of a new bloodflesh trait controlled by the single dominant locus DBF in peach[J].Tree genetics & genomes,2013,9(6):1435-1446.
[7] QUILOT B,WU B H,KERVELLA J,et al.QTL analysis of quality traits in an advanced backcross between Prunus persica cultivars and the wild relative species P.davidiana[J].Theor Appl Genet,2004,109(4):884-897.
[8] GILLEN A M,BLISS F A.Identification and mapping of markers linked to the Mi gene for rootknot nematode resistance in peach[J].J Am Soc Hortic Sci,2005,130(1):24-33.
[9] 沈志軍.桃初级核心种质、关联分析和红肉性状的图谱定位[D].南京:南京农业大学,2013.
[10] ZHOU H,WANG K L,WANG H L,et al.Molecular genetics of blood-fleshed peach reveals activation of anthocyanin biosynthesis by NAC transcription factors[J].The plant journal,2015,82(1):105-121.
[11] 王力榮,朱更瑞.桃种质资源描述规范和数据标准[M].北京:中国农业出版社,2005:60-61.
[12] 杨树勤.中国医学百科全书:医学统计学[M].上海:上海科学技术出版社,1985:135-140,213-214,101-103.
[13] 俞明亮,马瑞娟,沈志军,等.红肉桃研究与利用进展[J].果树学报,2014,31(5):959-966.
[14] DURAN C,APPLEBY N,EDWARDS D,et al.Molecular genetic markers:Discovery,applications,data storage and visualisation[J].Curr Bioinform,2009,4(1):16-27.
[14] 赵秀林,王富荣,徐凌云,等.红肉桃果实发育过程中色素含量及 PAL 活性的变[J].食品工业科技,2012,33(12):125-127.
[15] 赵玉,王力荣,曹珂,等.桃果肉花色苷遗传多样性及红肉桃判定指标的探讨[J].植物遗传资源学报,2013,14(1):167-172.
