PCOS与抑郁对雌鼠下丘脑单胺类神经递质和血清黄体生成素、睾酮分泌的影响
2017-08-11郑志群
郑 珞, 陈 权, 郑志群
PCOS与抑郁对雌鼠下丘脑单胺类神经递质和血清黄体生成素、睾酮分泌的影响
郑 珞1, 陈 权2, 郑志群1
目的 研究多囊卵巢综合征(PCOS)及抑郁2种因素对雌性大鼠下丘脑中单胺类神经递质[多巴胺(DA)、去甲肾上腺素(NE)、5-羟色胺(5-HT)、促性腺素释放素(GnRH)]及血清中黄体生成素(LH)、睾酮(T)分泌的影响,分析抑郁与PCOS之间的相互关系。 方法 将40只雌性6周龄清洁级SD大鼠分为:空白组、抑郁组及PCOS组及PCOS合并抑郁组。采用放射免疫法测定大鼠血清T及LH水平;ELISA法检测大鼠下丘脑中GnRH水平;高效液相色谱-荧光检测流速梯度法检测大鼠下丘脑中NE,DA及5-HT水平。 结果 4组大鼠血清LH及T水平、下丘脑GnRH水平比较,差别具有统计学意义(P<0.05),且呈递增趋势。4组大鼠下丘脑的DA,NE及5-HT水平比较,差别具有统计学意义(P<0.05),NE呈递增趋势,DA及5-HT呈递减趋势。GnRH变化趋势与DA(P<0.05,r=-0.874)、5-HT(P<0.05,r=-0.821)变化趋势呈负相关,而与NE变化趋势呈正相关(P<0.05,r=0.809)。 结论 PCOS及抑郁2种因素均会使机体中枢DA,NE及5-HT分泌异常,影响下丘脑GnRH、血清LH及T的分泌,影响雌性大鼠的神经内分泌系统,引起机体卵巢组织学、临床表征及心理等发生变化;抑郁可能是PCOS发生及产生远期并发症的重要诱因,而PCOS又可导致抑郁的发生及加剧其发展。
多囊卵巢综合征; 抑郁; 神经递质药; 促性腺素释放激素; 性腺甾类激素
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是育龄期女性常见的一种内分泌紊乱疾病,以促黄体生成素、雄激素分泌过多、间断或持续无排卵为特征,主要表现为体质量增加、体毛多、痤疮、月经紊乱或闭经、不孕等。抑郁症是由多种因素引起的精神、心理疾病,研究发现多巴胺(dopamine,DA)、去甲肾上腺素(noradrenaline,NE)、5-羟色胺(5-serotonin,5-HT)等单胺类神经递质的异常与抑郁的发生及病变程度有密切关系[1]。
PCOS的发病机制最主要为下丘脑促性腺素释放素-黄体生成素脉冲发生器即下丘脑-垂体-卵巢轴(H-P-OA)发生异常,此发生器的中枢调节物质主要由DA,NE及5-HT等构成;上述递质又通过调节促性腺素释放素(gonadotropin releasing hormone,GnRH)、黄体生成素(luteinizing hormone,LH)、睾酮(testosterone,T)等因子在PCOS的病理生理机制中发挥作用。PCOS与精神、心理因素之间也存在内在联系。
Annagur等认为,PCOS是一种生理与心理的复合疾病,可因抑郁等心理问题触发,同时其可诱发抑郁[2]。人群心理研究认为,在不孕症患者中合并PCOS者,其抑郁量表评分及生活不满意度均明显升高[3]。对PCOS合并抑郁或抑郁影响PCOS的判断目前多由主观量表界定,迫于伦理限制,常无法深入研究人类神经内分泌系统的内在机制。
本研究拟采用Maharjan等的PCOS大鼠模型及Willner等的慢性应激抑郁大鼠模型的方法构建全新的PCOS合并抑郁大鼠模型[4-5],通过各种已知实验验证模型及检测下丘脑-垂体-卵巢轴上的单胺类神经递质、GnRH、LH及T,探讨神经内分泌系统各因素之间的关系,以此进一步评估PCOS与抑郁之间的因果联系及相互作用[6-8]。
1 材料与方法
1.1 材料
1.1.1 动物 6周龄SD清洁级雌性大鼠40只[福建医科大学实验动物中心,许可证号:SCXK(闽)2014-0001],体质量163 g,二级动物房饲养,恒温22 ℃,12 h光照12 h黑暗交替,自由摄取食物和水。每日定时作阴道涂片检查,观察大鼠动情周期,连续2个正常动情周期(4~5 d)的大鼠用于实验。同时实验前各组之间体质量、摄食量、旷场实验评分和糖水偏爱性在统计学上无显著性差异。
1.1.2 试剂 来曲唑(批号:H19991001,江苏恒瑞公司);BCA蛋白定量试剂盒(货号:GF2202,Gene-Foci公司);LH及T放射免疫试剂盒(批号:S10950199及S10950203,天津协和医药科技公司);GnRH ELISA试剂盒(货号:B100-65503,R&D公司);DA(货号H8502,美国Sigma公司)、5-HT(货号55591,美国Sigma公司)、NE标准品(货号407453,美国Sigma公司)。
1.1.3 仪器 γ放射免疫计数器(XH-6020,国营二六二厂);高效液相色谱仪(LC-10Atvp,日本岛津公司);荧光检测器(RF-10AXL,日本岛津公司),C18柱(Shim-pack,日本岛津公司)。
1.2 方法
1.2.1 分组 将具有规律动情周期SD雌性大鼠40只随机分为4组:空白组、抑郁组、PCOS组及PCOS合并抑郁组。空白组:自由摄取食物和水21 d;抑郁组:构建慢性不可预见性的应激动物模型的方法:实验动物孤养,刺激方式包括禁水24 h、禁食24 h、强迫游泳(冰水)5 min、昼夜节律转换[早8点(暗箱) 晚8点(照明)、制动2 h、夹尾(距离尾部1 cm)1 min、热刺激(40 ℃)5 min、鼠笼倾斜30度 15 h/d],以上刺激随机安排,每日1种,连续21 d,同种刺激不连续出现[5];PCOS组:构建大鼠模型的来曲唑法:实验动物孤养,每日灌胃溶解在1%羟甲基纤维素水溶液(CMC 2 mL/kg)的来曲唑0.5 mg/kg,21 d[4];PCOS合并抑郁组:结合上述2组模型的构建方法:实验动物孤养,每日8:00灌胃溶解在1%羟甲基纤维素水溶液(CMC 2 mL/kg)的来曲唑0.5 mg/kg后,再开始慢性应激刺激,刺激方式同上,随机安排,每日1种,连续21 d,同种刺激不连续出现。
1.2.2 大鼠体质量变化情况 参照文献[6]的方法,每日以电子称称量大鼠体质量,比较各组大鼠体质量变化情况。
1.2.3 卵巢标本采集及处理 腹腔注射水合氯醛(0 .3 mL/100 mg)麻醉,打开腹腔,取出双侧卵巢,用10%中性福尔马林固定后石蜡包埋,光镜下(H-E染色)观察卵巢组织学改变。
1.2.4 大鼠动情周期变化 阴道分泌物涂片,瑞氏染色液染色干燥后,显微镜观察细胞形态确定动情周期。
1.2.5 旷场实验 参照文献[7]的方法,旷场实验箱由黑色不透明材料制成,底面为75 cm×75 cm的正方形,周壁高40 cm,底面分为面积相等的25块。8:30-12:00在安静的房间内进行此项实验。将大鼠置于方格的中心,计时3 min,根据动物穿越底面方格数(四爪均进入方格可计数)作为水平活动得分,以直立次数(两前爪腾空或攀附箱壁)为垂直活动得分,水平和垂直得分总和为总分。彻底清洁实验箱后再进行下1只大鼠的观察。
1.2.6 糖水消耗实验 参照文献[8]的方法,实验前48 h,在安静的房间内训练大鼠适应饮糖水,给动物2瓶水,1瓶为1%的蔗糖水,另1瓶为普通纯水,2瓶重量一致。大鼠单笼饲养,禁水禁食24 h后,给每只大鼠重量相等的2瓶水:1瓶1%蔗糖水,1瓶普通纯水,让其自由饮水1 h,然后通过称取饮水瓶的重量计算消耗量,按以下公式计算:
动物对糖水的偏爱性(%)=糖水摄入(g)/总摄入(糖水摄入+纯水摄入)(g)×100%
1.2.7 血清中激素的测定 旷场实验及糖水消耗实验后24 h,禁食8 h,对所有大鼠进行腹腔麻醉后腹腔静脉取血,约4~5 mL,将全血1 500 r/min离心5 min,取其上层血清,同时加入相应抑肽酶,将血清置于-20 ℃冷藏箱中,留待测定大鼠LH及T(据放射免疫分析药盒说明书测定),其中T单位:ng/dL;LH单位:mIU/mL。
不同指标加入标准品、质控血清和样本不尽相同,分别是:T:100 μL;LH:200 μL。
1.2.8 取大鼠下丘脑及制备检测样本 取出大鼠全脑,将全脑腹侧面向上,按Paxinos和Watson的大鼠脑立体定位图谱分别于视交叉前和乳头体后用双面刀片垂直切割,剥离大脑及周围组织取出下丘脑部分,将下丘脑组织分为两部分,一部分应用ELISA测定其中的GnRH,另一部分应用高效液相色谱-荧光检测流速梯度法测定其中的NE,DA及5-HT。
1.2.9 ELISA测定下丘脑中的GnRH 将上述处理好的一部分下丘脑组织迅速倒入玻璃匀浆器中,加入适量生理盐水捣碎,1 000 r/min离心10 min,取上清液,应用BCA蛋白定量试剂盒按照其说明书测定各样本总蛋白含量,通过定容调整使各样本总蛋白含量相同,前后各取50 μL样本,分别使用人GnRH ELISA试剂盒,按照说明书检测样本含量。
1.2.10 高效液相色谱-荧光检测流速梯度法检测下丘脑中的NE,DA及5-HT 标准品和脑匀浆样品的制备:准确称取标准品NE 4.23 mg,DA 47.40 mg,5-HT 53.18 mg,分别溶于0.1 mol/L HCl中,并定容于25 mL容量瓶,制成标准品储备液(NE 5 mmol/L,DA 10 mmol/L,5-HT 10 mmol/L)。再按需要用0.1 mol/L HCl稀释成各种浓度的标准液。
将另一部分下丘脑组织倒入玻璃匀浆器中,加入少量冰冷的0.4 mol/L HClO4溶液,在冰浴中充分研磨使组织匀浆化,将匀浆液转入Ependet管中,加冰冷的0.4 mol/L HClO4溶液适量,涡流2 min,置高速冷冻离心机(4 ℃)内以12 000 r/min离心20 min,将离心后的上清液转入Ependet管中,再以12 000 r/min二次离心15 min,取上清液用0.4 mol/L HClO4溶液定容至1 mL,涡流混匀,即得脑组织样品溶液。样品经HClO4处理后呈强酸性,加入一半样品体积的钾盐沉淀(20 mmol/L柠檬酸钾,300 mmol/L K2HPO4,2 mmol/L Na2EDTA),冰预10 min后离心(同前),取上清液再进样。色谱条件为Shim-pack C18柱,6.0 mm i.d.×150 mm,5 μm;流动相:0.1 mol/L的KH2PO4缓冲液-甲醇(体积比为9∶1)。单泵流速线性梯度程序:0.5 mL/min×10 min→1 mL/min×2.5 min→1.5 mL/min×20 min→0.5 mL/min。进样环体积为20 μL;柱温为室温;荧光检测器的激发波长为254 nm,发射波长为338 nm。
2 结 果
2.1 大鼠体质量情况 实验前各组大鼠体质量无明显差别(P>0.05),实验结束后各组大鼠体质量比较,PCOS合并抑郁组较空白组大鼠体质量无明显差别(P>0.05);抑郁组大鼠较空白组大鼠体质量明显降低(P<0.05);PCOS组大鼠较空白组大鼠体质量明显升高(P<0.05,表1)。

表1 各组大鼠体质量比较
n=10. PCOS:多囊卵巢综合征. 与空白组比较,☆:P<0.05.
2.2 阴道脱落细胞涂片观察大鼠动情周期 持续观察大鼠阴道脱落细胞涂片21 d,发现空白组大鼠阴道脱落细胞变化符合正常大鼠动情周期;抑郁组阴道脱落细胞变化不规则;而PCOS组大鼠在给来曲唑第5天起,规律动情周期消失,均处动情间期,镜下仅见大量白细胞及少量角化细胞,提示无排卵。PCOS合并抑郁组与PCOS组表现相似(图1)。
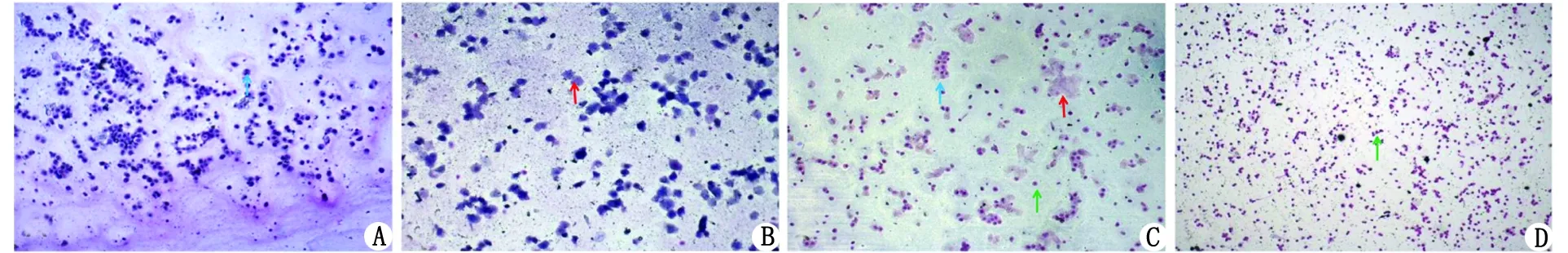
A 动情前期:大量有核细胞; B 动情期:大量角化细胞; C 动情后期:有核细胞、角化细胞及白细胞; D 动情间期:大量白细胞.图1 大鼠动情周期示意图(瑞氏染色 ×100)Fig 1 The schematic diagram of rat model of emotion(Wright’s staining ×100)
2.3 卵巢组织学H-E染色观察 空白组:卵泡内颗粒细胞呈多层,可达8~9层,可见各级不同发育阶段的卵泡,卵巢白膜较薄。抑郁组:卵泡呈囊状扩张,颗粒细胞层数减少至2~3层,可见少量的小卵泡及闭锁卵泡,卵巢白膜厚。PCOS组:卵泡呈囊状扩张明显,卵母细胞和放射冠消失,颗粒细胞层数减少明显,可见较多的小卵泡及闭锁卵泡,卵巢白膜较厚。PCOS合并抑郁组:卵泡数目明显减少,以小卵泡及闭锁卵泡为主,部分呈囊状扩张,卵母细胞和放射冠消失,颗粒细胞层数减少更明显,卵巢白膜厚(图2)。
2.4 大鼠行为情况 抑郁组、PCOS组、PCOS合并抑郁组大鼠水平运动得分(P<0.05)和垂直运动得分(P<0.05)都显著低于空白组,而抑郁组、PCOS组、PCOS合并抑郁组3组之间水平运动得分(P>0.05)和垂直运动得分(P>0.05)均无显著差异(表2)。
2.5 液体消耗结果 抑郁组、PCOS组、PCOS合并抑郁组大鼠的糖水消耗和糖水偏爱百分比都显著低于空白组(P<0.05),而纯水消耗量则显著高于空白组(P<0.05),总液体消耗在整个造模过程中无明显变化。抑郁组、PCOS组、PCOS合并抑郁组3组大鼠之间的糖水消耗和糖水偏爱百分比都无显著差别(P>0.05,表3)。

A:空白组; B:抑郁组; C:PCOS组; D:PCOS合并抑郁组. PCOS:多囊卵巢综合征.图2 大鼠卵巢切片H-E染色示意图(H-E染色 ×400)Fig 2 The schematic diagram of H-E staining of ovarian of rat model (H-E staining ×400)
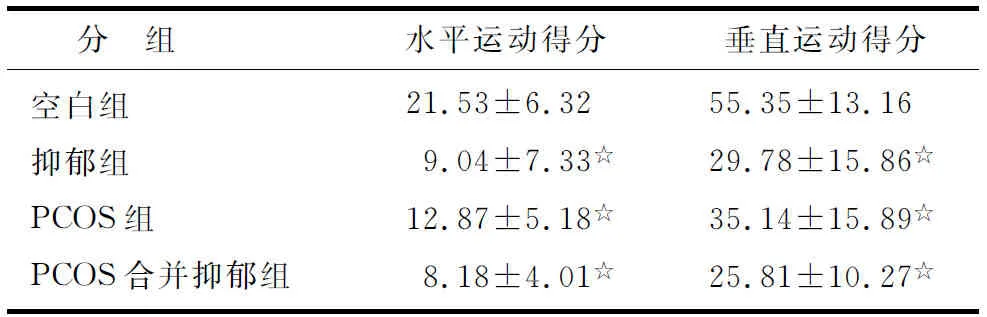
表2 各组大鼠行为情况结果比较
n=10. PCOS:多囊卵巢综合征. 与空白组比较,☆:P<0.05.
2.6 血清T及LH结果 抑郁组、PCOS组、PCOS合并抑郁组大鼠血清中T及LH水平均高于空白组,且有逐渐递增趋势。PCOS组、PCOS合并抑郁组大鼠血清中T及LH的水平高于空白组,PCOS合并抑郁组大鼠高于抑郁组,差别均具有统计学意义(P<0.05)。空白组与抑郁组之间、抑郁组与PCOS组之间、PCOS组与PCOS合并抑郁组之间虽有差别,但均无统计学意义(P>0.05)。

表3 各组大鼠液体消耗结果比较
n=10. PCOS:多囊卵巢综合征. 与空白组比较,☆:P<0.05.
表4 各组大鼠血清中T及LH的结果比较
Tab 4 Comparison of T and LH in serum of rats in each group

分 组ρT/(ng·dL-1) ρLH/(mIU·mL-1)空白组抑郁组PCOS组PCOS合并抑郁组8.95±1.6728.48±14.6561.75±27.82☆74.00±24.75☆◆1.46±0.372.12±0.313.12±0.81☆5.28±1.39☆◆
n=10. PCOS:多囊卵巢综合征; T:睾酮; LH:黄体生成素. 与空白组比较,☆:P<0.05;与抑郁组比较,◆:P<0.05.
2.7 下丘脑GnRH水平结果 抑郁组、PCOS组、PCOS合并抑郁组大鼠下丘脑GnRH水平[(15.289±2.079),(21.115±1.369),(29.767±1.772)ng/mL]均高于空白组[(11.799±1.385)ng/mL],并呈递增趋势。4组大鼠两两之间,除PCOS组与空白组、PCOS合并抑郁组与空白组及PCOS合并抑郁组与抑郁组有显著差别外(P<0.05),其余各组两两之间虽有差别,但无统计学意义(P>0.05)。
2.8 下丘脑中DA,NE及5-HT结果 抑郁组、PCOS组、PCOS合并抑郁组3组大鼠下丘脑DA及NE及5-HT水平均有别于空白组,NE有递增趋势,DA及5-HT有递减趋势。PCOS组DA水平与空白组、PCOS合并抑郁组与空白组比较,差别有统计学意义外(P<0.05),其余各组两两之间虽有差别,但无统计学意义(P>0.05)。PCOS合并抑郁的NE水平与空白组比较,差别有统计学意义外(P<0.05),其余各组两两之间虽均有差别,但无统计学意义(P>0.05)。4组大鼠两两之间5-HT水平比较,差别均有统计学意义(P<0.05,表5)。
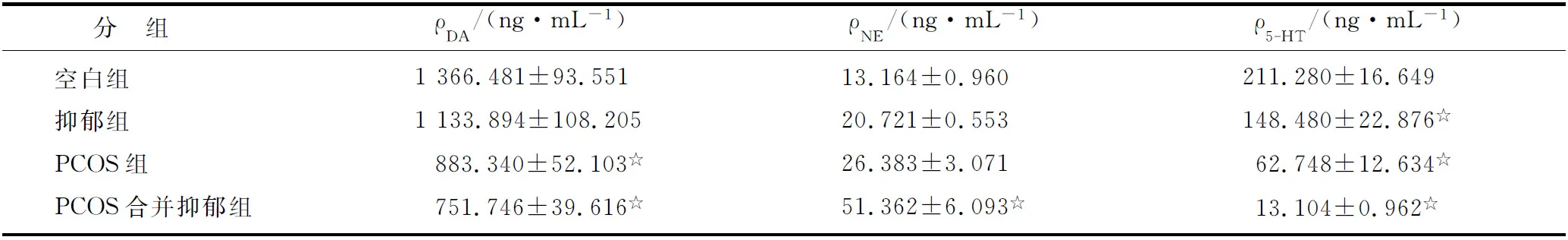
表5 各组大鼠下丘脑中DA,NE及5-HT水平的比较
PCOS:多囊卵巢综合征; DA:多巴胺; NE:去甲肾上腺素; 5-HT:5-羟色胺. 与空白组比较,☆:P<0.05.
2.9 下丘脑中GnRH与DA,NE,5-HT的相关性 4组中GnRH水平变化趋势与DA水平变化趋势呈负相关(P<0.05,r=-0.874),与5-HT水平变化趋势呈负相关(P<0.05,r=-0.821),GnRH水平变化趋势与NE水平变化趋势呈正相关(P<0.05,r=0.809)。
3 讨 论
PCOS是育龄期妇女最常见的内分泌紊乱疾病,是具有特异性的神经内分泌及基础代谢改变的疾病,其发病与下丘脑-垂体-卵巢轴调控异常密切相关。抑郁症是以显著而持久的抑郁情感或心境改变为主要特征,是与应激紧密联系的一类心理疾病。抑郁症发病机理以中枢单胺类神经递质分泌异常及功能紊乱最为认可,其中DA,NE及5-HT与抑郁症的发生关系密切[9]。PCOS与抑郁症之间通过下丘脑-垂体-卵巢轴在神经内分泌解剖及遗传学等方面存在着联系。
慢性应激为长期或反复的刺激,当机体受到慢性应激时,出现神经内分泌系统紊乱,即通过单胺类神经递质影响下丘脑中GnRH,进而影响垂体LH及血清T等。研究证实,抑郁与中枢神经递质DA,NE和5-HT功能障碍有关[10]。研究发现,慢性应激抑郁导致大鼠下丘脑DA及5-HT含量降低,下丘脑NE含量上升[11]。对抑郁患者的研究发现,血清中DA及5-HT含量明显降低,NE含量有明显上升[12]。本研究中,通过慢性轻度不可预见性应激成功构建的慢性抑郁大鼠模型,其下丘脑中DA,NE和5-HT的水平与空白组均有差别,其中5-HT的差别有统计学意义,提示与正常大鼠比较,慢性抑郁大鼠下丘脑中DA及5-HT含量降低,NE含量上升。
PCOS作为一种身心疾病,常合并抑郁等心理问题,机体在此状态下神经递质特别是单胺类神经递质可发生代谢变化。GnRH是一种多肽性激素,具有促进垂体分泌对其有依赖性的促性腺激素(gonadotropins,Gn),通过Gn再促进性激素释放,此即为下丘脑-垂体-卵巢轴分泌全程。对PCOS患者血清进行研究后发现,DA及5-HT含量明显降低,NE含量有明显上升变化[9]。本研究通过来曲唑成功构建PCOS大鼠模型,通过检测其下丘脑组织发现,下丘脑中DA,NE和5-HT的水平与空白组有差别,其中NE与5-HT差别有统计学意义,提示与正常大鼠比较,PCOS大鼠下丘脑中DA及5-HT含量降低,NE含量上升。
无论是抑郁大鼠还是PCOS大鼠,其下丘脑中单胺类神经递质可以通过下丘脑-垂体-卵巢轴起作用,通过调控GnRH来引起下游激素的改变。Liu等研究发现,DA能有效抑制成年小鼠约50%的GnRH神经元放电[13]。Han等利用转基因GnRH绿色荧光蛋白的小鼠模型证实了NE对雄性和雌性小鼠GnRH神经元的电兴奋性作用,间接反映了NE促进GnRH[14]。Pronina等在对胎儿小鼠的研究中发现,5-HT能抑制GnRH神经元前体细胞的增殖,反映其对GnRH的抑制作用[15]。
本研究采用来曲唑构建大鼠PCOS模型、慢性轻度不可预见性应激构建大鼠抑郁模型及尝试利用上述两种因素叠加作用于大鼠后构建一种全新的PCOS合并抑郁大鼠模型,并通过阴道涂片、卵巢组织学观察、血清激素水平测定、旷场试验及糖水消耗实验等验证了PCOS合并抑郁大鼠的阴道涂片结果符合PCOS持续无排卵的特点;血清激素LH及T水平明显高于空白组,符合PCOS内分泌改变的特点;其旷场试验及糖水消耗实验结果相对于空白组差别有统计学意义,符合抑郁疾病特点。综上所述,PCOS合并抑郁大鼠模型构建成功。本研究证实抑郁及PCOS 2种因素均会影响血液中的T及LH的含量及下丘脑中GnRH,DA,NE和5-HT的水平。
在下丘脑中,DA,NE及5-HT等是体现抑郁等精神、心理疾病指标,4组大鼠下丘脑中DA,NE及5-HT水平有明显差别,具有统计学意义(P<0.05),NE有递增趋势,DA及5-HT有递减趋势。上述结果提示,在抑郁及PCOS 2种因素干预下,大鼠下丘脑5-HT,DA及NE水平与空白组比较有明显差别,可认为此2种因素均可能导致精神、心理失衡,2种因素叠加后可加剧失衡情况,雌性机体在抑郁基础上再经历PCOS干预,其病情可能进一步加重。
4组大鼠下丘脑GnRH水平比较,差别有统计学意义,GnRH水平变化趋势与DA水平变化趋势呈负相关,与5-HT水平变化趋势呈负相关,与NE水平变化趋势呈正相关,表明GnRH可受上述三者单胺类神经递质控制调节,与其共同变化。当机体精神、心理发生变化时,脑内神经递质会发生变化,从而影响GnRH的分泌,影响性激素的分泌。
抑郁及PCOS对大鼠内分泌激素方面的影响主要体现在血清中T及LH水平。4组大鼠之间血清中T及LH水平有差别(P<0.05),且激素水平呈逐渐递增趋势,表明抑郁及PCOS因素均可导致内分泌激素异常,2种因素叠加后可使内分泌失调加剧。若雌性机体在PCOS内分泌调节改变的情况下再经历慢性应激而导致抑郁的发生,其内分泌紊乱更加严重,可认为抑郁能加重PCOS病情并导致其远期并发症发生,这表明在内分泌激素调节方面PCOS因素起主导作用,可明显促进T及LH升高,而抑郁因素作用有限。考虑到目前临床上PCOS诊断主要依据上述2种激素变化,推断抑郁可能仅是PCOS诱因之一。
PCOS及抑郁2种因素均会影响雌性大鼠的神经内分泌系统,使机体中枢DA,NE及5-HT的分泌异常,从而影响下丘脑GnRH、血清LH及T的分泌,引起机体卵巢组织学、临床表征及心理发生变化,所以上述2种因素可能存在互为因果、相互促进的关系。抑郁可能是PCOS发生及产生远期并发症的重要诱因,而PCOS又可导致抑郁的发生及加剧其发展,这为进一步了解抑郁与PCOS之间的相关性研究提供理论支持。
[1] Luo H O,Yang M H,Zhao H,etal. Activity of neurotran-smitter on encep-halofluctuograph in patients with depression[J].JChinPLAPostgradMedSch, 2011,32(4):347-348,356.
[2] Annagur B B,Tazegul A,Uguz F,etal. Biological correlates of major depression and generalized anxiety disorder in women with polycystic ovary syndrome[J].JPsychosomRes, 2013,74(3):244-247.
[3] Zueff L N,da Silva Lara L A,Vieira C S,etal. Body composition characteristics predict sexual functioning in obese women with or without PCOS[J].JSexMaritalTher, 2015,41(3):227-237.
[4] Maharjan R,Nagar P S,Nampoothiri L. Effect of aloe barbadensis Mill.F-ormulation on Letrozole induced polycystic ovarian syndromerat model[J].JAyurvedaIntegrMed, 2010,1(4):273-279.
[5] Willner P,Towell A,Sampson D,etal.Reduction of sucrose preference by chronic unpredictable mild stress, and its restoration by a tricyclic antidepressant[J].Psychopharmacology,1987,93(3): 358-364.
[6] Willner P. Validity, reliability and utility of the chronic mild stress model of depression: a 10-year review and evaluation[J].Psychopharmacology, 1997,134(4): 319-329.
[7] Fenli S,Feng W,Ronghua Z,etal.Biochemical mechanism studies ofvenlafaxine by meta bonomic method in rat model of depression[J].EurRevMedPharmacolSci, 2013,17(1):41-48.
[8] Gomez-Galan M,de Bundel D,van Eeckhaut A,etal. Dysfunctionalastrocytic regulation of glutamate transmission in a rat model of depression[J].MolPsychiatry, 2013,18(15):582-594.
[9] Racagni G, Brunello N. Physiology to functionality: The brain and neurotr-ansmitter activity[J].IntClinPsychopharmacol, 1999,14:3-7.
[10] 袁勇贵,吴爱勤,张心保.焦虑和抑郁合病的生理学研究进展[J].国外医学精神病学分册,2000,97:143-145.
[11] Anisman H,Kelly O,Hayley S,etal. Acoustic startle and fear-potentiated startle in rates selectively bred for fust and slow kindling rates: relation to monoamine activity[J].EurJNenrosci, 2000,12(12):4405-4416.
[12] Shi X,Zhang L,Fu S,etal. Co-involvement of psychological and neurological abnormalities in infertility with polycystic ovarian syndrome[J].ArchGynecolObstet, 2011,284(3):773-778.
[13] Liu X,Herbison A E. Dopamine regulation of gonadotropin-releasing hormone neuron excitability in male and female mice[J].Endocrinology,2013,154(1):340-350.
[14] Han S K, Herbison A E. Norepinephrine suppresses gonadotropin-releasing hormone neuron excitability in the adult mouse[J].Endocrinology,2008,149(3):1129-1135.
[15] Pronina T,Ugrumov M,Calas A,etal. Influence of monoamines on diff-erentiating gonadotropin-releasing hormone neurones in foetal mice[J].JNeuroendocrinol,2003,15(10):925-932.
(编辑:张慧茹)
The Influence of PCOS and Depression on the Expression of Neuro-transmitter on Hypothalamic and LH, T in Serum of Female Rats
ZHENG Luo1, CHEN Quan2, ZHENG Zhiqun1
1. Department of Obstetrics and Gynecology,Fujian Medical University Union Hospital, Fuzhou 350001,China; 2. Department of Neurosurgery, Fujian Medical University Union Hospital, Fuzhou 350001,China
Objective To study the impacts of PCOS and depression on serum sex hormone and Neuro-transmitter. To analyze the relationship between depression and PCOS, and to provide the reference for clinical research. Method Forty female SD rats were divided into four groups: normal control group, depression group, PCOS group, and depression with PCOS group. Serum T and LH levels were measured by radioimmunoassay. The levels of GnRH, NE, DA and 5-HT in hypothalamus were measured by ELISA and HPLC fluorescence. Results The difference in rats serum LH and T levels were statistically significant among the four groups(P<0.05), and there was a gradual increasing trend. The difference in GnRH levels of rats in the hypothalamus among the four groups had statistical significance(P<0.05), and there was a gradual increasing trend. DA, NE and 5-HT levels in hypothalamus were significantly different among 4 groups (P<0.05), while the NE level showed a increasing trend, whereas DA and 5-HT showed a decreasing trend. Correlation analysis showed that the level of GnRH in each group had a positive correlation with NE(P<0.05,r=0.809). The level of GnRH was negatively correlated with DA(P<0.05,r=-0.874)and 5-HT(P<0.05,r=-0.821). Conclusion PCOS and depression are two key factors that may affect the neuroen-docrine system in SD female rats. The abnormal secretion of DA, NE and 5-HT may affect the secretion of hypothalamic GnRH, serum LH and T therefore induce clinical manifestation and psychological and ovarian changes in female rats. Depression may be an important cause of PCOS occurrence and long-term complications, while PCOS can also lead to the occurrence of depression and aggravate its development.
polycystic ovary syndrome; depression; neurotransmitter agents; gonadotropin-releasing hormone; gonadal steroid hormones
2017-01-10
福建医科大学 附属协和医院 福州 350001 1.妇产科,2.神经外科
郑 珞,女,主治医师,医学硕士
陈 权. Email: 395304751@qq.com
R322.65; R347.512; R711.75; R737.31; R749.42; R749.72; R977.1
A
1672-4194(2017)03-0159-07
