晚期早产儿振幅脑电图变化特点及影响因素分析
2017-08-11邵巧燕林碧云马碧泓
邵巧燕, 吴 斌, 刘 健, 林碧云, 马碧泓
晚期早产儿振幅脑电图变化特点及影响因素分析
邵巧燕, 吴 斌, 刘 健, 林碧云, 马碧泓
目的 探讨晚期早产儿生后早期振幅整合脑电图(aEEG)变化特点,并分析影响aEEG的临床因素。 方法 分析65例晚期早产儿aEEG变化。探讨胎龄、宫内营养、窒息和临床严重疾病等因素对aEEG影响。采用χ2检验、非参数检验及Logistic回归分析进行统计学分析。 结果 (1)胎龄越长,晚期早产儿aEEG评分越高(χ2=13.6,P=0.01);(2)窒息严重程度越重,aEEG异常发生率越高(χ2=15.3,P=0.02);(3)合并临床严重疾病组aEEG异常发生率高(χ2=11.6,P=0.01);(4)Logistic回归分析提示,合并临床严重疾病是aEEG结果异常的独立危险因素(OR=1.2,95%CI:1.1~10.7,P=0.04);(5)除临床严重疾病因素外,窒息也是aEEG结果异常独立危险因子(OR=1.5,95%CI:1.5~15.1,P=0.01);(6)aEEG成熟度评分与NBNA评分正相关(r=0.77,P=0.02)。 结论 随着胎龄增长,晚期早产儿aEEG逐渐成熟,但窒息和临床严重疾病等因素是影响aEEG的独立危险因素,临床上应关注合并高危因素的晚期早产儿脑功能变化。
脑电描记术; 婴儿,早产; 婴儿,新生,疾病; 婴儿,小于胎龄; 窒息
晚期早产儿以往称为近足月儿,指胎龄34~36+6周的早产儿,约占早产儿的70%[1]。研究表明,晚期早产儿出生人数逐年增加,其住院期间低血糖、黄疸、呼吸暂停、呼吸窘迫综合征及神经发育障碍的发生率等均明显高于足月儿[2-3]。近年来,晚期早产儿的呼吸系统、感染、喂养及神经影像等临床问题逐渐得到重视。虽然晚期早产儿近足月出生,但发育并不成熟,同样面临着远期神经发育障碍的问题[4]。振幅整合脑电图 (amplitude integrated electroencephalogram, aEEG) 是一种简便、有效的神经功能监测手段,可应用于监测患儿脑功能状态和脑损伤程度,能较好地评价早产儿脑功能状态,并判断远期神经发育预后[5]。本研究旨在探讨晚期早产儿出生后早期aEEG变化特点,并分析影响aEEG变化的临床因素。
1 对象与方法
1.1 对象 选取2015年12月—2016年10月就诊于新生儿科的65例晚期早产儿,男性40例,女性25例,胎龄34~36+6周;出生体质量(2 031±318) g(1 510~2 830 g)。纳入标准:(1)出生胎龄34~36+6周;(2)日龄:出生后24 h以内。排除标准:(1)生后24 h内未完成aEEG监测;(2)纠正胎龄38~40 周时未返院完成NBNA评分;(3)颅脑磁共振检查提示严重神经疾病(Ⅲ~Ⅳ度脑室周围脑室内出血、脑梗死、脑室周围白质软化)及神经系统畸形(脑积水)。选取同期足月新生儿20例为对照组,对照组入院24 h内完成振幅脑电图检查,并排除严重神经疾病。本研究由福建医科大学附属第一医院医学伦理委员会通过审批,所有研究对象均在监护人知情同意后进行监测。
1.2 方法
1.2.1 aEEG监测方法 采用NicoletOne视频脑电监测仪(VIASYS Healthcare,USA),在研究对象出生后24 h内进行aEEG描记。操作前清洁新生儿局部头皮常规去脂,涂好导电膏,安放银质盘状电极,火棉胶固定,保持监测环境温度、湿度、灯光等条件一致。记录电极为双额、顶骨电极(相当于10/20系统的F3,F4,C3,C4,P3及P4处),参考电极及地极放置在前额处, 脑电信号以半对数形式输出、存盘,速度为6 cm/h。描记的图形表现为以振幅形式出现的波谱带。每次描记至少4 h。
1.2.2 aEEG的评估 参照文献[6-8]的标准对脑电图的背景活动及睡眠周期进行评价。将新生儿aEEG的背景活动分为3种:背景活动正常,具有连续性(波谱带上边界>10 μV,下边界>5 μV),为正常脑电图;部分连续(波谱带上边界>10 μV,下边界≤5 μV)和不连续(波谱带上边界<10 μV,下边界<5 μV)脑电图,振幅轻度抑制或伴有癫痫样活动均为异常脑电图[9]。
1.2.3 新生儿神经行为评分 使用鲍秀兰20项新生儿神经行为测定评分(neonatal behavioral neurological assessment, NBNA评分),对晚期早产儿纠正胎龄38~40周时进行门诊随访,对照组在入院期间完成NBNA评分,以判断患儿神经系统近期预后[10]。由新生儿科经过培训合格的专职人员进行测定,满分40分,≤35分为异常。
1.2.4 分组及诊断标准 晚期早产儿根据胎龄分为3组:34~34+6周、35~35+6周及36~36+6周;根据宫内营养状态(出生胎龄与体质量)分为:营养良好组及营养不良组;根据出生后是否合并严重临床疾病,依据新生儿危重病例评分分为:病情相对平稳组和严重疾病组(严重疾病包括新生儿呼吸窘迫综合征、新生儿呼吸衰竭、频繁呼吸暂停、新生儿脓毒性休克,新生儿低血糖症);根据出生后Apgar评分分为:无窒息组、轻度窒息组及重度窒息组。
1.2.5 分析内容 分析晚期早产儿aEEG变化特点,探讨胎龄、宫内营养、窒息和疾病等因素对晚期早产儿aEEG的影响以及纠正胎龄足月时NBNA评分与aEEG的关系。
1.3 统计学处理 应用SPSS 24.0软件进行处理,非正态分布计量资料以中位数及四分位数 [M(P25, P75)] 表示, 组间比较采用非参数检验。计数资料用率(%)表示, 组间比较采用非参数卡方检验。组间比较P<0.05为差别有统计学意义。采用Logistic回归分析进行多因素检验,P<0.05 为差别有统计学意义。
2 结 果
2.1 晚期早产儿一般情况 各胎龄组在性别、发病时间、分娩方式及aEEG 检查时间等方面比较,差别无统计学意义。晚期早产儿出现早产的高危因素,包括母亲妊娠期高血压或子痫前期(23例)、多胎妊娠(16例)、胎膜早破(24例)、母亲糖尿病(16例),羊水过少(6例),前置胎盘(8例)、胎盘早剥(6例),具体见表1。

表1 一般情况
2.2 晚期早产儿生后24 h内aEEG结果 随着胎龄的增长,晚期早产儿生后24 h内aEEG在连续性睡眠周期、下边界振幅、带宽结合下边界及总评分等方面逐渐成熟,其中睡眠周期、带宽结合下边界及总评分差别有统计学意义(P<0.05), 连续性及下边界振幅差别无统计学意义(P>0.05,表2)。
表2 34~36周晚期早产儿aEEG评分
Tab 2 The amplitude integrated electroencephalogram scores of late preterm infants
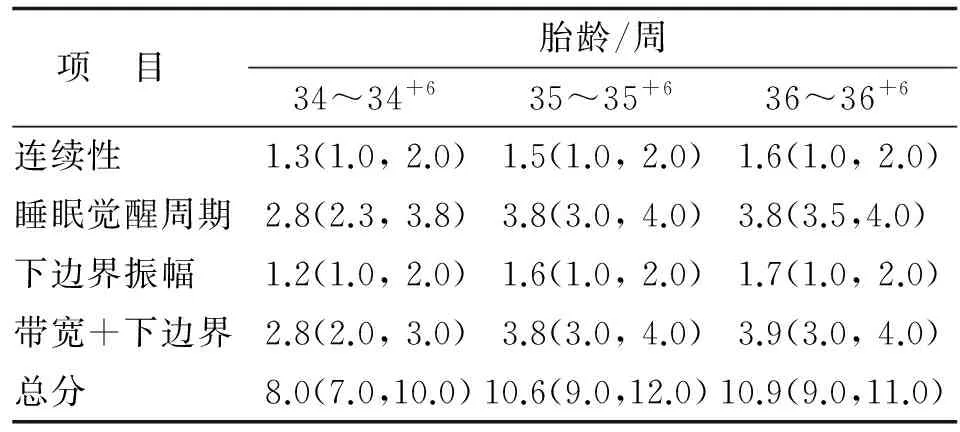
项 目 胎龄/周34~34+635~35+636~36+6连续性1.3(1.0,2.0)1.5(1.0,2.0)1.6(1.0,2.0)睡眠觉醒周期2.8(2.3,3.8)3.8(3.0,4.0)3.8(3.5,4.0)下边界振幅1.2(1.0,2.0)1.6(1.0,2.0)1.7(1.0,2.0)带宽+下边界2.8(2.0,3.0)3.8(3.0,4.0)3.9(3.0,4.0)总分8.0(7.0,10.0)10.6(9.0,12.0)10.9(9.0,11.0)
aEEG:振幅整合脑电图. 表中数据为[M(P25,P75)].
2.3 aEEG结果的影响因素
2.3.1 出生胎龄对aEEG影响 随着胎龄增长,足月儿aEEG背景活动异常率55.0%(11/20),晚期早产儿aEEG背景活动异常率由60.0%(15/25)降至42.8%(6/14), 4组之间差别有统计学意义(χ2=12.1,P<0.05), 但晚期早产儿3组之间差别无统计学意义(χ2=4.3,P>0.05,表3)。
表3 出生胎龄对晚期早产儿aEEG背景活动影响
Tab 3 The influence of gestational age of late preterm birth to aEEG background

胎龄/周nn正常n异常背景周期合计☆34~34+62510158835~35+62613137736~36+6148644足月儿2091133
aEEG:振幅整合脑电图. ☆:背景活动及周期均异常.
2.3.2 宫内营养状态对aEEG影响 营养不良组24例,脑电图异常率为45.8%(11/24);营养良好组41例,脑电图异常率为53.6%(22/41),2组比较,差别无统计学意义(χ2=3.4,P>0.05)。
2.3.3 临床严重疾病对aEEG影响 相对平稳组42例,合并严重疾病组23例(新生儿呼吸窘迫综合征6例、新生儿呼吸衰竭4例、频繁呼吸暂停6例,新生儿脓毒性休克3例,新生儿低血糖症4例)。相对平稳组脑电图异常率为45.2%(19/42),合并严重疾病组脑电图异常率为65.2%(15/23),2组比较,差别有统计学意义(χ2=11.6,P<0.05)。
2.3.4 窒息对aEEG影响 无窒息组41例,轻度窒息组19例,重度窒息组5例,脑电图异常发生率分别为41.5%(17/41)、68.4%(13/19)及80.0%(4/5),3组比较,差别有统计学意义(χ2=15.3,P<0.05)。
2.3.5 影响晚期早产儿aEEG结果的多因素分析 将出生胎龄、宫内营养状态、窒息及全身疾病等因素纳入Logistic回归分析,发现全身疾病情况是晚期早产儿aEEG结果异常的独立危险因素(OR=3.3,95%CI:1.1~10.7,P=0.04,表4);剔除全身严重疾病早产儿后重新分析出生胎龄、宫内营养和窒息因素对脑电图的影响,发现窒息也是晚期早产儿aEEG结果异常的独立危险因子(OR=3.6,95%CI:1.1~12.1,P=0.01)。
表4 影响晚期早产儿aEEG结果的多因素分析
Tab 4 Multiple factors affect the results of late preterm aEEG

影响因素POR95%CI出生胎龄0.511.10.3~6.8宫内营养0.063.20.1~1.0严重疾病0.053.31.1~10.7围产期窒息0.060.31.1~12.1
aEEG:振幅整合脑电图.
2.3.6 NBNA评分与aEEG的相关性研究 晚期早产儿生后纠正胎龄38~40周期间行新生儿神经行为评分(NBNA),aEEG异常率与NBNA异常符合率52.0%(13/25),此外aEEG成熟度评分与NBNA评分具有正相关,晚期早产儿生后第1天aEEG成熟度越高,纠正胎龄时NBNA评分就越高(r=0.77,P<0.05)。
3 讨 论
近年来,晚期早产儿出生人数逐年增加。研究发现,晚期早产儿容易出现脑损伤,其中中脑白质损伤占71.9%,占全部晚期早产儿的42.6%[11]。研究显示,晚期早产儿大脑灰质发育欠佳,主要表现在右侧颞叶及顶叶皮层容积及密度减少,在成长过程中容易出现认知、行为问题、学习困难、脑瘫、精神发育迟滞和智力低下等神经系统后遗症[12-13]。Mcgowan等对4 581项针对晚期早产儿1~7岁期间的学习与行为研究进行系统评价[14],认为晚期早产儿在1~7岁的发育阶段较足月婴儿更容易出现学习困难和行为障碍。因此,监测晚期早产儿脑功能变化,早期识别脑损伤是非常必要的。近年来,aEEG逐渐发展为新生儿监护室重要监护技术手段,是早产儿脑损伤的监测和预后评估的重要方法[15-16]。
晚期早产儿大脑尚处于快速发育阶段,妊娠晚期34~40周的宫内发育阶段极为重要,妊娠34~40周大脑皮质体积将增加50%,25%的小脑发育也在这段时间完成[17]。施亿赟等分析正常28~36周早产儿aEEG的背景连续性、睡眠-觉醒周期、窄带下边界电压和带宽[18],发现出生时胎龄越大,aEEG越成熟,aEEG图形的连续性增加,睡眠~觉醒周期逐渐明显,窄带下界电压逐渐升高,带宽变窄。Cui等研究不同受孕龄早产儿aEEG图形的连续性、睡眠周期及宽带、窄带下边界、上边界和带宽等参数[19],同样认为随着胎龄增长,aEEG的连续性及成熟睡眠周期的比例增加,宽带及窄带下边界的振幅增高, 窄带的下限电压上升和窄带宽度变窄。本研究发现,随着胎龄的增长,aEEG在连续性、睡眠周期、下边界振幅、带宽结合下边界及总评分等方面逐渐成熟,并且脑电图异常率也上升,其中不同胎龄aEEG背景连续性、下边界振幅及脑电图异常发生率比较差别无统计学意义,可能与样本量较少及不同胎龄病例分布不均有关系。
宫内营养状态不良可出现神经系统发育障碍,常导致行为异常、智力发育落后,明显增加儿童神经发育障碍和不良神经心理的风险,导致学习和记忆功能障碍以及成年期较低的学术及专业成就[20-22]。Schwindt等研究出生胎龄<30周的早产小于胎龄儿的脑电图变化,发现与适于胎龄儿相比,小于胎龄儿的脑电成熟度较低,并且生后2年的神经发育评估(Baley评分)也明显落后。Yerushalmy-Feler等研究发现,晚期早产的小于胎龄儿在生后48 h之内的脑电活动落后于同孕龄适于胎龄儿[23]。本研究发现,宫内营养不良组脑电图异常的发生率并没有高于宫内营养良好组,2组间差别无统计学意义,可能与样本量及病例种类分布不均有关系,需要扩大样本量病排除疾病因素进一步研究宫内营养状态对晚期早产儿的影响。
围产期窒息的严重后果是新生儿缺氧缺血性脑病,可影响新生儿早期脑功能并导致长久的神经预后不良。程国强等研究认为,aEEG在足月儿缺氧缺血性脑病敏感性高,aEEG预测足月新生儿HIE神经发育不良的汇总敏感性为86%(95%CI:81%~89%)、汇总特异性为90%(95%CI:86%~93%),认为aEEG是可用于预测足月儿HIE预后的床旁监测工具[23]。晚期早产儿本身大脑结构发育上不成熟,更容易受到缺氧缺血等因素影响。本研究显示,窒息组较无窒息组aEEG异常率高,且窒息的程度越重,aEEG异常的发生率越高,与足月儿研究相符。剔除全身严重疾病早产儿后重新分析窒息因素对脑电图的影响,发现窒息也是晚期早产儿aEEG结果异常的独立危险因子。因此,晚期早产儿aEEG异常与窒息程度密切相关。但由于本研究病例数目较少,需要扩大样本量以进一步证实。
严重全身性疾病可影响新生儿脑功能状态。罗芳等应用aEEG技术监测42例新生儿重症监护室危重患儿,发现合并严重的全身基础性疾病者,一旦出现严重的中枢神经系统损伤,其重度异常的aEEG特征类似于重症缺氧窒息aEEG改变[24]。本研究发现,合并全身疾病状态下,晚期早产儿脑电图异常发生率较病情相对平稳组明显升高,多因素回归分析显示,其为aEEG结果异常的独立危险因素,提示当合并全身严重疾病状态时可能会影响晚期早产儿的脑发育功能。因此,在晚期早产儿疾病的急性期应用aEEG动态监测患儿的脑功能状态,对于早期发现高危新生儿脑损伤有重要临床价值。
早产儿生后早期的脑电图对于神经发育预后有一定的预测作用。邢珊等研究认为,NBNA评分可用于反映早产儿脑发育状况及发展规律[25],并与神经发育预后有关,连续性评分对评价早产儿脑损伤更有意义。本研究发现,晚期早产儿校正胎龄后aEEG成熟度评分与新生儿NBNA评分符合率高,并且呈正相关,即aEEG越成熟NBNA评分就越高,提示早期应用aEEG对晚期早产儿脑功能状态评估有重要临床指导作用。
综上所述,晚期早产儿生后早期仍有较高的aEEG异常发生率,临床应尽早识别存在脑功能异常的这部分晚期早产儿。本研究发现,晚期早产儿生后早期aEEG异常可能与出生胎龄、宫内发育、围产期窒息及全身严重疾病有关。因此,对于合并临床高危因素的晚期早产儿,应及时行床旁aEEG监测脑功能变化以早期识别脑损伤,尽早进行干预与预防。
[1] Hamilton B E, Martin J A, Osterman M J. Births: Preliminary Data for 2015[J].NatlVitalStatRep, 2016,65(3):1-15.
[2] Leone A, Ersfeld P, Adams M,etal. Neonatal morbidity in singleton late preterm infants compared with full-term infants[J].ActaPaediatr, 2012,101(1): 6-10.
[3] Seikku L, Gissler M, Andersson S,etal. Asphyxia, neurologic morbidity, and perinatal mortality in early-term and postterm birth[J].Pediatrics, 2016,137(6): 20153334.
[4] Woythaler M, Mccormick M C, Mao W Y,etal. Late preterm infants and neurodevelopmental outcomes at kindergarten[J].Pediatrics, 2015,136(3):424-431.
[5] Klebermass K, Olischar M, Waldhoer T,etal. Amplitude-integrated EEG pattern predicts further outcome in preterm infants[J].PediatrRes, 2011,70:102-108.
[6] Hellströmwstas L, Rosén I. Continuous brain function monitoring: state of the art in clinical practice[J].SeminFetalNeonatalMed, 2006,11(6):503-511.
[7] Shellhaas R A, Chang T, Tsuchida T,etal. The american clinical neurophysiology society’s guideline on continuous electroencephalography monitoring in neonates[M].JClinNeurophysiol, 2011, 28:611-617.
[8] 乌普萨拉妇女儿童保健中心. 新生儿振幅整合脑电图图谱[M].2版.上海:上海科技教育出版社, 2011:15-18.
[9] Burdjalov V F, Baumgart S, Spitzer A R. Cerebral function monitoring: a new scoring system for the evaluation of brain maturation in neonates[J].Pediatrics, 2003,112(4): 855-861.
[10] 鲍秀兰. 新生儿行为测定及其临床应用[J].中国实用儿科杂志, 1993,3(6):336-337.
[11] 陈 丹,毛 健,李 娟,等.晚期早产儿脑白质损伤临床特点及磁共振影像发现[J].中国当代儿科杂志, 2010, 12(5):321-326.
[12] Rogers C E, Barch D M, Sylvester C M,etal. Altered gray matter volume and school age anxiety in children born late preterm[J].JPediatr, 2014,165(5):928-935.
[13] Lepomäki V, Leppänen M, Matomäki J,etal. Preterm infants’ early growth and brain white matter maturation at term age[J].PediatricRadiology, 2013,43(10):1357-1364.
[14] Mcgowan J E, Alderdice F A, Holmes V A,etal. Early childhood development of late-preterm infants: a systematic review[J].Pediatrics,2011,127(6):1111-1124.
[15] 俞秀雅, 程国强, 周文浩. 新生儿神经重症监护单元如何应用振幅整合脑电图[J]. 中国循证儿科杂志, 2015,10(2):119-125.
[16] Shah N A,Wusthoff C J. How to use: amplitude-integrated EEG (aEEG)[J].ArchDisChildEducPractEd, 2015,100(2):75-81.
[17] Kapellou O, Counsell S J, Kennea N,etal. Abnormal cortical development after premature birth shown by altered allometric scaling of brain growth[J].PLoSMed, 2006,3(8): 265.
[18] 施亿赟,程国强,邵肖梅,等. 正常早产儿振幅整合脑电图特点的研究[J]. 中华儿科杂志, 2011,49(9):648-654.
[19] Cui H, Ding Y,Yu Y,etal. Changes of amplitude integration electroencephalogram(aEEG) in different maturity preterm infants[J].Child’sNervousSystem, 2013,29(7):1169-1176.
[20] Kallankari H, Kaukola T, Olsen P,etal. Very preterm birth and foetal growth restriction are associated with specific cognitive deficits in children attending mainstream school[J].ActaPaediatr, 2014,104(1):84-90.
[21] Griesmaier, E, Burger, C, Ralser, E,etal. Amplitude-integrated electroencep-halography shows mild delays in electrocortical activity in preterm infants born small for gestational age[J].ActaPaediatricaSupplement, 2015,104(7): 283-288.
[22] Schwindt E, Thaller C, Czabahnizdo C,etal. Being born small for gestational age influences amplitude-integrated electroencephalography and later outcome in preterm infants[J].Neonatology,2015,108(2):81.
[23] Yerushalmy-Feler A, Marom R, Peylan T,etal. Electroencephalographic characteristics in preterm infants born with intrauterine growth restriction[J].JPediatrics, 2014,164(4):756-761.
[24] 程国强, 陈丽霞, 邵肖梅,等. 振幅整合脑电图预测足月儿缺氧缺血性脑病预后的meta分析[J]. 中华围产医学杂志, 2011, 14(11):653-659.
[25] 罗 芳, 林慧佳, 王陈红,等. 振幅整合脑电图对新生儿重症监护病房神经系统高风险危重患儿的脑功能监测意义[J]. 中华儿科杂志, 2013,51(8):614-620.
[26] 邢 珊, 刘 俐, 李改莲,等. NBNA评分在评价早产儿脑发育、脑损伤及预后中的应用[J]. 中国儿童保健杂志, 2016,24(2):191-194.
(编辑:张慧茹)
Analysis of Changes and Risk Factors of Amplitude-Integrated EEG in Late Preterm
SHAO Qiaoyan, WU Bin, LIU Jian, LIN Biyun, MA Bihong
Department of NICU, The First Affiliated Hospital of Fujian Medical University, Fuzhou 350005, China
Objective To investigate the characteristics and risk factors of late preterm infants in amplitude integration characteristic of EEG (aEEG). Methods We analyzed 65 cases in late preterm infants who received aEEG exam after birth in our hospital. We analyzed the effect of gestational age,intrauterine nutrition,perinatal asphyxia, and the clinical situation on aEEG. Chi-square test, nonparametric test, and Logistic regression analysis were used for statistical analysis. Results (1) With gestational age growth, the aEEG scores of late preterm became higher(χ2=13.6,P=0.01);(2) The aEEG abnormal rate was higher in group severe asphyxia group(χ2=15.3,P=0.02). (3) The aEEG abnormal rate was higher in group with serious illness(χ2=11.6,P=0.01). (4) Logistic regression analysis indicated that severe disease was an independent risk factor in late preterm with abnormal aEEG (OR=1.2, 95%CI:1.1~10.7,P=0.04); (5) Excluding systemic serious illness factors, asphyxia was also a risk factor (OR=1.5, 95%CI:1.5~15.1,P=0.01); (6) After adjusting the gestational age to full-term age, the aEEG score and NBNA score coincidence rate was 52.0%. The aEEG maturity score positively correlated with NBNA score (r=0.7,P=0.02). Conclusions With gestational age growth, late preterm aEEG matures gradually. The asphyxia and serious illness factors are independent risk factors that influence the aEEG. We should pay attention to the brain function changes in the late preterms with risk factors.
electroencephalography; infant, premature; infant, newborn, diseases; infant, small for gestational age; asphyxia
2017-02-27
福建省卫生和计划生育委员会青年科研课题(2014-1-51)
福建医科大学 附属第一医院新生儿科,福州 350005
邵巧燕,主治医师,医学硕士. Email:sqy0913@163.com
R741.044; R338; R714.51; R722; R729
A
1672-4194(2017)03-0190-05
