川芎浸膏萃取溶剂研究及其有机溶剂残留量的测定
2017-08-09刘慧娟王慧娟
刘慧娟,张 敏,王慧娟,周 英*,赵 致
(1.贵州大学 药学院,贵州 贵阳 550025;2.贵州省药食同源植物资源开发工程技术研究中心,贵州 贵阳 550025;3.贵州省药食两用资源应用开发工程实验室,贵州 贵阳 550025;4.贵州大学 农学院,贵州 贵阳 550025)
川芎浸膏萃取溶剂研究及其有机溶剂残留量的测定
刘慧娟1,2,张 敏1,2,3,王慧娟1,2,3,周 英1,2,3*,赵 致4
(1.贵州大学 药学院,贵州 贵阳 550025;2.贵州省药食同源植物资源开发工程技术研究中心,贵州 贵阳 550025;3.贵州省药食两用资源应用开发工程实验室,贵州 贵阳 550025;4.贵州大学 农学院,贵州 贵阳 550025)
本论文基于某已上市复方川芎制剂制备工艺,通过对其制备过程中的萃取溶剂替代研究以及有机溶剂残留测定方法研究,建立了以乙酸乙酯替代原生产工艺中三氯甲烷的川芎浸膏制备方法,同时建立了气相色谱法测定浸膏中有机溶剂的残留。结果表明,以乙酸乙酯作为川芎浸膏的萃取溶剂,与原浸膏HPLC法检测结果一致,并更安全绿色环保。应用所建立的GC法测定浸膏中乙酸乙酯残留,加样回收率98.44 %,该方法稳定可靠,可用于测定浸膏中的乙酸乙酯残留。
川芎;溶剂替代;GC;乙酸乙酯;残留
川芎为伞形科植物川芎(Ligusticumstriatum)的干燥根茎,始载于《神农本草经》。其性温,味辛、微苦,具有活血行气、祛风止痛的功效[1]。主要含有挥发油、生物碱类、苯酞类、有机酸类化学成分[2]。临床主要用于治疗心脑血管、呼吸、泌尿系统及妇科方面的疾病。
研究所用复方川芎制剂为已上市销售的治疗心血管疾病药物。其中川芎药材在制备过程中使用了易制毒三氯甲烷。本研究保持原有生产工艺不变,对川芎浸膏中所用三氯甲烷进行替代研究,筛选乙酸乙酯替代三氯甲烷。并参考相关文献[3],建立了乙酸乙酯气相色谱检测方法,测定川芎浸膏中乙酸乙酯的残留。
1 材料与方法
1.1 材料与仪器
川芎乙醇浸膏(贵州省民族药业股份有限公司药厂提供);乙酸乙酯(AR,上海申博化工有限公司);甲醇(AR,上海振兴化工一厂)。气相色谱仪(日本岛津,GC-2010,SHIMADZU);顶空进样器(日本岛津,DANI,HSS 86.50);5%苯基-95%甲基聚硅氧烷为固定相(30 m×0.63 mm×1.0 μm)毛细管色谱柱(M2824,大连中汇科学仪器有限公司);电子分析天平(AUW220D,日本岛津)。
1.2 川芎生物碱浸膏的制备
1.2.1 原川芎浸膏的制备工艺 (药厂生产工艺) 川芎破碎,加乙醇回流提取二次,第一次加6倍量,浸渍2 h,提取3 h,第二次加4倍量,提取2 h。滤过,合并滤液,减压回收乙醇并浓缩至相对密度1.05~1.55(55~60℃),静置让其分为三层,取中层液减压浓缩至相对密度1.10~1.05(55~60℃),用浓氨水调节PH至9~10,用三氯甲烷提取三次,第一次3倍量,第二次2倍量,第三次1倍量,合并三次三氯甲烷提取液,加压回收三氯甲烷并浓缩。回收浓缩15 min后,加入492 mL乙醇,浓缩至相对密度1.01~1.05(55~60℃),得川芎浸膏。
1.2.2 指纹图谱HPLC方法(药厂质控方法)
1.2.2.1 色谱条件 以十八烷基硅烷键合硅胶为填充剂,色谱柱为ZORBAX SB C18(250 mm×4.6 mm,5 μm),以乙腈-0.1%磷酸溶液为流动相进行梯度洗脱,流速1 ml/min,紫外检测波长250 nm,进样量10 μL,柱温25℃。
1.2.2.2 供试品溶液的制备 取川芎浸膏约0.5 g,精密称定,置锥形瓶中,精密加入甲醇25 ml,称定重量,超声提取20 min,取出放至室温,用甲醇补充减失重量,摇匀,过0.45 μm微孔滤膜,取续滤液10 μL,用于川芎浸膏HPLC进样分析。
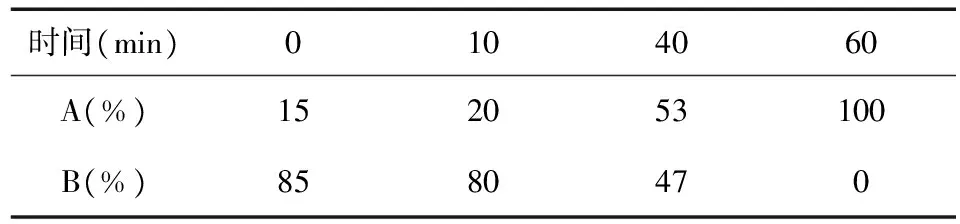
表1 梯度洗脱程序
1.2.3 萃取溶剂的替换 保持原川芎浸膏制备工艺不变, 对其中萃取溶剂三氯甲烷进行替换。选取工业中“易得、价廉、低毒”有机溶剂二氯甲烷、乙酸乙酯、石油醚进行替代研究。经过溶剂萃取制备得到的川芎浸膏,通过国家药典委员会的软件《中药色谱指纹图谱相似度评价系统》进行分析,以“平均数法”得到了溶剂替代后几种川芎浸膏的模拟对照指纹图谱(图1A),与三氯甲烷萃取的川芎浸膏进行对比,图谱以原浸膏(图1B)为参照物。
1.3 GC法测定乙酸乙酯残留量
1.3.1 色谱条件[3]色谱柱:Agilent HP-5(5%二苯基-95%二甲基硅烷共聚物为固定相)(30 m×0.32 mm×1.5 μm)毛细管色谱柱;进样口温度:180℃;检测器:氢焰离子化检测仪(FID)温度:250℃;载气:氮气,2 ml/min;分流比:2∶1;升温程序:起始温度40℃,恒温5 min后,以3℃/min升至60℃,再以20℃/min升至200℃,维持10 min。顶空瓶温度:90℃加热40 min,LOOP管温度:100℃,TR.LINE温度:115℃。
1.3.2 分流比 根据参考文献中乙酸乙酯残留气相色谱法[3],通过改变分流比,建立了川芎浸膏中乙酸乙酯残留检测法。
1.3.3 GC测定方法 色谱柱:5 %苯基-95 %甲基聚硅氧烷为固定相(30 m×0.63 mm×1.0 μm)毛细管色谱柱;进样口温度:180℃;检测器:氢焰离子化检测仪(FID)温度:250℃;载气:氮气,2 ml/min;分流比:20∶1;升温程序:起始温度40℃,恒温5 min后,以3℃/min升至60℃,再以20℃/min升至200℃,维持10 min。顶空瓶温度:90℃加热40 min,LOOP管温度:100℃,TR.LINE温度:115℃。
1.3.3.1 对照品溶液的制备
精密量取乙酸乙酯适量,加入甲醇,制成每毫升约含乙酸乙酯3 mg溶液,作为对照品储备液。精密量取上述对照品储备液10 ml用甲醇稀释至100 ml容量瓶,摇匀。精密量取本溶液10 ml,置20 ml顶空瓶,压盖密封,置20 ml顶空瓶,压盖密封,作为对照品溶液。
1.3.3.2 供试品溶液的制备
取川芎浸膏约1 g,精密称定,置100 ml量瓶,加甲醇80 ml,超声溶解,再加甲醇定容至刻度,摇匀,精密量取本溶液10 ml,置20 ml顶空瓶,压盖密封,作为供试品溶液。
1.3.3.3 空白对照溶剂的制备
精密量取甲醇10 ml,置20 ml顶空瓶,压盖密封,即空白对照溶剂。
1.3.3.4 系统适应性检验
分别取上述对照品溶液、供试品溶液及空白对照溶剂,照上述色谱条件,参照《中国药典》2015版四部0521气相色谱法,顶空进样,测得GC图谱。
1.3.3.5 外标一点法
测定乙酸乙酯残留量计算公式
W样=A样W对/A对
式中W样与A样分别代表在样品溶液进样体积中所含样品组分的重量及相应的峰面积。W对及A对分别代表在对照品溶液进样体积中含纯品组分的重量及相应峰面积。
1.3.3.6 精密度试验
精密量取乙酸乙酯对照品储备液10 ml,置100 ml量瓶,用甲醇定容,摇匀,分别精密量取10 ml,置6个20 ml顶空瓶,压盖密封,照上述色谱条件,顶空进样测定,记录峰面积,计算RSD。
1.3.3.7 稳定性试验
取浸膏样品,按上述供试品溶液制备方法制备供试品溶液,取6份,放置24h,分别于第0,2,4,6,9,12,24 h 进样一次,共进样6次,测得峰面积,计算RSD。
1.3.3.8 重复性试验
取浸膏样品,按上述供试品溶液制备方法制备供试品溶液,同法制备 6 份,照上述色谱条件,分别顶空进样测定,记录峰面积,求出RSD。
1.3.3.9 加样回收率试验
取已测知含量的本品约0.5 g,精密称定,置100 ml量瓶,加对照储备液4.5 ml,再加甲醇80 ml使超声溶解,加甲醇定容至刻度,摇匀,精密量取本溶液10 ml,置20 ml顶空瓶,压盖密封,作为供试品溶液。同法制备5份,按上述色谱条件,分别测定。
1.4 GC法测定样品中乙酸乙酯残留
取本品三个批次,按照乙酸乙酯残留量检测方法供试品溶液制备方法制备供试品溶液,照上述色谱条件分别测定,按外标法以峰面积计算乙酸乙酯的量,即得。
2 结果与分析
2.1 溶剂替代试验2.1.1 溶剂替代试验结果 根据原川芎浸膏制备工艺,选取上述列举溶剂进行萃取,分别制备出三氯甲烷、石油醚、乙酸乙酯萃取的川芎浸膏,根据《中药色谱指纹图谱相似度评价系统》分析,模拟对照指纹图谱如图1A,原浸膏指纹图谱如图1B,几种萃取溶剂川芎浸膏指纹图谱相似度结果如图1C。2.1.2 溶剂替代试验结果分析 二氯甲烷未萃取出任何物质,结果得到石油醚、乙酸乙酯、原浸膏3种浸膏的HPLC相似度,结果如表2。其中,乙酸乙酯与原浸膏相似度最高。因此,选择乙酸乙酯作为萃取溶剂。
2.2.2 系统适应性结果 系统适应性检验测得GC图谱,见图3。图谱表明空白溶剂对乙酸乙酯测定无干扰。理论板数按乙酸乙酯峰计算,不得低于8000。
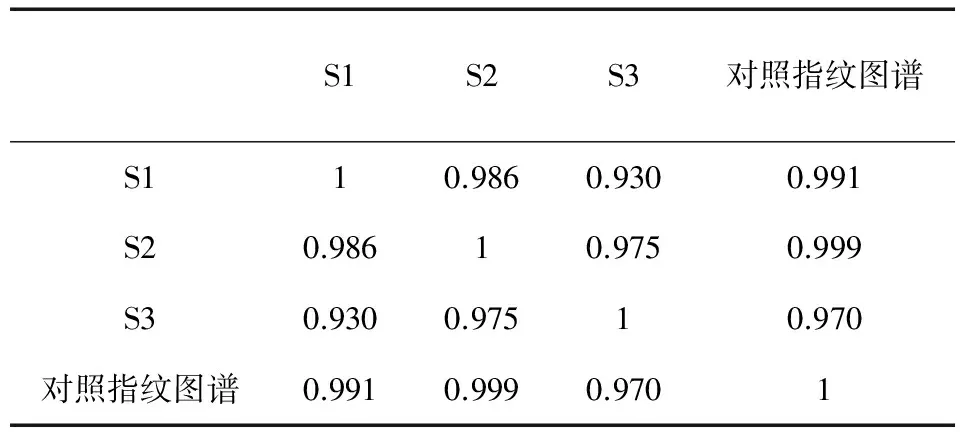
表2 几种萃取溶剂川芎浸膏的相似度分析
注:S1、S2、S3分别代表石油醚、乙酸乙酯、原浸膏。
2.2 乙酸乙酯残留量的气相色谱检测方法
2.2.1 分流比结果 结果显示当分流比为20∶1时,能检测出乙酸乙酯。如图2C所示。
2.2.3 精密度试验结果 乙酸乙酯峰面积的RSD为0.66%,说明精密度良好。2.2.4 稳定性试验结果 乙酸乙酯峰面积RSD为0.42 %,结果表明供试品中乙醇的量在24 h内稳定。2.2.5 重复性试验结果 本品中乙酸乙酯平均含量为0.027 %,RSD 为2.4 %。
2.2.6 加样回收率试验结果 结果表明该方法回收率良好,见表3。乙酸乙酯平均回收率98.44 %,RSD=3%。

图1 指纹图谱相似度分析
Fig.1 Fingerprint similarity analysis
注:图1-A为模拟对照指纹图谱;图1-B为原浸膏指纹图谱;图1-C为几种萃取溶剂川芎浸膏指纹图谱相似度图谱。
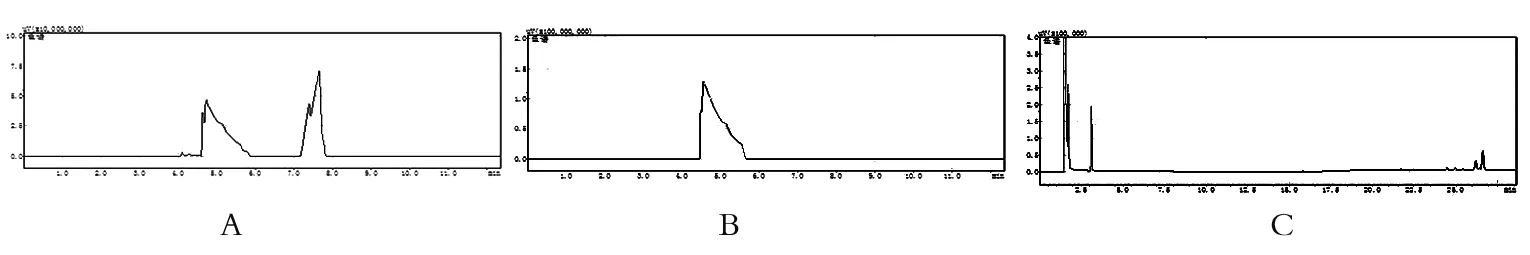
图2 分流比结果
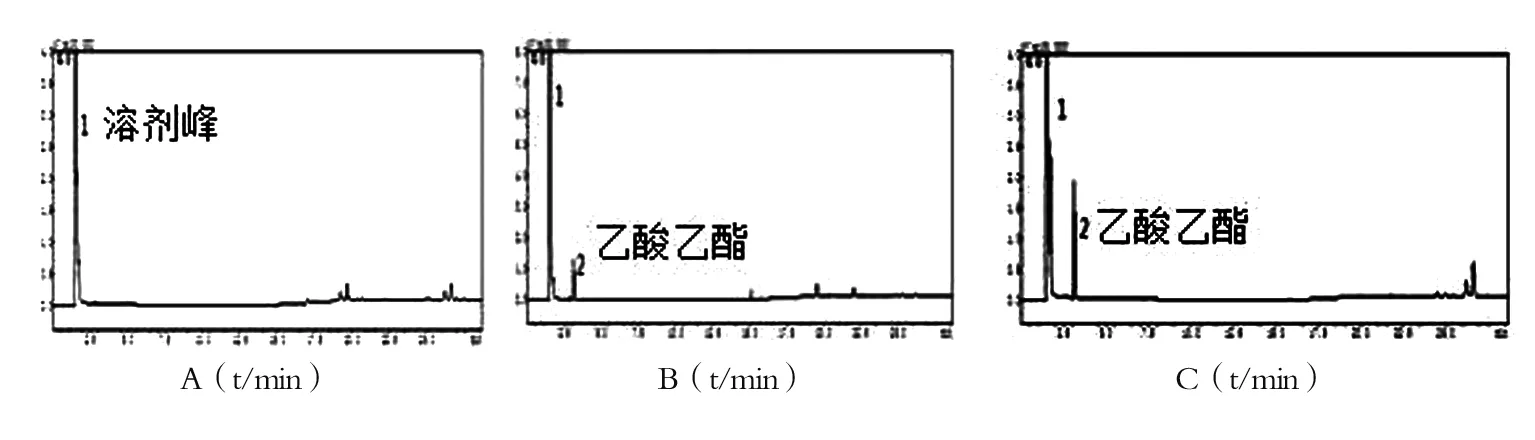
图3 系统适应性检验
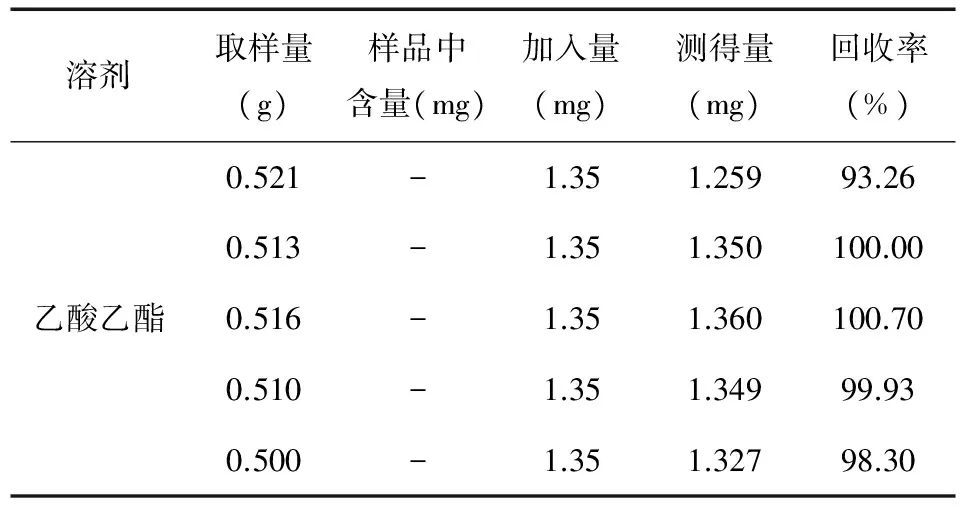
溶剂取样量(g)样品中含量(mg)加入量(mg)测得量(mg)回收率(%)0.521-1.351.25993.260.513-1.351.350100.00乙酸乙酯0.516-1.351.360100.700.510-1.351.34999.930.500-1.351.32798.30
注:“-”表示未检出。
2.3 GC法测定样品中乙酸乙酯残留
取本品三个批次,按照乙酸乙酯残留量检测方法供试品溶液制备方法制备供试品溶液,照上述色谱条件分别测定,按外标法以峰面积计算乙酸乙酯的量,即得。结果见表4。
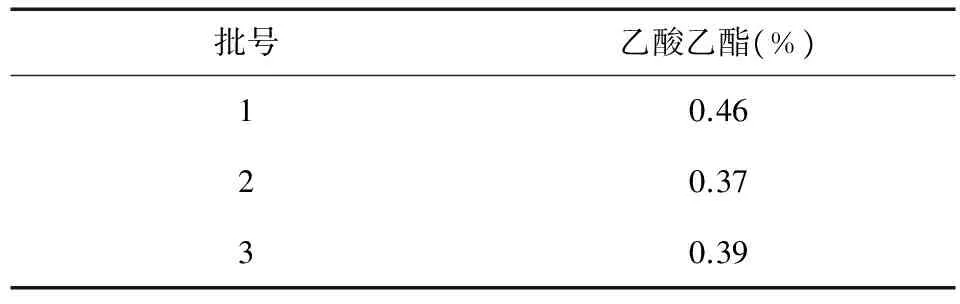
表4 样品中乙酸乙酯残留量(n=3)
由上表4可知,顶空气相法测定乙酸乙酯残留,乙酸乙酯残留量均小于0.5 %,即乙酸乙酯残留量在国家药典规定范围内(中国药典标准乙酸乙酯残留量小于0.5 %)。
3 结论与讨论
该川芎复方制剂在川芎浸膏制 备过程中使用易制毒试剂三氯甲烷,为公安部管制类试剂,污染环境,对人体有害。使用乙酸乙酯替代三氯甲烷,可使该制剂工艺更绿色环保,该产品更加安全健康。
川芎浸膏萃取溶剂经过替换后,与原浸膏进行指纹图谱相似度分析,乙酸乙酯萃取所得浸膏与原浸膏相似度最高,且相似度达到0.9以上。同时用GC法检测,乙酸乙酯残留符合国家药典限量标准。因此乙酸乙酯可以作为替换三氯甲烷的萃取溶剂。根据原制剂工艺制备出新川芎复方制剂,与原制剂相比,是否质量合格,仍需做进一步研究。对新制剂进行质量检查及初步药理活性试验,以确定溶剂替代后,该制剂是否具有与原制剂相同的疗效,最终为该制剂工艺优化提供更好的条件。
[1] 宋金春,胡传芹,曾俊芬,等.川芎RP-HPLC指纹图谱的建立及其质量研究[J].中国药师,2006,9(4):297-301.
[2] 郝淑娟,张振学,田 洋,等.川芎化学成分研究[J].中国现代中药,2010,12(3):22-25.
[3] 窦 霞,靳子明,李应东.顶空气相色谱法测定归黄胶囊中乙醇与乙酸乙酯残留量[J].医药导报,2012,31(11):1490-01.
Study on Extraction Solvent of Chuanxiong (Ligusticumstriatum) Extract and Determination of Residual Organic Solvent
LIUHui-juan1,2,3,ZHANGMin1,2,3,WANGHui-juan1,2,3,ZHOUYing1,2,3*,ZHAOZhi4
(1.SchoolofPharmaceuticalSciences,GuizhouUniversity,Guiyang,Guizhou550025,China;2.GuizhouMedicineEdiblePlantResourcesResearchandDevelopmentCenter,Guiyang,Guizhou550025,China;3.GuizhouMedicineEdibleResourcesApplicationDevelopmentEngineeringLaboratory,Guiyang,Guizhou550025,China;4.CollegeofAgriculture,GuizhouUniversity,Guiyang,Guizhou550025,China)
In this paper, based on the preparation process of a launched Chuanxiong (Ligusticum striatum) compound preparation technology, the preparation of Chuanxiong extract with ethyl acetate to replace trichloromethane in the original production process was established by studying the extraction solvent substitution and the determination of residual organic solvent in the preparation process. The determination method of residual organic solvent in the extract was established based on gas chromatography. The results showed that ethyl acetate was used as the extraction solvent of Chuanxiong extract, which was consistent with the results of the original extract but safer and greener. Sample recovery rate was 98.44% when determining ethyl acetate residues in the extract by the established GC method. The method was stable and reliable. It could be used to determine the ethyl acetate residue in the extract.
ligusticumstriatum; substitution of extraction solvent; gas chromatography; Ethyl acetate; Residue
2017-03-15;
2017-06-10
贵州省科技计划(黔科合LH字[2014]7661);贵州省药食同源资源研究开发科技创新人才团队(黔科合人才团队[2015]4010号);贵州省药食同源植物资源开发工程技术研究中心(黔科合G字[2015]4001);贵州省药食两用资源应用开发工程实验室(黔发改投资[2015]542号);贵州省中药民族药制药工程专业学位研究生工作站(黔教研合JYSZ字[2014]002)。
R917
A
1008-0457(2017)04-0068-04 国际
10.15958/j.cnki.sdnyswxb.2017.04.012
*通讯作者:周英(1971-),女,博士,教授,主要研究方向:药学、中药学;E-mail:yingzhou71@126.com。
