一卤鲜鲈鱼加工过程中蛋白质结构变化及安全性的研究
2017-08-09郝子娜锦州医科大学食品科学与工程学院辽宁锦州121001中国海洋大学食品安全实验室山东青岛266003
郝子娜(1.锦州医科大学食品科学与工程学院,辽宁锦州 121001; 2.中国海洋大学食品安全实验室,山东青岛 266003)
一卤鲜鲈鱼加工过程中蛋白质结构变化及安全性的研究
郝子娜1,2
(1.锦州医科大学食品科学与工程学院,辽宁锦州 121001; 2.中国海洋大学食品安全实验室,山东青岛 266003)
为了揭示一卤鲜鲈鱼加工过程中蛋白质结构基团变化及安全性情况,本研究分别于5个加工时间点对一卤鲜鲈鱼进行取样,分析蛋白羰基含量、总巯基含量、表面疏水性、菌落总数、亚硝酸盐、脂质过氧化值、生物胺的变化。结果表明,一卤鲜鲈鱼的羰基含量在整个加工过程中没有显著性变化(p>0.05),而蛋白的总巯基含量在加工过程中呈下降趋势。鲈鱼肌浆蛋白和肌原纤维蛋白表面疏水性在腌制阶段上升,疏水性分别增加了15.06%和101.03%,并在随后的脱盐阶段下降,与腌制72 h相比,分别减少了24.85%和42.79%。菌落总数腌制阶段保持在(3.9~9.7)×103CFU/g范围内,但在脱盐阶段迅速增加,最终产品中菌落总数达到1.2×105CFU/g。亚硝酸盐含量和脂质过氧化值在腌制阶段分别增加了2.5倍和10.7倍,而在脱盐阶段基本不变。脱盐阶段生物胺含量上升最多的为组氨酸,但没有超过安全限量300 mg/kg。产品中各指标均符合安全标准。
一卤鲜鲈鱼,腌制,脱盐,蛋白结构,安全性
腌制是一种提高鱼保质期的加工方法。近年来,随着加工条件和技术的提高,腌制越来越多地用于提高肉类感官品质[1-2]。一卤鲜是中国胶东地区一种传统特色腌鱼制品,海鲈鱼(或其他相似海水鱼)用适宜盐浓度的腌渍液进行较短时间处理,再进行部分脱盐的一种保持鱼肉鲜度和口感的一种低盐腌鱼加工方法,它具有加工时间短、鱼肉鲜嫩、含盐量较低、口感佳、口味好的优点。
蛋白质是肉制品主要的组成成分,在肉制品的腌制加工过程中,蛋白质会发生变性,导致蛋白溶解度和结构基团的变化。腌制时盐分和水的交换破坏了蛋白质的静电平衡,导致蛋白质-水相互作用的改变,因此蛋白质的构象也随之变化,蛋白质内部的巯基和疏水基团暴露,暴露的巯基进一步氧化生成二硫键,导致蛋白质之间的交联[3]。Nguyen MV等[4]发现在鳕鱼的腌制加工过程中,鳕鱼的蛋白发生聚集并且总巯基含量下降,二硫键含量升高。孙为正[5]发现广式腊肠的加工过程中蛋白的二硫键含量升高,肌浆蛋白和肌原纤维蛋白的羰基值逐渐升高,且二级结构也发生了显著性变化。Thorarinsdottir KA等[6]研究重盐腌制鳕鱼片时发现蛋白发生了变性和聚集,并且热变性发生改变。Martínez-Alvarez O等[7]发现腌制导致大西洋鳕鱼蛋白持水性和溶解度发生了改变。
在低盐鲈鱼制品的腌制和脱盐的加工过程中,存在微生物和酶的作用。而以前研究曾得出,微生物和原料鱼中酶类的作用会导致鱼体中的硝酸盐发生还原生成亚硝酸盐,蛋白质降解导致游离氨基酸增多,而氨基酸继续降解也会生成胺类等物质,脂质水解与氧化也会生成醛酮等成分和脂质过氧化产物,导致鱼肉的不安全因素升高[8-11]。
本文以海鲈鱼为研究对象,系统研究了一卤鲜加工过程中有关蛋白基团指标的变化,包括羰基含量、总巯基含量、表面疏水性,以及安全性指标,包括菌落总数、亚硝酸盐、脂质过氧化值、生物胺,阐明一卤鲜鲈鱼加工过程中蛋白质结构基团变化规律,并分析加工过程中的安全性,为优化一卤鲜加工工艺,有效控制产品品质,为以后进行标准化大规模生产提供科学依据。
1 材料与方法
1.1 材料与仪器
海鲈鱼(Lateolabraxjaponicus) 购买自青岛南山水产品批发市场,大小均匀,平均重量为(1.5±0.3) kg,迅速运送至实验室后去除内脏和鳞片,清洗干净,用于一卤鲜的加工;浓盐酸、叠氮化钠、三氯乙酸、氯化钠、尿素、硼酸钠、亚铁氰化钾、乙酸锌、碳酸钾、丙酮、亚硝酸钠、碳酸氢钠、碳酸钠、碳酸钾 国药集团化学试剂有限公司;牛血清白蛋白(BSA)、三羟甲基氨基甲烷(Tris)、2,4-二硝基苯肼(DNPH)、盐酸胍乙二胺四乙酸(EDTA)、5,5′-二硫代-二硝基苯甲酸(DTNB)、1-苯氨基-8-萘磺酸(ANS)、对氨基苯磺酸盐酸萘乙二胺、2-硫代巴比妥酸、甲基红、次甲基蓝 Solarbio公司;营养琼脂培养基 北京陆桥有限责任公司;生物胺标准物质 Sigma公司。
冷冻离心机 美国Sigma公司;酶标仪 美国雷勃公司;pH-3C型pH计 上海伟业仪器厂;匀浆机 中国美的集团股份有限公司;ZHWY-2012恒温振荡培养箱 上海智诚分析仪器制造有限公司;MS1 Minshaker涡旋振荡器 IKA公司;数显恒温HH-2水浴锅 精达仪器制造厂;TU-1810紫外分光光度计 北京普析通用有限责任公司;F4600荧光分光光度计 日立集团;拍打式无菌均质机 上海汉诺仪器有限公司;SW-CJ-2FD超净工作台 苏州安泰空气技术有限公司;MLS-3750高压蒸汽灭菌锅 日本三洋电机公司;XMT-152A电热恒温培养箱 宁波机电工业研究设计院。
1.2 实验方法
1.2.1 一卤鲜鲈鱼加工及样品制备 一卤鲜鲈鱼加工过程包括腌制和脱盐两个阶段。腌渍阶段时间为72 h,脱盐阶段时间为48 h,共120 h。将鲈鱼放入8%(w∶w)盐浓度的腌制液中,鱼和盐水的比为1∶10 (w∶v),腌制72 h,然后迅速沥干水分,放入纯水中进行脱盐处理48 h。以上所有步骤在(4±2) ℃温度范围内进行。
在本研究中,取一卤鲜加工过程中五个加工工艺点(未处理新鲜鲈鱼、腌制36 h、腌制72 h、脱盐24 h和脱盐48 h)作为取样点,每个取样点随机取一条鲈鱼作为待测样品。将这五个时间点取样的鲈鱼背部肌肉,置于-20 ℃冷冻保藏,以备后续蛋白质羰基、总巯基、表面疏水性、菌落总数、亚硝酸盐、TBARS值和生物胺的测定。
1.2.2 蛋白质提取 肌浆蛋白的提取参考Toldrá等的方法并略有修改[12]。取鱼肉10 g(精确到0.001 g)加入10倍体积Tris-HCl缓冲液(0.1 mol/L,pH7.4,5 mg/mL NaN3),用匀浆机在10000 r/min下匀浆2 min,匀浆液8000 r/min离心15 min,上清液为肌浆蛋白提取液。沉淀用10倍体积缓冲液洗涤三次,最后一次用四层纱布过滤除去基质蛋白,所得沉淀部分加入10倍体积的含有0.6 mol/L KCl的Tris-HCl缓冲液,抽提过夜,8000 r/min离心(30 min,上清液为肌原纤维蛋白溶液。此过程均在4 ℃下进行。
1.2.3 蛋白质羰基含量测定 羰基含量的测定按照Oliver[13]的方法并略加改动。各取0.3 mL的蛋白溶液,每管中加入0.3 mL、10 mmol/L的2,4-二硝基苯肼(DNPH),将其室温放置1 h,每隔10 min振荡一次。反应结束后,加入20%三氯乙酸0.6 mL,混匀后4 ℃、9000 r/min离心15 min,离心后静置10 min,弃上清。沉淀用2 mL乙醇∶乙酸乙酯(1∶1)溶液洗涤3次后加入2 mL、6 mol/L的盐酸胍溶液,振荡后在37 ℃恒温箱中孵育20 min,最后4 ℃、9000 r/min离心15 min,静置10 min后取上清,在367 nm处测其吸光度。空白组以0.3 mL、2 mol/L的盐酸代替蛋白溶液,后续操作相同。使用分子吸光系数22000 L/mol·cm计算羰基含量。每组重复测定三次。
1.2.4 蛋白质总巯基含量测定 参照Ellman的方法[14]测定蛋白质的总巯基含量,并略有改动,取0.5 mL蛋白溶液加入4 mL、0.05 mol/L磷酸盐缓冲液(0.6 mol/L NaCl、6 mmol/L EDTA、8 mol/L尿素,pH8.0)混匀。再加入0.5 mL、10 mmol/L 5,5-二硫代二硝基苯甲酸(DTNB)混合均匀。将该反应体系加入40 ℃水浴锅中反应0.5 h,在412 nm处测定吸光度。巯基浓度用摩尔消光系数13600 L/mol·cm计算。空白组不加蛋白溶液,其他步骤相同。按照下式计算蛋白质总巯基含量(C)。
C=A/ab
其中,A:吸光度;a:摩尔消光系数,b:样本厚度。
1.2.5 蛋白表面疏水性测定 蛋白表面疏水性测定采用Cardamone M的ANS(1-苯胺基-8-萘磺酸)荧光探针法[15],并略有改动。蛋白液用蛋白提取时使用的Tris-HCl缓冲液(pH7.4)稀释成5个梯度浓度的蛋白溶液(浓度在0.05~10 mg/mL)。取2 mL蛋白液加入20 μL 8 mmol/L的ANS溶液,迅速振荡混匀后在暗室中静置3 min使其充分反应,测定样品的荧光强度。激发波长为390 nm,发射波长为470 nm,以样品的荧光强度对蛋白质浓度作图,曲线的初始斜率即为蛋白质分子表面疏水性指数。
1.2.6 菌落总数的测定 在无菌操作环境中,称取5.0 g鱼背部肌肉(精确至0.001 g)放入无菌均质袋中并加入45 mL无菌生理盐水,密封后用均质器拍打1~2 min,制成1∶10的样品匀液。后用无菌生理盐水分别稀释成1∶100和1∶1000的样品匀液。采用PCA培养基,取100 μL不同稀释度的样品匀液滴加在培养基表面,用无菌玻璃涂棒将其均匀涂开,待样品被完全吸收后倒置培养,在(30±1) ℃恒温箱中培养(72±3) h,选取合适稀释度的平皿计数。
1.2.7 亚硝酸盐的测定 采用GB 5009.33-2010的方法[16]进行测定。
1.2.8 脂质过氧化羰基值(TBARS)值的测定 参考岑琦琼的方法[17],并略有修改。取5 g匀浆后的样品,加入25 mL、7.5%的三氯乙酸,振摇30 min,双层滤纸过滤两次。吸取过滤后的上清液2 mL,加入2 mL、0.02 mol/L 2-硫代巴比妥酸溶液,在沸水浴中加热反应40 min,取出冷却1 h后,2000 r/min离心5 min,取上清液,加2 mL氯仿摇匀,静置分层后取上清液分别在532 nm和600 nm处记录吸光值。TBARS值(mg/100 g)=(A532-A600)/155×(1/10)×72.6×100。
1.2.9 生物胺的测 生物胺的测定采用Dns-Cl柱前衍生高效液相色谱法。样品的处理和衍生根据Dadáková E等的方法[18],高效液相色谱条件采用姜维的方法[19]:选用Capcell Pak C18MGⅡ色谱柱;流动相A:超纯水,流动相B:甲醇溶液;流速:0.8 mL/min;进样量:10 μL;柱温:40 ℃;荧光检测器参数:Ex=350 nm,Em=520 nm;梯度洗脱程序见表1。
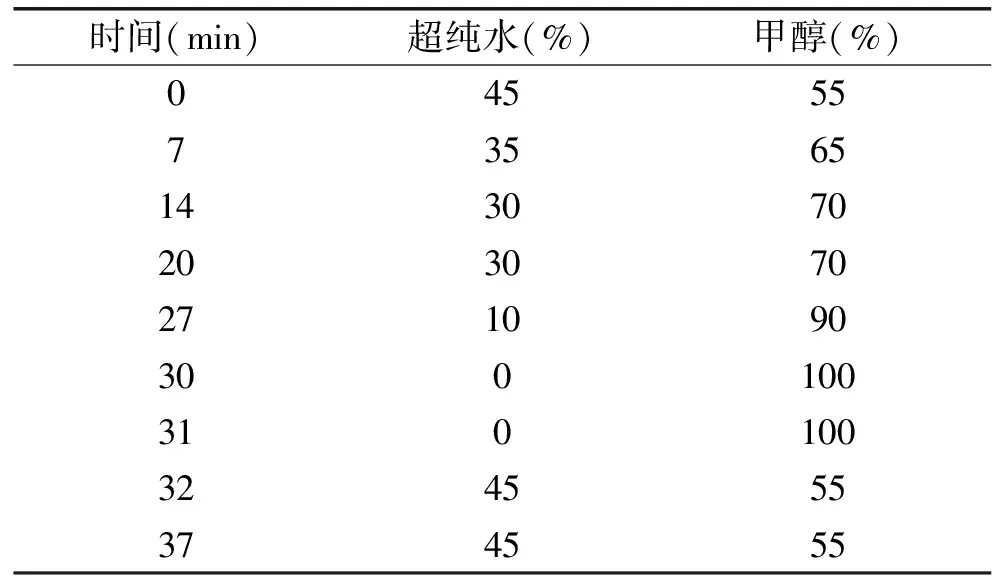
表1 生物胺的梯度洗脱程序Table 1 Gradient elution program of biogenic amine
1.3 数据分析
数据用SPSS 17.2统计软件描述性分析与方差分析程序进行处理,采用Origin 7.5作图。每组设三个平行,实验数据采用ANOVA进行邓肯氏(Duncan)差异分析,以p<0.05为显著性差异,不同字母代表不同样品之间有显著差异性(p<0.05)。
2 结果与讨论
2.1 肌浆蛋白和肌原纤维蛋白羰基含量的变化
蛋白质羰基含量是衡量蛋白质氧化程度的重要指标[20]。如图1所示,鱼肉肌浆蛋白和肌原纤维蛋白羰基含量虽有波动,但经统计学分析在整个加工过程中并没有显著性变化(p>0.05)。最终低盐鲈鱼制品的鱼肉肌浆蛋白羰基含量为0.07 nmol/mg,肌原纤维蛋白羰基含量为0.97 nmol/mg。在加工过程中,肌原纤维蛋白和肌浆蛋白的羰基含量经过统计学分析后均无显著变化,这表明加工过程中鱼肉蛋白质没有明显氧化问题。
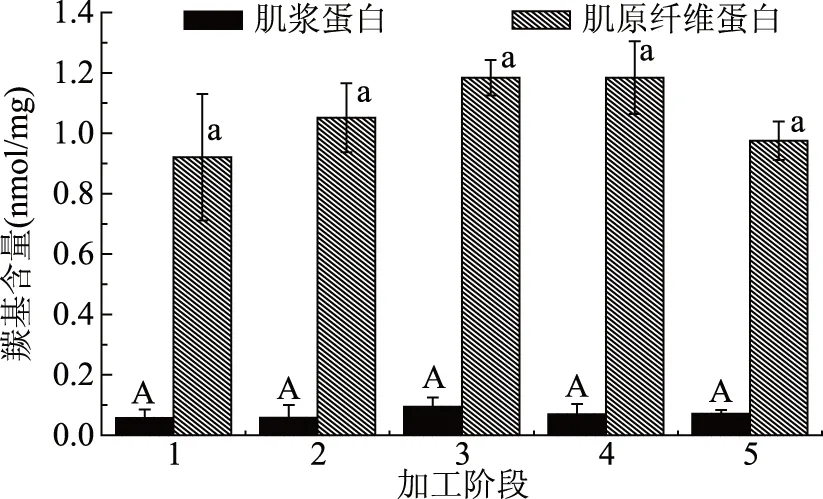
图1 低盐鲈鱼制品加工过程中肌浆蛋白和肌原纤维蛋白羰基含量变化Fig.1 The change of carbonyl content of myogen and myofibrillar proteins during the processing of low-salted bass注:图中1~5分别为新鲜鲈鱼、腌制36 h鲈鱼、腌制72 h 鲈鱼、脱盐24 h鲈鱼和脱盐48 h鲈鱼, 不同字母表示差异显著,p<0.05,图2~图5,表2、表3同。
2.2 肌浆蛋白和肌原纤维蛋白总巯基含量的变化
由图2可知,肌浆蛋白和肌原纤维蛋白在腌制阶段,总巯基含量与新鲜鲈鱼相比没有显著性变化(p>0.05),而到脱盐24 h时,肌浆蛋白总巯基含量发生显著下降(p<0.05),从腌制72 h的75.34 nmol/g下降到64.70 nmol/g,并在脱盐后期保持基本不变(p>0.05)。而肌原纤维蛋白在脱盐阶段总巯基含量持续下降,从腌制72 h的108.45 nmol/g下降到脱盐48 h的97.88 nmol/g。
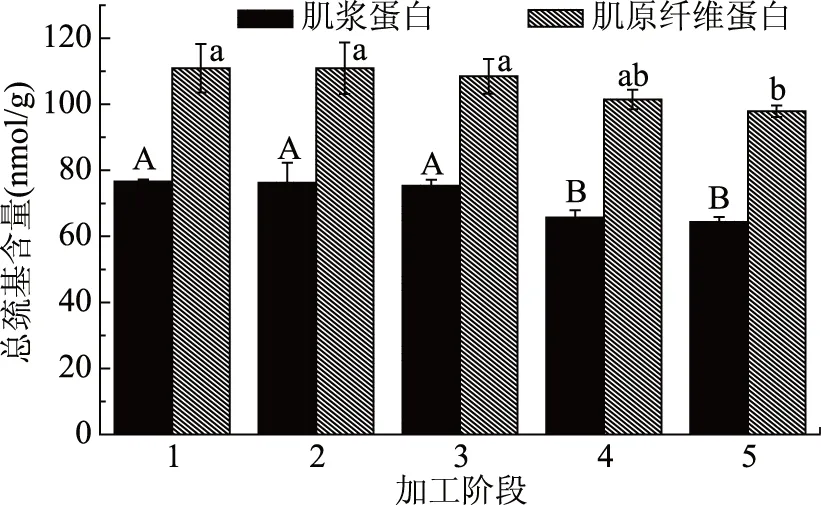
图2 低盐鲈鱼制品加工过程中肌浆蛋白和肌原纤维蛋白总巯基含量变化Fig.2 The change of total sulfhydryl content of myogen and myofibrillar proteins during the processing of low-salted bass
巯基和二硫键能够影响蛋白质结构的稳定性、易变性以及酶的催化作用[21]。本研究发现在加工过程中肌浆蛋白和肌原纤维蛋白在腌制阶段总巯基含量均未发生明显变化,但在整个加工过程中总巯基含量总体呈下降趋势。Nguyen MV等[4]曾在腌制鳕鱼过程中可溶性蛋白的总巯基含量随着腌制时间的增加而减少,这与本实验结果不同,可能由于在一卤鲜的腌制阶段,活性巯基暴露后并没有迅速被氧化,而在脱盐阶段暴露的巯基开始发生氧化,继而蛋白总巯基含量下降。总巯基含量的降低说明蛋白质发生了变性,活性巯基暴露在蛋白质表面,导致巯基的半胱氨酸残基发生氧化,生成二硫键形成分子内或分子间交联,从而导致蛋白结构表面的总巯基含量下降[22-23]。

表2 低盐鲈鱼制品加工过程中菌落总数变化Table 2 The change of total plate count during the processing of low-salted bass
2.3 肌浆蛋白和肌原纤维蛋白表面疏水性的变化
由图3可知,肌浆蛋白和肌原纤维蛋白在腌制过程中表面疏水性均发生了上升,并在脱盐阶段下降,但肌原纤维蛋白的变化趋势与肌浆蛋白相比更为明显。肌浆蛋白在腌制36 h时表面疏水性增加并不明显(p>0.05),但在腌制72 h时,其表面疏水性显著增加了15.06%。而肌原纤维蛋白在腌制阶段表面疏水性持续增加(p<0.05),到腌制结束后,其蛋白表面疏水性增加了101.03%。在脱盐阶段,肌浆蛋白表面疏水性逐渐降低(p<0.05),最终低盐鲈鱼制品鱼肉肌浆蛋白表面疏水性为30.34,与腌制结束相比减少了24.85%。肌原纤维蛋白在脱盐24 h后表面疏水性与腌制72 h相比并没有明显变化(p>0.05),但在脱盐48 h后显著降低至97.31,与腌制结束相比减少了42.79%。
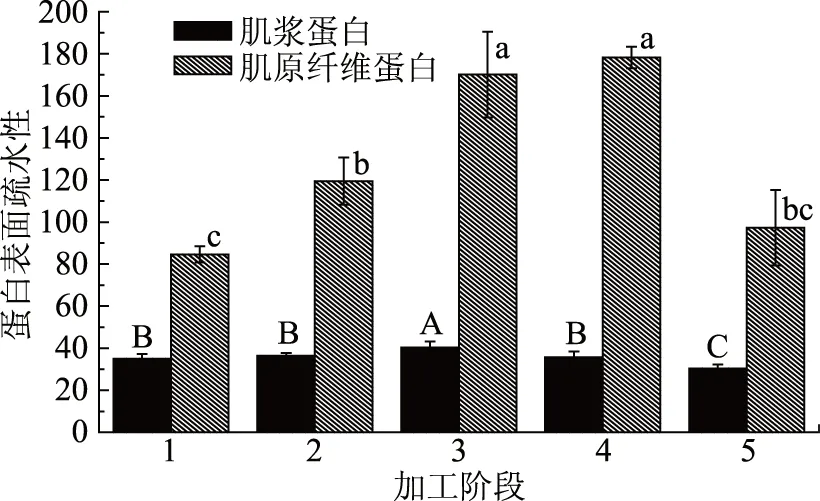
图3 低盐鲈鱼制品加工过程中肌浆蛋白和肌原纤维蛋白表面疏水性变化Fig.3 The change of surface hydrophobicity of myogen and myofibrillar proteins during the processing of low-salted bass
蛋白质的疏水作用对维持蛋白质结构的稳定性(主要维持蛋白的三级结构)、构象和功能性质起到很大的作用[24]。肌浆蛋白和肌原纤维蛋白的疏水性随着腌制的进行逐渐升高,表明腌制可以促使蛋白疏水性基团的暴露[5],Roura[25]和Yurchenko[26]也研究发现蛋白质表面疏水性随着腌制盐含量的升高而升高。而在脱盐阶段肌浆蛋白和肌原纤维蛋白表面疏水性下降,原因可能是由于盐含量降低导致疏水性降低。
2.4 菌落总数的变化
由表2可知,在加工过程的腌制阶段微生物总数变化不大,直到腌制结束后,鱼肉中微生物变化仍在同一个数量级上,与鲜鱼相比略有增多,从3.9×103CFU/g增加到7.6×103CFU/g,而在脱盐阶段,鱼肉中微生物数量迅速增多,增加到105CFU/g,并在脱盐阶段保持基本不变。最终产品指标符合国家标准的限量要求[36]。
鱼肉中菌落总数在腌制阶段变化不大,这主要是由于腌渍液盐浓度较高,而食盐吸水性很强,当它进入鱼体后,会导致鱼体脱水,抑制细菌的生长;而另一方面食盐也可以使菌体脱水,导致菌体的难以发育。也有研究者认为盐的存在导致氧的溶解度下降,从而抑制了需氧微生物的生长[24],因此菌落总数在此阶段增长缓慢。而在脱盐阶段,菌落总数迅速升高是由于缺少了盐的抑制作用,在低盐环境下,微生物迅速生长繁殖。
2.5 亚硝酸盐的变化
由图4可知,在腌制阶段,鱼肉中亚硝酸盐含量持续上升(p<0.05),从初始的0.44 mg/kg增加到腌制结束后的1.52 mg/kg。而在脱盐阶段,鱼肉的亚硝酸盐含量变化并没有显著性差异(p>0.05)。最终,鱼肉中亚硝酸盐含量为1.57 mg/kg,与鲜鱼相比增加了256.82%。最终产品指标符合国家标准的限量要求[36]。
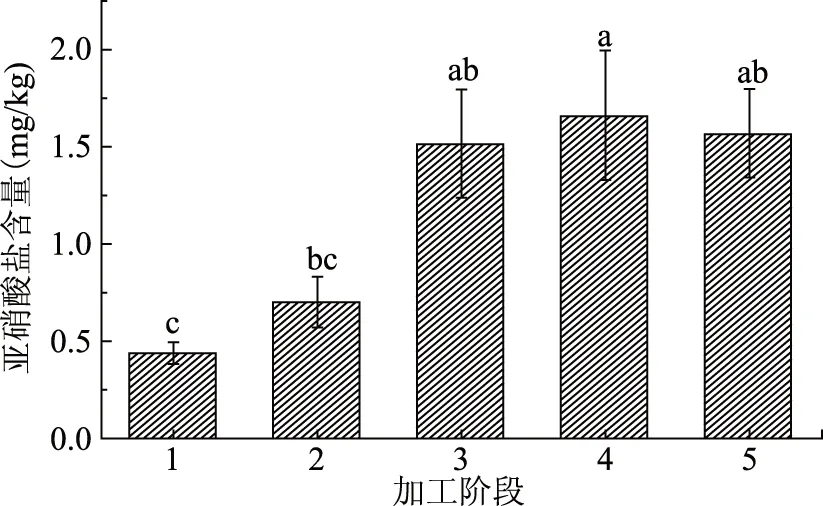
图4 低盐鲈鱼制品加工过程中亚硝酸盐含量变化Fig.4 The change of nitrite content during the processing of low-salted bass
在腌制阶段,鱼肉亚硝酸盐含量随着腌制的进行逐渐升高,这与之前的研究结果一致[27-28]。在此阶段亚硝酸盐含量的升高主要由于鱼体内含有的少量硝酸盐在硝基还原菌的作用下被还原为亚硝酸盐,并且鱼体中的蛋白质发生降解后产生一些含氮物质,在某些微生物的作用下合成硝酸盐,并进一步还原生成亚硝酸盐[27]。而在脱盐过程中,鱼肉的亚硝酸盐含量并没有显著增加,这可能是由于鱼肉蛋白质发生分解产生了三甲胺等胺类物质,这些物质能够与亚硝酸盐反应形成亚硝胺类物质[28]。
2.6 TBARS值的变化
由图5可知,新鲜鲈鱼的脂质过氧化值很低,仅为0.25 mg/100 g,而到腌制36 h后,脂质过氧化值迅速升高,达到3.17 mg/100 g,并在此后的腌制阶段和脱盐阶段保持较高浓度,最终鲈鱼鱼肉中脂质过氧化值达到2.84 mg/100 g。最终产品指标符合国家标准的限量要求[29]。
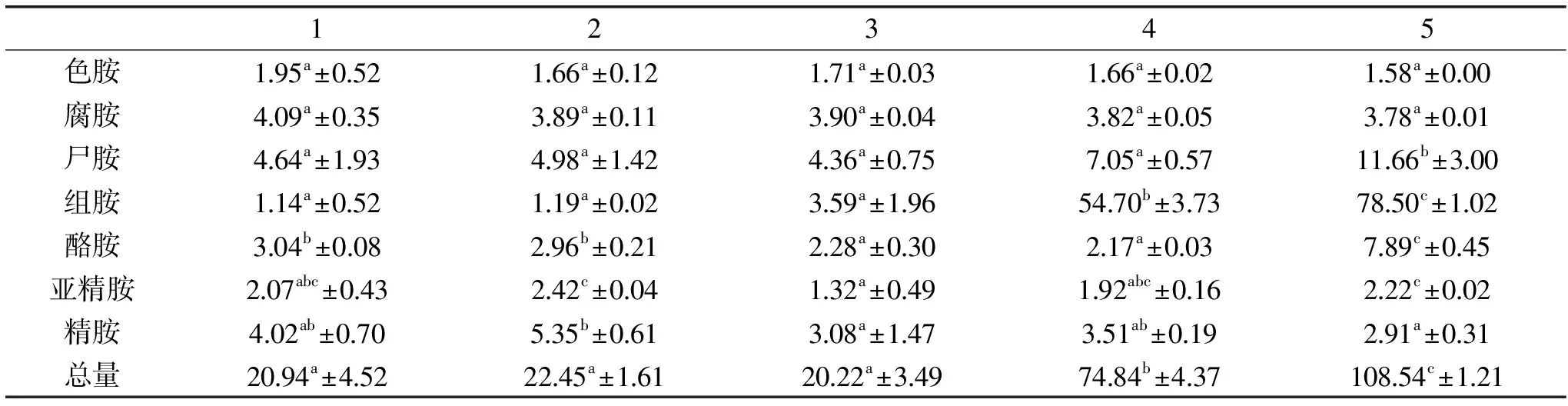
表3 低盐鲈鱼制品加工过程中生物胺含量的变化(mg/kg)Table 3 The change of biogenic amine content during the processing of low-salted bass(mg/kg)
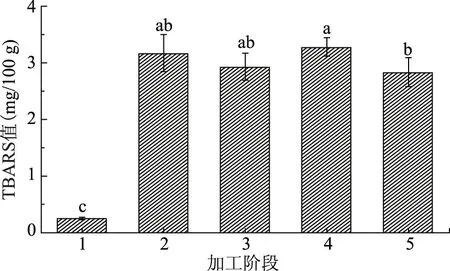
图5 低盐鲈鱼制品加工过程中脂质过氧化值的变化Fig.5 The change of lipid peroxide value during the processing of low-salted bass
TBARS值的大小反映了脂肪的氧化程度。在腌制阶段,鱼肉TBARS值显著升高,说明在腌制过程中鱼肉脂肪发生了氧化。而在TBARS值出现最高值后略有下降。蔡秋杏等[30]在腌制黄花鱼过程中也发现了TBARS值的先上升后下降的趋势,同样,Nassu[31]也发现山羊肉香肠在贮存中TBARS值先上升后下降。虽然MDA是脂质氧化的次级产物,但是它并不意味着TBARS数量会继续增加,TBARS值的降低被认为是由于MDA与蛋白质氨基作用生成1-氨基-3-氨基丙烯[32]。
2.7 生物胺含量变化
由表3可知,鱼肉中的色胺、腐胺在整个加工过程中没有显著性变化(p>0.05);尸胺在腌制阶段含量不变(p>0.05),但在脱盐后期含量上升(p<0.05);组胺规律与尸胺类似,但在脱盐阶段,组胺含量增大更明显(p<0.05);酪胺在脱盐后期含量上升;亚精胺在腌制后期含量略有减少,但最终含量变化并不大,统计学分析没有显著性差异。精胺在加工过程中含量略有下降但并无显著性趋势。生物胺的总含量在腌制阶段没有明显变化,在脱盐阶段迅速升高,最终鱼体内生物胺含量约为初始时的5倍。
生物胺是游离氨基酸脱羧而成,蛋白降解为生物胺提供前体物质。食品中的微生物菌群对其生物胺含量有重要影响[33]。在腌制阶段生物胺含量并没有显著变化是由于高盐环境不利于微生物的增长,并抑制了酶活。水浸阶段微生物迅速生长,且游离氨基酸含量丰富,导致生物胺含量升高。组胺和酪胺是影响健康的主要生物胺指标。组胺的形成是由于产生组氨酸脱羧酶的微生物对组氨酸脱羧而成,并且在鱼肉中作为组胺的前体物质组氨酸含量丰富。在低盐鲈鱼制品的鱼肉中组胺含量达到最大值78.50 mg/kg,小于它在食品中的允许限量300 mg/kg[19]。酪胺的累积是由几种常见的微生物对酪氨酸脱羧产生,例如肠球菌[34]。肉制品尸胺的产生是由于具有赖氨酸脱羧酶的肠细菌科微生物的存在[35]。因此脱盐阶段组胺、尸胺、酪胺浓度的增高主要由于盐浓度的降低导致产生此类氨基酸脱羧酶的微生物迅速繁殖和酶活的提高。而色胺、腐胺、精胺和亚精胺没有显著增多可能是由于生长的微生物不能产生此类氨基酸脱羧酶,这说明生物胺的产生受微生物种类的影响很大。赵中辉等[36]曾研究鲅鱼贮藏过程中生物胺的变化,得出在贮藏过程中,生物胺中的组胺、尸胺、酪胺、腐胺变化明显而色胺、精胺、亚精胺没有显著变化,这与本实验结果基本一致,腐胺结果的不同可能由于微生物种类的影响。在加工过程中,生物胺总量和各生物胺含量均低于限量标准[19]。
3 结论
一卤鲜鲈鱼在加工过程中蛋白羰基含量并没有显著性变化,总巯基含量在加工过程中呈下降趋势,表面疏水性在腌制阶段上升,并在脱盐阶段下降,与腌制72 h相比,分别减少了24.85%和42.79%,菌落总数在脱盐阶段迅速增加,最终产品中菌落总数达到1.2×105CFU/g。亚硝酸盐含量和脂质过氧化值在腌制阶段分别增加了2.5倍和10.7倍,而在脱盐阶段基本不变,但加工过程中均符合我国安全限量标准。脱盐阶段生物胺含量上升最多的为组胺,但含量并没有超过我国的安全限量标准300 mg/kg。
[1]Oliveira H,Nunes M L,Vaz-Pires P,et al. Salting and Drying of Cod[J]. Traditional Foods,2016,10:275-290.
[2]Almli V L,Hersleth M. Salt replacement and injection salting in smoked salmon evaluated from descriptive and hedonic sensory perspectives[J]. Aquaculture International,2013,21(56):1091-1108.
[3]杨鹏. 多脂红身鱼类鲭鱼在腌渍与干制加工中的品质变化及其控制技术的研究[D]. 杭州:浙江工商大学,2010.
[4]Nguyen M V,Thorarinsdottir K A,Gudmundsdottir A,et al. The effects of salt concentration on conformational changes in cod(Gadusmorhua)proteins during brine salting[J]. Food Chemistry,2011,125:1013-1019.
[5]孙为正. 广式腊肠加工过程中脂质水解、蛋白质降解及风味成分变化研究[D]. 广州:华南理工大学,2011.
[6]Thorarinsdottir K A,Arason S,Sigurgisladottir S,et al. Effects of different pre-salting methods on protein aggregation during heavy salting of cod fillets[J]. Food Chemistry,2011,124:7-14.
[7]Martínez-Alvarez O,Gómez-Guillén M C. Effect of brine salting at different pHs on the functional properties of cod muscle proteins after subsequent dry salting[J]. Food Chemistry,2006,94(1):123-129.
[8]张娜. 低盐度腌腊鱼生产中几个安全指标的变化及评价[D]. 武汉:华中农业大学,2010.
[9]Yurchenko S,Molder U. VolatileN-Nitrosamines in various fish Products[J]. Food Chemistry,2006,96(2):325-333.
[10]Viji P,Tanuja S,Ninan G,et al. Biochemical,textural,microbiological and sensory attributes of gutted and ungutted sutchi catfish(Pangasianodonhypophthalmus)stored in ice[J]. Journal of Food Science and Technology,2014,52(6):3312-3321.
[11]Alapont C,Martínez-Culebras P V,López-Mendoza M C. Determination of lipolytic and proteolytic activities of mycoflora isolated from dry-cured teruel ham[J]. Journal of Food Science and Technology,2015,52(8):5250-5256.
[12]Toldrá F,Rico E,Flores J. Cathepsin B,D,H and L activities in the processing of dry-cured ham[J]. Journal of the Science of Food and Agriculture,1993,62(2):157-161.
[13]Oliver C N,Alin B W,Moerman E J,et al. Age-related changes in oxidized proteins[J]. Journal of Biological Chemistry,1987,262:5488-5491.
[14]Ellman G L. Tissue Sulfhydryl Groups[J]. Archives of Biochemistry and Biophysics,1959,82(1):70-77.
[15]Cardamone M,Puri N K. Spectrofluorimetric assessment of the surface hydrophobicity of proteins[J]. Biochemical Journal,1992,282(2):589-593.
[16]GB 5009.33-2010,食品安全国家标准 食品中亚硝酸盐与硝酸盐的测定[S]. 北京:中国标准出版社,2010.
[17]岑琦琼. 梅鱼热风干燥工艺及脂肪氧化抑制技术的研究[D]. 杭州:浙江工商大学,2013.
[19]姜维. 一株耐盐性高效生物胺降解新菌的筛选、分类鉴定及应用研究[D]. 青岛:中国海洋大学,2014.
[20]Song Y N,Li Z X,Lin H,et al.Effect of malondialdehyde treatment on the IgE binding capacity and conformational structure of shrimp tropomyosin[J]. Food Chemistry,2015,175:374-380.
[21]李艳青. 蛋白质氧化对鲤鱼蛋白结构和功能性的影响及其控制技术[D].哈尔滨:东北农业大学,2013.
[22]Hsu K C,Hwang J S,Yu C C,et al. Changes in conformation and in sulfhydryl groups of actomyosin of tilapia(Orechromisniloticus)on hydrostatic pressure treatment[J]. Food Chemistry,2007,103:560-564.
[23]Kang D C,Zou Y H,Cheng Y P,et al. Effects of power ultrasound on oxidation and structure of beef proteins during curing processing[J]. Ultrasonics Sonochemistry,2016,33:47-53.
[24]章银良. 海鳗腌制加工技术的研究[D]. 无锡:江南大学,2007.
[25]Roura S I,Saavedra J P,Truco R E,et al. Conformational changes in actomyosin from post-spawned hake stored on ice[J]. Journal of Food Science,1992,57:1109-1111.
[26]Yurchenko S,Molder U. Volatile N-Nitrosamines in various fish Products[J]. Food Chemistry,2006,96(2):325-333.
[27]张娜. 低盐度腌腊鱼生产中几个安全指标的变化及评价[D]. 武汉:华中农业大学,2010.
[28]张进杰. 中国南方传统腊鱼加工、品质及安全性研究[D]. 杭州:浙江大学,2012.
[29]GB 10136-2015,食品安全国家标准 动物性水产制品[S].
[30]蔡秋杏,吴燕燕,李来好,等. 黄花鱼腌制加工过程的脂肪氧化分析[J]. 食品安全质量检测学报,2014,5(12):4079-4084.
[31]Nassu R T,Goncalves L A G,Pereira M A A,et al. Oxidative stability of fermented goat meat sausage with different levels of natural antioxidant[J]. Meat Science,2003,63(1):43-49.
[32]曹晖,王绍云,韩彩,等. 黔东南侗族传统食品腌鱼中亚硝酸盐含量变化研究[J]. 凯里学院学报,2009,27(6):36-38.
[33]Li M,Tian L,Zhao G,et al. Formation of biogenic amines and growth of spoilage-related microorganisms in pork stored under different packaging conditions applying PCA[J]. Meat Science,2014,96(2):843-848.
[34]Zhang Q,Lin S,Nie X. Reduction of biogenic amine accumulation in silver carp sausage by an amine-negative Lactobacillus plantarum[J]. Food Control,2013,32:496-500.
[35]Bover-Cid S,Izquierdo-Pulido M,Vidal-Carou M C. Changes in biogenic amine and polyamine contents in slightly fermented sausages manufactured with and without sugar[J]. Meat Science,2001,57:215-221.
[36]赵中辉,林洪,李振兴. 不同温度储藏条件下鲅鱼生物胺变化的研究[J].食品工业科技,2011,32(6):34-36.
Study on protein structure and security analysis during the processing of Yiluxian bass
HAO Zi-na1,2
(1.College of Food Science and Engeneering,Jinzhou Medical University,Jinzhou 121001,China; 2.Food Safety Laboratory,Ocean University of China,Qingdao 266003,China)
This paper revealed the changes of protein structure and security analysis in processing of Yiluxian. Several aspects,such as carbonyl content,total sulphur content,surface hydrophobicity,total number of colonies,nitrite,lipid peroxide value,biogenic amines,were particularly detected from samples got from 5 different time points. Results showed there was no significant variation of carbonyl content(p>0.05)and the total sulphur content of protein in a downward trend in the whole processing. The surface hydrophobicity of myogen and myofibrillar protein increased 15.06% and 101.03% in marinated and decreased 24.85% and 42.79% in desalination process comparing with the value of 72 h. Total number of colonies kept(3.9~9.7)×103CFU/g in marinated,but increased to 1.2×105CFU/g in the desalination process. Nitrite content and lipid peroxide value in marinated increased 2.5 times and 10.7 times respectively,but remained unchanged in the desalination stage. The content of histidine increased the most in the desalination stage,but no more than safe limits.
Yiluxian bass;salt;desalt;protein structure;security
2016-12-14
郝子娜(1989-),女,硕士,助教,研究方向:食品安全与质量控制,E-mail:hznhzndd@163.com。
TS254.1
A
1002-0306(2017)14-0087-06
10.13386/j.issn1002-0306.2017.14.017
