预注射阿托品预防心房颤动冷冻球囊消融术中迷走反射
2017-08-09桑才华孙莉萍董建增白融李松南龙德勇喻荣辉汤日波蒋晨曦刘念郭雪原闻松男宁曼杜昕马长生
桑才华 孙莉萍 董建增 白融 李松南 龙德勇 喻荣辉 汤日波 蒋晨曦 刘念 郭雪原 闻松男 宁曼 杜昕 马长生
·临床研究·
预注射阿托品预防心房颤动冷冻球囊消融术中迷走反射
桑才华 孙莉萍 董建增 白融 李松南 龙德勇 喻荣辉 汤日波 蒋晨曦 刘念 郭雪原 闻松男 宁曼 杜昕 马长生
目的 在心房颤动(房颤)冷冻球囊消融术中,消融肺静脉经常诱发迷走反射。本研究旨在评估预注射阿托品对此迷走反射的作用。方法 连续入选25例接受冷冻球囊消融术的阵发性房颤患者,前12例为试验组,后13例为对照组。试验组在冷冻球囊回缩前静推1 mg阿托品,对照组仅在血流动力学变化[心率和(或)血压降低]开始后给予阿托品,血流动力学变化恢复,即定义为治疗有效。结果 试验组中,3例血压一过性降低,无需治疗;1例发生低血压,需要支持治疗。对照组中,分别有6例低血压、3例心动过缓和3例混合性心动过缓-低血压。预注射阿托品可使术中迷走反射发生率显著降低(4/12 比 12/13,P<0.01)。结论 预注射阿托品可预防房颤冷冻球囊消融术中的迷走反射。
血管迷走反射; 阿托品; 心房颤动; 冷冻球囊
心房颤动(房颤)是最常见的心律失常。目前导管消融在房颤治疗中的地位逐步提高,冷冻球囊消融术亦日渐普遍[1]。Pappone等[2]发现导管消融术中约34.3%患者有迷走反射,表现为心搏骤停、房室传导阻滞等心率和传导的改变,而在冷冻球囊消融术中迷走反射发生率更高[3-4],但有关冷冻球囊消融术中迷走反射的发生特征尚不清楚。本文旨在总结术中迷走反射的发生特征,首次提出预注射阿托品预防迷走反射的方法。
1 对象与方法
1.1 研究对象
连续入选2015年10月至2016年3月于安贞医院心内科就诊的房颤患者,有确切心电图证据,符合阵发性房颤诊断,年龄18~80岁,至少1种抗心律失常药物治疗无效。阵发性房颤定义参照目前房颤治疗指南,包括自发持续时间<7 d以及持续48 h的房颤经电复律或者药物复律[5]。患者均在术前行经胸食管超声心动图。排除左心房血栓,排除有抗凝禁忌或不能坚持应用抗凝药物,合并其他严重疾病、不适合进行导管消融的患者。房颤患者均为首次接受导管消融手术,排除冷冻球囊消融术前出现血管迷走反射,服用抗胆碱能药物、阻断和激动交感神经的药物以及哮喘、胃反流或具有使用阿托品禁忌证的患者。共纳入25例,前12例为试验组,后13例为对照组。试验组在冷冻球囊回缩前静推1 mg阿托品,对照组仅在血流动力学变化[心率和(或)血压降低]开始后给予阿托品,血流动力学变化恢复,即定义为治疗有效。
1.2 主要设备及仪器
心内标测及导管消融使用仪器设备:冷冻球囊导管(Arctic Front Advance CB; Medtronic, Minneapolis, MN)和环形标测电极导管(spiral catheter,SC;Achieve,Medtronic, Minneapolis, MN)。数字减影血管造影机(Allura Xper FD20,Philips Healthcare,Netherlands)、多导心脏电生理记录仪(Prucka CardioLab 6.8; GE Healthcare, Little Chalfont, UK)、心脏程控刺激仪(Micropace, Bard Inc, USA),10 极可调弯冠状静脉窦标测电极(SL1, ST Jude Medical, USA)、房间隔穿刺针(BRK, ST Jude Medical, USA)、Swartz 长鞘(SL1, ST Jude Medical, USA)、10极环状标测电极(Lasso, Biosense Webster, USA)等。
1.3 电生理检查及导管消融
(1)术前准备。术前停用抗心律失常药物5个半衰期以上,常规行经胸食管超声心动图检查排除左心房血栓。围术期肝素桥接抗凝治疗,所有患者术前均签署知情同意书,禁食水至少4~6 h。
(2)冷冻球囊消融。穿刺双侧股静脉放置 6 F、8 F及8 F 静脉鞘,经左股静脉入径放置冠状静脉窦标测电极,经右侧股静脉入径穿刺房间隔,电生理检查及消融均在清醒状态进行,并静脉输注芬太尼及咪达唑仑。将冷冻球囊导管在螺旋电极支撑下送至靶静脉,球囊充气堵塞肺静脉后通过肺静脉造影评价贴靠程度,消融右肺静脉时起搏膈神经预防膈神经损伤。冷冻条件为每次持续240 s,温度达到-55℃~-45℃。为避免消融顺序对迷走反射的影响,选择左上、左下、右上及右下肺静脉的消融顺序。通过Achieve环状电极实时评价肺静脉电隔离情况。
(3)手术时间定义为从穿刺大静脉开始,至撤离全部导管的时间。透视时间定义为手术时间内的总透视时间。利用实时压力监测将血管迷走反射分为三类[6]:血管抑制型(图1A),其特征在于血压降低至 ≤80 mmHg(1 mmHg=0.133 kPa)或下降幅度≥30%但没有显著的心率降低;心脏抑制型(图2),其特征在于心率降低至<40次/min,血压的降低可以通过起搏提高心率来纠正;混合型(图1B),其特征在于心率降低至<40次/min,血压与心率无关,下降至绝对值≤80 mmHg或幅度≥30%,不能通过起搏纠正。若迷走反射持续> 30 s,给予阿托品或进行起搏。试验组患者在左上肺静脉首次冷冻球囊消融时,在球囊扩张回缩前1 min静脉内预注射阿托品1 mg。
1.4 术后处理及随访
患者术后均口服抗心律失常药物2个月,应用华法林抗凝治疗至少2个月并维持国际标准化比值(INR)在2.0~3.0,无房颤复发的卒中低危患者可停用华法林。房颤复发定义为未服用抗心律失常药物,术后3个月空白期后出现持续时间>30 s的房性心律失常发作。
1.5 统计学分析
数据采用SPSS 22.0软件进行统计学分析。计量资料以均值±标准差表示,组间比较采用独立样本t检验或单因素方差分析。计数资料以例数和百分比表示,数值比较采用卡方检验或Fisher确切概率法。双侧检验以P<0.05为差异有统计学意义。
2 结果
2.1 患者基线资料和手术特征比较
两组患者基线资料比较,差异均无统计学意义(均P>0.05,表1)。两组患者的初始心率和血压相似,患者均达到肺静脉隔离,冷冻球囊冷冻的次数和实现肺静脉隔离所需的最低温度两组比较,差异均无统计学意义(均P>0.05)。两组患者复发率比较,差异亦无统计学意义(P>0.05)(表2),两组患者均未见严重并发症发生。
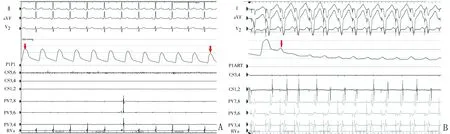
图1 不同类型迷走反射中的低血压 A:血管抑制型迷走反射,低血压与心率下降无关;B: 混合型迷走反射,仅使用起搏提高心率不能纠正低血压
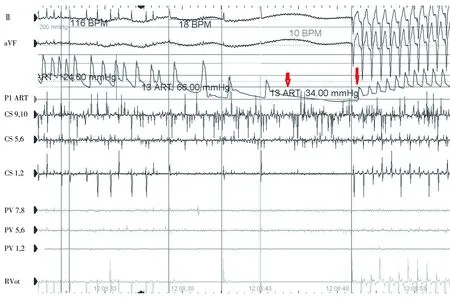
图2 心脏抑制型迷走反射 心率下降同时血压下降
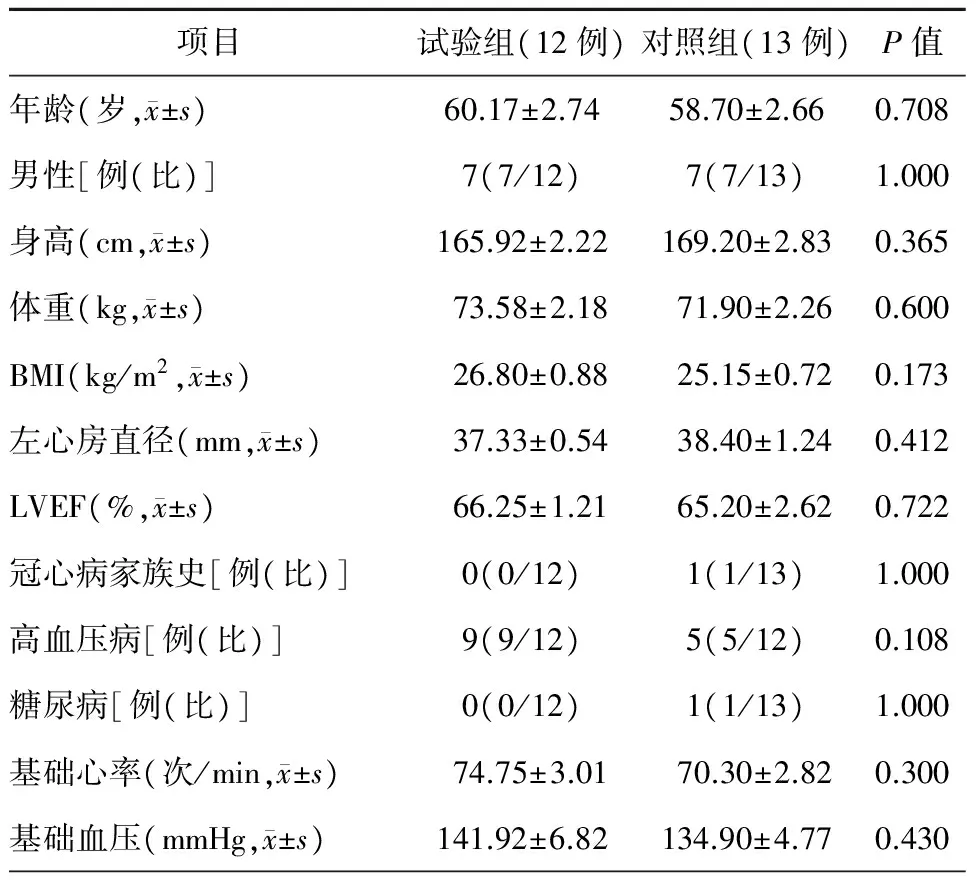
项目试验组(12例)对照组(13例)P值年龄(岁,x±s)60.17±2.7458.70±2.660.708男性[例(比)]7(7/12)7(7/13)1.000身高(cm,x±s)165.92±2.22169.20±2.830.365体重(kg,x±s)73.58±2.1871.90±2.260.600BMI(kg/m2,x±s)26.80±0.8825.15±0.720.173左心房直径(mm,x±s)37.33±0.5438.40±1.240.412LVEF(%,x±s)66.25±1.2165.20±2.620.722冠心病家族史[例(比)]0(0/12)1(1/13)1.000高血压病[例(比)]9(9/12)5(5/12)0.108糖尿病[例(比)]0(0/12)1(1/13)1.000基础心率(次/min,x±s)74.75±3.0170.30±2.820.300基础血压(mmHg,x±s)141.92±6.82134.90±4.770.430
注:BMI,体重指数;LVEF,左心室射血分数; 1 mmHg=0.133 kPa
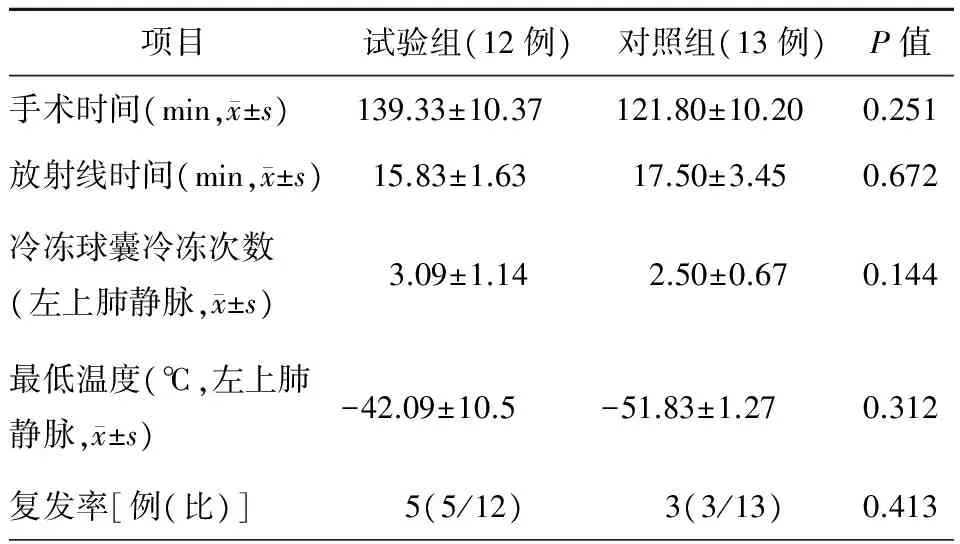
表2 两组患者导管消融手术特征比较
2.2 两组患者的血管迷走反射情况
左上肺静脉首次消融球囊回缩期内,16例患者出现迷走反射,发生于球囊回缩后(35±10)s,球囊回缩前未发生迷走反射。试验组迷走反射显著低于对照组(4/12比 12/13,P<0.01)。试验组血管抑制型3例,心脏抑制型1例;对照组血管抑制型6例,心脏抑制型3例,混合型3例。16例患者中有9例低血压,4例心动过缓,3例心动过缓-低血压。其中2例使用阿托品后再次冷冻仍然诱发低血压。1例患者左下肺静脉消融球囊回缩期间发生迷走反射,1例患者左上肺静脉消融期间已经使用了阿托品,但右上肺静脉消融仍出现了迷走反射。
2.3 两组患者迷走反射治疗的特点
试验组中3例患者,血压和(或)心率的下降趋势在30 s内停止,1 min内恢复,无需任何急救治疗。其中1例患者在没有心动过缓的情况下低血压持续约7 min。对照组中12例患者的血压和(或)心率下降趋势持续时间>30 s,因此给予支持治疗,其中10例在给药后10 s内开始恢复,在60 s内完全恢复。另外2例不伴发心动过缓的低血压分别持续13 min和20 min,直到给予其他支持性治疗得以缓解。
2.4 两组患者术后随访情况
平均随访(9.6±8.8)个月。8例患者房颤复发,试验组5例复发,对照组3例复发。试验组共7例患者成功维持窦性心律,对照组共10例维持窦性心律。
3 讨论
本研究分析了房颤冷冻球囊消融术中迷走反射的发生特征,提出预注射阿托品预防术中迷走反射。
在试验组中12例患者有4例观察到迷走反射,在对照组13例患者有12例观察到迷走反射,后者发生率远高于以前的研究。Oswald等[3]研究中发生率为36%, Miyazaki等[4]研究中13例(38.2%)发生。这种差异的原因可能是本研究监测实时血压,而Oswald等[3]采用的是间断无创血压测量技术,有可能错过了血压心率的瞬时改变。鉴于本组患者一半为血管抑制反应,较高的发生率是合理的。在全麻下进行冷冻球囊消融也可能是这些患者未出现迷走反射的原因(即迷走反射可以通过麻醉药物消除)。研究表明,麻醉深度和迷走反射之间具有强相关性, 故可采用更深的麻醉而不是抗胆碱能药物来预防术中迷走反射[3-4]。在本研究中,迷走反射的发生率也比逐点射频消融的明显增高。Pappone等[2]研究显示,至少三分之一的患者可引起迷走神经反射。在本中心临床实践中,停止射频消融后血管迷走性反射迅速缓解。然而,在冷冻球囊消融术中,迷走反射总是在球囊回缩复温期间,而不是冷冻期。这与Miyazak等[4]报道的结果一致,可能的原因是冷冻球囊消融后的细胞损伤不仅发生在细胞冷冻损伤期间,还发生在细胞冻融复温期间[7],此时左上肺静脉冻融可能刺激左上神经节丛中的迷走神经成分,而我们无法停止复温期间的温度回升,这可能是冷冻球囊消融术中迷走反射发生率高的原因。另外,也可能机械或压力诱导的损伤导致迷走反射,然而本研究中的迷走反射发生在回缩之后,这些机制需要进一步研究。
阿托品起效快、半衰期相对较短,临床应用安全且耐受良好,甚至可用于器质性心脏病患者。它具抗胆碱能作用,可拮抗传出迷走神经活动的突然增强,从而缓解其引起的心动过缓[8-9]。此外,由于外周血管床的胆碱能作用,迷走反射时血管舒张可能产生低血压,阿托品也有助于缓解血管抑制型的迷走反射[10-11]。
在本研究中,预注射阿托品患者的迷走反射发生率显著降低。因此,建议提前注射阿托品预防迷走反射。Santini等[12]评估静脉预注射阿托品对血管迷走性晕厥患者倾斜试验中迷走反射发生的缓解作用,41例患者接受安慰剂,在9例患者中有效(21.9%),43例患者使用阿托品,30例患者有效(69.7%),差异有统计学意义(P<0.01)。Gilani等[13]研究中,60例患者在全身麻醉下接受倾斜手术治疗,安慰剂组中的患者平均心率降低更多,低血压的发生率更高,手术期间需要阿托品注射的更多。安慰剂组中血管迷走反射的发生率为70%,在试验组中为10%。基于以上结果,可以合理地假设预注射阿托品能预防冷冻球囊消融术中患者的迷走反射。本研究中12例患者中有3例仍需要其他支持性治疗,这可能涉及其他机制,例如交感神经功能抑制等。
迷走反射似乎是不适当的心率反应(心脏抑制)和全身血管紧张性降低为特征的循环障碍。既往研究集中在心率变异性,但很少有人注意到消融期间的血管抑制反应。在本研究中,16例患者中有10例与心动过缓无关的低血压,6例与心动过缓相关的低血压。POISE试验[14]提示术中低血压被认为是卒中发生率升高的可能危险因素(从对照组的0.5%到美托洛尔组的1.0%)。 Bijker等[15]研究显示,术中低血压即平均血压从基线下降幅度>30%,每持续1 min低血压的卒中风险增加约1.3%,累积持续10 min的低血压将导致卒中风险增加1.14倍。在300例接受非心脏手术的患者中,术中收缩压下降幅度>50%,持续时间>5 min, 心肌损伤发生率升高[16]。在非心脏手术患者回顾性分析中,平均动脉压下降>55 mmHg与诸如急性肾损伤(AKI)和心肌损伤等不良结局相关[14]。在本研究中,低血压定义为平均血压降低幅度≥30%或绝对值<80 mmHg,11例患者发生持续≥1 min的低血压,直到进行支持性治疗,还有部分患者发生严重的迷走反射,甚至持续> 10 min,需要升压药物液体支持等额外治疗。在左上肺静脉消融期间预防突发、明显的迷走反射不仅减少了操作者的压力和负担,理论上还可以降低卒中、AKI等并发症的风险。既往的研究中,手术在全麻下进行,麻醉可抑制迷走反射。这与Meuwly等[17]所解释的心肌反射一致:足够的麻醉剂可以消除手术期间的血管迷走反射。然而,房颤导管消融术中,清醒镇静仍然广泛应用,临床医师应高度注意迷走反射的发生。持续性低血压是否与卒中或其他缺血性事件的高发病率相关仍然未知,需要进一步的研究。
总之,本研究发现迷走反射在冷冻球囊消融术中较常见,预注射阿托品显著减少迷走神经反射的发生率。随着冷冻球囊消融房颤逐步普及,迷走反射发生也会更多,阿托品和起搏电极应该是常规支持治疗,建议预防性静脉注射阿托品,在球囊回缩前给药以提高消融手术的安全性和减少围术期并发症。本研究样本量偏小,术中迷走反射是否会增加远期如短暂性脑缺血发作、卒中或者AKI等情况,还有待进一步验证。深度麻醉是否会比清醒镇静下预注射阿托品能更有效预防术中迷走反射发生还需进一步研究。
[1] Sarabanda AV, Bunch TJ, Johnson SB,et al. Efficacy and safety of circumferential pulmonary vein isolation using a novel cryothermal balloon ablation system.J Am Coll Cardiol,2005,46(10):1902-1912.
[2] Pappone C, Santinelli V, Manguso F, et al. Pulmonary vein denervation enhances long-term benefit after circumferential ablation for paroxysmal atrial fibrillation. Circulation,2004,109(3):327-334.
[3] Oswald H, Klein G, Koenig T, et al. Cryoballoon pulmonary vein isolation temporarily modulates the intrinsic cardiac autonomic nervous system. J Interv Card Electrophysiol,2010,29(1):57-62.
[4] Miyazaki S, Nakamura H, Taniguchi H, et al. Impact of the order of the targeted pulmonary vein on the vagal response during second-generation cryoballoon ablation. Heart Rhythm,2016,13(5):1010-1017.
[5] Calkins H, Hindricks G, Cappato R, et al. 2017 HRS/EHRA/ECAS/APHRS/SOLAECE expert consensus statement on catheter and surgical ablation of atrial fibrillation. Heart Rhythm,2017[Epub ahead of print].
[6] Sheldon RS, Grubb BP 2nd, Olshansky B, et al. 2015 heart rhythm society expert consensus statement on the diagnosis and treatment of postural tachycardia syndrome, inappropriate sinus tachycardia, and vasovagal syncope. Heart Rhythm,2015,12(6):e41-e63.
[7] Miyanaga S, Yamane T, Date T,et al. Impact of pulmonary vein isolation on the autonomic modulation in patients with paroxysmal atrial fibrillation and prolonged sinus pauses. Europace,2009,11(5):576-581.
[8] Sutton R. Is there an effective pharmacological treatment in the prevention of vasovagal syncope? Arch Mal Coeur Vaiss,1996,89 Spec No 1:25-28.
[9] Wray DW, Formes KJ, Weiss MS, et al. Vagal cardiac function and arterial blood pressure stability. Am J Physiol Heart Circ Physiol,2001,281(5):H1870- H1880.
[10] Devereaux PJ, Yang H, Yusuf S,et al. Effects of extended-release metoprolol succinate in patients undergoing non-cardiac surgery (POISE trial): a randomised controlled trial. Lancet,2008,371(9627):1839-1847.
[11] van Dijk JG, Sheldon R. Is there any point to vasovagal syncope? Clin Auton Res,2008,18(4):167-169.
[12] Santini M, Ammirati F, Colivicchi F, et al. The effect of atropine in vasovagal syncope induced by head-up tilt testing. Eur Heart J,1999,20(23):1745-1751.
[13] Gilani MM, Yarandi F, Eftekhar Z, et al. Comparison of pulse methotrexate and pulse dactinomycin in the treatment of low-risk gestational trophoblastic neoplasia. Aust N Z J Obstet Gynaecol,2005,45(2):161-164.
[14] Taffé P, Sicard N, Pittet V, et al. The occurrence of intra-operative hypotension varies between hospitals: observational analysis of more than 147,000 anaesthesia. Acta Anaesthesiol Scand,2009,53(8):995-1005.
[15] Bijker JB, Gelb AW. Review article: the role of hypotension in perioperative stroke. Can J Anaesth,2013,60(2):159-167.
[16] Hallqvist L, Mårtensson J, Granath F,et al. Intraoperative hypotension is associated with myocardial damage in noncardiac surgery: An observational study. Eur J Anaesthesiol,2016,33(6):450-456.
[17] Meuwly C, Chowdhury T, Gelpi R, et al. The Trigemino-cardiac Reflex: Is Treatment With Atropine Still Justified? J Neurosurg Anesthesiol,2017,29(3):372-373.
Prophylactic atropine administration prevents vasovagal response induced by cryoballoon ablation in patients with atrial fibrillation
SANGCai-hua,SUNLi-ping,DONGJian-zeng,BAIRong,LISong-nan,LONGDe-yong,YURong-hui,TANGRi-bo,JIANGChen-xi,LIUNian,GUOXue-yuan,WENSong-nan,NINGMan,DUXin,MAChang-sheng.
DepartmentofCardiology,BeijingAnzhenHospital,CapitalMedicalUniversity,Beijing100029,China
Correspondingauthor:MAChang-sheng,Email:chshma@vip.sina.com
Objective Cryoballoon ablation of pulmonary vein (PV) ostia often induces a vagal response.This prospective study was designed to assess the effectiveness of prophylactic intravenous administration of atropine on hemodynamic impairment induced by cryoballoon ablation in patients with atrial fibrillation.Methods Twenty-five patients with paroxysmal atrial fibrillation undergoing cryoballoon ablation were prospectively enrolled and assigned to either the trial group on the control group. First twelve patients (the trial group) were administered 1 mg of atropine before deflation of the cryoballoon, while the following 13 patients (the control group) were given atropine only after the onset of the hemodynamic variation (decrease in heart rate and/or blood pressure). Treatment was considered effective when the hemodynamic variations were restored.Results In the trial group, three patients with transient hypotension did not require further supportive care throughout the procedures and one patient with hypotension required supportive management. In the control group, hypotension, bradycardia and mixed bradycardia with hypotension requiring supportive care occurred in six, three, and three patients, respectively. Overall, the rate of marked vagal responses was significantly lower when prophylactic atropine was administrated (4/12vs. 12/13 patients,P<0.01).Conclusions Atropine is effective in the prevention of all types of vasovagal responses induced by cryoballoon ablation in patients with atrial fibrillation.
Vasovagal response; Atropine; Atrial fibrillation; Cryoballoon
10.3969/j.issn.1004-8812.2017.07.004
北京市博士后基金支持(2015ZZ-64)
100029 北京,首都医科大学附属北京安贞医院心内科
马长生,Email: chshma@vip.sina.com
R541.75
2017-05-10)
桑才华与孙莉萍为本文共同第一作者
