医疗器械监督抽验中复验问题的研究
2017-08-08郁红漪钱晓阳黄嘉华陈一览顾楠邹忠成国家食品药品监督管理局上海医疗器械质量监督检验中心上海市201318
【作 者】郁红漪,钱晓阳,黄嘉华,陈一览,顾楠,邹忠成国家食品药品监督管理局上海医疗器械质量监督检验中心,上海市,201318
医疗器械监督抽验中复验问题的研究
【作 者】郁红漪,钱晓阳,黄嘉华,陈一览,顾楠,邹忠成国家食品药品监督管理局上海医疗器械质量监督检验中心,上海市,201318
医疗器械的监督抽验是行政监管的措施之一,抽验中的复验问题影响抽验的最终结论。复验不当改判已比较严重地损害了监督检验的公正性和权威性。该文通过调研资料等统计分析了申请复验与改判的原因,提出了解决标准理解、标准缺陷、检验能力、样品问题与其它因素干扰的方案。为提高抽验复验的公信力,提出回避原则、优先原则、仲裁原则与考核原则,改进复验工作流程,使抽验复验工作更为合理、有效、公正。
医疗器械;监督检验;复验
0 引言
人民对生活质量、生命健康的不断追求,促进了医疗器械产业的蓬勃发展,同时也对医疗器械的行政监管提出了更高的要求。为此,国家食品药品监督管理总局医疗器械监管司进行了积极的探索,近年来对医疗器械的市场监督抽验已系统地、全面地铺开。这项工作尽管开展的时间不长,但暴露的问题却不少。为深入研究我国医疗器械的抽验工作,结合抽验实施过程中所遇到的困难、问题、困惑、思考,国家医疗器械抽验机制研究课题委托中检院监督所组织课题组开展研究。本课题为其中第五子课题的一部分,对复验工作中遇到的主要问题进行分析,探讨现有法规制度相关规定的适宜性,为降低系统性风险,提高复验结论的公信力,提出完善复验工作的措施和建议。
1 医疗器械抽验复验工作现状
经过座谈调研、问卷调查、调阅近两年国家监督抽验的数据资料进行统计分析,我们比较全面地了解了抽验复验中存在的问题,其中最突出的问题是复验结果与原检结果不一致,造成大量改判,而这一改判往往是不能信服的。
1.1 近两年国家监督抽验复验情况[1-6]
我们对2013年、2014年国家监督抽验的数据资料进行了统计分析,从中发现,近两年国家监督抽验的不合格批数是在下降的,而申请复验数和复验改判数反而是上升的。
2013年申请方多数向原检机构提出复验申请,到2014年向原检机构和向属地或原注册检验机构提出复验申请已基本持平。复验结果原检机构维持原判的比率要大大高于改判的比率;而属地或原注册检验机构改判的比率要大大高于原检改判的比率。具体数值见图1。
图1趋势表明,申请方向原检机构申请复验的比率在下降,原检机构维持原判的比率在下降,属地或原注册检验机构维持原判的比率呈陡峭的下降趋势;而申请方向属地或原注册检验机构申请复验的比率在上升,原检机构改判的比率在上升,属地或原注册检验机构改判的比率和合计改判的比率呈较陡的趋势上升。
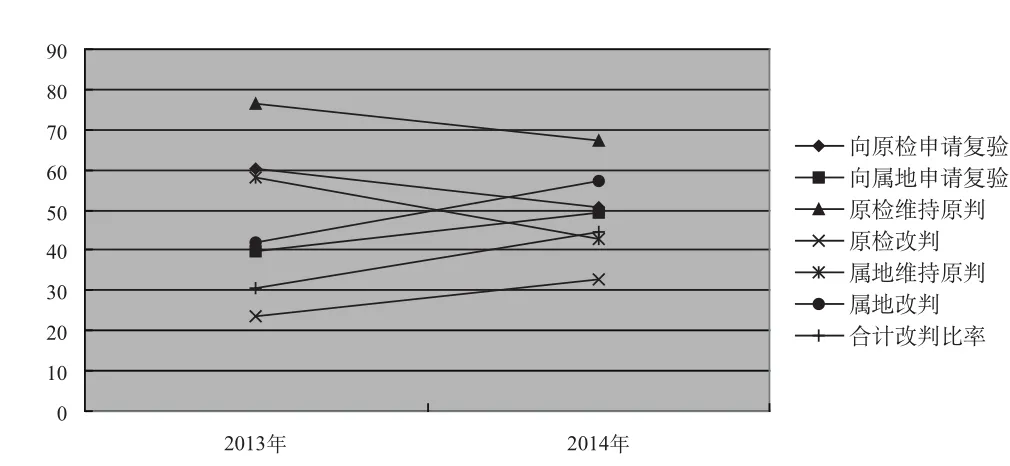

图2 申请复验理由与复验改判原因比较Fig.2 The comparison between the reasons for requesting reinspection and the reasons for overturns
统计分析显示,抽验复验工作中存在的问题是比较严重的,下检验结论的不慎重,复验改判的轻率甚至任性,造成监督检验的严肃性不够。问题的指证都向着削弱监督力度的方向发展,如果不采取措施加以遏制,那么只要有一例复验明显错判而不制止,就会像病毒一样传染开来。
1.2 抽验复验调查问卷的情况
本次调查问卷,我们向33家国监抽验承担单位发出了《复验情况调查表》,根据回复的调查数据统计分析;申请方提出复验申请的理由中:12.7%认为标准理解不一致;3.2%认为标准缺陷有歧义;65.1%怀疑检验机构的检验能力;7.9%认为样品有问题,11.1%是其他因素造成。检验机构改判的原因:11.9%是标准理解不一致;4.8%是标准缺陷有歧义;4.8%是检验能力问题;9.5%是样品问题;69%是其他因素造成(见图2)。
我们将申请复验理由与检验机构改判原因进行对比,发现申请方复验的理由主要是怀疑检验机构的检验能力导致错判,检验机构改判的原因主要是受其他因素的影响。
对此我们作了进一步的分析,在65.1%的申请方因怀疑检验能力而提出的复验申请中,改判的仅占26.8%。而在这26.8%的改判数中检验机构因其他因素影响改判的占54.5%。从中我们看出,即使是因申请方怀疑检验能力而提出的复验,改判主要还是因为其他因素的影响。
对国监复验存在的主要问题、有何建议的问题,反映较集中的一是对最终结论的认定问题,占意见的50%,二是对复验单位的选择问题,占意见的28.6%,三是复验的中立公正问题,占意见的21.4%。
对最终结论的认定问题,认为将复验结论作为最终结论不太合理,许多改判值得商榷,原检机构无复议权利,原检结论被推翻使原检机构很被动。各检验机构能力的参差不齐,使复验结果作为最终结论的权威性不够。对复验单位的选择问题,认为申请方自行选择有资质的检验机构进行复验,其对抽验方案、标准不是最了解,判定的尺度就会不一致。当复验结论与原检结论不一致时没有协调,组织专家进行评议、对比,找出不一致的原因,确定最终结论。轻易采信复验结论对外发布结果。对复验的中立、公正问题,认为复验由当事方检验机构进行检验,既不公正,也不恰当。而由属地检验单位复验,难于回避地方保护之嫌。由原注册检验机构复验则因利益的勾连或因与原注册检验结果不一致而给出产品合格的结论。
1.3 座谈调研意见汇总
课题组就医疗器械复验问题召集专业技委会秘书长、抽验方案制定人员、国监抽验工作管理人员、相关检测人员等召开了两次座谈调研会。针对抽验中的复验问题,与会人员都认为复验改判是当前最主要的问题且呈迅速扩大的趋势。因为改判的大量增加,申请复验的家数也迅速上升。原先复验申请方一般都选择与原检机构理论,现在更愿意到属地检验机构、原注册检验机构复验,因为改判的概率更高。《医疗器械质量监督抽查检验管理规定》(以下简称《抽验管理规定》)规定了申请方可以自行选择有资质的检验机构复验,且复验结论是最终结论,而《国家医疗器械抽查检验工作程序》(以下简称《工作程序》)对此规定如何操作又没有明确、细化,使抽验复验留下了漏洞。如果复验机构因为技术的原因不能权威信服地给出准确的最终结论,或者因为非技术的原因不能中立公正地给出准确的最终结论,那么复验仲裁就不是公道的维护者,而是公道的破坏者。我们也碰到过有些复验明显是错判,因为复验是最终结论,只要不会产生安全隐患,我们也只能沉默。这些问题如果不加以解决,长此以往,系统内检验机构的公信力就会逐渐丧失,国家监督检验的公正性、权威性就会大打折扣,监督抽验就会流于形式。
2 抽验复验改判问题的分析讨论
首先应肯定近两年来国监抽验复验工作的总体情况是不错的,大部分复验是秉持中立公正立场严肃对待的。复验改判各有各的原因,既有技术性的,也有非技术性的;技术性原因应用技术来解决,非技术性的原因应靠制度来保证。经分析我们例举出以下原因:
2.1 标准理解不一致导致得出的结论不一致
主要是对国行标条款释义和测试方法的理解不一致。标准文本的表述一般都是高度精炼的,其背后需要大量基础学科和专业学科知识的支撑,同一条文可能因为知识背景和专业经历的不同不能深刻理解条文要旨和用意而错判。
建议措施:一是对标准的解释要统一口径,避免“一标各表,自说自话”。标准的解释权只能是标准归口的专业技术委员会秘书处。二是标准归口的专业技术委员会要加强标准的宣贯培训,尽力使标准的使用者统一理解、统一方法、统一尺度,减少自行解读裁量。三是标准化管理相关部门网页要建立专业技术委员会专栏,就标准执行中产生的问题开展讨论交流,加深理解,共同提高。
2.2 标准缺陷有歧义,不同的解释导致不同的结果
主要是产品注册标准没有正确采标,或采用不适宜的标准达不到要求,或采用错误的项目要求,或降低要求采标,或条文表述词不达意,要求和方法不匹配等,按不同的依据检验机构即可这么判也可那么判,导致不同的结果。
建议措施:专业技术委员会要加强标准的体系建设,为国监抽验提供充分的技术支持,至少对同种类产品应制定通用要求的行业标准,抽验方案应尽量以国行标作为判定依据。如以注册标准作为判定依据,应尊重企业注册标准规定。明确当发生歧义时该如何判定,比如有相应国行标的按国行标相应条款要求复验,没有相应国行标的,由产品类别归属的专业技术委员会作出书面解释意见后按此意见复验。
2.3 检验机构的检验能力不足,不能得出正确结果
检验机构的大扩容使部分机构仓促上阵,虽然获得了检验资质,但并不代表真正具备了检验能力。检验能力是人、机、料、法、环诸多环节的综合体现,无论哪个环节不足都会造成检验能力不足,导致不能得出正确结果。
建议措施:实验室认可评审不能走过场,要加强对实验室的能力验证。鉴于目前的客观现状,国监抽验的牵头单位在抽验方案实施前要组织承担单位一起对方案涉及的标准、检验项目、测试方法、判定尺度等展开研讨,对方案的疑点、要点进行讲解、演示,使各相关方的检验水平达到方案要求。对一些影响因素多、结果离散大的检验项目要编写详细的检验大纲来保证检验能力的一致性。
2.4 样品问题导致得出不同的结果
样品是影响检验结果的重要因素之一。样品的前处理(包括安装调试)影响检验结果,样品运输、储存、保管不当损坏、变质,造成不能复验,影响最终结论的判定,同批样品不均匀,会引起原检和复验结果不同,而原检和复验用的样品如果不是同批次的,则直接导致复验结论错判。
建议措施:样品问题比较复杂,我们只能给出一些原则性的意见。
因样品前处理(包括安装调试)不当引起复验的,可以认为原检机构能力不足,复验结论为最终结论。
如果样品包装运输不当会影响样品状态的,复验样品运输由申请方在规定期限内包装托运。到样损坏、变质说明不符合包装运输要求,申请方担责,复验维持原判。
复验样品在检验机构储存、保管不当损坏、变质,检验机构担责,对抽验不作结论。对检验机构作为责任事故追责。
样品不均匀引起原检和复验结果不一致的,方案应规定该项目的复验应用原样检验,不能用原样检验的,不能复验。
复验用的样品和原检样品不是同批次的,不能复验。
2.5 其他因素干扰造成难以得出正确结论
其他因素一般都是非技术性因素。我们认为首先应该是文件规定的原因,《抽验管理规定》的使然[7],《工作程序》规定的疏漏[8],给其他因素的干扰留了一条缝。其次是医疗器械属地化监管的职责所在,地方产业发展需要;检验机构注册检验的利益勾连,尤其是与重要客户的紧密联系,当原检结论与注册检验结论不一致时,复验承受的压力,等等诸多因素的干扰,违心利用规则。
建议措施:目前开展医疗器械抽验复验依据的文件主要是《抽验管理规定》和《工作程序》。《抽验管理规定》第二十三条中规定“被抽样单位或标示生产企业(以下称申请人)对检验结果有异议的,可以自收到检验报告之日起7个工作日内向具有相应资质的医疗器械检验机构提出复验申请”。第二十五条中规定“复验应当按照监督抽验工作方案进行,复验机构出具的复验结论为最终检验结论”。《工作程序》对此两条基本是忠实原文表述,没有在操作层面作具体展开。我们知道,司法实践中利益相关方要遵循回避原则,仲裁要遵循上级裁定的原则。作为具体的执行文件,如果在执行中涉及上述问题,还是应对规定中的原则性意见加以明确、细化,对如何操作作出补充规定,确保原则性意见的正确贯彻实施。

图3 改进的复验流程Fig.3 Improved workflow of reinspection
3 改进的《工作程序》复验流程
3.1 复验流程补充的原则
针对《工作程序》中复验规定的疏漏,我们补充了如下4个原则:
(1)回避原则
申请方可自行选择具有相应资质的医疗器械检验机构提出复验申请,但应回避,不得向属地检验机构、原注册检验机构提出复验申请。不能回避的情况除外。提出申请时应提供原注册检验报告复印件。
(2)优先原则
在遵循回避原则的前提下,申请方可自行选择具有相应资质的医疗器械检验机构提出复验申请。可优先向原检机构、产品类别归属的专业技术委员会挂靠单位提出复验申请,优先向专业技术委员会挂靠单位提出复验申请,复验结论为最终结论。
(3)仲裁原则
申请方未采用优先原则提出复验申请的,复验不合格时,复验结论为最终结论;合格时,应将检验结果报告中检院,由中检院安排专家组现场目击试验。目击试验结论为最终结论。
(4)考核原则
检验机构的检验能力应纳入考核系统,对检验能力不足的检验机构应有针对性地加强测量审核、能力验证。对原检、复验反映出的检验能力问题应在实验室监督评审时重点审核。对违规改判的,应取消相应产品监督抽验的检验资格。
3.2 改进的复验流程
针对以上问题和建议,我们提出改进的复验流程见图3。
4 结论
抽验复验工作受种种因素的影响造成大量改判,其中有技术性的也有非技术性的,不当改判是显见的。问题的发展趋势是严峻的,如不加以遏制,将造成抽验公信力不足。诸多改判造成监管不严肃,问题突出已比较严重地损害了监督检验的公正性和权威性,应采取措施解决,把抽验复验改判率控制在合理可接受水平。
[1] 国家食品药品监督管理总局. 2013年国家医疗器械抽验(中央补助地方项目)产品抽样方案和检验方案[R].
[2] 国家食品药品监督管理总局. 食药监械监便函〔2014〕84号2014年国家医疗器械抽验(中央补助地方项目)产品抽样方案和检验方案[R].
[3] 国家食品药品监督管理总局. 2013年国家监督抽验数据统计[R].
[4] 国家食品药品监督管理总局. 2014年国家监督抽验数据统计[R].
[5] 国家食品药品监督管理总局. 2013年国家监督抽验质量评估报告[R].
[6] 国家食品药品监督管理总局. 2014年国家监督抽验质量评估报告[R].
[7] 国家食品药品监督管理总局. 食药监械监〔2013〕212号 医疗器械质量监督抽查检验管理规定[R].
[8] 国家食品药品监督管理总局. 国家医疗器械抽查检验工作程序[R].
The Research on Reinspection Problems in Supervisory Sampling Inspection for Medical Devices
【 Writers 】YU Hongyi, QIAN Xiaoyang, HUANG Jiahua, CHEN Yilan, GU Nan, ZOU Zhongcheng Shanghai Medical Device Quality Supervision and Inspection Center, SFDA, Shanghai, 201318
medical devices, supervisory inspection, reinspection
F203
A
10.3969/j.issn.1671-7104.2017.04.012
1671-7104(2017)04-0279-04
2017-05-12
郁红漪,E-mail: yhy_y6@163.com
【 Abstract 】Supervisory sampling inspection is one of the administrative supervision measures for medical devices. As the reinspection work affects the final conclusion of sampling inspection, inappropriate overturn during the reinspection has already impaired the impartiality and authority of the supervisory inspection work. By the statistics of survey materials, this article analyzes the reasons for requesting reinspection and making overturns,and proposes a scheme for eliminating the interference factors such as the understanding divergences and the defects of standards,the inspection capacity and the issues of sampled devices, etc. To enhance the authoritative of reinspection, this article also proposes principals of evasion, precedence, arbitration and assessment, and the improvement of the reinspection workflow in order to make the reinspection work more appropriate, more efficient and more impartial.
