医疗器械临床应用的人因失误分析研究
2017-08-08江明尹,冯庆敏,高佳琦等
医疗器械临床应用的人因失误分析研究
【作 者】江明尹1,冯庆敏1,2,高佳琦1,张强1,2,刘胜林1,2,苏敏1,2
1 华中科技大学同济医学院附属协和医院,生物医学工程研究室,武汉市,430022 2 华中科技大学同济医学院附属协和医院,医学工程科,武汉市,430022
该文介绍了医疗器械临床应用中人因失误的概念,论述了在医疗器械应用质量管理中进行人因失误研究的重要性,提出了基于临床使用环境下进行医疗器械人因失误分析的一般流程,对于防范和减少由人因失误引发的医疗器械临床使用带来的医疗事故具有重要意义。
人因工程;人因失误;医疗器械;质量管理
现代化的诊疗活动高度依赖于各种高精尖医疗器械,其应用质量的优劣直接影响着临床诊疗效果,严重者会引发医疗事故[1],有研究表明,有60%~70%的医疗器械相关事故是由人因失误引发的[2],美国急救医学研究所(Emergency Care Research Institute,ECRI)发布的“2017年十大医疗技术危害”中表明,器械使用的人因失误会对患者造成致命伤害[3]。因此,如何保证医疗器械正常运转,保障其医疗功效的发挥,是医疗机构进行医疗器械应用质量管理的重要内容[4]。人因工程(Human Factors Engineering)作为一门边缘新兴学科,有机融合相关学科理论,将人-机-环境纳入整体进行系统分析与研究,有效地提高了工作效率、减少人因失误以及提高人员舒适度,其研究方法已应用于多个领域[5]。人因工程作为改善医疗器械应用质量的有效方法学理论[6],为日益严峻的医疗器械应用人因失误问题提供了新的解决方案及理论支撑。
1 概述
人因失误(Human Error)即人在认知活动中的行为失误,认知任务过程不恰当的信息处理会导致人因失误的发生[7]。医疗器械临床应用过程中产生的人因失误主要与人机交互行为有关,因此医疗器械人因失误引发的风险同样应该得到重视。人因失误会导致器械发生的功效与临床实际期望不符,并且对患者造成的潜在危害比传统医疗器械风险更为严重。因此,减少并预防医疗器械人因失误造成的医疗风险关键在于如何在现有医疗器械应用质量管理体系中识别并发现人因问题并及时处理,建立一个完善的认知机制及处理流程,有效地减少医疗器械人因安全隐患,降低医疗事故发生频率,从而更大程度上保障患者临床就医安全。
人因工程作为研究人-机-环境中工作效率、人的健康、安全及舒适度等问题的学科[8],可以将其应用于医疗器械临床应用质量管理流程中,可在器械临床使用环境中减少使用失误,增强器械的易用程度,减轻临床使用人员疲劳程度及压力,增加工作满意度,改善器械临床应用的安全性,从而有效降低器械应用带来的医疗风险。
2 医疗器械应用人因失误研究
人因研究方法应当融入到医疗器械风险管理研究中,作为风险管理的一部分降低器械在应用过程中的人因失误。图1描述了人因分析方法在医疗器械应用质量管理中的处理流程,用以识别、处理及预防在用医疗器械的人因失误。
因此,完成一个成功的在用医疗器械人因问题分析需要注重以下四步:① 对器械应用的人-机-环境系统进行系统分析,发现人因问题;② 修改医疗器械所处的人-机-环境系统;③ 提出人因解决方案;④ 执行人因验证研究,检验解决措施的有效性。

图1 医疗器械人因失误处理流程Fig.1 Human error treatment process for medical devices

图2 医疗器械临床应用人因失误来源Fig.2 Human error sources for medical devices Clinical application

图3 人因系统分析内容及方法Fig.3 Human factor system analysis and research methods
2.1 医疗器械人因失误的系统分析
人因失误系统分析主要用于识别临床应用路径下医疗器械使用过程中可能造成人因失误的根因。人因失误系统分析内容涵盖了人-机-环境三方面(如图2、3),对于医疗器械,主要从它的医疗功能、界面设计以及器械反馈的信息流向等方面着手,查清器械自身设计存在的缺陷可能导致使用者产生的人因失误。如:两个界面功能按钮设计过于相似容易让操作者造成混淆,某些操作流程设计与医务人员日常习惯不符,人机交互界面存在明显缺陷等,都是造成临床使用人因失误的常见原因。对于临床使用人员,主要通过进行任务测试以及工作负荷测量等方式,探究临床使用器械时对使用者认知、心理及体力等能力要求。当器械操作超过使用者能力范围时,很容易发生人因失误,如过多要求使用人员记忆能力导致功能按键的误用、过高要求使用人员的自身经验能力导致不正确功能的使用。对于医疗器械使用环境,如器械房间内的灯光、温度、噪音等物理因素[9],会直接影响到医务人员对器械的使用状况,此外器械所处的空间的工作场所布局同样会导致人因失误。较为常见如器械摆放位置不符合医务人员的操作习惯、空间布局不合理造成操作不便等,这些情况都会导致医疗器械使用人因失误的产生。因此,通过人因系统分析,可以有针对性地全面挖掘临床使用人员人因失误的根源,有目标性地提出解决措施,确保器械使用安全、有效。
人因工程为人因失误研究提供了大量的研究方法(如图3),对于已知人因失误根源可以通过访谈、问卷调查以及口头报告等主管调查方法获得;对于潜在未知的人因失误根源,可通过关键事件分析、特定器械操作任务分析等方式发现临床使用人员在模拟操作过程中存在的问题,从而及时进行改正及预防。
2.2 人- 机-环境系统修改及综合解决方案
医疗器械人-机-环境应用系统的修改主要通过前期人因系统发现的问题有针对性的进行。依据人因失误所涉及的方面可以从以下方面对系统提出修改措施:① 重新设计在用医疗器械的工作流程(如任务序列、职责等);② 改进器械临床使用物理环境(如噪声、灯光照明,警报等);③ 重新设计信息传输流程;④ 开发器械使用帮助系统;⑤ 改变系统人机交互界面(如器械设计缺陷);⑥ 开发器械使用培训方案;⑦ 整合器械使用安全保障系统。
通常,医疗器械人-机-环境应用系统单方面的改进并不足以达到消除人因失误的目的,它还需要综合考虑医疗器械应用的人机环境存在的人因缺陷,提出整合的解决方案,人-机-环境应用系统的修改不是毫无根据的,需要进行一定的综合评价才能付诸实践,常用的综合解决方案有人员培训、引入新的器械质量管理技术、修改系统组织架构和进行成本—效益分析,这些手段可以有效减少并预防人因失误的发生。
2.3 人因验证研究
人因验证研究的主要目的是测试已修改的医疗器械人-机-环境应用系统消除人因失误的有效性以及发现系统中还存在的人因问题。医疗器械人因验证研究应当全面考虑其实际使用情况,测试过程中能够有效验证系统改进后的效果以及精确捕捉还存在的人因问题,且研究的结果可以应用实际人-机-环境系统的进一步改进。图4介绍了医疗器械人-机-环境应用系统修改后的人因验证流程。
执行人因验证测试应当注意以下几点,首先验证测试研究中的受试者应当为临床目标使用者;其次,所有的器械关键操作任务应当被执行;最后,进行验证的使用环境应当与临床真实使用环境相类似。
人因验证研究通常在临床模拟环境下进行器械操作,当需要在真实使用环境下操作时,修改后的人-机-环境系统也应该可以进行人因验证研究的数据采集。人因确认研究应当建立在已进行医疗器械应用系统人因分析、系统修改及解决方案提出的基础上。图5揭示了综合人因处理流程后的医疗器械质量管理体系中人因失误处理流程。

图4 人因验证流程Fig.4 Human factor verification process
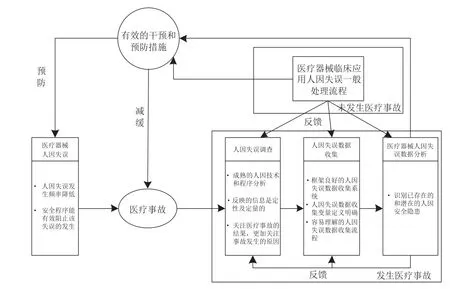
图5 处于医疗器械质量管理体系中人因失误处理流程Fig.5 Human error process flow in the medical device quality management system
3 人因失误研究在医疗器械质量管理中的应用
为了减少或预防医疗器械临床应用人因失误带来的医疗风险,对医疗器械应用人因失误产生的根本原因进行分析尤为重要。进行人因失误的根源分析主要是识别医疗器械应用人-机-环境系统内可能存在潜在的人因安全隐患,防止医疗器械应用人因事故的发生。
目前,国内外已有部分关于医疗器械临床应用人因失误研究。如国内,陈宏文等[10]将“瑞士奶酪模型”应用于医疗设备使用风险管理,研究发现使用人员人因失误的主要来源为主动失效(不安全的操作行为)与潜伏失效(不可预见的人因因素)。潜伏失误一直存在于人-机-环境系统中,与系统中的主动失效相互交织,引发医疗事故,并且主动失效引发的风险远大于潜伏失效。李萍等[11]利用人因可靠性分析方法—认知可靠性与误差分析方法(Cognitive Reliability and Error Analysis Method,CREAM),对医院静脉注射泵任务流程进行分解,结合9项绩效条件(环境、组织、人员、界面等)对使用者任务完成质量进行综合评价,定量评测使用操作人员人因失误发生的概率,为医院管理者提供了人因失误管理工具及思路。程鹏[12]将灰色关联法和HFACS理论引入到医疗设备维修人因失误分析中,对医疗设备差错模式与人因来源进行关联分析,从而从多个角度获得维修差错发生的人因根源,为防范医疗设备维修的人因失误提供了有效的管理对策。
在国外,不少学者已将人因工程学理论用于器械人因失误研究,如Lin L等[13]利用人因工程学的理论及技术,对一台患者自控型镇痛泵和雅培Lifecare 4100注射泵的人机交互界面进行了重设计,并将改进泵与原泵进行仿真实验研究,结果发现改进泵在任务完成时间、精神负荷和出错概率上远低于原泵,大大降低了器械人因失误的发生频率;Elbardissi A W等[14]运用遵循人因分析与分类系统理论HFACS对手术期间医疗器械不良事件展开研究发现,大部分的事故是由人因失误造成,主要原因为组织影响、不安全监管、不良精神状态、不良生理状态、心理/精神局限和不安全行为等,这些都是人因失误造成医疗事故的诱发因素;Chan A J等[15]利用人因工程学中的可用性测试研究方法,将有缺陷的软件人机界面进行重设计,用以评估其减少人因失误的有效性,结果发现人因工程学方法对人因失误的发生频率有显著的抑制作用;Lópeztarjuelo J等[16]通过利用直线加速器放射治疗过程中已发生的医疗事故历史数据进行了故障树分析,然后利用人因学中的失效模式与效果分析(Failure Mode and Effect Analysis,FMEA)对事故中的人因失误进行了详细分析,为解决放疗系统中的人因失误管理提供了新的解决工具。
综上所述,在医疗器械使用管理中,人因失误引发的医疗风险已成为医疗事故发生的重要诱因,如何利用人因工程学方法识别并预防医疗器械临床应用人因失误带来的严重后果,将是未来医疗器械质量管理的重要研究内容。
4 结论
医疗器械临床应用人-机-环境系统是一个复杂度极高的动态变化系统,人为因素作为其中一个主要节点,其引发的人因失误很容易造成医疗事故。为防止类似事故的反复发生,应对造成人因失误的潜在根源仔细进行探寻和追溯,有利于医疗机构防范和管理医疗器械临床应用人因失误。当前,已有不少基于人因工程的理论用于分析器械的人因失误(如“瑞士奶酪模型”、故障树、失效模型等),但大多数都是事故发生后进行人因失误研究,较少有事前主动对器械临床应用人-机-环境系统可能存在的缺陷进行人因系统分析,本文提出的医疗器械人因失误处理流程可以较好地应用于人因失误事前管理,避免了消极、被动的时候反应,使器械使用安全性大幅提高,对于保障器械的正常运作、患者就医安全具有重要应用价值。
[1] 高关心, 夏慧琳, 朱永丽, 等. 医疗机构医疗器械风险管理概述[J]. 中国医疗设备, 2015,30(11):10-12.
[2] Medical devices post market surveillance: global guidance for adverse event reporting for medical devices[S]. GHTF/SG2/ N54R82006:32.
[3] ECRI Institute. Top 10 health technology hazards [EB/OL]. https:// www.ecri.org/Pages/SearchResults.aspx?k=2017%20Top%20 10%20Technology%20Hazards&Page=1&PageSize=20&Sort=rele vance&mo=false, 2016-11-7/2016-11-18.
[4] 吴永东. 医疗器械临床应用质量与管理体会[J]. 中国药物经济学, 2013, 8(2): 162-163.
[5] Kohn L T, Corrigan J M, Corrigan M S. To err is human: building a safer health system[M]. Washington DC: National Academy Press, 2000.
[6] Pascale Carayon. Handbook of human factors and ergonomics in healthcare and patient care Second Edition[M]. New York: CRC Press, 2011.
[7] Norman D A. Categorization of action slips[J]. Psychol Review, 1981, 88(1): 1-15.
[8] 孙林岩. 人因工程[M]. 北京:高等教育出版社,2008.
[9] 陆钢, 刘宪, 郑焜. 医疗设备与使用环境关系[J]. 中国医疗设备, 2014, 29(3): 98-100.
[10] 陈宏文, 崔飞易, 廖伟光. “瑞士奶酪模型”在医疗设备使用风险管理中的应用[J]. 中国医疗设备, 2016, 31(5): 130-132.
[11] 李萍, 王竹, 寇静波, 等. 人因可靠性分析在医疗器械风险评估中的应用[J]. 中国医疗设备, 2014, 29(2): 113-115, 135.
[12] 程鹏. 基于人因工程学的医疗设备维修差错分析研究[D]. 武汉:华中科技大学, 2013.
[13] Lin L, Isla R, Doniz K, et al. Applying human factors to the design of medical equipment: patient-controlled analgesia[J]. J Clin Monitor Comput, 1998, 14(4): 253-263.
[14] Elbardissi A W, Wiegmann D A, Dearani J A, et al. Application of the human factors analysis and classification system methodology to the cardiovascular surgery operating room[J]. Ann Thorac Surg, 2007, 83(4): 1412-1419.
[15] Chan A J, Islam M K, Rosewall T, et al. The use of human factors methods to identify and mitigate safety issues in radiation therapy[J]. Radiotherapy Oncol J Eur Soc Therapeutic Radiol Oncol, 2010, 97(3): 596-600.
[16] Lópeztarjuelo J, Bouchébabiloni A, Santosserra A, et al. Failure mode and effect analysis oriented to risk-reduction interventions in intraoperative electron radiation therapy: the specific impact of patient transportation, automation, and treatment planning availability[J]. Radiotherapy Oncol, 2014, 113(2): 283-289.
Study of Human Error Analysis in Medical Devices Clinical Application
【 Writers 】JIANG Mingyin1, FENG Qingmin1,2, GAO Jiaqi1, ZHANG Qiang1,2, LIU Shenglin1,2, SU Min1,2
1 Biomedical Engineering Lab, Wuhan Union Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan, 430022 2 Deparment of Medical Engineering, Wuhan Union Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan, 430022
human factors engineering, human error, medical device, quality management
R197.39
A
10.3969/j.issn.1671-7104.2017.04.018
1671-7104(2017)04-0298-04
2016-11-29
国家重点研发计划项目(2016YFC0106700)子课题(2016YFC0106702)
苏敏,E-mail: sumin9966@163.com
【 Abstract 】This paper introduces the concept of human error in medical devices during clinical application, the importance of human error research in medical device quality management has been discussed, the general flow of human error analysis in medical device based on the clinical use environment has been presented, which has great significance for prevention and reduction human errors caused by medical devices clinical use.
