膈下逐瘀汤对大鼠纤维化肝脏组织硫氧还蛋白系统的影响*
2017-08-07杨婧贾彦王蔚戚基萍刘宏代巧妹
杨婧,贾彦**,王蔚,戚基萍,刘宏,代巧妹
(1.黑龙江中医药大学基础医学院病理教研室哈尔滨150040;2.哈尔滨医科大学附属第一医院哈尔滨150001)
膈下逐瘀汤对大鼠纤维化肝脏组织硫氧还蛋白系统的影响*
杨婧1,贾彦1**,王蔚1,戚基萍2,刘宏1,代巧妹1
(1.黑龙江中医药大学基础医学院病理教研室哈尔滨150040;2.哈尔滨医科大学附属第一医院哈尔滨150001)
目的:验证“膈下逐瘀汤抑制大鼠纤维化肝脏组织氧化应激的作用是通过增强硫氧还蛋白系统而实现”这一假说。方法:SD大鼠随机分为正常对照组、模型组,正常大鼠+膈下逐瘀汤组、模型大鼠+膈下逐瘀汤组。大鼠免疫性肝纤维化模型通过每周2次每只大鼠腹腔注射猪血清0.5 mL的方法制备。同时按含生药每天7.37 g·kg-1的剂量给予膈下逐瘀汤灌胃给药干预。采用分光光度法检测肝脏组织中脂质过氧化物(Lipid Peroxidation,LPO)含量、硫氧还蛋白还原酶(Thioredoxin Reductase,TrxR)活性、PCR检测编码核转录因子E2相关因子2(Nuclear Factor Erythroid 2-related Factor 2,Nrf2)基因Nfe2l2的表达,利用Western blot检测硫氧还蛋白-1(Thioredoxin-1,Trx1)蛋白表达和Akt磷酸化水平。结果:与模型对照组大鼠比较,膈下逐瘀汤组大鼠纤维化肝脏组织LPO含量显著降低,Trx1蛋白表达和TrxR活性显著提高,Akt磷酸化水平显著增加,Nfe2l2 mRNA表达显著上调(均P<0.05)。结论:膈下逐瘀汤增强机体肝脏硫氧还蛋白系统与其活化Akt-Nrf2信号通路有关,从而预防大鼠纤维化肝脏组织氧化应激状态,本实验结果为支持假说提供了实验依据。
肝纤维化膈下逐瘀汤氧化应激硫氧还蛋白系统核转录因子E2相关因子2
肝纤维化是由病毒性和自身免疫性肝炎、铁沉积、酒精性肝病和胆汁淤积等病因引起的慢性肝病进展至肝硬化的必经阶段[1]。迄今为止,临床上尚缺乏特异性针对肝纤维化的有效逆转或阻止其进展的药物[2]。前期研究发现,经典方膈下逐瘀汤可以改善实验性大鼠肝纤维化,抑制肝星状细胞活化和细胞外基质形成[3-5]。越来越多的研究发现,氧化应激是肝纤维化形成和肝星状细胞活化的重要机制,抗氧化已成为防治肝纤维化治疗的策略之一[6]。为了探究膈下逐瘀汤抗肝纤维化的机制是否与其抗氧化特性有关,本研究提出膈下逐瘀汤保护大鼠纤维化肝脏组织氧化应激损伤的作用是通过增强硫氧还蛋白系统而实现的这一假说。为了验证这一假说,本研究采用猪血清腹腔注射诱导大鼠免疫性肝纤维化模型,观察了氧化应激相关指标,为明确膈下逐瘀汤抗肝纤维化的作用机制提供实验数据。
1 材料和方法
1.1 材料
1.1.1 实验动物
SD大鼠从北京维通利华实验动物技术有限公司购买,为同一批次7周大小雄性60只大鼠,许可证编号:SCXK京2002-0003。饲养环境:温度为20℃-23℃;相对湿度45%-55%,按每笼5只饲养,自然光照,正常摄食饮水,环境安静,通风良好。饲料由长春市亿斯实验动物技术有限责任公司提供。
1.1.2 主要仪器与试药
Smart Chemi™图像分析系统(北京赛智创业科技有限公司);JY-ZY5和JY-SCZ2电泳仪(北京君意东方电泳设备有限公司);Stratagene Mx3005P Real-time PCR仪(Agilent公司);S1000™Thermal Cycler(美国BIORAD公司生产);ELX800全自动酶标仪(美国BioTek公司),XPE504分析天平(瑞士Mettler Toledo公司)。
SYBRExScriptTMRT-PCR Kit、总RNA提取试剂RNAiso Reagent(大连宝生物工程有限公司,Cat号分别是:DRR031A、B13031)。Nfe2l2(NM_031789)和GAPDH(NM_017008)基因序列通过美国国立生物技术中心(National Center of Biotechnology Information,NCBI)库获得,用Primer Primier 5.0引物设计软件设计Nfe2l2和GAPDH引物。Nfe2l2上游引物5′-CCC AGC ACA TCC AGA CAG AC-3′,下游引物5′-TAT CCA GGG CAA GCG ACT C-3′,扩增产物大小为195 bp;GAPDH上游引物5′-GAC AAC TTT GGC ATC GTG GA-3′,下游引物5′-ATG CAG GGA TGA TGT TCT GG-3′,扩增产物大小为143 bp。引物均由生物工程(上海)股份有限公司合成。脂质过氧化物检测试剂盒(Cayman公司,Cat:705002)。硫氧还蛋白还原酶活性分光光度分析试剂盒(BioVision公司,Cat:K763-100)。p-Akt抗体(Santa Cruz公司,Cat:sc-16646-R);GAPDH抗体、Akt抗体、Trx1抗体(Cell Signaling公司,Cat号分别是:#2118、#4685、#2429)。细胞浆蛋白与核蛋白抽提试剂盒(上海碧云天生物技术有限公司,Cat:P0028);Super Signal®West Pico Chemiluminescent Substrate(美国Thermo公司,Cat:PH203837)。
猪血清(上海纬群生物技术有限公司,批号:20081214);膈下逐瘀汤由五灵脂∶当归∶丹皮∶桃仁∶川芎∶乌药∶赤芍∶玄胡索∶甘草∶香附∶红花∶枳壳比例为4∶6∶4∶6∶4∶4∶4∶2∶6∶3∶6∶3组成。各味中药从齐齐哈尔市中医医院购买,经齐齐哈尔医学院牛英才研究员鉴定均为正品。按中医传统方法煎煮2次,水煎液浓缩成含生药1.5 g·mL-1,分装置于冰箱4℃保存备用。
1.2 方法
1.2.1 动物分组、造模及给药
60只大鼠适应性喂养1周后,随机分为4组,即正常对照组、模型组、正常大鼠+膈下逐瘀汤组、模型大鼠+膈下逐瘀汤组。以每周2次,每次每只大鼠腹腔注射0.5 mL的NaCl注射液或猪血清,正常对照组、正常大鼠+膈下逐瘀汤组大鼠腹腔注射NaCl注射液,模型组和模型大鼠+膈下逐瘀汤组大鼠腹腔注射猪血清。膈下逐瘀汤按体重给药,给药剂量根据人临床使用剂量通过每公斤体重占有体表面积相对比值计算所得。在造模的同时,正常对照组和模型组大鼠每天连续灌胃给予生理盐水,而正常大鼠+膈下逐瘀汤组和模型大鼠+膈下逐瘀汤组大鼠每天连续灌胃给予膈下逐瘀汤(每天剂量为生药7.37 g·kg-1),共12周。
1.2.2 分光光度法检测LPO含量
肝脏组织匀浆取上清,按照Cayman公司LPO检测试剂盒说明书检测。
1.2.3 分光光度法检测TrxR活性
肝脏组织匀浆取上清,按照硫氧还蛋白还原酶活性分光光度分析试剂盒说明书检测。
1.2.4 Real-time PCR检测大鼠Nfe2l2 mRNA表达
采用RNAiso Reagent试剂盒提取肝脏组织总RNA,cDNA合成采用PrimeScript™RT Reagent kit。采用SYBR®Premix Ex Taq™试剂盒检测Ct值,Nfe2l2 mRNA表达的相对定量采用2-ΔΔCt方法进行分析。
1.2.5 Western blot法检测大鼠肝脏组织Trx1蛋白表达和Akt磷酸化
蛋白提取试剂盒抽提肝脏组织蛋白。十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离肝脏组织蛋白,电泳结束后再将蛋白质转移到PVDF膜上,用5%的脱脂奶粉/ TBST室温封闭120 min后,加入一抗4℃孵育过夜,加入相应二抗,室温孵育2 h后,进行化学发光反应、显影、定影和印迹条带的积分光密度分析。
1.2.6 统计分析
2 结果
2.1 膈下逐瘀汤预防了猪血清诱导的氧化应激(图1)
与空白对照组比较,猪血清组大鼠肝脏组织中LPO含量显著增加(P<0.05)。与猪血清组比较,猪血清+膈下逐瘀汤组大鼠肝脏组织LPO含量显著降低(P<0.05)。
2.2 膈下逐瘀汤增强了肝脏组织硫氧还蛋白系统(图2)
与空白对照组比较,正常大鼠+膈下逐瘀汤组和猪血清+膈下逐瘀汤组大鼠肝脏组织Trx1蛋白表达和TrxR活性显著增加(均P<0.05)。猪血清组与空白对照组大鼠肝脏组织Trx1蛋白表达和TrxR活性无显著性差异。
2.3 膈下逐瘀汤活化了肝脏组织Akt-核转录因子E2相关因子2信号通路(图3)
与空白对照组比较,正常大鼠+膈下逐瘀汤组和猪血清+膈下逐瘀汤组大鼠肝脏组织Akt磷酸化水平和Nfe2l2 mRNA表达显著增加(均P<0.05)。猪血清组与空白对照组大鼠肝脏组织中Akt磷酸化和Nfe2l2 mRNA表达无显著性差异。
3 讨论
膈下逐瘀汤是王清任在《医林改错》中独创的经典方剂,具有活血行气、祛瘀止痛的功效。由桃仁、丹皮、当归、川芎、红花、赤芍、乌药、延胡索、五灵脂、枳壳、香附和甘草等12味药物组成。中医理论认为,肝纤维化具有瘀血的特征[7],归属于胁痛和症瘕等病的范畴。越来越多的证临床研究表明,气滞血瘀是肝纤维化最主要的证型,贯穿肝纤维化发病的过程,是肝纤维化最重要的病因之一[8],血瘀是乙型肝炎病毒等湿热邪毒引起的重要病理产物[9]。本研究结果支持了我们的假说,显示膈下逐瘀汤预防了猪血清腹腔注射诱导的肝脏组织氧化应激,虽然猪血清对硫氧还蛋白系统和Akt-Nrf2信号通路有轻微的影响,但是这种影响没有达到统计学意义。膈下逐瘀汤对病理和生理状态下的硫氧还蛋白系统和Akt-Nrf2信号通路均具有显著的增强/活化作用。

图1 膈下逐瘀汤对大鼠纤维化肝脏组织LPO含量的影响。
本研究采用的猪血清诱导的免疫性肝纤维化与人类肝纤维化的形成原因有一定相似之处,肝纤维化持久且致纤维化的过程中对肝细胞无损[10],因此在评价药物特别是中药复方疗效中较化学中毒性肝纤维化模型有显著特色和优势[11]。Ge等研究发现,机体反复接受异体血清引起体内产生大量的免疫复合物,进而导致Kupffer细胞产生大量细胞因子,诱导脏肝纤维化发生[12]。我们采用腹腔注射猪血清(每只0.5 mL,每周2次)成功的制备大鼠免疫性肝纤维化模型,VG染色[4]、HE染色[5]和Masson染色[3];其实验结果显示,腹腔注射猪血清诱导了大鼠肝脏组织大量的胶原沉积。郝瑞春等[13]研究发现,免疫性肝纤维化大鼠机体存在氧化应激,这与我们的发现一致,但是腹腔注射猪血清诱导氧化应激的机制尚不明确,需要将来进一步研究。
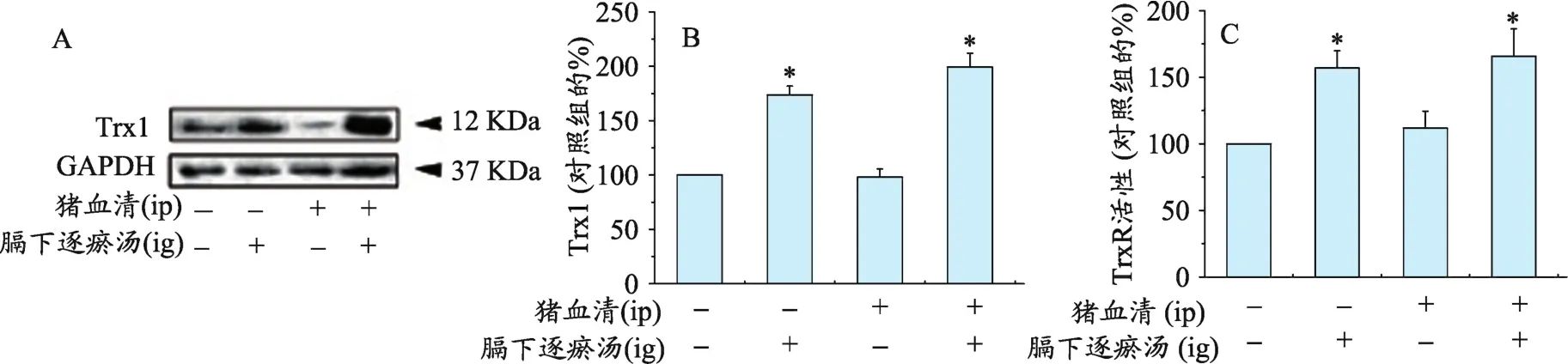
图2 膈下逐瘀汤对大鼠纤维化肝脏组织中Trx1蛋白表达和TrxR活性的影响。

图3 膈下逐瘀汤对大鼠纤维化肝脏组织中Akt磷酸化和Nfe2l2 mRNA表达的影响。
肝细胞比其他细胞具有更强的抗氧化功能[14]。Mohammadalipour等[15]研究发现,多数致肝损伤的因素可引起活性氧的过量产生和抗氧化能力的减弱,导致氧化应激状态。氧化应激参与了肝纤维化的发生和发展,肝脏纤维化与氧化应激之间的因果关系受到广泛的关注。肝炎病毒能够诱导活性氧(Reactive Oxygen Species,ROS)的产生,ROS能够活化肝星状细胞和导致肝纤维化形成[16]。由于氧化应激是肝纤维化发病的主要机制之一,减轻氧化应激以及增强机体抗氧化防御能力的抗氧化治疗策略,可能逆转或阻止肝纤维化的发展。目前在临床上一些常用保护肝细胞的药物(如水飞蓟宾)已经在体外发现有较强的抗氧化活性,具有抗纤维化的潜质[17,18]。由于膈下逐瘀汤和肝纤维化方证对应,在临床上治疗肝纤维化疗效确切[19]。前期研究也发现膈下逐瘀汤具有抗实验性肝纤维化作用[3],本研究进一步发现膈下逐瘀汤的抗氧化活性可能使其预防肝纤维化的重要机制。
在研究抗氧化酶的过程中,非酶系统在抗氧化反应中的重要作用已逐渐被许多学者认识[20]。硫氧还蛋白是抗氧化非酶系统的重要成员之一,具有强大的抗氧化作用,发挥着维持细胞内的氧化还原稳态作用[21]。本研究发现,膈下逐瘀汤显著提高了大鼠纤维化肝脏组织Trx1蛋白表达和TrxR活性。有趣的是,膈下逐瘀汤同时也增加了基础水平的硫氧还蛋白系统,表明膈下逐瘀汤的抗氧化特性与猪血清诱导无显著相关。
Nrf2是一种含有一高度保守的碱性亮氨酸拉链结构转录因子,氧化应激等外界因素刺激或抗氧化剂等诱导可增加Nrf2转录和核转位,然后与抗氧化反应元件结合[22,23],诱导TrxR表达增高[24]。本研究发现,膈下逐瘀汤显著上调Nfe2l2 mRNA表达,从而提高了纤维化肝脏组织中硫氧还蛋白系统。
丝-苏氨酸激酶Akt通过磷酸化多种酶、激酶和转录因子等调节细胞的功能[25]。多项研究证实Nrf2是Akt的靶蛋白之一,Akt抑制剂可抑制Nrf2活性[26]。激活的Akt通过调节HSC活化、增加Ⅰ型胶原的表达促进肝纤维化的形成[27]。本研究发现,膈下逐瘀汤显著显著的提高了Akt磷酸化水平。本研究虽然发现膈下逐瘀汤通过活化Akt-Nrf2信号通路增强机体抗氧化能力,但膈下逐瘀汤调控Akt-Nrf2信号通路的专属性需要将来采用基因敲除动物模型进一步明确,这是本研究的不足之处。
综上所述,膈下逐瘀汤可能活化Akt-Nrf2信号通路增加硫氧还蛋白系统,抑制纤维化肝脏组织氧化应激。
1Huang Y,Deng X,Liang J.Modulation of hepatic stellate cells and reversibility of hepatic fibrosis.Exp Cell Res,2017,352(2):420-426.
2Ma R,Chen J,Liang Y,et al.Sorafenib:A potential therapeutic drug for hepatic fibrosis and its outcomes.Biomed Pharmacother,2017,88 (1):459-468.
3贾彦,杨婧,刘宏,等.膈下逐瘀汤逆转猪血清诱导大鼠肝纤维化的作用及机制研究.中国实验方剂学杂志,2013,19(5):220-224.
4杨婧,贾彦,刘宏,等.膈下逐瘀汤对大鼠纤维化肝组织α-SMA和TGF-β1表达的影响.中国中医基础医学杂志,2012,18(2):158-160.
5代巧妹,贾彦,刘宏,等.膈下逐瘀汤抗大鼠免疫性肝纤维化的研究.中国实验方剂学杂志,2011,17(22):187-190.
6Tarry-Adkins J L,Fernandez-Twinn D S,Hargreaves I P,et al. Coenzyme Q10 prevents hepatic fibrosis,inflammation,and oxidative stress in a male rat model of poor maternal nutrition and accelerated postnatal growth.Am J Clin Nutr,2016,103(2):579-588.
7张玲,曾健,李军,等.软肝化纤汤治疗慢性乙型肝炎肝纤维化患者50例临床观察.中华中医药杂志,2016,31(12):5382-5385.
8汪涛,涂燕云,杨文凤,等.几种常用中成药治疗肝纤维化研究近况.实用中医药杂志,2016,32(11):1143-1145.
9武瑞美.养肝化瘀汤治疗乙型肝炎代偿期肝硬化气虚血瘀证的临床疗效分析.中外医疗,2016,25(25):179-181.
10张帅,古维立,黄迪,等.四氯化碳、硫代乙酰胺和猪血清诱导大鼠肝纤维化模型的比较.中国普通外科杂志,2012,21(1):71-76.
11赵庆华,史海立,刘静生,等.强肝软坚丸对肝纤维化大鼠肝组织中MMP、TIMP表达的影响.中医学报,2017,32(2):260-264.
12 Ge S,Wang X,Xie J,et al.Deep sequencing analysis of microRNA expression in porcine serum-induced hepatic fibrosis rats.Ann Hepatol, 2014,13(4):439-449.
13郝瑞春,门九章,李孝波,等.雄芍汤通过抗氧化机制抗肝纤维化研究.中药药理与临床,2013,29(2):166-168.
14张华,刘平.基于黄芪汤益气效应解析代偿期乙肝肝硬化的“虚损”病机理论.世界科学技术-中医药现代化,2016,18(11):1833-1838.
15 Mohammadalipour A,Karimi J,Khodadadi I,et al.Dasatinib prevent hepatic fibrosis induced by carbon tetrachloride via anti-inflammatoryand antioxidant mechanism.Immunopharmacol Immunotoxicol,2017,39 (1):19-27.
16 Takeda H,Takai A,Inuzuka T,et al.Genetic basis of hepatitis virusassociatedhepatocellularcarcinoma:linkagebetweeninfection, inflammation,and tumorigenesis.J Gastroenterol,2017,52(1):26-38.
17 Vecchione G,Grasselli E,Voci A,et al.Silybin counteracts lipid excess and oxidative stress in cultured steatotic hepatic cells.World J Gastroenterol,2016,22(26):6016-6026.
18闫广利,周小航,孙晖,等.基于代谢组学的茵陈蒿汤及组分配伍对大鼠酒精性肝损伤的保护作用研究.世界科学技术-中医药现代化, 2016,18(10):1749-1756.
19何金波,张晓云,陈绍宏.陈绍宏教授运用膈下逐瘀汤的临床经验.中国中医药现代远程教育,2016,14(7):78-79.
20 Han K H,Hashimoto N,Fukushima M.Relationships among alcoholic liverdisease,antioxidants,andantioxidantenzymes.WorldJ Gastroenterol,2016,22(1):37-49.
21 Benhar M.Nitric oxide and the thioredoxin system:a complex interplay in redox regulation.Biochim Biophys Acta,2015,1850(12):2476-2484.
22Stefanson A L,Bakovic M.Dietary regulation of Keap1/Nrf2/ARE pathway:focus on plant-derived compounds and trace minerals. Nutrients,2014,6(9):3777-3801.
23李晓明,张丽华,綦艳秋,等.镇肝熄风汤对帕金森病肝阳上亢证大鼠旋转行为的影响.世界科学技术—中医药现代化,2016,18(12): 2137-2142.
24 Hu B,Wu Y,Liu J,et al.GSK-3beta Inhibitor Induces Expression of Nrf2/TrxR2 Signaling Pathway to Protect against Renal Ischemia/ Reperfusion Injury in Diabetic Rats.Kidney Blood Press Res,2016,41 (6):937-946.
25 Wang L,Zhou K,Fu Z,et al.Brain Development and Akt Signaling:the Crossroads of Signaling Pathway and Neurodevelopmental Diseases.J Mol Neurosci,2017,61(3):379-384.
26 Gong YQ,Huang W,Li KR,et al.SC79 protects retinal pigment epithelium cells from UV radiation via activating Akt-Nrf2 signaling.Oncotarget, 2016,7(37):60123-60132.
27 Ezhilarasan D,Evraerts J,Sid B,et al.Silibinin induces hepatic stellate cell cycle arrest via enhancing p53/p27 and inhibiting Akt downstream signaling protein expression.Hepatobiliary Pancreat Dis Int,2017,16 (1):80-87.
Effects of Ge-Xia Zhu-Yu Decoction on Hepatic Thioredoxin System in Rats with Hepatic Fibrosis
Yang Jing1,Jia Yan1,Wang Wei1,Qi Jiping2,Liu Hong1,Dai Qiaomei1
(1.Department of Pathology,College of Basic Medicine,Heilongjiang University of Chinese Medicine,Harbin 150040, China;2.The First Affiliated Hospital of Harbin Medical University,Harbin 150001,China)
This study was aimed to verify the hypothesis that Ge-Xia Zhu-Yu(GXZY)decoction protects liver from porcine serum-induced oxidative stress through the thioredoxin system.SD rats were randomly divided into the blank control group,model group,normal rat+GXZY decoction group,model rat+GXZY group.The rat autoimmune hepatic fibrosis model was induced with porcine serum by intraperitoneal injection(0.5 mL/each rat)twice a week.And GXZY decoction(7.37 g raw material/kg·d)was simultaneously administered daily by gavage.Lipid peroxidation(LPO)levels and thioredoxin reductase(TrxR)activity in liver tissues were determined by the colorimetric method.Polymerase chain reaction(PCR)was used to analyze the transcription factor nuclear factor erythroid 2-related factor 2(Nfe2l2,previously known as Nrf2)mRNA expression.And the western blot was used to analyze the thioredoxin-1(Trx1)protein expression and Akt phosphorylation in the liver.The results showed that compared to the model control group,the GXZY decoction group attenuated porcine serum-induced oxidative stress,as indicated by the LPO level,in liver tissues.Furthermore, GXZY decoction significantly enhanced TrxR activity,Trx1 protein expression,Nfe2l2 mRNA expression,and Akt phosphorylation(all P<0.05).It was concluded that the strong antioxidant properties of GXZY decoction in the porcine serum rat model was due to the enhancement of the hepatic thioredoxin system via activating Akt-Nrf2 signaling pathway.The study results provided experimental evidences for the supporting of this hypothesis.
Hepatic fibrosis,Ge-Xia Zhu-Yu decoction,oxidative stress,thioredoxin ssystem,transcription factor nuclear factor erythroid 2-related factor 2
10.11842/wst.2017.04.025
R285
A
(责任编辑:马雅静,责任译审:王晶)
2017-04-06
修回日期:2017-04-20
*国家自然科学基金委青年科学基金项目(81603418):膈下逐瘀汤干预循环miRNA治疗非酒精性脂肪性肝纤维化的机制研究,负责人:杨婧。
**通讯作者:贾彦,教授,主要研究方向:中医药防治肝纤维化的基础研究。
