29例肝细胞肝癌患者的肿瘤组织代谢组学研究*
2017-08-07李君孙淑军王洋刘才峰仲兴阳徐峰蔡志刚张永煜
李君,孙淑军,王洋,刘才峰,仲兴阳,徐峰,蔡志刚,张永煜,4**
(1.第二军医大学东方肝胆外科医院上海200438;2.上海交通大学药学院上海200240;3.上海中医药大学中医方证与系统生物学研究中心上海201203;4.滇西应用技术大学傣医药学院西双版纳600100;5.上海通微分析技术有限公司上海201203;6.上海中医药大学附属曙光医院上海201203)
29例肝细胞肝癌患者的肿瘤组织代谢组学研究*
李君1,孙淑军2,5,王洋3,刘才峰1,仲兴阳1,徐峰1,蔡志刚6,张永煜3,4**
(1.第二军医大学东方肝胆外科医院上海200438;2.上海交通大学药学院上海200240;3.上海中医药大学中医方证与系统生物学研究中心上海201203;4.滇西应用技术大学傣医药学院西双版纳600100;5.上海通微分析技术有限公司上海201203;6.上海中医药大学附属曙光医院上海201203)
目的:运用组织代谢组学方法,探讨肝细胞肝癌的发病机制与治疗策略。方法:采用GC-MS分析肝细胞肝癌(Hepatocellular Carcinoma,HCC)患者癌组织和癌旁组织中的内源性小分子代谢产物,进行单维和多维统计分析,寻找差异代谢物。通过KEGG和HMDB数据库检索和分析,获得相关代谢通路。结果:经PCA、PLS-DA分析得知癌组织和癌旁组织的代谢轮廓具有显著性差异,经OPLS-Loading plot分析寻找到25个差异性代谢产物,与之相关代谢通路有36条,多属于糖代谢、氨基酸代谢和线粒体转移代谢。25个差异物中ROC曲线下面积大于0.8的差异物有16个,经分析该16个差异物与三磷酸腺苷结合盒(ATP-binding Cassette,ABC)转运体代谢、半乳糖代谢、氨基糖和核苷酸代谢有关。结论:肝癌组织细胞中存在沃伯格效应(Warburg effect),即糖酵解异常增强,三羧酸循环减弱。线粒体转运功能异常、钴含量的升高,均可能与Warburg effect相关。能量代谢异常是肝癌的发病机制之一,阻断相关代谢通路有望成为靶向治疗的新途径。
肝细胞肝癌肿瘤组织代谢组学沃伯格效应
肝细胞肝癌(HCC)是一种常见的腹内恶性肿瘤,在原发性肝癌中占比高达91.5%,在世界范围内其发病率、死亡率分别居恶性肿瘤排名的第5位、第3位,其5年生存率不到7%[1]。近几年,中国肝癌发病人数约占全球肝癌患者的55%,其死亡率排在肿瘤疾病第2位,对中国人民生命健康造成严重威胁。目前,全世界约有3.5-4亿的乙肝携带者,据估计50%的男性和14%的女性携带者最终会死于乙肝导致的肝硬化或肝癌[2]。然而,肝癌的发病机制仍然不十分明确[3,4]。研究者们曾在抗体[5,6]、细胞因子[7]和生化指标[8]等方面寻找与癌变相关的指标,但目前真正有价值并运用于临床的极少。同时,中药干预或介入的治疗研究也越来越多,如复方苦参注射液[9]、华蟾素注射液[10]等分别联合化疗治疗原发性肝癌,发现疗效更优。为了寻找更好的治疗方式,HCC疾病的发病机制还有待进一步研究。
近年来,用组学技术来研究发病及病程机制的报道逐渐增多,包括基因组学、MicroRNA组学[11]、蛋白组学[12]、代谢组学[13]等。其中,代谢组学能够跟踪检测代谢物之间的相互转化与含量水平变化,这些信息与病理生理过程中的生物化学以及生理功能改变联系起来可以作为潜在靶标和作用位点,进而确定相关的生物标志物[1]。与基因组学和蛋白组学等其他组学技术相比较,代谢组学可以展现其优势:①代谢组反应基因和蛋白层面综合作用下的最终结果,而基因和蛋白的微弱变化在代谢组中具有“延增效应”[14];②机体中小分子化合物的组成相对简单,更容易阐释其生物学功能;③代谢组的数据分析可通过KEGG或HMDB等数据库进行辅助。目前已有不少研究者利用代谢组学方法对HCC的发病机制或早期诊断指标进行研究:Yin等[15]利用代谢组学技术寻找了血清中的HCC生物标志物;Patterson等[16]利用UPLC-ESI-QTOF/MS、UPLC-ESITOM/MS和GC-MS三种分析技术进行血浆脂类代谢物定量分析,寻找了HCC患者血浆中的潜在生物标记物;Shariff等[17]尝试用尿液代谢标志物诊断HCC。上述多数研究均使用血液和尿液等的样本,采用组织作为样本的研究较少,例如王红阳等[18]利用HCC患者的癌组织及其癌旁组织样本,采用UPLC-MS联用技术研究了HCC患者癌变组织的特异性代谢产物。然而值得注意的是,目前国内采用GC-MS技术进行HCC组织代谢组学的研究却鲜有报道。
本研究旨在采用组织代谢学技术研究肝细胞肝癌的发病机制,并探讨其治疗策略。具体将采用GC-MS联用技术,对29例HCC患者肝癌组织进行代谢组学研究,找寻差异性代谢物及相关代谢通路,并初步探讨HCC的发病机制与潜在的治疗策略。
1 材料与方法
1.1 主要仪器与试剂
Agilent 6890/5975B气相色谱-质谱联用仪(美国Agilent科技有限公司);DB-5 MS气相毛细管色谱柱(美国Agilent科技有限公司);Vortex-Genie 2微型漩涡混合器(美国Scientific Industries公司);SBH 130D/3样品浓缩仪(英国Stuart公司);Centrifuge 5415R高速冷冻离心机(德国Eppendorf公司);Milli-Q Gradient超纯水系统(美国Millipore中国有限公司);KQ-250DB型数控超声仪(昆山市超声仪器有限公司);SX-1型箱式电阻炉(上海树立仪器仪表有限公司);烘箱(上海福玛实验设备有限公司);U9260-020低温冷冻冰箱(英国)。
N-O-双(三甲硅基)三氟乙酰胺(BSTFA,含1% TMCS,美国Sigma-Aldrich公司,批号:LC00975);甲氧胺(美国Sigma-Aldrich公司,批号:2097987);L-2-氯苯丙氨酸(美国Sigma-Aldrich公司,批号:060507);十七酸(美国Sigma-Aldrich公司,批号:H3500);甲醇(国药集团化学试剂有限公司,批号:80080418);氯仿(国药集团化学试剂有限公司,批号:10006818)。
1.2 实验对象与准入条件
本研究所使用样本为病理诊断为肝细胞肝癌患者的癌组织和癌旁组织,共计29例,由第二军医大学东方肝胆外科医院所采集。同时收集了入组患者的临床信息,包括性别、年龄、术前血清丙氨酸转氨酶(Ala⁃nine Aminotransferase,ALT)、血清天冬氨酸转氨酶(As⁃partate Aminotransferase,AST)、血清甲胎蛋白(Alphafetoprotein,AFP)含量及肿瘤体积等信息。所有入组患者均自愿参加本试验,并签署知情同意书。另外,本研究的剔除标准包括:①除伴有乙型肝炎以外其他类型肝炎的肝细胞肝癌患者;②重症患者;③并发糖尿病等代谢性疾病患者。
1.3 标本采集与处理
1.3.1 标本采集
标本离体后,先观察肿瘤的部位、范围,注意与周边正常组织相鉴别,时间约5-10 min。将癌肿、癌旁组织切成3-5块、直径约0.3-0.5 cm的组织块,去除表面淤血,装入已编号的冻存管中,并迅速投入液氮罐内低温保存、备用。记录下患者基本信息、组织采集时间及肿瘤大小。
1.3.2 组织样本前处理
用生理盐水洗净、擦干后,于精密天平称重50 mg肿瘤组织;加入3倍量生理盐水,匀浆后加500 μL甲醇,涡旋1 min,放入-20℃冰箱放置10 min,沉淀蛋白。经12 000 r⋅min-1,4℃离心10 min;吸取上清200 μL于进样瓶中,室温下氮气流吹干;加入15 mg·mL-1甲氧胺(吡啶溶剂)80µL,封盖密封后,振荡30 s;在30℃下摇床(250 rpm)中反应90 min进行甲氧胺对羰基的封闭反应;加入80µL的BSFTA(含1%TMCS),振荡30 s,在70℃的烘箱里反应60 min;振荡10 s,室温下放置1 h后待GC/MS进样分析[19]。
1.4 GC-MS分析
取三甲基硅烷衍生血清萃取物样品1µL进行GC-MS分析。色谱和质谱的分析参数设置如下:
1.4.1 液相色谱条件
进样口温度:270℃;进样量:1.0µL;不分流进样,载气:高纯氦(99.999%);流速:1.0 mL⋅min-1;接口温度:260℃;色谱柱:DB-5MS毛细管柱,色谱柱程序升温进行检测[20]。
1.4.2 质谱条件
离子源温度:230℃;四级杆温度:150℃,溶剂延迟:5 min;电子碰撞电离电压:70 eV,质谱全扫描范围(m/z):30-600,采用全扫描方式。
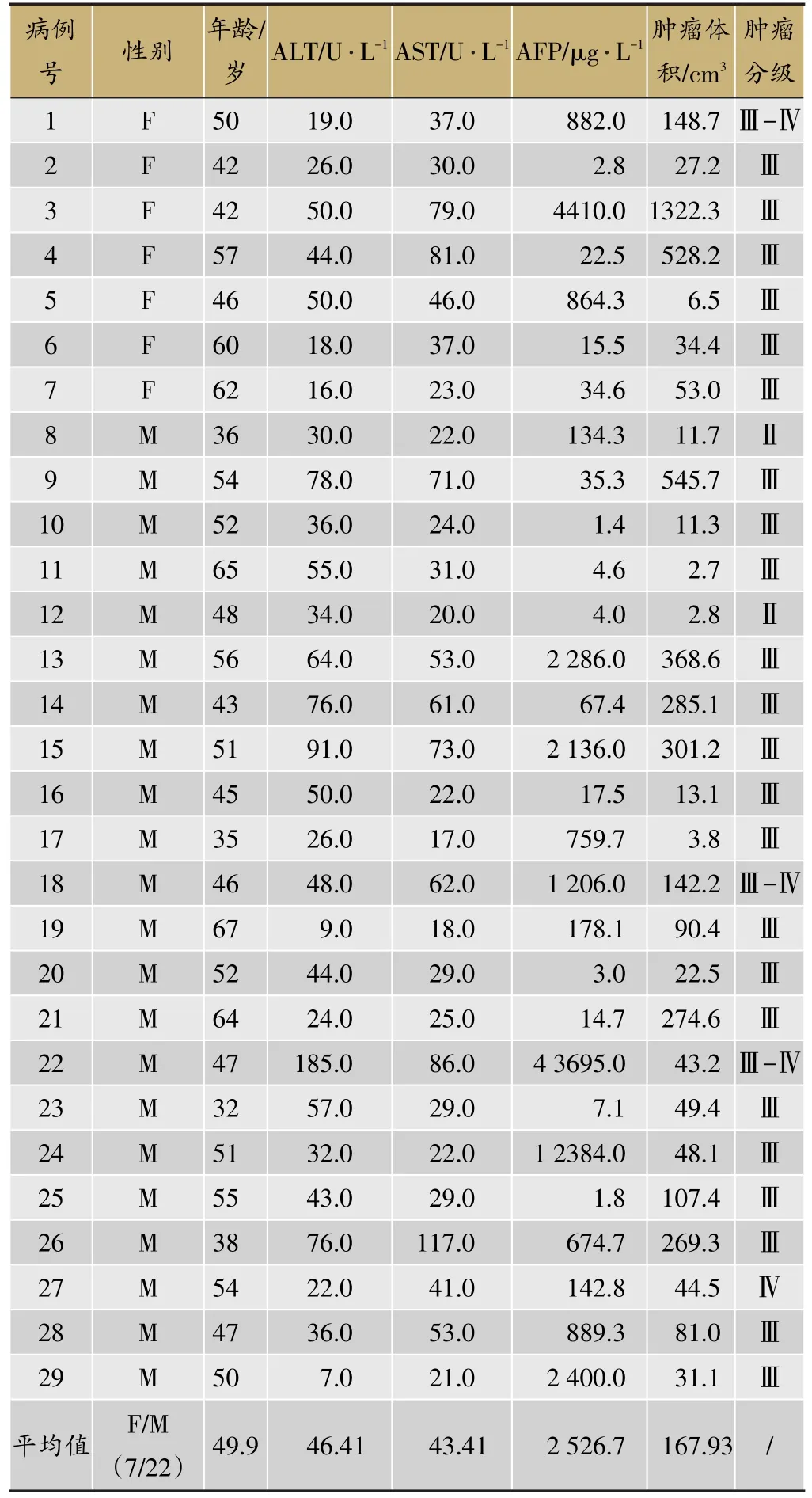
表1 29例患者基本临床信息
1.5 数据处理与模式识别
1.5.1 数据前处理
原始数据经Agilent MSD工作站自带软件转化为NetCDF格式后,导入R软件采用XCMS工具箱处理(http://meltin.scripps.edu/download/)。经基线校正、峰辨识、峰对齐等计算过程,最终得到一个由指定的峰指数(保留时间-质荷比)、样品名称、峰面积组成的三维矩阵表。
1.5.2 模式识别
本研究所采用的线性模式识别技术一般包括非监督分析方法和有监督分析方法两种。三维矩阵经过中心化、标准化后导入SIMCA-P11.5软件(Umetrics,Umea, Sweden)后,采用主成分分析(Principal Component Anal⁃ysis,PCA)和偏最小二乘法判别分析法(Partial Least Square-Discriminant Analysis,PLS-DA)进行数据处理,用来考察血液样本总体代谢谱图分布状况,以观察样品的聚集、离散及离群点。采用正交偏最小二乘法判别分析法(Orthogonal Partial Least Square-Discriminant Analysis,OPLS-DA)来寻找对代谢轮廓贡献较大的差异变量,即与疾病最相关的差异变量,权重系数VIP值越大,表明对模型的贡献越大,采用VIP大于1.0为阈值选择多维统计上的差异变量[21]。
为了验证多维统计结果,采用Mann-Whitney U检验对所得差异代谢物进行分析,选择P<0.05的差异物。同时满足VIP大于1.0和单维统计P<0.05的代谢物被认为是最终差异代谢物。
1.5.3 差异表达代谢物的鉴别
数据经多维统计后,给出的差异变量,通过检索代谢物谱库(NIST库)找到相对应的化合物,并用标准品进行鉴定,从而得到可以区分两组动物的差异表达的代谢物。
1.5.4 代谢通路分析
通过KEGG(http://www.genome.jp/kegg/)和HMDB(http://www.hmdb.ca/)数据库检索代谢物代谢通路,并通过Metabolites Biological Role(http://csbg.cnb.csic.es/ mbrole/index.jsp)进行分析,确定相关代谢通路。
2 实验结果
2.1 病例基本临床信息
入组HCC患者29例,其中7例女性,22例男性患者。平均年龄为49.9岁。入组患者的ALT、AST、AFP、肿瘤大小和肿瘤分级信息见表1。
2.2 肝癌患者癌组织与癌旁组织之间代谢模式的比较
采用PCA和PLS-DA法对其癌组织和癌旁组织的代谢轮廓进行比较分析。从图1可知,HCC患者的癌组织和癌旁组织整体轮廓分别集中在右上区域和左下区域,说明癌组织和癌旁组织的代谢图谱存在差异,即HCC患者的癌组织存在特异性的代谢物质基础。
2.3 肝癌患者癌组织与癌旁组织之间差异代谢产物
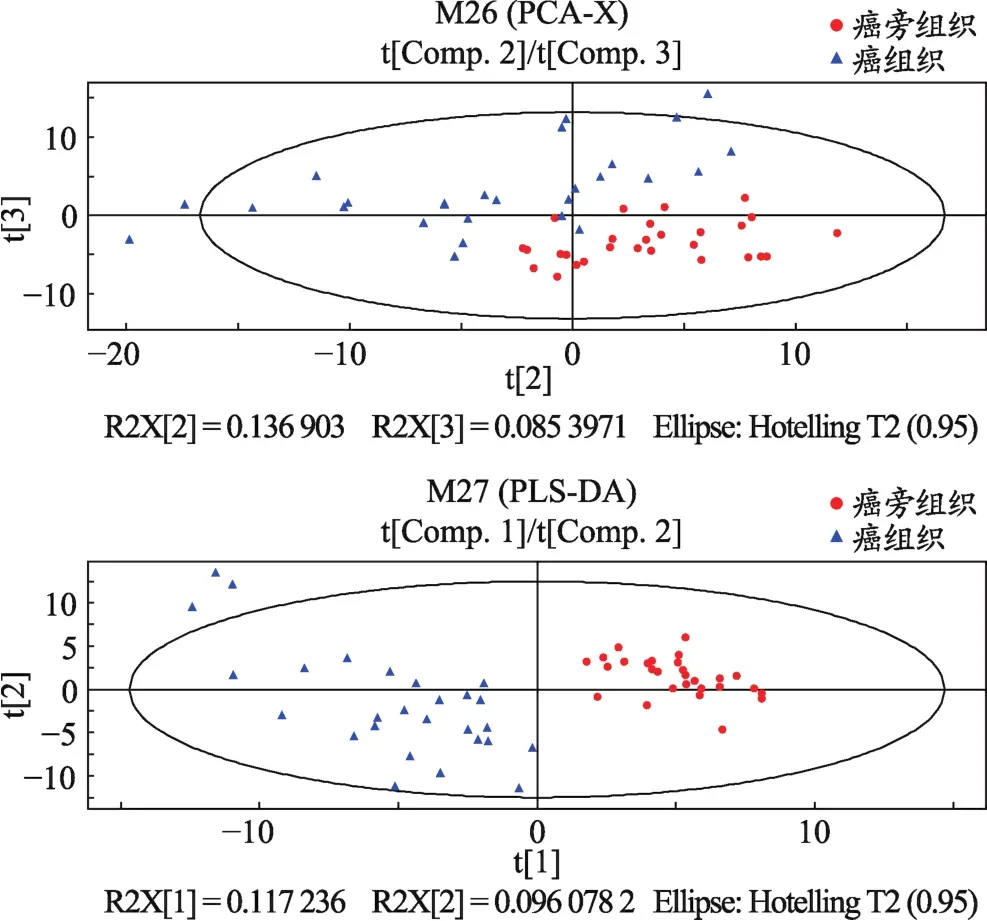
图1 HCC患者的癌组织和癌旁组织比较的PCA图和PLS-DA图
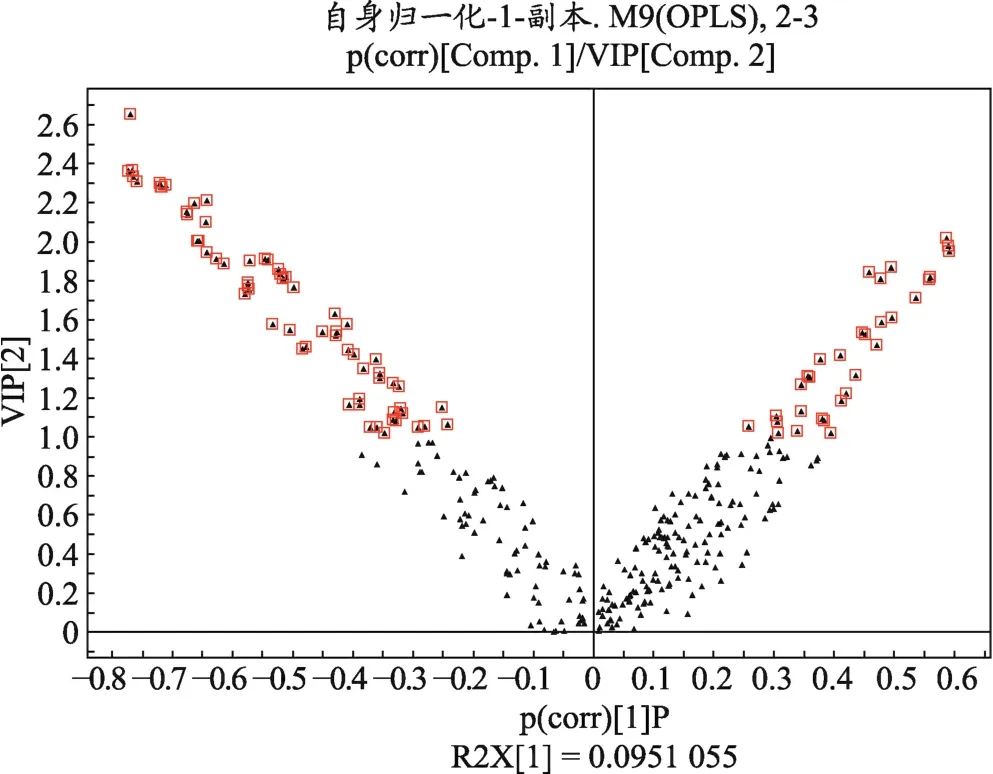
图2 HCC患者癌组织与癌旁组织比较的载荷图
为了获得HCC癌组织的代谢物质基础,我们将癌组织与癌旁组织比较,进行OPLS分析,其载荷图(V-plot图)。如图2所示,通过多维统计和单维统计,选择VIP>1.0并且单位统计P<0.05的差异变量,最终筛选找出25个差异峰,经鉴定代谢差异物结果见表2。
2.4 肝癌患者癌组织与癌旁组织之间差异代谢通路分析
将表2中的差异代谢物,输入KEGG数据库和MBRole数据库进行检索,找到有统计学差异(P<0.05)的相关代谢通路(表3)。HCC患者癌组织与癌旁组织代谢途径比较,共找到了33条相关的代谢通路。
2.5 肝癌患者癌组织与癌旁组织之间差异性代谢物的ROC分析
用以上差异性代谢物的峰值绘制ROC曲线,并求得ROC曲线下面积,筛选出ROC曲线下面积≥0.8的16个差异性代谢物(图3、表4)。
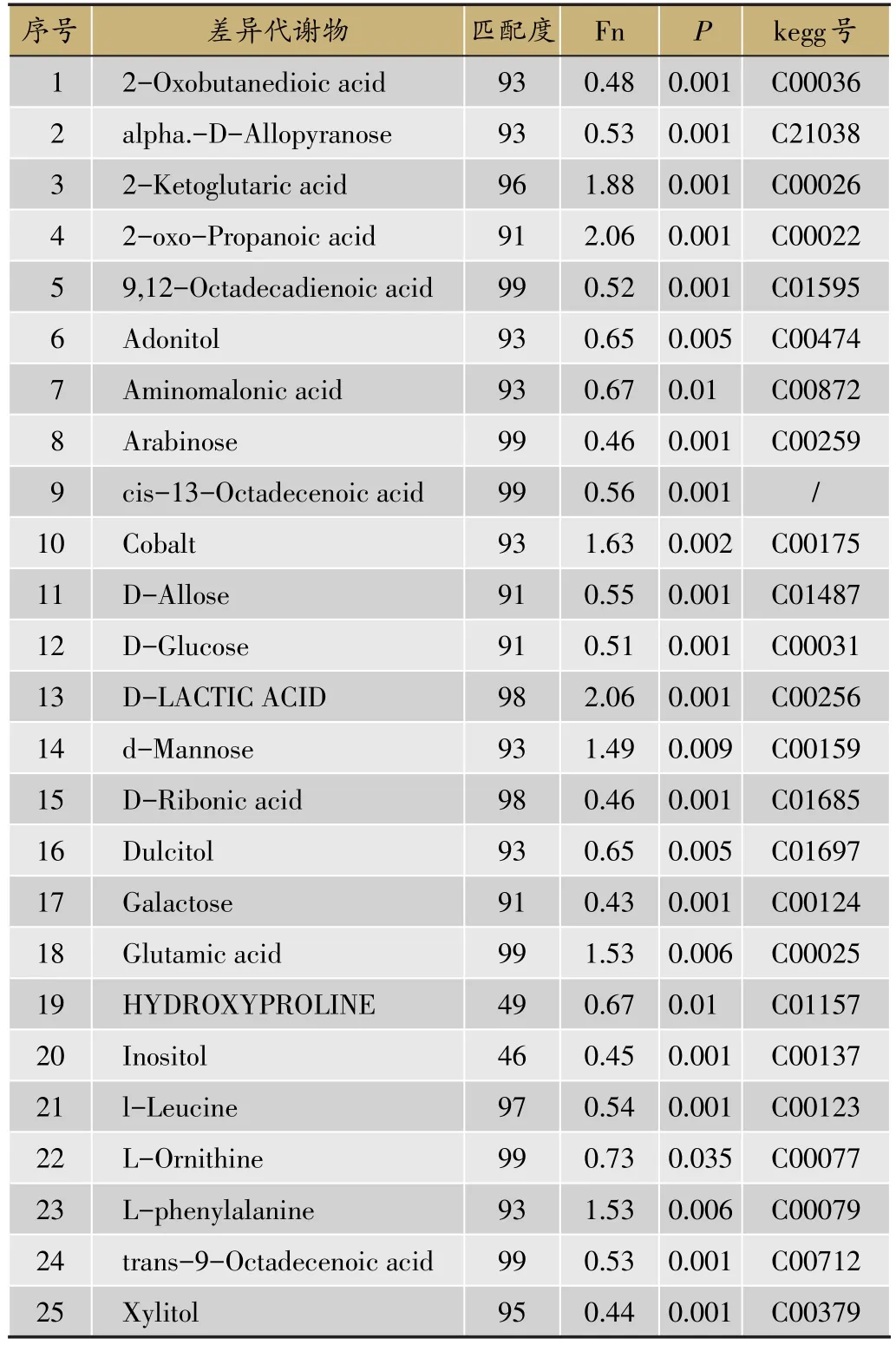
表2 HCC患者癌组织与癌旁组织比较所得代谢差异物列表

图3 16个显著差异性代谢物的ROC曲线图
将16个ROC曲线下面积≥0.8的差异代谢物进行KEGG数据库和MBRole数据库检索,找到有统计学差异(P<0.05)的相关代谢通路。结果显示,ABC trans⁃porters、Galactose metabolism、Amino sugar and nucleotide sugar metabolism这三条代谢通路具显著性差异物。说明HCC患者癌组织和癌旁组织之间存在显著性差异的代谢通路为ABC转运体代谢、半乳糖代谢、氨基糖和核苷酸代谢。

表3 相关代谢通路及信息列表
3 讨论
本文采用GC-MS技术对29例HCC患者的癌组织和癌旁组织的代谢轮廓进行了分析,PCA、PLS-DA分析结果均表明,癌组织和癌旁组织的代谢轮廓具有显著性差异,经OPLS-Loading plot分析寻找到25个差异性代谢产物。将该25个代谢差异物进行Kegg和HM⁃DB数据库检索,得与之相关的代谢通路有36条,其中大多属于糖代谢、氨基酸代谢和线粒体转移代谢。将以上25个差异物进行ROC分析,发现ROC曲线下面积不小于0.8的差异物有16个,经分析可知:该16个差异物多数与ABC转运体代谢、半乳糖代谢、氨基糖和核苷酸代谢有关。
沃伯格[23]发现健康细胞中的能量来源于线粒体氧化糖类分子,而肿瘤细胞则靠糖酵解作用为自身供能,这种作用机制既不需要氧原子参与也不需要线粒体参与。同时,无论氧原子存在与否,肿瘤组织细胞的糖酵解率是正常组织的200倍[24]。沃伯格认为这种能量方式的变化是癌症的根本原因。而本研究经分析,得知肝癌组织与癌旁组织之间的代谢差异很大程度在于糖代谢和能量代谢。其中糖酵解是一个显著性差异代谢通路,糖酵解即:1个葡萄糖分子转变为2个丙酮酸分子[25-27],同时释放能量的过程。本研究癌组织中葡萄糖的含量是癌旁组织的0.51倍,而前者的丙酮酸则是后者的2.01倍,足以说明癌组织中糖酵解代谢增强,直接验证了沃伯格反应,即肝癌细胞通过糖酵解释放的能量为自身供能。假设沃伯格反应在肝癌细胞中是存在的,则肝癌细胞靠糖酵解反应为自身供能,而线粒体中的三羧酸循环代谢减弱。而本研究中显示三羧酸循环反应确实有显著性差异,涉及到的三个代谢物,C00022丙酮酸含量上升2.06倍,C00026草酰乙酸含量上升1.88倍,C00036戊二酸降低为0.48倍。其中,丙酮酸是三羧酸循环代谢的底物,该代谢物含量升高,说明三羧酸循环反应强度降低,即癌细胞能量不需要三羧酸循环释放提供,间接证实了沃伯格反应。基于肿瘤能量代谢的特性,如何阻断肿瘤的能量代谢成为目前研究的热点。丙酮酸激酶(Pyruvate Kinase,PK)是细胞糖酵解中的限速酶,将底物磷酸烯醇丙酮酸(Phosphoenolpyruvate,PEP)催化生成丙酮酸。有研究[28]认为丙酮酸激酶M2型(Pyruvate Kinase M2,PKM2)是肿瘤组织有氧酵解的关键酶,其在肿瘤细胞的增殖、转移等方面具有重要作用。而诸如3-溴丙酮酸[29]、维生素K3、K5[30]及紫草醌类衍生物[31]等一些PKM2阻断剂能够有效抑制肝癌、卵巢癌及绒毛膜癌等多种肿瘤细胞的生长。综上所述,如果能在患者肝癌组织中检测到丙酮酸的代谢异常,抑制或阻断PKM2活性或许有望成为一条潜在的靶向治疗新途径。
本研究发现肝癌细胞多条膜转运及线粒体相关代谢通路异常,如ABC转运体(ABC transporters)、苹果酸-天冬氨酸穿梭(Malate-Aspartate Shuttle)、乙酰基转移到线粒体(Transfer of Acetyl Groups into Mitochon⁃dria)。癌细胞供能途径发生改变,势必线粒体相关代谢会出现异常,丁忠阳等通过17例HCC患者肝癌组织及癌旁组织的分子生物学研究发现线粒体D-Loop区是一个具有高度多态性和突变性的区域,在肝癌中突变率较高[32,33]。Mirabella等[34]发现线粒体中某些mtD⁃NA的缺失或突变与肿瘤细胞凋亡过程有关[35],可影响肿瘤的发生和发展。本研究中发现三条异常代谢通路ABC transporters、Malate-Aspartate Shuttle、Transfer of Acetyl Groups into Mitochondria均属膜转运相关,膜转运的异常必然会直接影响能量传递,这极有可能是肝癌发病机制中的一个重要环节。原发性肝癌的综合治疗已成为目前的趋势,许多接受肝癌切除的患者常常需接受化疗,而多药耐药(Multidrug Resistance,MDR)是化疗失败不可回避的重要原因[36]。如何选择有效低毒的化疗药物常常是临床医师需要面临的棘手问题。前文所提及的ABC转运体,是膜转运蛋白家族中的一类特殊蛋白。目前研究认为ABC转运体能够介导肿瘤的多药耐药,而由ABC蛋白家族编码的MRP跨膜转运蛋白与肝癌的耐药机制关系更为密切[37,38]。然而,本实验结果发现,肝癌患者中ABC转运体代谢的异常,将对此部分患者术后化疗方案的选择及疗效评估起到一定提示作用。
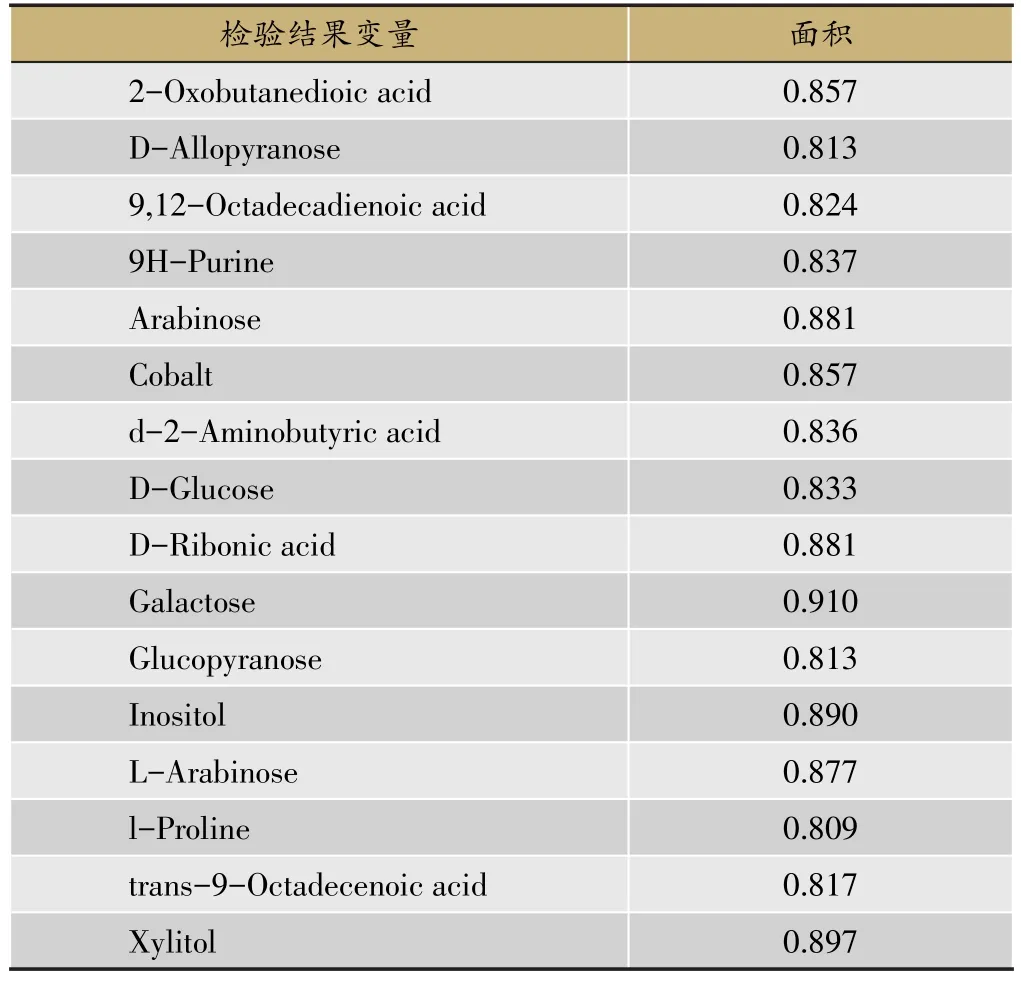
表4 ROC曲线下面积
氧化应激一旦发生,自由基便开始激活,形成肝癌缺氧微环境的同时,将诱发一种重要的缺氧调节因子(Hypoxia Inducible Factor-1,HIF1)的产生。目前认为HIF1对肝癌细胞的增殖、侵袭及转移起着重要的促进作用[39]。钴元素可通过抑制细胞内的呼吸酶而造成胞内缺氧,间接刺激红细胞生成素产生,进而促进骨髓造血[40]。氯化钻作为目前常用的化学性低氧模型剂,其所含的Co2+可以与Fe2+竞争性结合血红蛋白,含氧血红蛋白生成减少,而脱氧血红蛋白反而增加,使得细胞其处于一种“条件性”的缺氧状态中[41]。基于钴离子这种生物学特性,目前已有学者设计合成出一些含钴的配合物,在抗氧化、抗肿瘤方面的研究中取得了一些进展。Nadia[42]等通过希夫碱合成钴、铜、镍等络合物,发现它们具有一定抗氧化作用,其中钴络合物最高。而就抑制HepG2细胞而言,仅仅表现为轻度作用。Aha⁃med[43]等的研究发现氧化钴铁纳米粒子能够通过诱导氧自由基的生成,介导P53、BAX的表达升高、Bcl-2的表达降低以及caspase-3、caspase-9的活力增强,而促使HepG2细胞凋亡。本研究发现的差异性代谢通路中戊糖磷酸途径(Pentose phosphate pathway)和VB6代谢(Vitamin B6 metabolism)均与钴代谢密切相关。而且,数据显示肝癌组织中的钴(Cobalt;C00175)含量为癌旁组织的1.63倍,说明钴含量在肝癌组织细胞中含量明显上升。对于原发性肝癌的诊断,目前临床中使用比较普遍的是甲胎蛋白(Alpha-Fetoprotein,AFP)。但正如本文纳入的研究对象中,仍有部分患者甲胎蛋白显示阴性。因此,钴代谢异常的发现可以对原发性肝癌的诊断做有益补充。同时,能否将含钴元素组成的金属配合物运用到钴代谢异常的肝癌患者治疗上,筛选、研发更具特异性的化疗药物,以达到个体化治疗的愿景,这将是颇具挑战性的研究方向。
近年来,尿液和血液等无创、微创体液样品,因取材方便、受试对象损伤小、预处理简单及样本量大,常作为代谢组学研究的主要样本。针对疾病广谱代谢物的大规模筛查,运用此类样品具有独特优势[44]。目前,组织代谢组学研究一般选用同一个患者或同一个受试动物的病变组织和正常组织进行比较分析,可排除了由于年龄、性别、患病异同等因素导致的组间系统误差,且更能反应病理状态,故组织代谢组学更适合用于做疾病的发病机制和个性化诊疗研究。本研究发现了一些肝癌代谢差异物并探讨了差异物的代谢途径类型,而肝癌发生、发展及预后相关的全程机制,还有待进一步研究。后续我们将补充血液、尿液及粪便的标本,结合基因组学、蛋白组学的方法进行更深入地筛查及研究,力求为寻找原发性肝癌诊治的新靶标做有益的探索。
1刘悦,赵亮,李燕,等.肝细胞性肝癌代谢组学研究进展.药学实践杂志,2013,31(2):81-85.
2Lai C L,Yuen M F.Chronic Hepatitis B-New Goals,New Treatment.N Engl J Med,2008,359(23):2488-2491.
3Song Y,Jang J,Shin T H,et al.Sulfasalazine attenuates evading antican⁃cer response of CD133-positive hepatocellular carcinoma cells.J Exp Clin Cancer Res,2017,36(1):38-53.
4Xiao J F,Varghese R S,Zhou B,et al.LC-MS Based Serum Metabolo⁃mics for Identification of Hepatocellular Carcinoma Biomarkers in Egyp⁃tian Cohor.J Proteome Res,2012,11(12):5914-5923.
5Abou-Alfa G K,Yen C J,Hsu C H,et al.Phase Ib study of codrituzum⁃ab in combination with sorafenib in patients with non-curable advanced hepatocellular carcinoma(HCC).Cancer Chemother Pharmacol,2017, 79(2):421-429.
6Shiu K Y,Mclaughlin L,Rebollo-Mesa I,et al.Graft dysfunction in chronic antibody-mediated rejection correlates with B-cell-dependent indirect antidonoralloresponses and autocrine regulation of interferon-γ production by Th1 cells.Kidney Int,2017,91(2):477-492.
7刘立国,杨志英.肿瘤微环境中巨噬细胞及相关细胞因子对肝癌切除术后患者预后的影响.癌症进展,2016,14(1):29-31.
8阴斌霞,王香玲,赵丽,等.多项生化指标联合检测在肝脏疾病中的临床应用研究.诊断学理论与实践,2007,6(6):540-544.
9韩伍龙,袁春樱,张婷素.复方苦参注射液联合介入化疗治疗原发性肝癌的疗效观察及其对免疫功能的影响.中国中医药科技,2012,19 (1):61-62.
10林清,黄念,赵志恒,等.华蟾素注射液联合肝动脉栓塞化疗治疗原发性肝癌的Meta分析.湖北中医药大学学报,2016,18(1):62-67.
11 Zhou J,Yu L,Gao X,et al.Plasma microRNA panel to diagnose hepati⁃tis B virus-related hepatocellular carcinoma.J Clin Oncol,2011,29 (36):4781-4788.
12 Sarvari J,Mojtahedi Z,Kuramitsu Y,et al.Comparative Proteomics of Sera From HCC Patients With Different Origins.Hepat Mon,2014,14 (1):e13103.
13 Kimhofer T,Fye H,Taylorrobinson S,et al.Proteomic and metabonomic biomarkers for hepatocellular carcinoma:a comprehensive review.Br J Cancer,2015,112(7):1141-1156.
14 Schmidt C.Metabolomics Takes Its Place as Latest Up-and-Coming“Omic”Science.J Natl Cancer Ins,2004,96(10):732-734.
15 Yin P,Wan D,Zhao C,et al.A metabonomic study of hepatitis B-in⁃duced liver cirrhosis and hepatocellular carcinoma by using RP-LC and HILIC coupled with mass spectrometry.Mol Biosyst,2009,5(8):868-876.
16 Patterson A D,Maurhofer O,Beyoglu D,et al.Aberrant lipid metabo⁃lism in hepatocellular carcinoma revealed by plasma metabolomics andlipid profiling.Cancer Res,2011,71(21):6590-6600.
17 Shariff M I F,Ladep N G,Cox I J,et al.Characterization of urinary bio⁃markers of hepatocellular carcinoma using magnetic resonance spectros⁃copy in a Nigerian population.J Proteome Res,2010,9(2):1096-1103.
18 Huang Q,Tan Y,Yin P,et al.Metabolic characterization of hepatocellu⁃lar carcinoma using nontargeted tissue metabolomics.Cancer Res,2013, 73(16):4992-5002.
19刘一博,张玮,张永煜,等.慢性乙型肝炎肝气郁结证患者血液代谢指纹图谱研究初探.中西医结合肝病杂志,2013,23(1):7-10.
20戴建业,郑宁宁,孙淑军,等.基于血清代谢组学的柴胡醋炙生物学效应研究.中华中医药学刊,2014,32(7):1717-1720.
21曹慧娟,李君,孙淑军,等.黄芩素对人肺腺癌A549细胞的药效作用及机制探讨.中国实验方剂学杂志,2017(2):98-103.
22 Naito S,von Eschenbach A C,Giavazzi R,et al.Growth and metastasis of tumor cells isolated from a human renal cell carcinoma implanted in⁃to different organs of nude mice.Cancer Res,1986,46(8):4109-4115.
23 Hsu P P,Sabatini D M.Cancer cell metabolism:Warburg and beyond. Cell,2008,134(5):703-707.
24李澎瀛,张东阳,吴美玲,等.缺氧条件下肝癌细胞和正常肝细胞能量代谢通路的差异.复旦学报(医学版),2016,43(2):127-134.
25 Fang Z,He L,Jia H,et al.The miR-383-LDHA axis regulates cell pro⁃liferation,invasion and glycolysis in hepatocellular cancer.Iran J Basic Med Sci,2017,20(2):187-192.
26彭秋平,梁后杰.糖酵解代谢在恶性肿瘤细胞中的特异性表型及其意义.临床肿瘤学杂志,2009,14(5):470-473.
27萨日娜,武会娟.四种肝(癌)细胞系糖代谢的流量解析.肿瘤防治研究,2016,43(11):942-947.
28次旦旺久,赵相轩,王晓明.丙酮酸激酶M2在肝癌发病及诊疗中的作用.临床肝胆病杂志,2016,32(4):806-810.
29易长虹,袁琳波,钱坤,等.肝动脉灌注3-溴丙酮酸阻断大鼠肝癌能量代谢的实验研究.介入放射学杂志,2013,22(12):1027-1032.
30 Chen J,Jiang Z,Wang B,et al.Vitamin K 3,and K 5,are inhibitors of tumor pyruvate kinase M2.Cancer Lett,2012,316(2):204-210.
31王慧智,李会影,徐清雨,等.紫草素抑制STAT3信号通路对人绒毛膜癌JEG-3细胞迁移和侵袭能力的影响.中国现代中药,2016,18 (4):420-424.
32丁忠阳,张峰,蔡兵,等.肝癌细胞线粒体DNA D—Loop高变区基因突变的研究及意义.实用临床医药杂志,2007,11(5):68-70.
33 Wheelhouse N M,Lai P B S,Wigmore S J,et al.Mitochondrial D-loop mutations and deletion profiles of cancerous and noncancerous liver tis⁃sue in hepatitis B virus-infected liver.Br J Cancer,2005,92(7):1268-1272.
34 Mirabella M,Giovanni S D,Silvestri G,et al.Apoptosis in mitochondrial encephalomyopathies with mitochondrial DNA mutations:a potential pathogenic mechanism.Brain,2000,123(Pt 1):93-104.
35陈晓红,程海清,邓易,等.镰形棘豆对SMMC-7721细胞线粒体膜电位和凋亡相关蛋白表达的影响.南京中医药大学学报,2017,33(1): 54-58.
36 Maya B Z,Assaraf Y G,Livney Y D.β-casein nanovehicles for oral de⁃livery of chemotherapeutic Drug combinations overcoming P-glycopro⁃tein-mediated multidrug resistance in human gastric cancer cells.Onco⁃target,2016,7(17):23322-23334.
37 Liu Y,Lou G,Wu W,et al.Involvement of the NF-κB pathway in multi⁃drug resistance induced by HBx in a hepatoma cell line.J Viral Hepat, 2011,18(10):e439-e446.
38 Sahani D V,Jiang T,Hayano K,et al.Magnetic resonance imaging bio⁃markers in hepatocellular carcinoma:association with response and cir⁃culating biomarkers after sunitinibtherapy.J Hematol Oncol,2013,6: 51-62.
39 Luo D J,Wu J H.Roles of HIF-1 in hepatocellular carcinoma.World Chinese Journal of Digestology,2014,22(1):1-8.
40盛庆丰,咸华,印其友.二氯化钴诱导大鼠肝癌细胞缺氧与凋亡和增殖的研究.南通大学学报:医学版,2008,28(5):324-325.
41陈国凤,张培建,刘歆农,等.氯化钴诱导低氧环境对人肝癌HepG2细胞株的生长代谢影响.国际外科学杂志,2016,43(1):17-23.
42 Nadia El-wakiel,Mai El-keiy,Mohamed Gaber.Synthesis,spectral,an⁃titumor,antioxidant and antimicrobial studies on Cu(II),Ni(II)and Co (II)complexes of 4-[(1H-Benzoimidazol-2-ylimino)-methyl]-benzene-1,3-diol.Spectrochimica Acta A,2015,147(8):117-123.
43 Ahamed M,Akhtar M J,Khan M A,et al.Cobalt iron oxide nanoparti⁃cles induce cytotoxicity and regulate the apoptotic genes through ROS in human liver cells(HepG2).Colloids Surf B Biointerfaces,2016,148: 665-673.
44张永煜,张玮,杨永清.系统生物学在中医药研究中的应用.北京:科学出版社,2014:42-44.
Research on Tissue Metabolomics of 29 Patients with Hepatocellular Carcinoma
Li Jun1,Sun Shujun2,5,Wang Yang3,Liu Caifeng1,Zhong Xingyang1, Xu Feng1,Cai Zhigang6,Zhang Yongyu3,4
(1.Eastern Hepatobiliary Surgery Hospital,Second Military Medical University,Shanghai 200438,China; 2.School of Pharmacy,Shanghai Jiao Tong University,Shanghai 200240,China; 3.Center for Traditional Chinese Medicine and Systems Biology,Shanghai University of Traditional Chinese Medicine,
Shanghai 201203,China; 4.School of Traditional Dai Medicine,West Yunnan University of Applied Sciences,Xishuangbanna 600100,China; 5.Unimicro(Shanghai)Technologies Co.Ltd.,Shanghai 201203,China; 6.Shuguang Hospital Affiliated to Shanghai University of Traditional Chinese Medicine,Shanghai 201203,China)
The present study aimed to research pathogenesis and therapeutics of hepatocellular carcinoma(HCC)with the method of tissue metabolomics.A combined gas chromatography–mass spectrometry(GC–MS)method was developed suitable for analyzing the endogenous small molecule of liver cancer tissues and adjacent tissues.The unidimensional and multidimensional statistics were used to look for differential metabolites.And then,the KEGG and HMDB database were utilized to find related differential pathways and pathogenesis of HCC.The PCA and PLS-DA showed that there were significant differences on the endogenous small molecule of liver cancer tissues and adjacent tissues.Through the OPLS-Loading plot analysis,there were 25 differential metabolites and 36 relevant pathways.The differential pathways belong to carbohydrate metabolism,amino acid metabolism and mitochondrial transfer.There were 16 metabolites’area under the ROC curve which was bigger than 0.8,which were related with ATP-binding cassette (ABC)transporters,galactose metabolism,amino sugar and nucleotide sugar metabolism.It was concluded that the Warburg effect exists in HCC cells.The energy of HCC cell was from glycolytic function,because the glycolysis was enhanced and the citric acid cycle decreased.Mitochondrial dysfunction and the increased cobalt content may correlate with the Warburg effect,which may be one of the pathogenesis of liver cancer,and expected to become the breakthrough point of a new targeting therapeutic approach.
Hepatocellular carcinoma,tumor tissue,metabonomics,Warburg effect
10.11842/wst.2017.04.006
R735.7
A
(责任编辑:马雅静,责任译审:王晶)
2017-04-17
修回日期:2017-04-20
*国家自然科学基金面上项目(81373519):基于整体代谢网络的异病同证(三焦)湿热证的证候基础及病变机制研究,负责人:张永煜;上海市科委项目(13401900306):黄芩总黄酮苷元有效组分抗肾纤维化的成药性研究,负责人:张永煜。
**通讯作者:张永煜,本刊编委,博士,教授,博士生导师,主要研究方向:证候及药效物质基础与体内代谢。
