陈皮表面优势真菌的分离鉴定及其对药效物质的影响*
2017-08-07刘素娟张鑫王智磊贺仪蒲秋华陈林陈鸿平刘友平
刘素娟,张鑫,王智磊,贺仪,蒲秋华,陈林,陈鸿平,刘友平
(成都中医药大学药学院/中药材质量标准化教育部重点实验室/中药资源系统研究与开发利用省部共建国家重点实验室培育基地成都611137)
陈皮表面优势真菌的分离鉴定及其对药效物质的影响*
刘素娟,张鑫,王智磊,贺仪,蒲秋华,陈林,陈鸿平**,刘友平**
(成都中医药大学药学院/中药材质量标准化教育部重点实验室/中药资源系统研究与开发利用省部共建国家重点实验室培育基地成都611137)
目的:研究陈皮表面分离的优势真菌对主要药效物质的影响;方法:采用平板涂布法从陈皮表面分离纯化得到优势菌株,结合显微与分子鉴定方法进行鉴定,采用HPLC法和UV紫外分光光度法测定陈皮的主要药效成分。结果:从陈皮表面分离到优势菌为黑曲霉和黄曲霉;陈皮反接黑曲霉与黄曲霉后药效成分发生了改变,二者的改变存在差异,且不同黑曲霉菌株影响药效成分的改变也具有差异,其中1株黑曲霉菌株对陈皮药效成分改变最为明显,与对照组相比,总黄酮、橙皮皮苷含量极显著增加(P<0.01),产生了5个明显的新化学成分。结论:真菌代谢转化与陈皮药效物质变化具有相关性,在陈皮陈化过程起重要作用,其生长代谢消耗药效物质,产生成分改变。从微生物转化角度阐释陈皮“陈久者良”的科学内涵。
陈皮优势真菌分离鉴定反接药效物质
陈皮为芸香科植物橘Citrus reticulata Blanco及其栽培变种的干燥成熟果皮。其以橘柚之名始载于《神农本草经》,具有理气健脾,燥湿化痰之功效[1],为临床常用药材。陈皮为中药“六陈”之一,传统中医理论认为陈皮:“陈久者良”[2,3],指出陈皮经过陈化方能药用,而道地药材“新会陈皮”陈化长达数十年。课题组认为陈皮陈化与烟叶自然发酵实为同理,自然发酵是借助自然气候的变化进行发酵,而陈皮自然发酵是仓储环境和陈皮本身所含的药效物质、表面微生物等共同作用的结果。其中微生物在陈皮陈化过程中发挥着关键作用,是陈皮品质形成的必要条件。目前已有研究发现陈皮表面分离得到的优势菌株黑曲霉可造成陈皮中黄酮类成分含量增加[4],因此本研究进一步对不同贮藏年限广陈皮表面真菌进行分离鉴定,并将得到的优势真菌反接于药材,分析药效物质含量变化,以探讨真菌与陈皮品质的相关性,阐释陈皮陈化机理,为加速陈皮陈化提供新方法。
1 仪器与材料
Agilent 1260高效液相色谱仪(美国Agilent科技有限公司),岛津LC-20AT型HPLC色谱仪(日本岛津公司),UV-1100型紫外-可见分光光度计(上海天美科技有限公司),电子分析天平BP211D(d=0.01 mg,德国Sartorius股份有限公司),HWS型恒温恒湿培养箱(北京中兴伟业仪器有限公司)。橙皮苷对照品(纯度99.70%,批号:MUST-15070211)、川陈皮素对照品(纯度99.46%,批号:MUST-14100814)、橘红素对照品(纯度99.77%,批号:MUST-14112410)、辛弗林对照品(纯度99.53%,批号:MUST-14082611)、没食子酸对照品(纯度99.78%,批号:MUST-15011211)均购自成都曼思特生物科技有限公司。无水葡萄糖(纯度≥98%,批号:160425,成都克洛玛生物科技有限公司)。
不同贮藏年限陈皮药材,购自广东新会区新宝堂公司,样品均经成都中医药大学药学院中药鉴定教研室严铸云教授鉴定为茶枝柑C.reticu1ata‘Chachi’。
2 实验方法
2.1 优势真菌的分离与鉴定
2.1.1 菌株分离和形态鉴定
取陈皮样品,制备成浓度为1×10-4的菌液,涂布分离培养菌株,纯化保藏;通过对初分菌落形态特征和显微结构的观察,以《真菌鉴定手册》及《中国真菌志》对真菌鉴定的形态描述为参照,对目标菌株进行鉴定[5]。
2.1.2 分子鉴定
用DNA提取试剂盒提取样品DNA;ITS序列扩增使用DNA条形码通用引物ITS1/ITS4。PCR反应条件及扩增程序参考候[6]等的研究。将PCR产物送至成都擎科梓熙生物技术有限公司进行纯化和测序,将测序得到的序列提交Genbank,通过Blast比对,找到同源性高的菌种并构建进化树。
2.2 陈皮样品反接优势真菌实验
称取100 g陈皮样品平铺于培养皿底部,紫外线灭菌30 min,翻面,继续照射30 min。将灭菌处理后的陈皮样品分为对照组与侵染组。侵染组:每皿精密加入1 mL标准孢子悬浮液,分别编号标记为S1、S2、S3、S4、S5,其中S1、S2、S3、S5为4株不同黑曲霉,S4为黄曲霉,因黄曲霉存在产毒的隐患,是否与陈皮有效性具有相关性,所以只选择一株作为对比;对照组CK:精密加入1 mL无菌水,编号标记。将两组样品置于30℃恒温恒湿培养箱培养,培养5天后取样测量。每个样品平行测定3次。
2.3 优势真菌对药效成分的影响
2.3.1 总黄酮及3种黄酮类成分含量测定
总黄酮含量测定方法参考文献[7]:精密称取样品0.50 g,加入甲醇25 mL,称重,在75℃下水浴回流1 h,冷却,再次称重,用溶剂补重,过滤,即得供试品溶液,采用紫外分光光度法进行测定。
3种黄酮类成分含量测定方法参考文献方法[7]:供试品制备同总黄酮含量测定方法。色谱条件:色谱柱:ZORBAX SB-C18(4.6×200 mm,5 μm);流动相:0.05%磷酸水-乙腈,按以下梯度程序洗脱:时间:0-10 min,乙睛:20%-30%;10-20 min,乙睛:30%-50%;20-30 min,乙睛:50%-60%;30-35 min,乙睛:60%-90%;35-40 min,乙睛:90%-100%;柱温:30℃;流速:0.7mL·min-1;检测波长:283nm及335nm;进样量:5.0μL。
2.3.2 多糖含量测定
测定方法参考文献方法[8]:精密称取样品粉末1.0 g,加入石油醚25 mL于500 mL圆底烧瓶中,45℃水浴回流2 h,过滤,残渣挥干石油醚。加入80%乙醇30 mL,在80℃下水浴回流2 h,过滤,残渣用80%乙醇洗涤2次,每次15 mL,残渣连同滤纸置于烧瓶中,加入250 mL蒸馏水于92℃下回流提取2.5 h,趁热抽滤,滤液置于250 mL容量瓶中,冷却至室温,加水稀释至刻度,摇匀即得。精密量取供试品溶液1.0 mL于10 mL具塞试管中,加水补足2.0 mL,加入5%苯酚溶液1.0 mL、浓硫酸7.0 mL,于80℃水浴下反应15 min,取出置于冷水浴中冷却至室温。以蒸馏水为空白,于488 nm下依次测定吸光度。由回归方程计算出供试品溶液中多糖的含量。
2.3.3 总酚酸含量测定
测定方法参考文献方法[8]:取各样品约1.0 g,精密称定,置250 mL棕色量瓶中,加水150 mL,放置过夜,超声处理10 min,放冷,用水稀释至刻度,摇匀,静置(使固体物沉淀),滤过,弃去初滤液50 mL,精密量取续滤液20 mL,置100 mL棕色量瓶中,用水稀释至刻度,摇匀,即得。精密量取供试品溶液2.0 mL,置25 mL棕色容量瓶中,加入磷钼钨酸试液1 mL,加水10 mL,用29%碳酸钠溶液稀释至刻度,摇匀,放置30 min以相应的试剂为空白,照紫外-可见分光光度法在760 nm的波长处测定吸光度,测定吸光度,由回归方程计算出供试品溶液中总酚酸的量。
2.3.4 生物碱类成分—辛弗林的含量测定
测定方法参考文献方法[9]:精密称取样品0.5 g,加入甲醇25 mL,称定重量,超声提取45 min,冷却,再次称定重量,用溶剂补足减失的重量,过滤,取续滤液过0.22 μm微孔滤膜,即得供试品溶液。色谱条件:色谱柱:Hypersil BDSC18(4.6×200 mm,5 μm);流动相甲醇-水(水中含0.06%磷酸及0.%十二烷基庚烷磺酸钠)=57:43;柱温:30℃;流速:0.7mL·min-1;检测波长:224 nm;进样量:10.0 μL。
2.4 HPLC指纹图谱研究
2.4.1 色谱条件
色谱柱:Hypersil BDS C18(4.6×200 mm,5 μm);流动相为乙腈(A)、0.05%磷酸水溶液(B)按二元梯度洗脱:0-15 min,15%-20%A;15-45min,20%-42%A;45-65 min,42%-60%A;65-70 min,60%-100%A;70-85 min,100%-100%A;检测波长:225 nm、283 nm及335 nm,柱温:30℃,流速:0.7mL·min-1。进样量:10 μL。
2.4.2 供试品溶液的制备
参考“2.3.1”项下供试品溶液的制备方法。
3 统计学分析
4 结果
4.1 优势真菌的分离与鉴定
从陈皮样品表面共获得10株真菌,经过初步的形态学观察主要为子囊菌类曲霉属和青霉属真菌。将PCR产物测序结果提交到GenBank,通过Blast对比,将同源性高的菌株利用MEGA6软件构建进化树。真菌菌株ITS分子鉴定结果结合菌株的形态学鉴定结果,最终得到了2个属4个种的微生物,其中优势菌株为黑曲霉和黄曲霉。
4.2 优势真菌对药效成分的影响
由表1结果表明,与对照组CK相比,S1、S2、S5样品中总黄酮含量均有增加,其中S5组总黄酮增加显著,具有统计学差异(P<0.01)总酚酸含量变化趋势与总黄酮一致;与对照组CK相比,各组样品中多糖含量均有降低,且S3、S4、S5组样品显著减少,具有统计学差异(P<0.01)与对照组CK相比,S1、S5,样品中橙皮苷含量均显著增加;与对照组CK相比,S2与S3组川陈皮素含量显著增加,其差异具有统计学意义(P<0.05),除S5组外,其余组也呈不同程度的增加;橘皮素含量与对照组CK相比,S3、S5组样品含量显著增加,其余组减少或不变;辛弗林含量与对照组CK相比,只有S5样品含量增加。
4.3 HPLC指纹图谱研究
将HPLC指纹图谱分别进行匹配,利用《中药色谱指纹图谱相似度评价系统研究版(2004A)》对指纹图谱数据进行评价。各样品谱图显示,反接黑曲霉的S1、S2、S5样品产生了新的化学成分,对照CK图谱在相应位置上无相应的峰出现。由图1可见,S1、S2、S5样品均产生了5个明显的新化学成分,标记为1、2、3、4、5,将5个新的成分峰面积与样品所含橙皮苷峰面积比较(表2),由峰面积比值看出,S1、S5中产生新成分的4号峰峰面积比值分别达到了0.61、0.74,说明黑曲霉菌株确实使得陈皮产生新的化学成分。
5 讨论
5.1 陈皮表面优势真菌对主要药效物质的影响
本研究首次将陈皮表面分离得到的优势真菌与药效成分进行关联,探索黑曲霉与黄曲霉对药效成分的影响,结果表明二者对陈皮药效物质基础影响不同,其中3株黑曲霉可使陈皮总黄酮含量增加,这与课题组前期研究结果一致,同时,进一步发现部分黑曲霉菌株还可使陈皮中橙皮苷、川陈皮素含量增加,橘皮素减少,且产生新的化学成分,而另外1株黑曲霉和黄曲霉均呈现相反的作用,能使橘皮素增加,橙皮苷减少,总黄酮减少。从而证实陈皮表面真菌的生长代谢与药效成分的改变具有相关性,在陈皮陈化过程起重要作用,其生长代谢消耗药效物质,产生成分改变。综上,不同真菌及同一真菌不同菌株对陈皮的药效成分影响均不同,可能是陈皮在陈化过程中,并不是受单一真菌的影响,而是多种真菌、不同菌株之间的协同作用促进药效物质的积累,从而达到“陈久者良”。
表1 反接不同优势真菌陈皮药效物质含量测定结果(,n=3)

表1 反接不同优势真菌陈皮药效物质含量测定结果(,n=3)
注:与对照相比,*P<0.05,**P<0.01
编号CK S1 S2 S3 S4 S5总黄酮/% 10.54±0.24 12.13±0.38 11.95±0.35 10.00±0.15 9.82±0.35 14.89±0.36**多糖/% 18.48±1.07 13.34±0.12 14.48±2.09 10.52±0.94*12.28±0.58*10.74±0.97*总酚酸/% 0.94±0.13 1.06±0.06 1.17±0.19 0.82±0.07 0.86±0.06 1.48±0.05*橙皮苷/% 3.95±0.11 4.18±0.06*3.64±0.08*3.11±0.30*3.69±0.06*5.05±0.11**川陈皮素/% 0.42±0.01 0.43±0.01 0.47±0.01*0.49±0.00**0.44±0.01 0.38±0.01橘皮素/% 0.29±0.01 0.18±0.00**0.29±0.01 0.31±0.00 0.32±0.00*0.08±0.01**辛弗林/% 0.31±0.01 0.26±0.01*0.13±0.01**0.13±0.00**0.09±0.01**0.34±0.01
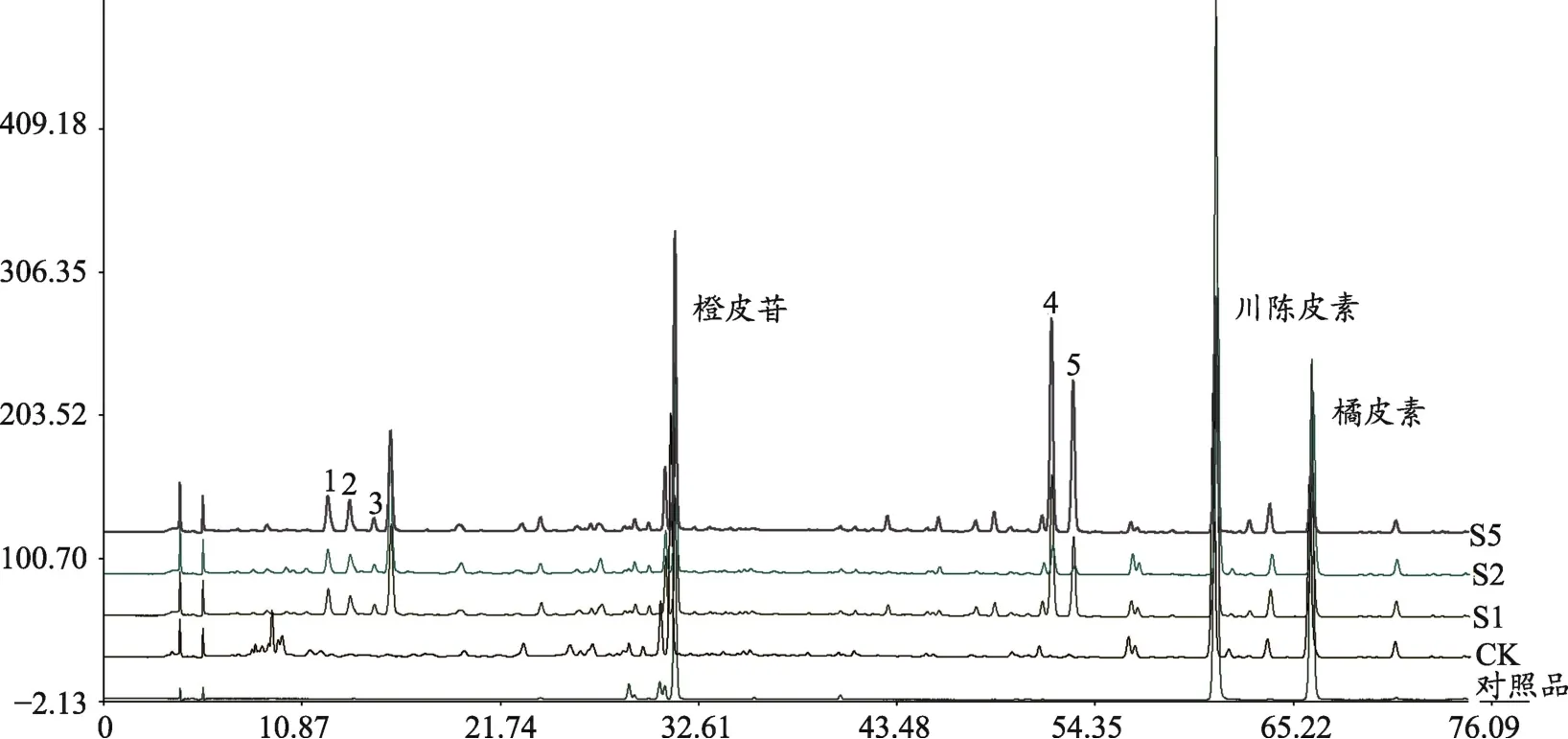
图1 产生新成分样品指纹图谱叠加
据文献报道黑曲霉可以产生多种酶类,是一种广泛应用于工业生产的菌种[10,11],而本文研究表明黑曲霉对药效成分的改变具有一定作用,另据文献[12]报道,黑曲霉具有较强抑制黄曲霉生长能力的作用,同时对黄曲霉毒素具有降解作用,因此推断中药陈皮在陈化过程中,因受到环境中黑曲霉的侵染,其代谢活动不仅导致了药效成分的改变,同时还抑制了黄曲霉真菌的生长、降解了黄曲霉毒素,达到了增效减毒的效果。从陈皮中筛选出一株具有双重作用的黑曲霉菌株,为加速陈皮陈化提供新方法,同时对陈皮中黄酮类成分的高效提取、活性成分转化具有较大的应用前景。
5.2 陈皮“陈久者良”科学内涵阐释
目前对陈皮“陈久者良”已有较多研究进行阐释,均证明久贮陈皮药效成分发生改变[13-15]。本研究证实真菌代谢转化与陈皮药效物质变化具有相关性,表明黑曲霉等微生物在陈皮陈化过程中对其药效物质基础的改变起着十分重要的作用。已有大量研究表明中药通过微生物转化可使药效物质含量增加或得到新的活性物质,使原中药的药用价值得到提高[16-20]。但微生物具有两面性,在条件适宜的情况下可使药材品质增加,但若条件不当也可导致药材发生劣变甚至产生毒素,严重影响药材品质和安全性[21,22]。因此接下来应对陈皮陈化过程微生物多样性分析,明确陈皮微生物与药效物质基础变化的相关性,阐明微生物是如何影陈皮药材的有效性和安全性,基于微生物转化角度阐明陈皮“陈久者良”的科学内涵。
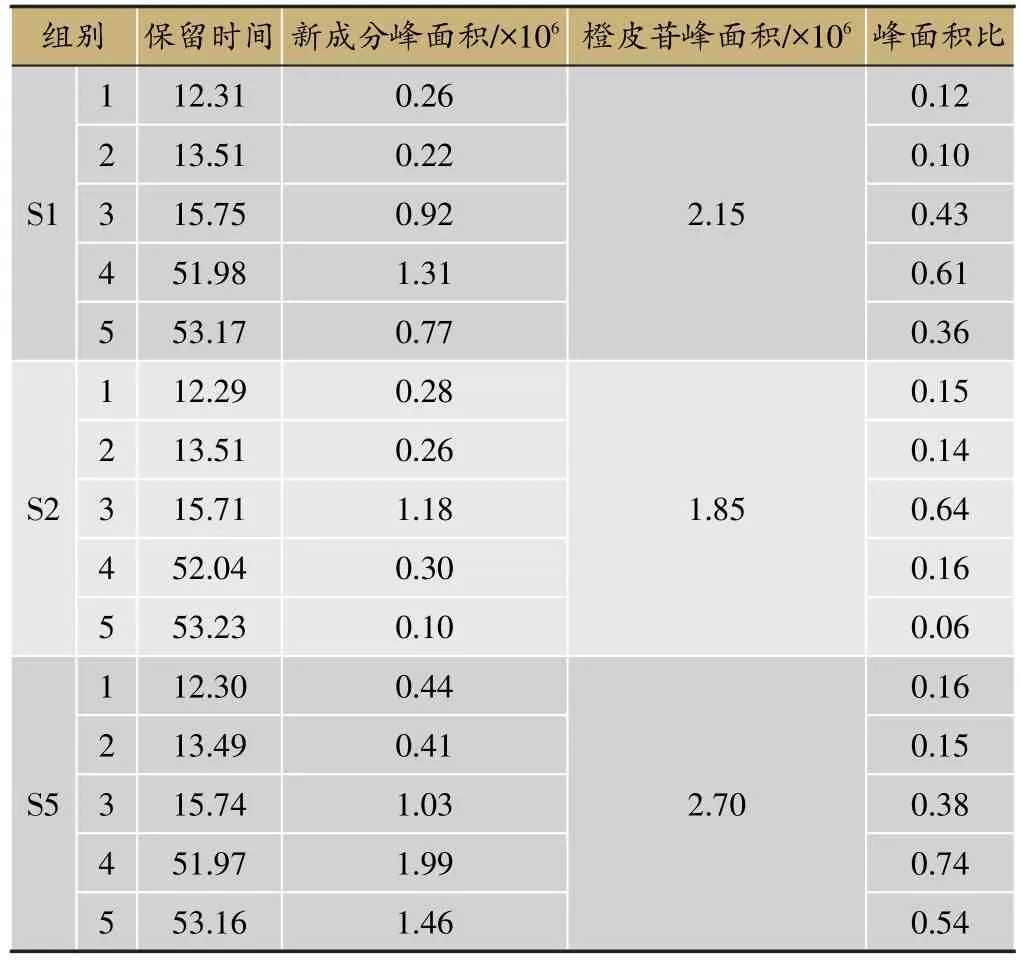
表2 5个新成分与橙皮苷峰面积比值
1国家药典委员会.中华人民共和国药典(一部).中国医药科技出版社,2015:191.
2陶弘景.本草经集注.昆明:群联出版社,1955:360-362.
3雷斅.雷公炮炙论.上海:上海中医学院出版社,1986:52.
4王福,张鑫,卢俊宇,等.陈皮“陈久者良”之黄酮类成分增加原因探究.中国中药杂志,2015,40(24):4890-4896.
5魏景超.真菌鉴定手册.上海:上海科技出版社,1979.
6候典云等.ITS/ITS2条形码序列在花椒药材鉴定中的应用.中国中药杂志,2014,4(7):534-537.
7张鑫,刘素娟,王智磊,等.模拟加速试验研究陈皮挥发性成分与黄酮类成分动态变化规律.天然产物研究与开发,2016,28(11):1752-1757.
8刘荣.不同栽培品种橘的主要药效成分动态变化与遗传多样性分析研究.成都:成都中医药大学硕士学位论文,2014.
9张鑫,刘素娟,王智磊,等.模拟加速实验研究陈皮主要药效物质动态变化规律.成都中医药大学学报,2016,39(3):8-12.
10张熙,韩双艳.黑曲霉发酵产酶研究进展.化学与生物工程,2016,33 (1):13-16.
11 Show P L,Oladele K O,Qi Y S,et al.Overview of citric acid production from Aspergillusniger.Front Life Sci,2015,8(3):1-13.
12 Zhang W,Xue B,Li M,et al.Screening a Strain of Aspergillusniger and Optimization of Fermentation Conditions for Degradation of Aflatoxin B1.Toxins(Basel),2014,6(11):3157-3172.
13周欣,孙素琴,黄庆华.陈皮储存年限的分析与鉴定.光谱学与光谱分析,2008,28(1):72-74.
14林林,林子夏,莫云燕,等.不同年份新会陈皮总黄酮及橙皮苷含量动态分析.时珍国医国药,2008,19(6):1432-1433.
15高蓓.广陈皮黄酮类化合物和挥发油成分及其活性研究.武汉:华中农业大学博士学位论文,2011.
16 Cui L,Wu S Q,Zhao C A,et al.Microbial conversion of major ginsen⁃osides in ginseng total saponins by Platycodongrandiflorumendophytes. J Ginseng Res,2016,40(4):366-374.
17 Feng L,Xu C,Li Z,et al.Microbial Conversion of Ginsenoside Rd From Rb1 by the Fungus Mutant Aspergillus Niger Strain TH-10a.Prep Bio⁃chem Biotechnol,2016,46(4):336-341.
18 Kim J H,Park T S,Yang S H,et al.Microbial bioconversion and pro⁃cessing methods enhanced the phenolic acid and flavonoids and the rad⁃ical scavenging capacity of Smilax china L.leaf.J Sci Food Agric,2015, 96(3):878-885.
19 Lee S J,Kim Y,Kim M G.Changes in the ginsenoside content during the fermentation process using microbial strains.J Gins Res,2015,39 (4):392-397.
20孙敏鸽,赵倩,陈丽霞,等.黑曲霉(AS3.739)对莪术醇的生物转化及条件优化.沈阳药科大学学报,2013,30(3):226-231.
21梁乙川,刘珈羽,张鑫,等.真菌对中药材药效物质和安全性影响研究进展.中药材,2016,39(11):2660-2663.
22张鑫,王福,陈鸿平,等.中药材真菌及真菌毒素污染研究现状.世界科学技术-中医药现代化,2015,17(11):2381-2388.
Separation and Identification of Surface Preponderant Fungi on Citri Reticulatae Pericarpium and Its Influence on Effective Substance
Liu Sujuan,Zhang Xin,Wang Zhilei,He Yi,Pu Qiuhua,Chen Lin,Chen Hongping,Liu Youping
(Pharmacy College,Chengdu University of Traditional Chinese Medicine,Breeding Base of State Key Laboratory of Resources System Research and Development Utilization of Chinese Herbal Medicines Co-constructed by Ministry of Science and Technology of the PeopleƳs Republic of China and Sichuan Province,Chengdu 611137,China)
This paper studied the influence ofsurface preponderantfungi on main effective substances of CitriReticulatae Pericarpium(CRP).Spreading plate method was used to isolatepredominant strains from the surface of CRP.Besides,the method combining microscopic and molecular identification was also adopted.HPLC and UVspectrophotometric methods were used to determine the main effective substances in CRP.From thesurface of CRP,the advantage strain fungi were Aspergillusniger and A.Flavus.After the inoculation of A.Niger and A.flavus against CRP,the effective compositionwas changed.And different A.niger strains had differenceeffectiveness oneffective chemical components,especially one strain of A.niger.Compared withthe control group,contents of total flavonoids and hesperidin were significantly increased (P<0.01);and five types of obvious new chemical compositions were produced.It was concluded that the metabolic transformation of fungi was related tochanges ofeffective substances of CRP,which played a significant role in the aging process of CRP.The growth and metabolism of fungi consumeeffective substances and producechanges of composition. From the perspective of microorganisms,“the older,the better”of CRP hasa better explanation.
Citri reticulatae pericarpium,preponderant fungi,separation and identification,inoculation,effective substance
10.11842/wst.2017.04.012
R282.7
A
(责任编辑:陈宁,责任译审:王晶)
2017-02-15
修回日期:2017-03-14
*国家自然科学基金委面上项目(81072991),基于陈皮、青皮“一体二用”研究植物次生代谢产物动态变化与中药功效的相关性,负责人:刘友平;国家自然科学基金委国家基础科学人才培养基金(J1310034-14):霉变陈皮污染真菌的分离鉴定及物质基础变化规律研究,负责人:刘友平;四川省科技厅应用基础项目(2015JY0012):川产大宗药材川陈皮快速、无损模式识别及品质评价模型研究,负责人:陈鸿平。
**通讯作者:刘友平,研究员,博士生导师,主要研究方向:中药化学成分与质量标准化研究;陈鸿平,副教授,主要研究方向:中药炮制、中药质量标准化及药效物质基础研究。
