缺血后处理对止血带休克致肾损伤的作用
2017-08-07赵利军李开济门秀丽
赵利军,李开济,吴 静,门秀丽*
(1华北理工大学基础医学院病理生理学系,唐山 063000;2唐山市慢性病临床基础研究重点实验室;*通讯作者,E-mail:xiulimen@126.com)
缺血后处理对止血带休克致肾损伤的作用
赵利军1,2,李开济1,2,吴 静1,2,门秀丽1,2*
(1华北理工大学基础医学院病理生理学系,唐山 063000;2唐山市慢性病临床基础研究重点实验室;*通讯作者,E-mail:xiulimen@126.com)
目的 观察缺血后处理对止血带休克致肾损伤的作用,并探讨其可能机制。 方法 30只SD大鼠随机分为对照组(Control组)、止血带休克组(TOS组)和缺血后处理组(I-postC组)。止血带法制作止血带休克动物模型,另对I-postC组动物在止血带休克基础上实施缺血后处理。经腹主动脉取血测各组大鼠血浆肌酐(Cr)、尿素氮(BUN)、C反应蛋白(CRP)水平;肾组织匀浆测组织SOD、MDA、XOD和MPO水平;免疫组化法检测肾组织细胞凋亡相关蛋白Bcl-2及Bax的表达;TUNEL法检测肾细胞凋亡;电镜下观察肾组织超微结构改变。 结果 ①与Control组比较,后两组肾组织SOD活力明显降低(P<0.01),血浆Cr、BUN、CRP均升高(P<0.01);肾组织MDA、XOD和MPO升高,差异具有统计学意义(P<0.05或P<0.01);免疫组化检测中Bax蛋白表达增强而Bcl-2蛋白表达略增强;TUNEL法检测可见肾细胞凋亡数目增多;透射电镜下可见肾近曲小管上皮细胞核固缩,胞内空泡,溶酶体和致密颗粒沉积增多,部分线粒体嵴断裂或模糊。肾小球足突细胞突起不规则、融合,线粒体嵴断裂并减少,有空泡,粗面内质网扩张。②与TOS组比较,I-postC组肾组织SOD活性增强,血浆Cr、BUN、CRP及肾组织MDA、XOD、MPO等相关损伤指标均有所下降,差异具有显著性(P<0.05或P<0.01);Bcl-2蛋白表达增强而Bax减弱,肾凋亡细胞数目减少。电镜下观察可见肾小管上皮细胞及肾小球毛细血管内皮细胞损伤程度减轻。 结论 肢体长时间应用止血带可导致肾功能障碍和肾组织结构损伤,缺血后处理可通过减少氧自由基生成和抑制炎症反应,减轻肾损伤。
止血带休克; 肾损伤; 缺血后处理; 细胞凋亡
肢体在遭受一定时间重度缺血后再突然恢复血供,有时会发生更为严重的组织损伤,机体甚至陷入休克状态,临床上称之为止血带休克(tourniquet shock,TOS),这也是临床外科多器官功能障碍发生的常见病因。大量资料表明,肾脏是止血带休克过程中最易受累的器官之一,严重时表现为急性肾功能衰竭(acute renal failure,ARF)[1]。缺血后处理(ischemic postconditioning,I-postC)是一种在组织长时间缺血后多次短暂的缺血和恢复血供交替进行的预处理方法[2],对止血带休克中肾脏功能和结构的影响尚不完全明确。本研究应用I-postC措施,从多方面观察止血带休克时肾脏的变化,探讨I-postC的器官保护意义及机制。
1 材料与方法
1.1 实验动物
6周龄SPF级健康雄性SD大鼠30只,清洁级,体重200-250 g,购自河北联合大学实验动物中心。动物合格证号:SCXK京2009-0004。将大鼠随机分为3组(每组10只):对照组(Control组)、止血带休克组(TOS组)和缺血后处理组(I-postC组)。
1.2 动物模型
制作大鼠止血带休克模型[3],即:在乙醚浅麻醉下,用标准化弹性的橡皮带结扎大鼠双后肢根部使其缺血4 h,然后松解橡皮带恢复血供4 h。I-postC组在缺血4 h后,行缺血5 min和恢复血液灌注5 min,重复3次的操作,即缺血后处理,然后再持续恢复血流灌注4 h。Control组的橡皮带仅松弛环绕双后肢不阻断血流。
1.3 标本检测
①全麻下开腹经腹主动脉取血,离心15 min(3 500 r/min),应用全自动生化分析仪测定血浆肌酐(creatinine,Cr)、尿素氮(blood urea nitrogen,BUN)、C反应蛋白(C-reactive protein,CRP)含量。②摘取一侧肾脏并迅速纵向剖开,冷生理盐水冲洗,用滤纸吸附表面水分,扭力天平称取肾组织200 mg制作组织匀浆,离心取上清液,用分光光度法测超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、黄嘌呤氧化酶(xanthine oxidase,XOD)和髓过氧化物酶(myeloperoxidase,MPO)的变化趋势。③横向切取对侧肾组织块约4 mm长,立即投入10%甲醛溶液中固定,石蜡包埋,低温切片,TUNEL法检测细胞凋亡;免疫组化法检测凋亡相关蛋白Bcl-2及Bax的表达情况。④术中在肾皮质部位迅即切取米粒大小肾组织,投入冷4%戊二醛-磷酸缓冲液,再修成1 mm×1 mm×1 mm的小块预固定,转入2.5%戊二醛中固定,经丙酮脱水、环氧树脂包埋,制作超薄切片,染色后在透射电镜下观察肾组织超微结构。
1.4 统计学分析

2 实验结果
2.1 血浆Cr、BUN和CRP测定结果
与Control组比较,TOS组和I-postC组的Cr、BUN和CRP均明显升高(P<0.01);I-postC组与TOS组比较,三者含量均降低(P<0.01,见表1)。
2.2 肾组织SOD、XOD、MDA、MPO测定结果
与Control组比较,TOS组MDA、XOD和MPO均明显升高(P<0.01);I-postC组与TOS组比较,MDA、XOD和MPO均降低(P<0.01,见表2),SOD均降低,损伤减轻。
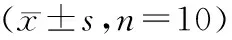


组别Cr(U/L)BUN(U/L)CRP(U/L)Control组21.55±3.905.06±1.623.53±0.21TOS组58.93±6.76**17.09±2.06**6.05±0.80**I-postC组27.86±2.31**##12.04±1.41**##4.98±0.68**##
与对照组比较,**P<0.01;与TOS组比较,##P<0.01
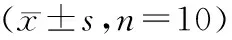


组别SOD(U/gprot)XOD(U/g)MDA(nmol/mg)MPO(U/g) Control组87.64±6.4874.96±4.63 4.98±0.490.39±0.06 TOS组46.86±4.66**111.00±10.05**11.01±1.00**1.04±0.15** I-postC组61.01±7.06**#87.47±5.16*##6.94±0.51**##0.57±0.09*##
与Control组比较,*P<0.05,**P<0.01;与TOS组比较,#P<0.05,##P<0.01
2.3 肾组织细胞凋亡情况
激光共聚焦显微镜下观察,Control组肾组织凋亡细胞罕见。TOS组可见较多TUNEL阳性信号为黄绿色或黄色荧光,位于胞核,呈小圆形、环行或颗粒状。凋亡细胞主要见于肾小管上皮细胞和肾小球毛细血管内皮细胞,间质细胞凋亡少见(见图1)。I-postC组TUNEL阳性细胞较IR组明显减少。

A.Control组 B.TOS组 C.I-postC组图1 TUNEL染色激光共聚焦显微镜下观察肾组织细胞凋亡情况 (×200)Figure 1 Apoptosis in renal tissues under laser confocal microscope by TUNEL staining (×200)
2.4 肾组织Bcl-2、Bax蛋白表达情况
Bcl-2蛋白和Bax蛋白阳性表达主要存在于肾小管上皮细胞和肾小球毛细血管内皮细胞胞浆内,呈棕黄色颗粒。Control组可见少量肾细胞胞质呈浅棕黄色,即Bcl-2和Bax蛋白弱阳性表达。TOS组及I-postC组阳性表达的细胞数目更多,且着色加深。与TOS组比较,I-postC组Bcl-2蛋白表达增强,而Bax蛋白表达明显减少(见图2)。
2.5 肾组织超微结构改变
透射电镜下观察可见Control组肾组织细胞结构清晰完整。TOS组可见近曲小管上皮细胞核固缩,线粒体数量减少,部分线粒体嵴断裂或模糊,甚至空泡化。肾小球足突细胞足突排列不规则,部分突起融合;线粒体肿胀,空泡变性较明显,线粒体嵴断裂并减少,粗面内质网扩张(见图3)。在I-postC组,肾组织超微结构的损伤改变较之TOS组有一定程度改善(见图3)。

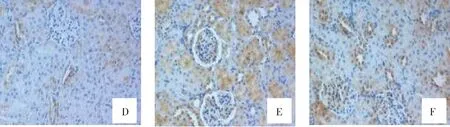
A-C.Control组、TOS组、I-postC组Bcl-2表达;D-E.Control组、TOS组、I-postC组Bax表达图2 各组大鼠肾组织Bcl-2和Bax蛋白表达情况 (×200)Figure 2 Expression of Bcl-2,Bax protein in renal tissues (×200)

a:足突融合;b:内质网扩张;c:线粒体嵴断裂、空泡化A-C分别为Control 组、TOS 组、I-postC 组的肾小球组织

d:核固缩,有较多空泡;e:线粒体嵴断裂、空泡化D-F分别为Control 组、TOS 组、I-postC 组的肾小管组织图3 电镜下各组大鼠肾组织形态学 (Bar=1 μm)Figure 3 Morphology of renal tissue of rats in different groups under electron microscope (Bar=1 μm)
3 讨论
在临床外科实践中,止血带休克可见于松解结扎时间过长的止血带后,由于各种毒素刺激以及有效循环血量不足导致的以神经-体液因子失调与急性循环障碍为特征的危重状态,是创伤性休克的一种[1]。以全身循环衰竭为基础,急性肾损伤是止血带休克常见且后果严重的并发症。关于止血带休克的防治,目前有多种药物和措施,其中缺血后处理具有可控性好、操作简单,无毒副作用等特点,临床应用前景值得期待。
本实验中,动物双后肢在缺血期以无氧代谢为主要产能方式,乳酸、腺苷等酸性代谢产物生成增多,大量炎细胞活化。在第二个阶段,随着血流大规模的重新灌注,各种炎性介质(inflammatory mediators)、酸性代谢产物以及氧自由基(oxygen free radicals,OFR)等有毒有害物质均匀循环周身,成为远隔器官受损的直接因素[4],肾脏是敏感器官之一。此外,在止血带休克的全程,机体均处于应激状态,交感-肾上腺髓质及肾素-血管紧张素系统强烈激活,肾血管收缩,加上血流重新分布的调控作用,肾脏血供明显不足,也是加重肾损伤的重要的神经-体液因素[5]。
SOD是生物体内主要的抗氧化酶,短期内可因清除OFR被消耗而活性下降。本实验中缺血后处理组的SOD活性得以保护,可能是因为反复短暂的血流灌注,形成了局部组织的良性应激效应,抑制了XOD的过多生成,ATP不至于短时大量分解,氧自由基的生成受到了抑制,SOD总活性得到了保护。全身性炎症反应(systemic inflammatory response)也是止血带休克时远位器官受累的主要机制[5],组织MPO活性可反映中性粒细胞的激活、游走和在组织内聚集的程度。CRP是一种非特异性炎性标志物[6],可在炎症或损伤的急性期敏感表达。实验中MPO和CRP的变化,验证了止血带休克时炎性反应在全身的播散,缺血后处理可在一定程度上抑制炎性反应,从而减轻了肾损伤的程度。
肢体局部长时间应用止血带,可经多途径启动全身的细胞凋亡通路[7]。Bcl-2和Bax是调控细胞凋亡的重要基因,二者相互作用决定了细胞死亡的阈值[8]。本实验中,血流再灌注后Bcl-2高度表达于肾小管上皮细胞,其抗细胞凋亡的主要机制在于抗氧化,抑制线粒体释放细胞色素氧化酶(Cyto-C)、凋亡诱导因子(apoptosis inducing factor,AIF)等促凋亡蛋白[9],抑制半胱天冬酶(caspase)激活,抑制Bax、Bak等细胞毒作用,维持细胞钙稳态[10]。免疫组化结果提示,I-postC可增加Bcl-2表达而抑制Bax表达,上调Bcl-2/Bax 比值,减少细胞凋亡。在激光共聚焦显微镜下观察肾组织细胞的凋亡,I-postC组阳性信号较TOS组明显减少。血Cr和BUN是反映肾功能的常用指标,实验结果提示I-postC可以降低血Cr和BUN水平,减轻止血带休克肾损伤的程度。
综上所述,缺血后处理可保护大鼠止血带休克的肾脏,其机制可能与减轻氧化应激反应,抑制炎症反应和抗细胞凋亡有关,有关更为详尽的具体机制有待于进一步研究。
[1] 门秀丽,张连元,董淑云,等.牛磺酸在大鼠止血带休克后肺损伤中的保护作用[J].第四军医大学学报,2004,25(2):144-146.
[2] Yang Xiu-hong,Wang Yin-huan,Wang Jian-jun.Role of angiotensin-converting enzyme (ACE and ACE2) imbalance on tourniquet-induced remote kidney injury in a mouse hind limb ischemia-reperfusion model[J].Peptides,2012,36 (1):60-70.
[3] 张连元,杨林.生理科学实验教程[M].北京:人民军医出版社,2001:29.
[4] Men X,Han S,Gao J,etal.Taurine protects against lung damage following limb ischemia reperfusion in the rat by attenuating endoplasmic reticulum stress-induced apoptosis[J].Acta Orthop,2010,81(2):263-267.
[5] Zambas NA,Karkos CD,Kambaroudis AG,etal.Protective effect of antithrombin III against lung and myocardial injury in lower limb ischemia-reperfusion syndrome [J].Ann Vasc Surg,2012,26(4):566-570.
[6] Shinohara G,Morita K,Nagahori R,etal.Ischemic postconditioning promotes left ventricular functional recovery after cardioplegic arrest in an invivo piglet model of global ischemia reperfusion injury on cardiopulmonary bypass[J].J Thorac Cardiovasc Surg,2011,142 (4):926-932.
[7] Fu X,Li S,Jia G,etal.Protective effect of the nitric oxide pathway in l-citrulline renal ischemia-reperfusion injury in rats[J].Folia Biologica,2013,59 (6):225-232.
[8] 李开济,贺宝玲,卢秋玲,等.缺血后处理减轻大鼠肢体缺血再灌注后肺损伤的实验研究[J].天津医药,2016,44(4):453-456.
[9] Zhang Y,Leng YF,Xue X,etal.Effects of penehyclidine hydrochloride in small intestinal damage caused by limb ischemia-reperfusion [J].World J Gastroenterol,2011,17(2):254-259.
[10] Zhao W,Gan X,Su G,etal.The interaction between oxidative stress and mast cell activation plays a role in acute lung injuries induced by intestinal ischemia-reperfusion[J].J Surg Res,2014,187(2):542-552.
Effect of ischemic postconditioning on kidney injury caused by tourniquet shock
ZHAO Lijun1,2,LI Kaiji1,2,WU Jing1,2,MEN Xiuli1,2*
(1DepartmentofPathophysiology,BasicMedicalCollege,NorthChinaUniversityofScienceandTechnology,Tangshan063000,China;2TangshanKeyLaboratoryforPreclinicalandBasicResearchonChronicDiseases;*Correspondingauthor,E-mail:xiulimen@126.com)
ObjectiveTo investigate the effects of ischemic postconditioning(I-postC) on kidney injury caused by tourniquet shock,and explore its possible mechanisms.MethodsThirty SD rats were randomly divided into control group,tourniquet shock group(TOS group) and I-postC group.The tourniquet shock animal models were induced by tourniquet.In I-postC group,ischemic postconditioning was performed based on the treatment in model group.Blood was taken from the abdominal aorta to measure the contents of blood creatinine(Cr),blood urea nitrogen(BUN) and C-reactive protein(CRP) in plasma.The contents of superoxide dismutase(SOD),malondialdehyde(MDA),xanthine oxidase(XOD),and myeloperoxidase(MPO) in renal tissues were determined.The expression of Bcl-2 protein and Bax protein in renal tissue was detected.The apoptotic cells in renal tissue were determined by terminal-deoxynucleotidyl trans-ferase-mediated d-UTP nick end labeling(TUNEL).The histological ultrastructure changes of renal tissues were observed under electron microscope.Results①Compared with control group,SOD activity in renal tissues reduced in TOS group and I-postC group(P<0.01),while the levels of Cr,BUN and CRP in plasma increased(P<0.01),and the levels of MDA,XOD,MPO in renal tissues also increased(P<0.01).Compared with control group,Bax protein expression increased obviously in TOS group and I-postC group,and the antiapoptotic gene Bcl-2 expression increased slightly.The number of renal tubular epithelial cells and endothelial cell apoptosis increased in TOS group and I-postC group.Under the transmission electron microscope,there were renal proximal convoluted tubule epithelial cell nucleus pycnosis,intracellular cavitation,increased lysosome and dense particle deposition,and some mitochondria crest fracture or fuzzy.Glomerular podocyte protuberant,irregular,fusion,mitochondrial cristae fracture and reduced free bubble,rough endoplasmic reticulum expansion were also observed.②Compared with TOS group,SOD activity in renal tissues increased in I-postC group(P<0.05 orP<0.01),while the levels of Cr,BUN and CRP all decreased(P<0.05 orP<0.01),and the number of renal cell apoptosis reduced(P<0.05 orP<0.01).Compared with TOS group,Bcl-2 protein expression increased and Bax was decreased in I-postC group.Under the transmission electron microscope,the structural damage was reduced in renal tubular epithelial cells and glomerulus.ConclusionTourniquet shock can induce renal dysfunction and structural damage,while I-postC can relieve the kidney damage by reducing the oxygen free radicals and inhibiting the inflammation.
tourniquet shock; kidney damage; ischemic postconditioning; apoptosis
河北省卫生厅医学研究重点课题资助项目(20130060)
赵利军,女,1975-07生,硕士,副教授,E-mail:786411506@qq.com
2016-12-09
R363
A
1007-6611(2017)04-0328-05
10.13753/j.issn.1007-6611.2017.04.006
