miR-582在胃癌组织中的表达及其作用机制
2017-08-07王建华孙学军郑见宝刘思达毛智军普彦淞段降龙龙延滨
刘 栋,王建华*,宋 斌,孙学军,郑见宝,刘 斌,刘思达,毛智军,普彦淞,段降龙,龙延滨
(1陕西省人民医院普外二科,西安 710068;2西安交通大学第一附属医院普外科;*通讯作者,E-mail:wangjianhuaman@163.com)
miR-582在胃癌组织中的表达及其作用机制
刘 栋1,王建华1*,宋 斌1,孙学军2,郑见宝2,刘 斌1,刘思达1,毛智军1,普彦淞1,段降龙1,龙延滨1
(1陕西省人民医院普外二科,西安 710068;2西安交通大学第一附属医院普外科;*通讯作者,E-mail:wangjianhuaman@163.com)
目的 研究胃癌和癌旁组织中microRNA-582(miR-582)的表达水平,以及调控miR-582表达后对胃癌细胞SGC-7901功能的影响。 方法 采用实时荧光定量PCR检测人胃癌和正常胃组织中miR-582的表达水平;将miR-582 inhibitors(miR-582下调表达)通过脂质体转染至人胃癌SGC-7901细胞中(miR-582 inhibitors组),设未转染对照组(control组)和miRNA无义序列转染对照组(NC组)。实时荧光定量PCR检测转染组细胞中miR-582的表达变化;MTT方法检测各组细胞的生长活力;流式细胞术检测各组的细胞周期和凋亡率;Transwell实验检测各组细胞侵袭能力;Western blot检测各组细胞中Rab7a、CDK1和AKT3蛋白表达。 结果 miR-582在胃癌中的表达量为癌旁组织的(0.34±0.11)倍(P<0.05)。与control组和NC组相比,miR-582 inhibitors组中SGC-7901细胞增殖和侵袭能力上升(P<0.05),细胞周期被促进,细胞凋亡减少(P<0.05),Rab23蛋白表达上调,差异具有统计学意义(P<0.05)。 结论 miR-582在胃癌组织中低表达,miR-582通过下调Rab23抑制胃癌细胞SGC-7901增殖、侵袭、迁移能力,促进其凋亡。其可以作为胃癌诊断和治疗的新靶点。
胃癌; miR-582; Rab23; SGC-7901细胞; 细胞活力; 细胞凋亡; 细胞侵袭
胃癌是全世界最常见的恶性肿瘤之一,在我国也是发病率和死亡率分别位居第2位和第3位的恶性肿瘤[1]。从分子水平上阐释胃癌的发生和发展的具体机制,是为了寻求新的胃癌早期标记物和有效生物治疗的靶点。胃癌的发生发展涉及到多种癌基因的激活、抑癌基因的失活等一系列的异常生物学过程[2]。microRNA(miRNA)是一种19-25个核苷酸大小的内源性非编码的RNA,在基因表达的转录后水平发挥重要作用[3],现在大量研究已证实其参与到肿瘤发生发展的很多过程,如增殖、凋亡、侵袭、耐药等[4]。一般来说,miRNA主要以完全或部分互补配对的方式通过结合到靶基因mRNA的3′非编码区(3′UTR)来发挥功能[5]。miR-582作为近年来在肿瘤发展中扮演重要角色的微小RNA成员之一,已经引起了越来越多的关注。很多研究表明miR-582涉及到肿瘤细胞生长及侵袭迁移的多种生物学进程中,如膀胱癌[6]和结直肠癌[7,8]。然而miR-582在胃癌中的功能尚不清楚,本研究检测miR-582在胃癌组织中的表达及抑制miR-582在胃癌细胞SGC-7901中的表达,研究其在胃癌增殖、凋亡、侵袭转移中的作用,探讨miR-582作为胃癌治疗靶点的可能性。
1 材料与方法
1.1 主要试剂和仪器
Trizol试剂购自美国Invitrogen公司;反转录试剂盒RevertAid First Strand cDNA Synthesis Kit购自美国Thermo Scientific公司;Real-Time PCR购自日本TaKaRa公司生产;Real-Time PCR检测仪器为美国Bio-Rad公司生产的CFX96TMReal-Time PCR Detection System;miR-582、U6引物由广州锐博生物科技有限公司设计并合成;RPMI 1640培养基购自美国Corning公司;胎牛血清购自法国Biowest公司;LipofectamineTM2000转染试剂购自美国Invitrogen公司;OPTI-MEN购自美国Gibco公司;Annexin Ⅴ-FITC试剂盒购自美国BD公司;MTT购置美国Sigma公司;miR-582及Negative Control(NC)购自上海吉玛公司生产;Rab23,CDK1,AKT3和GAPDH抗体购自美国Santa Cruz公司;凝胶成像仪购自美国Bio-rad公司。
1.2 细胞培养
GES-1、SGC-7901、MGC-803、AGS、BGC-823和MKN28为西安交通大学医学院中心实验室长期保存,采用RPMI1640培养基(含10%胎牛血清),于37 ℃、5%CO2培养箱中培养,待细胞长满约80%时用0.25%胰蛋白酶消化传代,取生长状态良好的对数生长期细胞用于实验。收集2016-01~2016-05于陕西省人民医院普通外科手术切除的20例原发性胃癌标本及相应癌旁正常组织标本(距离癌灶边缘5 cm以上的组织),其中男14例,女6例;年龄39-73岁,平均年龄58.3岁。所有患者术前未经过放、化疗,术后经病理确诊。新鲜标本离体后迅速置于液氮中保存待用。所有入选患者均签署知情通知书,并经医院伦理委员会同意批准。
1.3 real-time PCR检测miR-582
用Trizol试剂按照操作说明书对正常胃黏膜细胞系GES-1和5株胃癌细胞行总RNA提取,各取2 μg RNA进行反转录成cDNA,行real-time PCR。反应条件:反应条件:95 ℃预变性30 s;然后按95 ℃ 5 s,60 ℃ 30 s进行40个循环。以每个样本的U6作为内参,基因相对表达量采用2-ΔΔCt方法进行计算分析。实验重复3次。
1.4 细胞转染
将对数生长期SGC-7901细胞经0.25%胰酶消化,取2×104个接种于6孔板,设实验组(转染miR-582 inhibitors)、阴性对照组(转染negative control)组和空白对照组(untreated cell)。用250 μl OPTI-MEN稀释LipofectamineTM2000转染试剂5 μl室温静置5 min,再用250 μl OPTI-MEN稀释miR-582 inhibitors或Negative Control 5 μl,两者混合室温静置20 min, 每孔加入500 μl中的转染复合液,在5%CO2、37 ℃培养箱中孵育4-6 h,用新鲜的完全培养基(含血清)替换含有转染复合物的培养基,供后续实验使用。实验重复3次。
1.5 细胞增殖实验
采用MTT法,将消化后的胃癌细胞SGC-7901按照5×103个/孔接种于96孔板中,随机分为实验组、阴性对照组和空白对照组,每组设4个复孔;未接种细胞的孔中加入RPMI 1640培养基作为调零孔,放于5%CO2、37 ℃培养箱中培养。接种后24,48,72,96 h,每孔加入MTT 20 μl继续在培养箱中孵育4 h,后用酶标仪检测其490 nm处吸光值。实验重复3次。
1.6 细胞周期检测
取胃癌细胞SGC-7901按照2×105个/孔接种于6孔板中,分为实验组、阴性对照组和空白对照组,转染后48 h、24 h,然后再换成含10%胎牛血清的RPMI 1640培养基培养24 h,用胰酶收集各组细胞,所收集细胞用预冷的PBS洗涤3次,1 000 r/min,5 min,弃上清。加入-20 ℃预冷的75%冰乙醇1 ml固定细胞,置于4 ℃冰箱过夜;检测前离心(1 000 r/min 5 min),用PBS洗涤2次;加入100 μl PBS并将细胞吹悬;用含0.01%RNase和0.5%碘化丙锭(PI)4 ℃处理细胞20 min。过300目尼龙网。送流式细胞仪检测。实验重复3次。
1.7 细胞凋亡检测
取胃癌细胞按照2×105个/孔接种于6孔板中,分为实验组、阴性对照组和空白对照组,转染后24 h Annexin Ⅴ-FITC试剂盒进行染色,并在1 h内检测。实验重复3次。
1.8 Western blot检测Rab23的表达水平
取胃癌细胞按照2×105个/孔接种于6孔板中,分为实验组、阴性对照组和空白对照组,收集转染72 h细胞,加入细胞裂解液,提取细胞总蛋白,BCA法检测总蛋白浓度,每组样本取10 μl进行10%SDS-PAGE垂直电泳,湿转法将胶中蛋白水平转移至PVDF膜上,5%脱脂牛奶在37 ℃摇床上封闭1 h,加入TBST稀释后的一抗,4 ℃过夜;取出后TBST洗膜3次再加入二抗,孵育1 h,再洗膜3次,添加ECL发光液反应底物,凝胶成像系统扫描,采用相关图像分析软件(Bio-rad Quantity One,CA)进行条带灰度分析,实验采用GAPDH作为参照蛋白。
1.9 统计学分析
采用SPSS18.0统计学分析软件,两组间差异分别采用两样本t检验,多组间差异采用单因素方差分析One-way ANOVA,P<0.05认为差异有统计学意义。
2 结果
2.1 人胃癌组织和胃癌细胞中miR-582的表达
与20例相应的癌旁组织相比,miR-582在胃癌组织中表达明显降低(P<0.05,见图1A)。miR-582在胃癌中的表达量为癌旁组织的(0.34±0.11)倍(P<0.05)。与正常胃黏膜细胞GES-1相比,miR-582在人胃癌细胞MGC-803和SGC-7901相对高表达,差异有统计学意义(均P<0.01),而MKN28、BGC-823、AGS等胃癌细胞中miR-582的表达量与GES-1细胞相比差异无统计学意义(均P>0.05,见图1B)。因此,后续功能学研究选用miR-582表达量较高的胃癌细胞SGC-7901为实验细胞,采用miR-582 inhibitors下调miR-582在胃癌细胞SGC-7901中的表达。
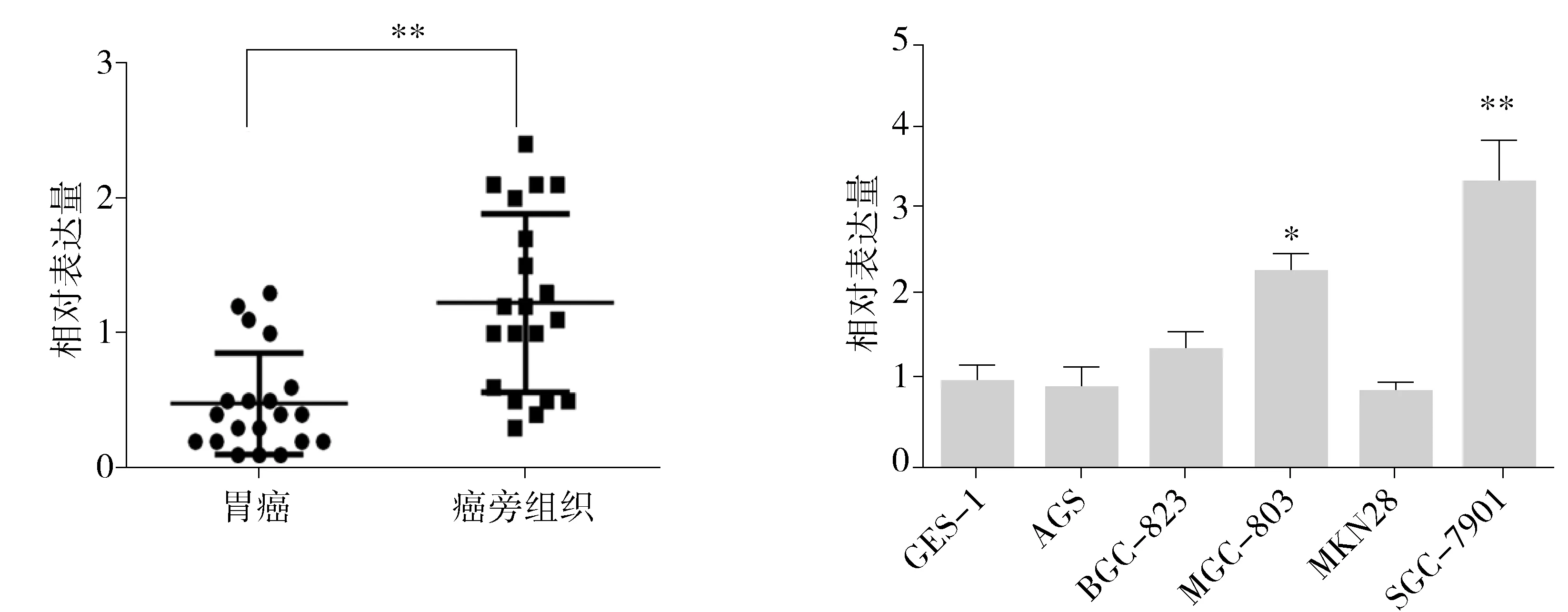
与GES-1细胞比较,*P<0.05,**P<0.01 A.20例胃癌及癌旁组织 B.正常胃黏膜细胞及胃癌细胞系图1 组织及细胞系中miR-582的表达Figure 1 The expression of miR-582 in gastric cancer tissue and gastric cancer cells
2.2 转染后24 h miR-582的表达水平
与阴性对照组比较,人胃癌细胞SGC-7901转染miR-582 inhibitors后miR-582的表达水平显著下调,差异有统计学意义(P<0.05,见图2)。阴性对照组和空白对照组间没有统计学差异(P>0.05)。
2.3 miR-582对胃癌细胞增殖的影响
MTT结果显示,相对阴性对照组,人胃癌细胞SGC-7901转染miR-582 inhibitors,在转染后24 h、48 h生长速度均没有统计学差异(P>0.05,见图3),在72 h、96 h生长速度明显增快,差异有统计学意义(P<0.05)。阴性对照组和空白对照组间差异无统计学意义(P>0.05)。结果表明下调miR-582具有促进胃癌细胞增殖的作用。
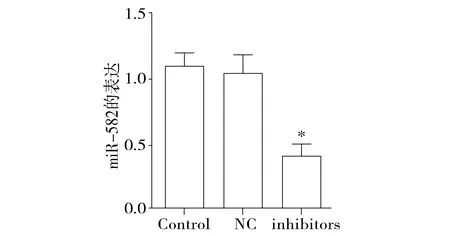
与NC组比较,*P<0.05图2 细胞系SGC-7901转染miR-582 inhibitors 24 h后miR-582的表达Figure 2 Expression of miR-582 in SGC-7901 cells after transfection with miR-582 inhibitor for 24 h
2.4 miR-582对胃癌细胞周期的影响
流式细胞仪检测显示,相比阴性对照组和空白对照组,人胃癌细胞SGC-7901转染miR-582 inhibitors 48 h,其G0/G1期细胞比例明显减少(实验组vs阴性对照组vs空白对照组:45.6%vs52.4%vs53.4%,P<0.05,见图4),S期细胞比例增多(实验组vs阴性对照组vs空白对照组:32.9%vs21%vs23.9%,P<0.05),G2/M期细胞比例没有统计学差异(实验组vs阴性对照组vs空白对照组:20.6%vs26.7%vs23.3%,P>0.05)。阴性对照组与空白对照组间没有统计学差异(P>0.05)。结果表明下调miR-582具有促进胃癌细胞G1/S转化的作用。
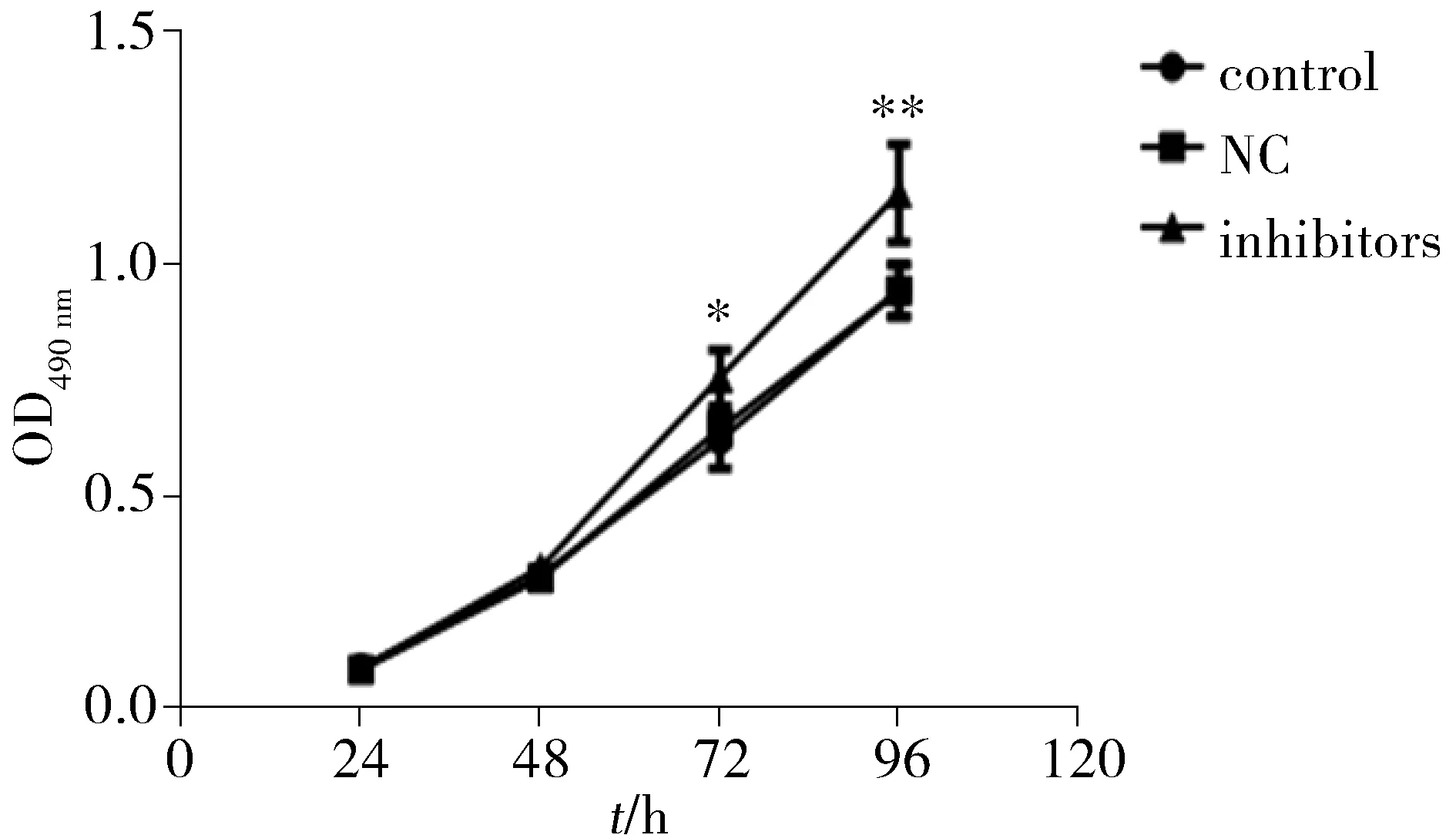
与阴性对照组和空白对照组比较,*P<0.05,**P<0.01图3 SGC-7901细胞生长曲线Figure 3 Cell growth curves of SGC-7901 cells after transfection with miR-582
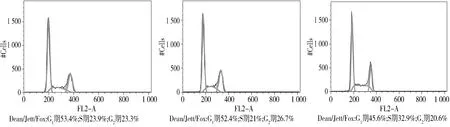
A.control组 B.NC组 C.inhibitors组图4 流式细胞仪检测转染后48 h细胞周期Figure 4 Cell cycle distribution by flow cytometry at 48 h after transfection
2.5 miR-582对胃癌细胞凋亡的影响
与阴性对照组比较,转染了miR-582 inhibitors的人胃癌细胞SGC-7901凋亡比例减少,差异有统计学意义(P<0.05,见图5)。阴性对照组和空白对照组间没有统计学差异(P>0.05)。结果表明下调miR-582对胃癌细胞具有促进凋亡的作用。
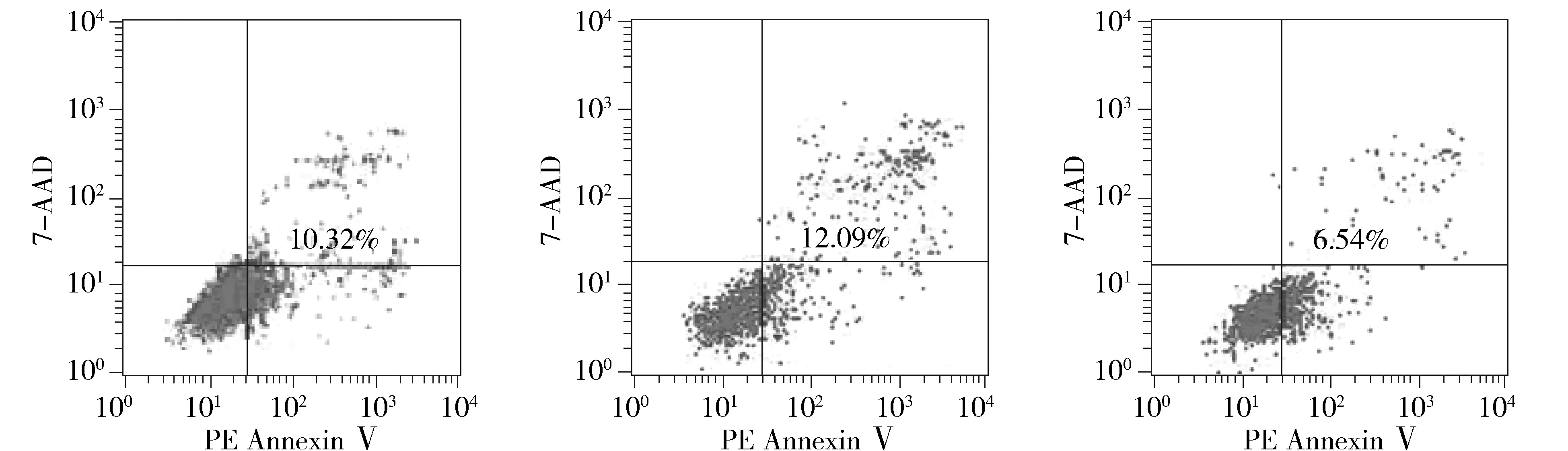
A.Control组 B.NC组 C.Inhibitors组图5 细胞仪检测SGC-7901细胞凋亡Figure 5 Apoptosis of SGC-7901 cells by flow cytometry
2.6 miR-582对胃癌细胞侵袭及迁移的影响
与阴性对照相比,人胃癌细胞SGC-7901转染miR-582 inhibitors后侵袭能力均显著增强(见图6),即每视野穿膜细胞数均显著增加(均P<0.05,见图7)。阴性对照组和空白对照组间没有统计学差异(P>0.05)。结果表明下调miR-582对胃癌细胞具有促进侵袭的作用。
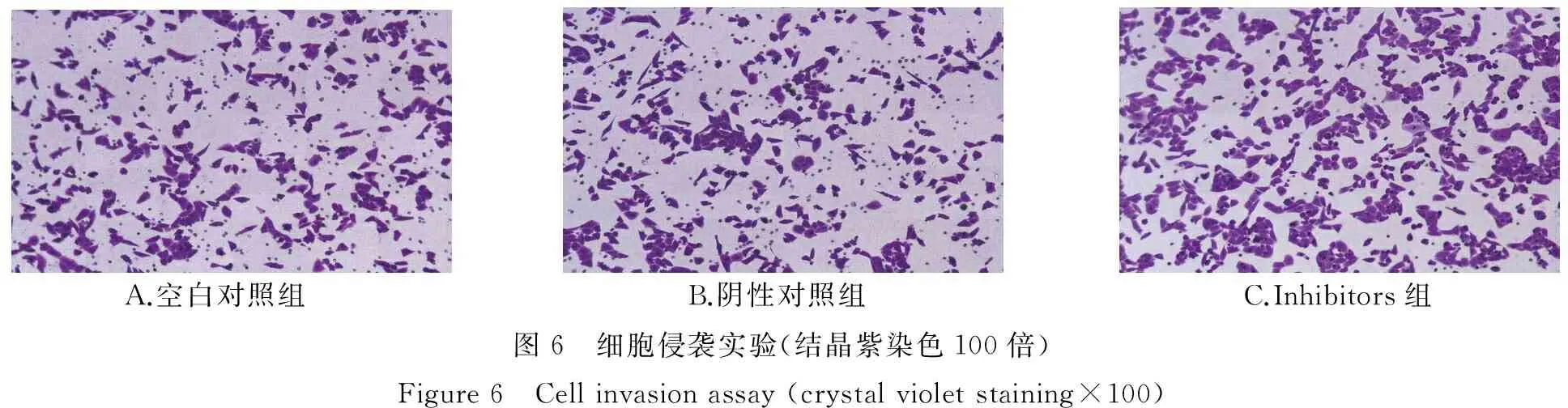
A.空白对照组 B.阴性对照组C.Inhibitors组图6 细胞侵袭实验(结晶紫染色100倍)Figure6 Cellinvasionassay(crystalvioletstaining×100)
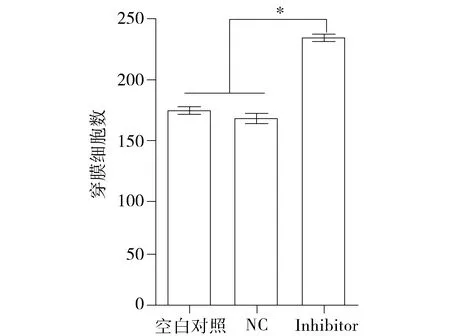
图7 miR-582对胃癌细胞侵袭的影响(*P<0.05)Figure 7 Effect of miR-582 on cell invasion(*P<0.05)
2.7 miR-582对胃癌相关蛋白Rab23、CDK1及AKT3的影响
相比阴性对照组,转染了miR-582 inhibitors后的SGC-7901细胞Rab23表达明显升高(P<0.05),CDK1及AKT3表达没有统计学意义(P>0.05,见图8)。阴性对照组和空白对照组间没有统计学差异(P>0.05)。
3 讨论
越来越多的证据表明,miRNA在对其靶向的癌基因、抑癌基因或者参与肿瘤增殖、血管生成和凋亡的相关基因的调控方面发挥着至关重要的作用[9]。此外血清中游离的异常的miRNA的表达为肿瘤的早期诊断和疾病进展的标志物提供新的诊疗希望[10,11]。根据先前的研究[12],在胃癌中许多miRNA异常表达,提示在胃癌的发生发展中miRNA的表达的差异性是十分普遍的现象,miRNA的异常表达与胃癌细胞增殖活性,药物敏感性和侵袭迁移能力密切相关。miR-582已被证实在多种人的肿瘤发生发展中发挥作用。最近一篇文献[6]显示miR-582能抑制膀胱癌细胞生长,在肿瘤形成过程中发挥关键作用。但是关于miR-582在胃癌中的作用至今未被报道。
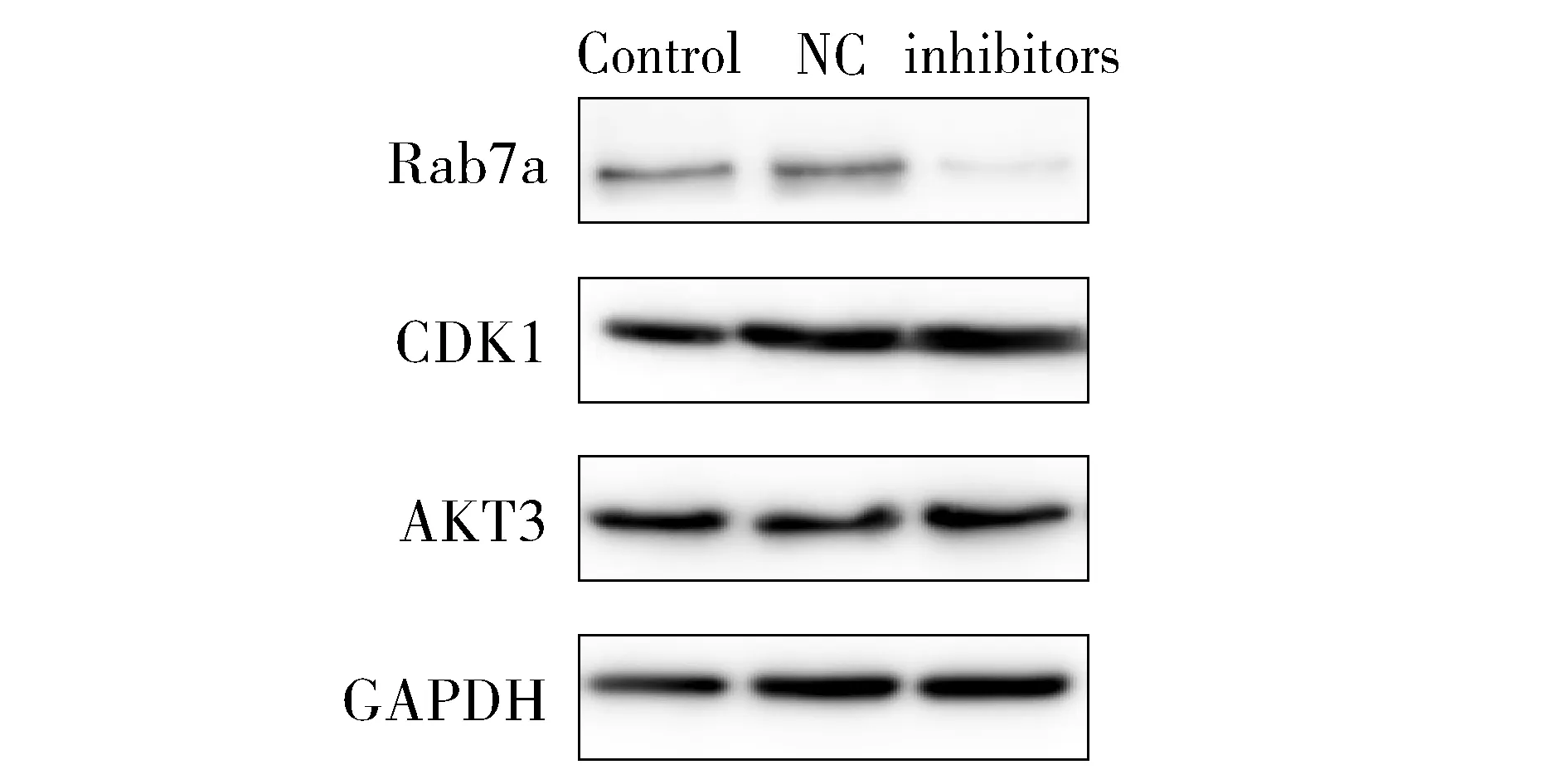
图8 Western blot实验检测miR-582在SGC-7901细胞中的表达Figure 8 The expression of miR-582 protein in SGC-7901 cells by Western blot
Rab蛋白是小GTPase超家族的成员,其在细胞分泌、内吞、信号传导和发育过程中都有重要作用[13],在肿瘤的发生发展中同样参与了重要过程[14]。Rab23,是Rab家族的成员,与细胞生长、侵袭迁移密切相关。根据以往的报道,Rab23被认为在胃癌中高表达,且被miR-367所调节[15]和本研究结果相一致,Rab23可以促进胃癌细胞的增殖、侵袭和迁移,并抑制凋亡。高分辨率的基于芯片的比较基因组杂交发现胃癌细胞中Rab23基因的扩增现象,且Rab23可以显著性提高AGS细胞的侵袭能力[16]。
本研究证实miR-582在胃癌的组织和细胞中显著性下降,Rab23可能是miR-582在胃癌细胞的靶基因之一,下调miR-582能够通过增加Rab23的表达而促进胃癌细胞的增殖,减少凋亡,增加侵袭能力。因此,本研究得出miR-582在胃癌的肿瘤形成过程中扮演者抑癌基因的角色。其他肿瘤的相关报道,miR-582在肝癌组织和肝癌细胞系的表达降低,上调miR-582能抑制肝癌细胞的生长,且CDK1和AKT3作为miR-582的直接靶基因调节肝癌的进程[17]。然而在不同类型的实体肿瘤中miR-582的靶基因也不尽相同。在人前列腺癌细胞和脑胶质瘤细胞中miR-582表达上调且促进细胞增殖,在前列腺细胞中miR-582在剥夺雄激素的条件下靶向下调EFNB2[18],而胶质瘤中靶向下调凋亡相关基因caspase 3和9[19]。在急性肺结核中,miR-582上调并通过靶向FOXO1来抑制单核细胞的凋亡[20]。而本研究发现miR-582通过Rab23来抑制胃癌细胞的增殖和侵袭,促进其凋亡。
综上所述,上调miR-582能够抑制胃癌细胞的增殖活性和侵袭能力,促进胃癌凋亡,提示其在胃癌中可能扮演致抑癌基因的角色,本研究首次提示其可能通过靶基因Rab23发挥生物学功能,为胃癌的发生机制及临床生物治疗提供新的靶点。
[1] Torre LA,Bray F,Siegel RL,etal.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[2] Tamura G.Alterations of tumor suppressor and tumor-related genes in the development and progression of gastric cancer[J].World J Gastroenterol,2006,12(2):192-198.
[3] Hammond SM.An overview of microRNAs[J].Adv Drug Delivery Rev,2015,87:3-14.
[4] Bushati N,Cohen SM.microRNA functions-Annual review of cell and developmental biology[J].Annu Rev,2007,23(1):175-205.
[5] Ameres SL,Zamore PD.Diversifying microRNA sequence and function[J].Nat Rev Mol Cell Biol,2013,14(8):475-488.
[6] Uchino K,Takeshita F,Takahashi RU,etal.Therapeutic effects of microRNA-582-5p and-3p on the inhibition of bladder cancer progression[J].Mol Ther,2013,21(3):610-619.
[7] Zhang X,Zhang Y,Yang J,etal.Upregulation of miR-582-5p inhibits cell proliferation,cell cycle progression and invasion by targeting Rab27a in human colorectal carcinoma[J].Cancer Gene Ther,2015,22(10):475-480.
[8] Shu Z,Chen L,Ding D.miR-582-5P induces colorectal cancer cell proliferation by targeting adenomatous polyposis coli[J].World J Surg Oncol,2016,14(1):239.
[9] Leva GD,Garofalo M,Croce CM.microRNAs in cancer[J].Annu Rev Pathol,2014,9(2):287-314.
[10] Schwarzenbach H,Nishida N,Calin GA.Clinical relevance of circulating cell-free microRNAs in cancer[J].Nat Rev Clin Oncol,2014,11(3):145-156.
[11] Simonson B,Das S.microRNA therapeutics:the next magic bullet[J].Mini-Rev Med Chem,2015,15(6):467-474.
[12] Shi Z,Wei Q,She J.MicroRNAs in gastric cancer metastasis[J].Crit Rev Eukar Gene,2014,24(1):39-53.
[13] Park HH.Structural basis of membrane trafficking by Rab family,small G protein[J].Int J Mol Sci,2013,14(5):8912-8923.
[14] Ho JR,Chapeaublanc E,Kirkwood L,etal.Deregulation of Rab and Rab effector genes in bladder cancer[J].PLoS One,2012,7(6):e39469.
[15] Bin Z,Dedong H,Xiangjie F,etal.The MicroRNA-367 inhibits the invasion and metastasis of gastric Cancer by directly repressing Rab23[J].Genet Test Mol Biomarkers,2015,19(2):69-74.
[16] Hou Q,Wu YH,Grabsch H,etal.Integrative genomics identifies RAB23 as an invasion mediator gene in diffuse-type gastric cancer[J].Cancer Res,2008,68(12):4623-4630.
[17] Zhang Y,Huang W,Ran Y,etal.miR-582-5p inhibits proliferation of hepatocellular carcinoma by targeting CDK1 and AKT3[J].Tumor Biol,2015,36(11):8309-8316.
[18] Maeno A,Terada N,Uegaki M,etal.Up-regulation of miR-582-5p regulates cellular proliferation of prostate cancer cells under androgen-deprived conditions[J].Prostate,2014,74(16):1604-1612.
[19] Floyd DH,Zhang Y,Dey BK,etal.Novel anti-apoptotic microRNAs 582-5p and 363 promote human glioblastoma stem cell curvival via direct inhibition of caspase 3,caspase 9,and Bim[J].PLoS One,2014,9(5):e96239.
[20] Liu Y,Jiang J,Wang X,etal.miR-582-5p is upregulated in patients with active tuberculosis and inhibits apoptosis of monocytes by targeting FOXO1[J].PLoS One,2013,8(10):e78381.
Expression of miR-582 in gastric cancer and its mechanism
LIU Dong1,WANG Jianhua1*,SONG Bin1,SUN Xuejun2,ZHENG Jianbao2,LIU Bin1,LIU Sida1,MAO Zhijun1,PU Yansong1,DUAN Xianglong1,LONG Yanbin1
(1SecondDepartmentofGeneralSurgery,ShaanxiProvincialPeople’sHospital,Xi’an710068,China;2DepartmentofGeneralSurgery,FirstAffiliatedHospitalofXi’anJiaotongUniversity;*Correspondingauthor,E-mail:wangjianhuaman@163.com)
ObjectiveTo explore the expression level of microRNA-582(miR-582)in human gastric cancer and normal gastric tissues and the effect of miR-582 expression on the function of gastric cancer cells.MethodsThe expression levels of miR-582 in human gastric cancer and normal gastric tissues were detected by real-time PCR. The miR-582 inhibitors were transfected into human gastric cancer SGC-7901 cells by liposome method. The expression of miR-583 in the cells after transfection was detected by real-time PCR.The experiment was divided into control group,negative control group(NC)and miR-582 inhibitors group.The cell viability was measured by MTT assay.The cell cycle and apoptotic rate of SGC-7901 cells were analyzed by flow cytometry.The invasion ability of SGC-7901 cells was measured by Transwell assay.The expression levels of Rab23,CDK1 and AKT3 were detected by Western blot.ResultsThe expression level of miR-582 in human gastric cancer tissues was significantly lower than that in normal gastric tissues(P<0.05).Compared with control group and NC group,the viability and invasion ability of the SGC-7901 cells were increased in miR-582 inhibitors group(P<0.05),the cell cycle was promoted(P<0.05),and the cell apoptosis was decreased and the protein expression of Rab23 was up-regulated(P<0.05).ConclusionThe expression of miR-582 significantly decreases in gastric cancer tissues.MiR-582 can inhibit gastric cancer SGC-7901 cell proliferation,migration and invasion by down-regulating Rab23 to promote apoptosis.It can be used as a new diagnosis and treatment target for gastric cancer.
gastric cancer; miR-582; Rab23; SGC-7901cells; cell proliferation; cell apoptosis; cell invasion
国家自然科学基金资助项目(81101874)
刘栋,男,1982-09生,博士,主治医师,E-mail:liudong522@163.com
2017-01-08
R735.2
A
1007-6611(2017)04-0316-06
10.13753/j.issn.1007-6611.2017.04.004
