卵巢癌腹水中不同肿瘤相关性巨噬细胞亚型IL-10、IL-12表达的差异
2017-08-07宋玉霞王宏卫王雪娟
宋玉霞,赵 涛,王宏卫,郭 清,王雪娟
(河北省石家庄市第一医院妇科,河北 石家庄 050011)
·论 著·
卵巢癌腹水中不同肿瘤相关性巨噬细胞亚型IL-10、IL-12表达的差异
宋玉霞,赵 涛,王宏卫,郭 清*,王雪娟
(河北省石家庄市第一医院妇科,河北 石家庄 050011)
目的研究不同临床分期的卵巢癌患者腹水或腹腔冲洗液中M2/M1比值;采用流式细胞学方法分选出M1型巨噬细胞和M2型巨噬细胞;检测与M1、M2相关的细胞因子白细胞介素10(interleukin-10,IL-10)、IL-12 mRNA的相对表达量,从细胞因子水平初步阐述卵巢癌腹腔播散和转移的免疫学机制。方法①用CD64、CD163分别标记M1型巨噬细胞和M2型巨噬细胞,观察10例卵巢癌患者及17例卵巢良性肿瘤患者腹水或腹腔冲洗液中M2/M1比值。②用流式细胞学方法分选出M1型巨噬细胞和M2型巨噬细胞。③采用RT-PCR方法检测检测M1型巨噬细胞、M2型巨噬细胞中IL-10、IL-12 mRNA的相对表达量。结果对照组M2/M1比值低于Ⅰ+Ⅱ期和Ⅲ+Ⅳ期,卵巢癌Ⅰ+Ⅱ期M2/M1比值低于Ⅲ+Ⅳ期,差异均有统计学意义(P<0.05)。IL-10在M2型巨噬细胞中的相对表达量高于M1型巨噬细胞,IL-12在M1型巨噬细胞中的相对表达量高于M2型巨噬细胞,差异均有统计学意义(P<0.05)。结论在上皮性卵巢癌患者腹水中有巨噬细胞浸润,早期患者M1型巨噬细胞所占比例较高,晚期患者M2型巨噬细胞所占比例较高;M2型巨噬细胞比例较高提示卵巢癌期别较高;IL-10、IL-12的表达差异提示M2型巨噬细胞可能有助于卵巢癌腹腔的播散及远处转移。
卵巢肿瘤;巨噬细胞;白细胞介素10;白细胞介素12
卵巢癌是妇科肿瘤中恶性程度最高的疾病,腹膜转移是晚期卵巢癌的特征之一。晚期卵巢癌患者腹水微环境的浸润细胞包括内皮细胞、淋巴细胞、成纤维细胞、巨噬细胞等,其中巨噬细胞是含量最丰富的免疫细胞。近年来研究发现,M2型巨噬细胞浸润数量与卵巢癌侵袭转移及临床进展有显著的相关性[1]。M1型巨噬细胞和M2型巨噬细胞在某些细胞因子的表达上有所差异。本研究通过分析不同期别卵巢癌患者及卵巢良性肿瘤患者腹水或腹腔冲洗液中M2/M1比值的差异,采用RT-PCR方法比较M1巨噬细胞和M2型巨噬细胞白细胞介素10(interleukin-10,IL-10)、IL-12表达的差异,初步筛选出肿瘤细胞中的关键分子靶点,旨在为解释卵巢癌的腹腔播散和转移提供新的线索,并为卵巢癌分子靶点的干预策略提供理论基础。现报告如下。
1 资料与方法
1.1 一般资料 选择自2014年1月—2015年7月在河北省石家庄市第一医院妇科门诊及住院的首诊上皮性卵巢癌患者10例为观察组,年龄53~67岁,平均(60.12±4.51)岁,行肿瘤细胞减灭术,术后FIGO分期为Ⅰ~Ⅳ期,FIGO Ⅰ、Ⅱ期4例,FIGO Ⅲ、Ⅳ期6例。选择同期卵巢良性肿瘤患者17例为对照组,年龄33~47岁,平均(41.24±3.81)岁。卵巢良性肿瘤需要手术者排除盆腔炎性疾病、子宫肌瘤、子宫腺肌症或交界性瘤、免疫系统疾病等能引起腹腔免疫环境改变的并发症患者。
1.2 腹腔巨噬细胞分离、培养与纯度鉴定
1.2.1 腹腔巨噬细胞分离 对照组采用腹腔冲洗液,观察组有腹水者收集腹水,没有腹水者采用腹腔冲洗液,严格无菌操作。离心收集细胞沉淀(1 200 r/min,15 min,4 ℃),Ficoll 密度梯度法收集中间层单个核细胞(1 000 r/min,20 min,23 ℃), PBS 重悬后再次离心(800 r/min,7 min,23 ℃)。
1.2.2 腹腔巨噬细胞培养 细胞以无血清RPMI 1640重悬后种于100 mm细胞培养皿,细胞种植密度为1.0×106/mL,培养箱中静置 2 h 使细胞贴壁,用预热的PBS润洗3次, 除去悬浮细胞。加入10%FBS-RPMI 1640,置入37 ℃、5%CO2培养箱培养,备用。
1.2.3 腹腔巨噬细胞纯度鉴定 以免疫荧光的方式鉴定分离培养巨噬细胞纯度。细胞刮轻刮培养皿收集巨噬细胞,离心收集的细胞沉淀1 200 r/min, 5 min,23 ℃。弃上清,以CD68抗体标记巨噬细胞,37 ℃,1 h。PBS洗涤3遍,标记荧光二抗,37 ℃,1 h。PBS洗涤3遍,Hocest染核5min。PBS洗涤3遍,荧光显微镜观察,统计。
1.3 腹腔巨噬细胞各亚型比例的检测 以CD68作为腹腔巨噬细胞(M0)的表面标记,以CD64作为M1巨噬细胞的表面标记,以CD163作为M2型巨噬细胞的表面标记。将对照组和观察组不同分期收集的腹腔冲洗液或腹水离心收集细胞沉淀,取1.0×106个细胞,分别标记上述荧光抗体,采用流式细胞学方法检测M2/M1比值。
1.4 方法 采用流式细胞学方法分选出卵巢癌患者腹腔冲洗液或腹水中M1型巨噬细胞和M2型巨噬细胞:以CD64作为M1巨噬细胞的表面标记,以CD163作为M2型巨噬细胞的表面标记;将对照组和观察组不同分期收集的腹腔冲洗液或腹水离心收集的细胞沉淀,取1.0×106个细胞,分别标记上述荧光抗体,用流式细胞仪进行分选。将分选出来的M1型巨噬细胞和M2型巨噬细胞分别培养:细胞以无血清RPMI 1640重悬后种于100 mm细胞培养皿,细胞种植密度为1.0×106/mL,培养箱中静置 2 h 使细胞贴壁,用预热的PBS润洗3次, 除去悬浮细胞;加入10%FBS-RPMI 1640,置入37 ℃、5%CO2培养箱培养,备用。采用RT-PCR方法检测M1型巨噬细胞、M2型巨噬细胞中IL-10、IL-12 mRNA的表达:取生长状态良好且细胞密度在80%~90%的M1型巨噬细胞、M2型巨噬细胞,收集细胞,分别提取其总RNA。根据RT-PCR试剂盒说明书,检测M1型巨噬细胞、M2型巨噬细胞中IL-10、IL-12 mRNA表达量,引物序列见表1。
1.5 统计学方法 应用SPSS 13.0软件分析数据。计量资料比较分别采用t检验、F检验和q检验。P<0.05为差异有统计学意义。

表1 RT-PCR引物序列Table 1 Sequence of RT-PCR primers
2 结 果
2.1 3组M2/M1比值比较 对照组M2/M1比值低于卵巢癌Ⅰ+Ⅱ期与Ⅲ+Ⅳ期,卵巢癌Ⅰ+Ⅱ期M2/M1比值低于Ⅲ+Ⅳ期,差异均有统计学意义(P<0.05),见表2。
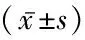
表2 对照组、Ⅰ+Ⅱ期组、Ⅲ+Ⅳ期组M2/M1比值比较Table 2 M2/M1 ratio of control group,Ⅰ+Ⅱ stage and Ⅲ+Ⅳ stage
*P<0.05与对照组比较 #P<0.05与卵巢癌Ⅰ+Ⅱ期比较(q检验)
2.2 IL-10、IL-12分别在M1、M2型巨噬细胞中的相对表达量 IL-10在M2型巨噬细胞中的相对表达量高于M1型巨噬细胞,IL-12在M1型巨噬细胞中的相对表达量高于M2型巨噬细胞,差异均有统计学意义(P<0.05),见表3。
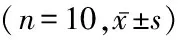
表3 IL-10、IL-12分别在M1、M2型巨噬细胞的相对表达量Table 3 The relative expression of IL-10 and IL-12 in M1 and M2 macrophages respectively
3 讨 论
近年来,恶性肿瘤发病率及病死率逐年上升,妇科恶性肿瘤也不例外。卵巢癌是女性生殖器官中最常见的恶性肿瘤,由于至今无有效的疾病筛查及诊断方法,初诊的卵巢癌患者中近70%已是晚期,卵巢癌已成为女性生殖系统肿瘤中病死率最高的疾病[2]。
卵巢恶性肿瘤主要的组织学类型为上皮性卵巢癌,但由于卵巢位于盆腔深部,不易被扪及,临床发觉时多已是晚期,5年存活率为25%~30%,卵巢癌FIGOⅢ/Ⅳ期患者,病变多已转移至盆腹腔内的许多脏器,如转移至大网膜、肠系膜根部或肝脏、膀胱等,导致上皮性卵巢癌成为妇科恶性肿瘤临床诊断及治疗中的难点。
巨噬细胞作为第一道免疫防线(固有免疫的主要细胞成分),大量存在于人体正常腹腔微环境中,这些巨噬细胞的作用主要是维持腹腔正常免疫环境。晚期卵巢癌患者主要临床特征为腹腔内病灶的广泛种植播散和大量腹水,在卵巢癌腹腔种植播散的过程中,巨噬细胞与肿瘤细胞存在一定的相互作用,从而影响肿瘤细胞的恶性表型和不良转归。机体中的巨噬细胞可塑性较强,在不同的微环境的作用下,可表现出不同性质及功能,局部微环境是决定巨噬细胞发生类型和功能差异的主要因素[3-4]。根据发挥功能不同及活化状态的不同,巨噬细胞主要可分为经典活化的M1型巨噬细胞和替代性活化的M2型巨噬细胞。M1型巨噬细胞主要通过分泌促炎性细胞因子、专职提呈抗原、趋化因子,从而参与正向免疫应答,发挥免疫监视,使M1型巨噬细胞具有杀菌、抗肿瘤作用。所以在肿瘤发病早期,M1型巨噬细胞在抑制肿瘤的发生发展过程中发挥着重要的作用。M1型巨噬细胞的特点是高IL-12,并产生IL-23,抗原递呈能力强,主要促进Th1细胞免疫;而M2型巨噬细胞的特点是低IL-12和高IL-10,抗原递呈能力较低,抑制Th1获得性细胞免疫。
人IL-12由单核-巨噬细胞、淋巴细胞、树突状细胞等抗原提呈细胞分泌,在人体内发挥着非常重要的免疫调节功能。它可以刺激各种免疫细胞如自然杀伤细胞和T细胞产生γ- 干扰素(interferon-γ,IFN-γ),促进多种黏附分子的表达;也能够诱导初始CD4+T细胞分化成为Thl辅助细胞,同时促使Th2细胞产生多种免疫细胞因子如IL-4、IL-13等[5-6]。大量实验研究证明,IL-12可以抑制肿瘤细胞的恶性增殖,延长荷瘤动物的生存寿命,具有一定的抗肿瘤功效,是一种重要的抗肿瘤细胞因子[7-9]。尽管如此,人们对于IL-12的具体抗肿瘤机制仍未完全明了,而且由于直接应用IL-12的不良反应较大,限制了IL-12在临床抗肿瘤领域中的应用。
IL-10是一种炎症负调控因子,能够激活STAT3通路,高表达IL-10R[10-11],并且通过多种途径对免疫应答进行负向调节:抑制CD4+T 细胞合成和产生IL-2、IL-5、肿瘤坏死因子α 和IFN-γ;抑制细胞毒性T细胞、自然杀伤细胞释放IFN-γ;抑制巨噬细胞向Th1细胞提呈抗原,减少巨噬细胞表面的主要组织相容性复合体(major histocompatibility complex,MHC)-Ⅱ类分子、细胞间黏附分子[12-13]。IL-10也是拮抗IL-12生物学活性的重要细胞因子,有研究发现IL-10呈剂量依赖性地抑制IL-12诱导的血单核细胞的非MHC限制性杀伤活性及产生IFN-γ的能力。本研究证实IL-10与IL-12表达量呈负相关。同时,IL-12可迅速降低IL-10在肿瘤相关巨噬细胞的表达,可见IL-10与IL-12在细胞因子网络中相互影响[14]。
Reinartz等[15]将IL-10R阻断抗体注射入小鼠体内,发现肿瘤浸润巨噬细胞迅速发生了从M2向M1表型的转变,并在16 h内对肿瘤产生持续的免疫反应。此外,除了阻断IL-10R外,还发现阻断IL-6 能在一定程度上遏制M1 型巨噬细胞向M2 型转化,但其是否能使M2向M1表型进行逆分化仍需进一步研究证明[16-17]。
综上所述,本研究证明了上皮性卵巢癌患者腹水中有巨噬细胞浸润,早期患者M1型巨噬细胞所占比例较高,晚期患者M2型巨噬细胞所占比例较高。提示随着卵巢癌患者腹腔微环境的变化,由最初的M0主要向M1分化转变为M0向主要M2分化;M2型巨噬细胞比例较高提示卵巢癌患者期别较晚。M1型巨噬细胞的特点是高IL-12低IL-10,M2型巨噬细胞的特点是低IL-12和高IL-10,已有大量的研究证实了IL-12的抗瘤、抑瘤作用,这就为IL-12应用于卵巢癌的治疗提供了一定的理论基础。
[1] 柯星,吴梦,陈献,等.肿瘤相关M2型巨噬细胞在卵巢癌组织中的分布及意义[J].免疫学杂志,2016,(7):589-595.
[2] Zhang M,He Y,Sun X,et al. A high M1/M2 ratioof tumor-associated macrophages is associated with extended survival in ovarian cancer patients[J]. J Ovarian Res,2014,7:19.
[3] No JH,Moon JM,Kim K,et al. Prognostic significance of serum soluble CD163 level in patients with epithelial ovarian cancer[J]. J Gynecol Obstet Invest,2013,75(4):263-267.
[4] 耿华.巨噬细胞的研究进展[J].国际免疫学杂志,2013,36(6):450-454.
[5] Lan C,Huang X,Lin S ,et al. Expression of M2-polarized macrophages is associated with poor prognosis for advanced epithelial ovarian cancer[J]. J Technol Cancer Res Treat,2013,12(3):259-267.
[6] Staudt ND,Jo MJ,Hu JJ,et al. Myeloid cell receptor LRP1/CD91 regulates monocyte recruitment and angiogenesis in tumors[J]. J Cancer Res,2013,73(13):3902-3912.
[7] Reinartz S,Schumann T,Finkernagel F,et al. Mixed-Polarization Phenotype of Ascites-Associated Macrophages in Human Ovarian Carcinoma:Correlation of Cd163 Expression,Cytokine Levels and Early Relapse[J]. Int J Cancer,2014,134(1):32-42.
[8] Leinster DA,Colom B,Whiteford JR,et al. Endothelial cell junctional adhesion molecule C plays a key role in the development of tumors in a murine model of ovarian cancer[J]. FASEB J,2013,27(10):4244-4253.
[9] Hara M,Kono H,Furuya S,et al. Macrophage colony-stimulatingfactor plays a pivotal role in chemically induced hepatocellular carcinoma in mice[J]. Hepatol Res,2013,44(7):798-811.
[10] Raposo T,Gregrio H,Pires I,et al. Prognostic value of tumour-associated macrophages in canine mammary tumours[J]. Vet Comp Oncol,2014,12(1):10-19.
[11] Hutterer GC,Pichler M,Chromecki TF,et al. Tumour-associated macrophages might represent a favourable prognostic indicatorin patients with papillary renal cell carcinoma[J]. Histopathology,2013,63(3):309-315.
[12] Zhang Y,Sime W,Juhas M,et al. Crosstalk between colon cancer cellsand macrophages via inflammatory mediators and CD47 promotestumour cell migration[J]. Eur J Cancer,2013,49(15):3320-3334.
[13] Kipps E,Tan DS,Kaye SB. Meeting the challenge of ascites in ovarian cancer:new avenues for therapy and research[J]. Nat Rev Cancer,2013,13(4):273-282.
[14] de Palma M,Lewis CE. Macrophage regulation of tumor responses to anticancer therapies[J]. Cancer Cell,2013,23(3):277-286.
[15] Reinartz S,Schumann T,Finkernagel F,et al. Mixed-polarization phenotype of ascites-associated macrophages in human ovarian carcinoma:correlation of CD163 expression,cytokine levels and early relapse[J]. Int J Cancer,2014,134(1):32-42.
[16] Chambers SE,O'Neill CL,O'Doherty TM,et al. The role of immune-related myeloid cells inangiogenesis[J]. Immunobiology,2013,218(11):1370-1375.
[17] Escamilla J,Schokrpur S,Liu C,et al. CSF1 receptor targeting in prostate cancer reverses macrophage-mediated resistance to androgen blockade therapy[J]. Cancer Res,2015,75(6):950-962.
(本文编辑:刘斯静)
Differences in IL-10 and IL-12 expression of different tumor-associated macrophage subtypes in ascites of ovarian carcinoma
SONG Yu-xia, ZHAO Tao, WANG Hong-wei, GUO Qing*, WANG Xue-juan
(DepartmentofObstetricsandGynecology,theFirstHospitalofShijiazhuangCity,HebeiProvince,Shijiazhuang050011,China)
Objective To detecte M2/M1 ratio of ascites or peritoneal washings of different macrophages subtypes of ovarian cancer patients at different stages, to separate M1 subtype macrophages and M2 subtype macrophages by flow cytometry, to test the mRNA expression of M1- and M2-related cytokines IL-10 and 1L-12, and to explain the immune mechanism of ovarian cancer abdominal metastasis at the point of cytokines. Methods ①M1 macrophages and type M2 macrophages were labeled with CD64 and CD163 respectively, and the ratio of M2/M1 in ascites or peritoneal lavage fluid in 10 cases of ovarian cancer and 17 cases of benign ovarian tumor was observed. ②Flow cytometry was used to separate M1 subtype macrophages and M2 subtype macrophages. ③RT-PCR was used to test the mRNA expression of M1- and M2-related cytokines IL-10 and 1L-12. Results M2/M1 ratio in control group was lower than that in Ⅰ+Ⅱ stage and Ⅲ+Ⅳ stage; while Ⅰ+Ⅱ stage M2/M1 ratio was lower than Ⅲ+Ⅳ stage, and there was statistically significant differencein two groups(P<0.05). IL-10 expression in M2 subtype macrophages was higher than it in M1 subtype macrophages. IL-12 expression in M1 subtype macrophages was higher than that in M2 subtype macrophages. There was statistically significant difference respectively(P<0.05). Conclusion There were macrophages in epithelial ovarian cancer patients' ascites. M1 subtype macrophages accounted for high proportion at the early stage, while M2 subtype macrophages accounted for high proportion at the terminal stage.The high proportion of M2 subtype macrophages indicated that ovarian cancer patients were at the terminal stage. The difference expression of IL-10 and IL-12 indicated that M2 macrophages may create favorable conditions for ovarian cancer peritoneal dissemination and distant metastases.
ovarian neoplasms; macrophages;interleukin-10;interleukin-12
2016-12-15;
2017-02-04
宋玉霞(1981-),女,河北藁城人,河北省石家庄市第一医院主治医师,医学硕士,从事妇科疾病诊治研究。
R737.31
A
1007-3205(2017)06-0676-04
10.3969/j.issn.1007-3205.2017.06.014
*通讯作者
