Wnt/β-catenin信号通路在甲状腺乳头状癌中的表达及意义
2017-08-07李清怀
严 丽,李清怀,冀 宏,郝 芳
(河北医科大学第二医院甲状腺乳腺外科,河北 石家庄 050000)
·论 著·
Wnt/β-catenin信号通路在甲状腺乳头状癌中的表达及意义
严 丽,李清怀,冀 宏,郝 芳
(河北医科大学第二医院甲状腺乳腺外科,河北 石家庄 050000)
目的探讨Wnt/β-catenin通路中Wnt通路抑制因子(Wnt inhibitory factor-1,WIF-1)、β连环蛋白(β-catenin)和细胞周期蛋白(cyclin D1)在甲状腺乳头状癌(papillary thyroid cancer,PTC)中的表达及意义。方法选取PTC患者60例,留取癌灶组织和癌旁组织标本。检测WIF-1、β-catenin和cyclin D1 mRNA和蛋白表达,并分析WIF-1 mRNA与β-catenin和cyclin D1 mRNA的相关性。结果PTC组织WIF-1 mRNA表达水平和蛋白表达阳性率均显著低于癌旁组织,β-catenin、cyclin D1 mRNA表达水平和蛋白表达阳性率均显著高于癌旁组织(P<0.05)。PTC淋巴结转移组WIF-1 mRNA表达水平和蛋白表达阳性率低于无淋巴结转移组,β-catenin、cyclin D1 mRNA表达水平和蛋白表达阳性率高于无淋巴结转移组(P<0.05)。不同性别、年龄、肿瘤直径、病灶数目和是否包膜侵犯PTC中WIF-1、β-catenin、cyclin D1 mRNA表达水平和蛋白表达阳性率差异无统计学意义(P>0.05)。WIF-1 mRNA与β-catenin和cyclin D1 mRNA表达呈负相关。结论WIF-1基因在PTC中表达下调促进了β-catenin蛋白在细胞质中累积,导致靶基因cyclin D1过度激活。WIF-1下调和(或)β-catenin、cyclin D1上调在PTC的发生和转移中发挥促进作用。
甲状腺肿瘤;Wnt信号通路;β连环素
甲状腺乳头状癌(papillary thyroid cancer,PTC)是最常见的一类甲状腺癌,占所有甲状腺癌的80%~90%,发病率逐年上升。绝大部分PTC恶性程度低、预后良好。仅一小部分PTC并发淋巴结或远处脏器转移,放射碘治疗无效,预后较差。Wnt/β-catenin信号通路是调控细胞生长增殖的关键途径,在胚胎发育和肿瘤发生中发挥重要作用。本研究通过检测Wnt/β-catenin信号通路中β连环蛋白(β-catenin)、细胞周期蛋白(cyclin D1)和负反馈调节基因Wnt通路抑制因子(Wnt inhibitory factor-1,WIF-1)在PTC中的表达以及与淋巴结转移等临床病理参数的关系,探讨Wnt/β-catenin信号通路在PTC发生发展和转移中的作用,期望对PTC的诊断和治疗发挥一定的指导作用。
1 资料与方法
1.1 一般资料 选取2014年1月—2016年12月河北医科大学第二医院甲状腺乳腺外科经术后病理证实的PTC患者60例,留取癌灶组织和癌旁组织标本,癌旁组织取自距癌灶边缘2 cm以上的正常甲状腺组织。其中男性12例,女性48例。年龄22~70岁,平均(45.6±9.7)岁。手术方式:甲状腺腺叶、峡部切除+患侧Ⅵ区淋巴结清扫术18例,甲状腺全切+单侧Ⅵ区淋巴清扫术12例,甲状腺全切+双侧Ⅵ区淋巴结清扫术16例,甲状腺全切+单侧Ⅱ~Ⅵ区淋巴结清扫术9例,甲状腺全切+双侧Ⅱ~Ⅵ区淋巴结清扫术5例。所有患者均为首次手术。
本研究经河北医科大学第二医院伦理委员会批准。
1.2 主要试剂 兔抗人β-catenin多克隆抗体、兔抗人cyclin D1多克隆抗体、兔抗WIF-1单克隆抗体(美国Santa Cruz公司);通用型免疫组织化学试剂盒(上海基因科技有限公司);PrimeScript Ⅱ High Fidelity RT-PCR Kit(DR023A)、SYBR Premix DimerEraser试剂盒(DRR091A)(日本Takara公司)。
1.3 实时定量RT-PCR 取液氮冻存的PTC和癌周正常组织各20 mg,应用TRIzol法提取 RNA,凝胶电泳法验证提取质量良好的RNA,应用PrimeScript Ⅱ High Fidelity RT-PCR试剂盒进行反转录获得cDNA模板,严格按照SYBR Premix DimerEraser试剂盒说明书操作,将反应体系置于 ABI-7500 Real-Time PCR仪中进行扩增。反应结束后确认扩增曲线和熔解曲线,证实无非特异性扩增,采用ΔΔCT法计算GRTH的相对表达量,以Gapdh (管家基因)作为对照,引物序列见表 1。

表1 实时定量RT-PCR所用引物序列Table 1 Sequence of primers used in quantitative RT-PCR
1.4 免疫组织化学法 取PTC组织和癌周正常组织放入预冷4%多聚甲醛固定24 h、制成石蜡切片,10%山羊血清室温封闭1 h,分别滴加WIF-1、β-catenin和cyclin D1抗体4 ℃孵育过夜,次日蒸馏水漂洗3次,滴加二抗复合物室温孵育1 h,二氨基联苯胺显色,苏木精复染或不复染,脱水、透明、封片,显微镜观察并摄片,每片选取30个细胞,应用Image-Pro Plus 6.0软件进行定量分析比较。
1.5 统计学方法 应用SPSS 19.0统计软件分析数据。计量资料比较采用t检验;计数资料比较采用χ2检验;相关性采用Pearson相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 PTC与癌旁组织中WIF-1、β-catenin、cyclin D1 mRNA和蛋白表达比较 WIF-1主要表达于细胞质和细胞膜,个别PTC中可见WIF-1表达缺如(图1,2);β-catenin主要表达于细胞质中,个别PTC的细胞核内也可见表达(图3,4);cyclin D1在PTC中表达于细胞核,癌旁组织中呈阴性表达(图5,6)。PTC组织WIF-1 mRNA表达水平和蛋白表达阳性率均显著低于癌旁组织,β-catenin、cyclin D1 mRNA表达水平和蛋白表达阳性率均显著高于癌旁组织,差异有统计学意义(P<0.05)。见表2,3。
2.2 不同临床特征PTC组织中WIF-1、β-catenin、cyclin D1 mRNA和蛋白表达比较 PTC淋巴结转移组WIF-1mRNA表达水平和蛋白表达阳性率低于无淋巴结转移组,β-catenin、cyclin D1表达水平和蛋白表达阳性率高于无淋巴结转移组,差异有统计学意义(P<0.05);不同性别、年龄、肿瘤直径、病灶数目和是否包膜侵犯PTC中WIF-1、β-catenin、cyclin D1 mRNA表达水平和蛋白表达阳性率差异无统计学意义(P>0.05)。见表4,5。
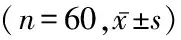
表2 PTC与癌旁组织中WIF-1、β-catenin和cyclin D1 mRNA表达比较Table 2 Comparison of WIF-1, β-catenin and cyclin D1 mRNA expression between PTC and paracancerous tissue
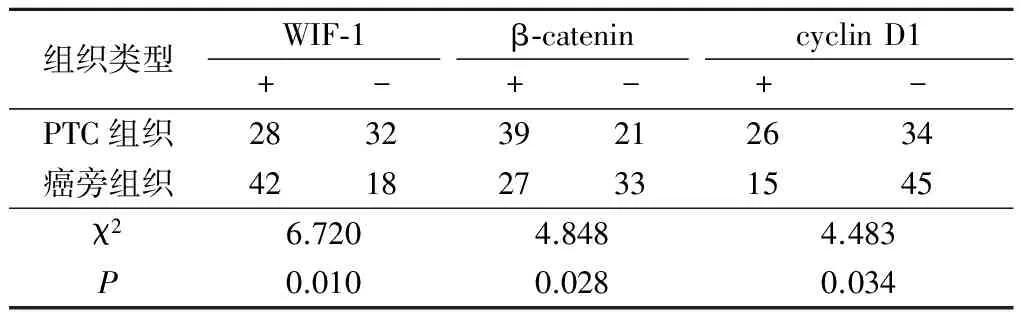
表3 PTC和癌旁组织中WIF-1、β-catenin和cyclin D1蛋白表达比较Table 3 Comparison of WIF-1, β-catenin and cyclin D1 protein expression between PTC tissue and paracancerous tissue (n=60,例数)
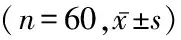
表4 不同临床特征PTC组织中WIF-1、β-catenin和cyclin D1 mRNA表达比较Table 4 Comparison of WIF-1, β-catenin and cyclin D1 mRNA expression in PTC tissue with different clinical features

表5 不同临床特征PTC组织中WIF-1、β-catenin和cyclin D1蛋白表达比较 Table 5 Comparison of WIF-1,β-catenin and cyclin D1 protein expression levels in PTC tissue with different clinical features (n=60,例数)
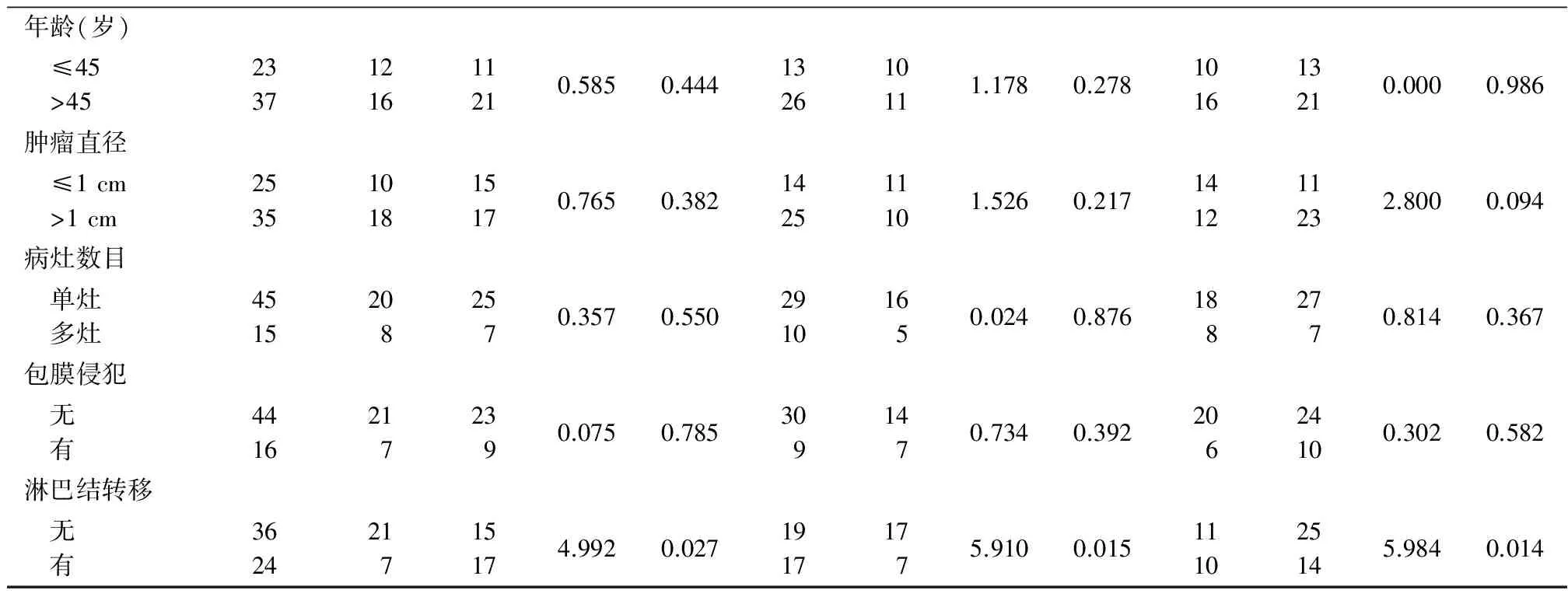
表5 (续)
2.3 WIF-1、β-catenin和cyclin D1 mRNA相关性分析 Pearson相关分析结果显示,WIF-1 mRNA与β-catenin和cyclin D1 mRNA表达呈负相关(r=-0.961、-0.970,P=0.000)。
3 讨 论
Wnt/β-catenin信号通路也叫经典Wnt信号途径,是目前研究较多且较深入的一种。其具体过程是:当经典的Wnt信号通路被激活后,分泌到细胞外的Wnt与跨膜受体LRP 5/6 以及Fzd结合形成复合物并激活受体,进而激活胞内的Dishevelled蛋白(Dsh),导致糖原合成酶3(glycogensynthase kinase-3,GSK-3)活性受到抑制使其从axin上脱落,阻止β-catenin降解复合体(主要由APC、axin、GSK-3构成)的形成,故β-catenin也不会被磷酸化和降解,使胞内β-catenin表达升高。当胞内 β-catenin 达到一定水平时,游离β-catenin 发生核转移,与转录因子TCF/LEF结合,形成转录激活复合体,最终实现某些特定基因(如C-myc、cyclin D1、MMP-7、CD44、survivin、PPAR-γ、生长因子等)表达的增强或减弱。
在Wnt/β-catenin信号通路中β-catenin处于中心位置,其在细胞内的数量和状态对该途径有决定性影响,被认为是该信号通路激活的标志。细胞周期调控因子cyclin D1是Wnt信号转导通路中非常重要的靶基因,多种肿瘤中cyclin D1过表达与β-catenin异常表达和Wnt突变有关[1-6]。Wnt/β-catenin信号通路的异常激活在多种肿瘤的发生发展和转移中发挥重要作用[7]。研究表明,乳腺癌组织中Wnt/β-catenin信号通路的激活是由β-catenin和APC-axin-GSK-3β复合体引起的,乳腺癌组织中β-catenin、cyclin D1和C-myc的表达均显著高于良性病组,且表达程度与淋巴结转移密切相关[8-9]。cyclin D1参与肿瘤细胞的转移和运动,抑制cyclin D1的表达,能显著抑制肺癌细胞A549的迁移,过表达cyclin D1则使肺癌细胞SK-MES-1的迁移能力增强;同时转移能力越强的细胞中Wnt/TCF信号越强,cyclin D1基因表达越高[2]。WIF-1基因被认为是Wnt/β-catenin信号通路的负反馈调节基因。WIF-1通过与Wnts蛋白结合阻断Wnts蛋白与细胞膜上卷曲蛋白(Frizzled Receptor,FzR)及辅助受体LRP 5/6相结合,致使细胞外信号无法传至细胞内,进而使细胞质中的β-catenin磷酸化而不能积累。在Wnt通路激活的多种类型肿瘤中均出现WIF-1基因表达下调或缺失。WIF-1启动子甲基化可导致Wnt信号通路过度激活,从而导致细胞增殖、分化及肿瘤的发生发展[10-12]。
Wnt/β-catenin信号通路在正常甲状腺细胞的增殖中发挥重要作用,正常甲状腺细胞可表达Fzd、Dvl、Wnt蛋白和β-catenin。Wnt/β-catenin信号通路的过度激活也促进甲状腺肿瘤的形成。研究发现[13],沉默β-catenin能显著提高cyclin D1水平、抑制甲状腺癌细胞的增殖、诱导细胞衰老、缩小肿瘤的体积。HRAS和BRAF致癌基因均可诱导β-catenin小幅升高,合并RAS基因突变的甲状腺细胞可诱导β-catenin在细胞核聚集,抑制GSK3β。50%的PTC和甲状腺未分化癌中存在β-catenin和Axin基因突变导致的Wnt/β-catenin信号通路的激活,表现为细胞质和细胞核中β-catenin累积增多。这些突变损害正常β-catenin降解,导致肿瘤细胞的胞质及胞核内的积累,并参与生物功能所必需的致癌的靶基因的激活。Wnt/β-catenin信号通路与甲状腺癌的分化程度也密切相关,细胞核内β-catenin表达水平越高,细胞增殖程度越高、肿瘤分化程度越低。还有研究认为,Wnt信号通路在分化型甲状腺癌的基础上发生二次突变,促使分化型甲状腺癌进展为未分化型甲状腺癌或更具侵袭性的甲状腺癌[14]。本研究结果显示,PTC组织中 β-catenin和cyclin D1 mRNA表达水平和蛋白表达阳性率均显著高于癌周组织(P<0.05);免疫组织化学检测可见β-catenin主要表达于细胞质中,个别PTC的细胞核中也有少量表达。这印证了Wnt/β-catenin信号通路激活的标志就是β-catenin的累积并向细胞核内转移;β-catenin的异位表达可能与甲状腺癌的分化程度有关,分化程度越低,细胞核内β-catenin水平越高。WIF-1基因是Wnt/β-catenin信号通路的负反馈调节基因,WIF-1在多种肿瘤中表达下调。目前有研究认为,WIF-1基因启动子区甲基化改变是基因沉默的主要原因,在很多肿瘤中发现其启动子区域CpG岛的高甲基化状态,而经去甲基化剂作用后可恢复WIF-1的表达,起到间接治疗肿瘤的作用[15]。本研究结果显示,PTC组织中WIF-1 mRNA表达水平和蛋白表达阳性率均显著低于癌周组织(P<0.05),且WIF-1 mRNA与β-catenin和cyclin D1 mRNA的表达呈负相关;在一部分PTC组中还可观察到WIF-1表达缺如。这说明PTC中WIF-1基因表达下调促进了β-catenin在细胞核中的异常积聚,进而促进靶基因cyclin D1的过度表达。WIF基因下调促进了甲状腺癌发生。
Wnt/β-catenin信号通路在甲状腺癌转移中也发挥重要作用。有研究表明,β-catenin和cyclin D1在PTC中表达显著增强,且cyclin D1在转移淋巴结组织中的表达显著高于原发灶,与PTC淋巴结转移密切相关[16]。本研究结果显示,PTC淋巴结转移组中β-catenin和cyclin D1 mRNA表达水平和蛋白表达阳性率均显著高于无淋巴结转移组(P<0.05);淋巴结转移组中WIF-1 mRNA表达水平和蛋白表达阳性率显著低于无淋巴结转移组(P<0.05),且一部分淋巴结转移组中出现WIF-1表达缺失。这说明WIF-1下调、β-catenin和cyclin D1的激活促进了PTC的淋巴结转移。
综上所述,Wnt信号通路的异常激活可引起细胞异常增殖、分化而导致肿瘤。WIF-1、β-catenin和cyclin D1有望成为PTC早期诊断、早期治疗的分子标志物。通过沉默Wnt/β-catenin信号通路中的某些关键因子或应用Wnt拮抗剂可以阻断信号通路的异常激活,从而抑制肿瘤的发生,有望成为难治性甲状腺癌的治疗新靶点。(本文图见封三)
[1] 张世蘋,张旭.Wnt信号通路在肿瘤调控方面的研究进展[J].中国药理学通报,2017,33(1):14-17,18.
[2] 李尊岭,邵淑红,焦飞,等.Cyclin D1调控肺癌细胞的浸润和转移[J].生理学报,2012,64(1):55-61.
[3] Karim S,AI-Maghrabi JA,Farsi HM,et al. Cyclin D1 as a therapeutic target of renal cell carcinoma-acombined transcriptomics,tissue microarray and molecular docking study from the Kingdom of Saudi Arabia[J]. BMC Cancer,2016,16(Suppl 2):741.
[4] Ji XK,Xie YK,Zhong JQ,et al. GSK-3β suppresses the proliferation of rat hepatic oval cells through modulating Wnt/β-catenin signaling pathway[J]. Acta Pharmacol Sin,2015,36(3):334-342.
[5] Chen J,Yin JY,Li XP,et al.Association of Wnt-inducible signaling pathway protein 1 genetic polymorphisms with lung cancer susceptibility and platinum-based chemotherapy response[J]. Clin Lung Cancer,2015,16(4):298-304,e1-2.
[6] 王建功,胡万宁,王晓红,等.Wnt5a、CyclinB2在甲状腺肿瘤组织及血清中的表达及临床意义[J].河北医科大学学报,2012,33(11):1268-1270.
[7] Wang HS,Nie X,Wu RB,et al. Downregulation of human Wnt3 in gastric cancer suppresses cell proliferation and induces apoptosis[J]. Onco Targets Ther,2016,9:3849-3860.
[8] Aristizabal-Pachon AF,Castillo WO. Role of GSK3β in breast cancer susceptibility[J]. Cancer Biomark,2017,18(2):169-175.
[9] Zeng R,Huang J,Zhong MZ,et al. Multiple roles of WNT5A in breast cancer[J]. Med Sci Monit,2016,22:5058-5067.
[10] Zheng Y,Li X,Jiang Y,et al. Promoter hypermethylation of Wnt inhibitory factor-1 in patients with lung cancer:a systematic meta-analysis[J]. Medicine(Baltimore),2016,95(49):e5433.
[11] Gao JZ,Zhao JO,Tan Y. Expression of Wif-1 and β-catenin in the Wnt pathway in childhood actue lympho-blastic leukemia[J]. Zhongguo Dang Dai Er Ke Za Zhi,2016,18(9):835-839.
[12] Mitsui Y,Yasumoto H,Nagami T,et al. Extracellular activation of Wnt signaling through epigenetic dysregulation of Wnt inhibitory factor-1(Wif-1) is associated with pathogenesis of adrenocortical tumor[J]. Oncotarget,2014,5(8):2198-2207.
[13] Sastre-Perona A,Riesco-Eizaguirre G,Zaballos MA,et al. β-catenin signaling is required for RAS-driven thyroid cancer thyrough P13K activation[J]. Oncotarget,2016,7(31):49435-49449.
[14] Sastre-Perona A,Santisteban P. Role of the wnt pathway in thyroid cancer[J]. Front Endocrinol(Lausanne),2012,3:31.
[15] Abdelmaksoud-Dammak R,Miladi-Abdennadher I,Saadallah-Kallel A,et al. Downregulation of WIF-1 and Wnt5a in patients with colorectal carcinoma:clinical significance[J]. Tumour Biol,2014,35(8):7975-7982.
[16] Zhang J,Gill AJ,Issacs JD,et al. The wnt/β-catenin pathway drives increased cyclin D1 levels in lymph node metastasis in papillary thyroid cancer[J]. Hum Pathol,2012,43(7):1044-1050.
(本文编辑:赵丽洁)
Expression and significance of Wnt/β-catenin signal transduction pathway in papillary thyroid carcinoma
YAN Li, LI Qing-huai, JI Hong, HAO Fang
(DepartmentofThyroidandBreastSurgery,theSecondHospitalofHeberMedicalUniversity,Shijiazhuang050000,China)
Objective To study expression and significance of Wnt inhibitory factor-1(WIF-1), β-catenin and chclin D1 in Wnt/β-catenin signal transduction pathway in papillary thyroid cancer(PTC). Methods Sixty cases of PTC were selected and the specimens of cancerous foci and adjacent tissues were taken. The expression of WIF-1, β-catenin and cyclin D1 mRNA and protein were detected, and the correlation between WIF-1 mRNA and β-catenin, cyclin D1 mRNA was analyzed. Results The expression levels of WIF-1 mRNA and positive rates of WIF-1 protein expression in PTC tissues were significantly lower than those in paracancerous tissues(P<0.05), while expression levels of β-catenin, cyclin D1 mRNA and protein in PTC tissues were on the contrary(P<0.05). And the expression levels of WIF-1 mRNA and protein in PTC lymph node metastasis group was lower than those without lymph node metastasis, but the expression levels of β-catenin, cyclin D1 mRNA and protein in PTC lymph node metastasis group were on the contrary(P<0.05). There were no statistically significant differences in the expression levels of WIF-1, β-catenin, cyclin D1 mRNA and positive rates of protein in PTC tissues in different sex, age, tumor diameter, number of lesions and whether or not the capsule was invaded(P>0.05). Expression levels of β-catenin, cyclin D1 mRNA were negatively correlated with those of WIF-1 mRNA(P<0.05). Conclusion The down regulation mechanism of WIF-1 gene in PTC tissues promoted the accumulation of β-catenin protein in the cytoplasm, which resulted in over activation of target gene cyclin D1. The WIF-1 down regulation or β-catenin and cyclin D1 up regulation mechanism may play an auxo-action role in the occurrence and metastasis in PTC.
thyroid neoplasms; Wnt signaling pathway; beta catenin
2017-04-07;
2017-05-08
河北省医学科学研究重点课题(20160122)
严丽(1977-),女,河北石家庄人,河北医科大学第二医院副主任医师,医学博士,从事甲状腺疾病诊治研究。
R736.1
A
1007-3205(2017)06-0663-06
10.3969/j.issn.1007-3205.2017.06.011
