云南松松塔提取物对小鼠急性酒精性肝损伤的影响
2017-08-07吴道勋张娜邵维莉杨贤英陈进汝刘熙
吴道勋,张娜,邵维莉,杨贤英,陈进汝,刘熙,2
1.大理大学药学与化学学院,云南 大理 671000;2.云南省昆虫生物医药研发重点实验室,云南 大理 671000
云南松松塔提取物对小鼠急性酒精性肝损伤的影响
吴道勋1,张娜1,邵维莉1,杨贤英1,陈进汝1,刘熙1,2
1.大理大学药学与化学学院,云南 大理 671000;2.云南省昆虫生物医药研发重点实验室,云南 大理 671000
目的 观察云南松松塔提取物对小鼠急性酒精性肝损伤的影响,探讨其作用机制。方法 采用酒精灌胃制备急性酒精性肝损伤小鼠模型。实验小鼠随机分为正常组、模型组、阳性对照组和云南松松塔低、中、高剂量组,各给药组给予相应药物灌胃,每日 1 次,连续 7 d。末次灌胃 3 h 后,计算肝、脾指数,检测丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、丙二醛(MDA)、一氧化氮(NO)含量,超氧化物歧化酶(SOD)、微量还原型谷胱甘肽(GSH)活性,HE 染色观察肝脏病理形态。结果 与模型组比较,云南松松塔各剂量组小鼠肝指数显著降低(P<0.01),云南松松塔高剂量组脾指数显著降低(P<0.01),云南松松塔中、高剂量组血清 AST 含量显著降低(P<0.01),云南松松塔各剂量组肝组织 GSH 活性显著升高(P<0.05,P<0.01);云南松松塔低、高剂量组肝组织 MDA 含量显著降低(P<0.05);云南松松塔各剂量组血清 ALT 含量降低,肝组织 SOD 活性升高和 NO 含量降低,差异均无统计学意义(P>0.05);HE 染色结果显示,云南松松塔各剂量组小鼠肝组织损伤较模型组明显改善。结论 云南松松塔提取物对小鼠急性酒精性肝损伤具有保护作用。
云南松松塔提取物;急性酒精性肝损伤;氧化因子;小鼠
酒精性肝病(alcoholic liver disease,ALD)是酗酒导致的肝脏损害性疾病,在病理组织学上按照肝细胞发生脂肪病变的程度分为酒精性脂肪肝、酒精性肝炎、酒精性肝纤维化及酒精性肝硬化。ALD是一种进行性发展且后期严重危害身体健康和威胁生命安全的疾病,其致病因素单一、明确,即长期大量的饮酒所致,但发病机制十分复杂,至今尚未完全明了,目前治疗手段主要是戒酒、营养支持和药物治疗。松塔(Pinecone)系松科(Pinaceae)松属(Pinus)植物的球果,别名松实、松元、松果、松球。松科松属植物约 80 种,多分布于北半球,我国有 22 种,10 个变种。云南松是松科常绿针叶乔木,主要分布于我国西南地区,在云南全省几乎都有分布,资源十分丰富。松香、松实、松针历代都有入药使用。本实验采用酒精灌胃制备急性酒精性肝损伤小鼠模型,观察云南松松塔提取物对急性酒精性肝损伤的影响,探讨其作用机制。
1 实验材料
1.1 动物
雄性昆明种小鼠 60 只,6~8 周龄,清洁级,体质量(18±5)g,昆明医科大学实验动物中心,动物许可格证号 SCXK(滇)2011-0006。饲养于温度 22~25 ℃、湿度 50%~80%环境,自由摄食饮水。
1.2 药物
云南松松塔提取物,大理大学刘光明教授提供,批号 20160621;联苯双酯滴丸,万邦德制药股份有限公司,批号 A020150302。
1.3 主要试剂与仪器
丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、丙二醛(MDA)、总超氧化物歧化酶(T-SOD)试剂盒、微量还原型谷胱甘肽(GSH)、一氧化氮(NO)试剂盒,南京建成生物工程研究所;56度红星二锅头白酒,北京红星酿酒总厂;化学试剂均为国产分析纯。快速混匀器(江苏新康医疗器械有限公司,型号 XK96-A),高速低温离心机(丹麦LABOGENE 公司,型号 1580MGR 型),梅特勒电子天平(瑞士,型号 AE240)。
2 实验方法
2.1 分组和给药
适应性饲养 3 d 后,60 只小鼠按体质量随机分为正常组、模型组、阳性对照组(联苯双酯 75 mg/kg)和云南松松塔低、中、高剂量组(100、200、400 mg/kg),每组 10只。各组小鼠均灌胃给药,正常组和模型组给予等量生理盐水。给药体积为 0.02 m L/g,每日 1次,连续 7 d。
2.2 造模
参照文献[1]方法和本批昆明种小鼠预实验结果造模。小鼠每日下午灌胃给药 3 h 后,除正常组外,其他各组小鼠给予 56 度红星二锅头白酒(5 m L/kg)灌胃制备酒精性肝损伤模型,正常组给予等量生理盐水灌胃。第 7 日给药、给酒后禁食不禁水,3 h 后称重,采集血液、肝脏、脾脏进行相关检测。
2.3 指标测定
2.3.1 小鼠肝、脾指数检测 小鼠采血后脱颈处死,取小鼠肝脏和脾脏,置于冷的 0.9%氯化钠注射液中润洗,滤纸吸干,肉眼观察外观,称重,计算肝、脾指数。肝指数(%)=肝质量(mg)÷体质量(g)×100%,脾指数(%)=脾质量(mg)÷体质量(g)×100%。
2.3.2 生化指标检测 小鼠采用摘除眼球法采血,3500 r/m in 离心 10 m in,分离血清,按试剂盒说明书测定血清 ALT、AST 含量和 GSH 活性。剪下小鼠肝左叶相同部位肝组织,4 ℃生理盐水制备成 10%肝匀浆,3000 r/m in 离心 10 min,取上清液,按照试剂盒说明书测定肝组织 SOD 活性和 MDA、NO含量。
2.3.3 肝脏组织病理观察 取小鼠肝脏次大肝叶,置于 10%甲醛溶液中保存,组织切片,HE 染色,光镜下观察各组小鼠肝脏组织病理学变化并拍照。
3 统计学方法
采用 SPSS17.0 统计软件进行分析。计量资料以—x±s 表示,组间比较用方差分析。P<0.05 表示差异有统计学意义。
4 结果
4.1 云南松松塔提取物对模型小鼠肝、脾指数的影响
与正常组比较,模型组小鼠肝、脾指数均显著升高(P<0.01);与模型组比较,阳性对照组和云南松松塔高剂量组脾指数均显著降低(P<0.01),阳性对照组和云南松松塔组低、中、高剂量组肝指数显著降低(P<0.01)。结果见表 1。
表 1 各组小鼠肝、脾指数比较(±s,%)
注:与正常组比较,**P<0.01;与模型组比较,△△P<0.01
组别 只数剂量/(mg/kg)肝指数 脾指数正常组 10 4.63±0.56 0.37±0.03模型组 10 5.36±0.47** 0.44±0.03**阳性对照组 10 75 4.40±0.57△△ 0.38±0.05△△云南松松塔低剂量组 10 100 4.64±0.35△△ 0.32±0.04云南松松塔中剂量组 10 200 4.29±0.17△△ 0.40±0.09云南松松塔高剂量组 10 400 4.13±0.47△△ 0.28±0.04△△
4.2 云南松松塔提取物对模型小鼠血清丙氨酸氨基转移酶、天冬氨酸氨基转移酶和谷胱甘肽水平的影响
与正常组比较,模型组小鼠血清 ALT、AST 含量显著升高(P<0.01),GSH 活性显著降低(P<0.01);与模型组比较,云南松松塔中、高剂量组和阳性对照组血清 AST 含量显著降低(P<0.01),各给药组血清GSH 活性显著升高(P<0.05,P<0.01)。结果见表 2。
4.3 云南松松塔提取物对模型小鼠肝匀浆超氧化物歧化酶、丙二醛和一氧化氮水平的影响
与正常组比较,模型组小鼠肝匀浆 SOD 活性显著降低,MDA、NO 含量显著升高(P<0.01);与模型组比较,阳性对照组肝匀浆 SOD 活性显著升高,MDA、NO 含量显著降低(P<0.05),云南松松塔低、高剂量组肝匀浆 MDA 含量显著降低(P<0.05)。结果见表3。
表 2 各组小鼠血清 ALT、AST、GSH 水平比较(±s)

表 2 各组小鼠血清 ALT、AST、GSH 水平比较(±s)
注:与正常组比较,**P<0.01;与模型组比较,△P<0.05,△△P<0.01
组别 只数 剂量/(mg/kg) ALT/(U/L) AST/(U/L) GSH/(μmol/L)正常组 10 14.78±3.02 16.05±2.93 2.12±0.49模型组 10 23.15±7.68** 30.59±5.03** 1.56±0.40**阳性对照组 10 75 16.86±7.65 24.41±2.91△△ 2.26±0.70△云南松松塔低剂量组 10 100 18.62±3.90 29.30±0.68 2.28±0.48△云南松松塔中剂量组 10 200 19.19±3.34 21.59±3.87△△ 2.55±0.44△△云南松松塔高剂量组 10 400 16.89±1.64 15.20±0.95△△ 2.60±0.53△△
表 3 各组小鼠肝组织 SOD、MDA、NO 水平比较(±s)
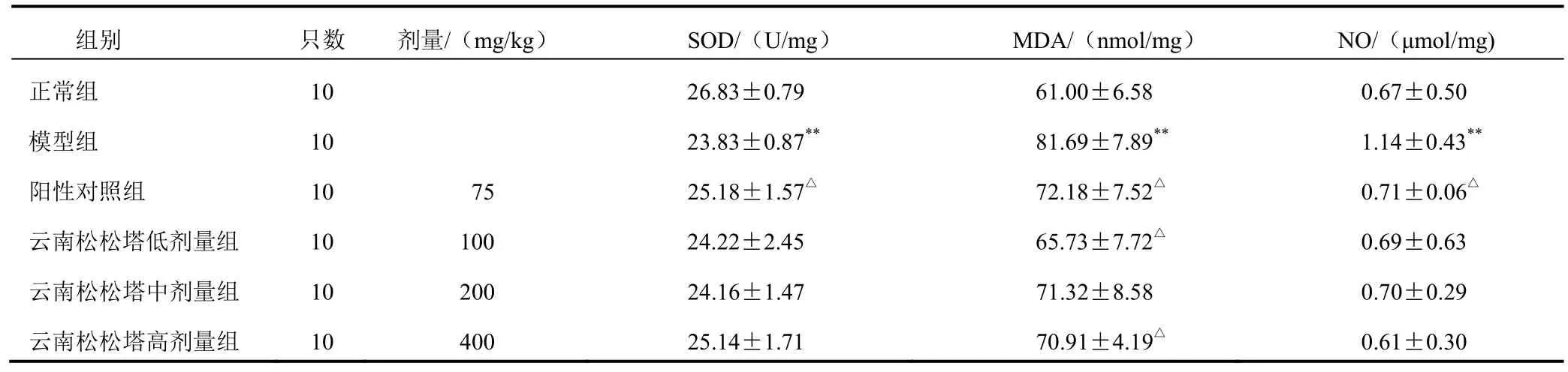
表 3 各组小鼠肝组织 SOD、MDA、NO 水平比较(±s)
注:与正常组比较,**P<0.01;与模型组比较,△P<0.05
组别 只数 剂量/(mg/kg) SOD/(U/mg) MDA/(nmol/mg) NO/(μmol/mg)正常组 10 26.83±0.79 61.00±6.58 0.67±0.50模型组 10 23.83±0.87** 81.69±7.89** 1.14±0.43**阳性对照组 10 75 25.18±1.57△ 72.18±7.52△ 0.71±0.06△云南松松塔低剂量组 10 100 24.22±2.45 65.73±7.72△ 0.69±0.63云南松松塔中剂量组 10 200 24.16±1.47 71.32±8.58 0.70±0.29云南松松塔高剂量组 10 400 25.14±1.71 70.91±4.19△ 0.61±0.30
4.4 云南松松塔提取物对模型小鼠肝组织病理形态的影响
正常组小鼠肝组织结构正常,肝细胞无明显病变;模型组小鼠肝组织较正常组变化显著,肝细胞明显肿胀,呈气球样变及脂肪变性,胞质疏松,其内可见大小不一、数量不等脂滴,部分细胞核溶解、坏死,坏死灶内有大量炎性细胞浸润;各给药组肝细胞肿胀、炎性细胞浸润和脂肪变性较模型组减轻。见图 1。

图 1 各组小鼠肝组织病理形态(HE 染色,×100)
5 讨论
胃灌注酒精和腹腔注射酒精是目前国内外对酒精性肝损伤主要的2种造模方法。由于腹腔注射死亡率较高,而胃灌注酒精造模周期短、易复制、稳定性好、死亡率低,与人饮酒所致的肝损伤特点相符,对研究酒精性肝损伤的发病机制和筛选药物起着关键作用。酒精性肝损伤模型与现代人过度饮酒造成的肝损害相似,而且以肝脏及血中某些化学指标改变为主要特征,是研究急性酒精性肝损伤发病机制和后续保肝药物及保护机制研究的理想模型[2]。因此,本实验采用白酒灌胃制备急性酒精性肝损伤模型。
酒精代谢产物对肝脏的毒理作用、氧化应激、炎症损失、细胞凋亡、病毒的叠加作用等可能是酒精性肝损伤的发病机制[3]。小鼠酒精灌胃会导致消化道损伤,且酒精 95%以上是由肝脏代谢造成肝细胞损伤[4]。因此,小鼠在造模后第3日开始出现明显的饮食量减少、体质量减轻、毛发渐渐失去光泽、精神萎靡不振等表现。本实验结果显示,各给药组上述状况较模型组稍好。
有研究表明,急性酒精中毒会损伤肝细胞中细胞器及酶的结构功能,影响脂肪酸在线粒体内 β-氧化,引起脂质过氧化反应,导致肝细胞膜损伤[5]。AST 和ALT 是存在于肝脏中重要的转氨酶,肝细胞损伤或坏死,均会使血液中这2种转氨酶的活性升高,因此临床上将 AST 和 ALT 作为肝脏是否受到损害的指标。ALT 主要存在于肝细胞浆内,当肝细胞损伤时可进入血中,引起血 ALT 升高。AST 也存在于肝细胞浆内,并分布于线粒体内,当肝细胞损害严重时,线粒体内AST 释放入血,使血清 AST 升高大于 ALT[6]。本实验结果显示,模型组较正常组肝、脾指数增大,血清ALT 和 AST 水平显著升高,表明肝细胞受损严重。相比之下,云南松松塔各剂量组对 ALD 小鼠的肝、脾肿胀有一定抑制作用,能改善肝脏病变,使血清ALT、AST 向正常水平恢复。
机体内的自由基清除防御体系主要由抗氧化酶体系和非酶体系组成。SOD 是生物体抗氧化酶防御体系的主要组成部分,它能有效清除活性氧自由基,终止自由基链式反应,在抗氧方面起到了重要作用。其酶活性的降低将导致氧自由基蓄积,从而诱导细胞损伤。GSH是机体内最重要的非酶性抗氧化物,是衡量机体抗氧化能力大小的重要因素。MDA 是氧自由基与生物膜不饱和脂肪酸发生脂质过氧化反应的产物,间接反映出细胞损伤的程度。NO在生物体内作为一种反应极强的自由基,兼有第二信使和神经递质作用,同时又是一种效应分子,在体内具有广泛的生理作用,如松弛血管平滑肌、抑制血小板聚集、调节脑流量、介导细胞毒效应和免疫调节等,NO产生异常与某些疾病的发展有着密切关系。本研究结果显示,与模型组比较,预先给予云南松松塔提取物能显著提高 SOD、GSH 活性,明显降低 MDA 含量,NO 含量也有所下降。
本实验病理结果显示,模型组小鼠肝组织结构紊乱,出现肝细胞片状坏死等现象;云南松松塔提取物组肝损伤较模型对照组减轻,肝细胞及肝细胞结构排列趋于正常,与阳性对照组相当,基本接近正常水平。病理切片显示和各指标测定结果相符,提示预先给予云南松松塔提取物可提高肝细胞对酒精的抵御能力,减轻肝损伤,增强肝细胞更新再生的能力。
综上所述,云南松松塔提取物对小鼠急性酒精性肝损伤有保护作用,其机制可能与云南松松塔增强机体抗氧化和清除自由基的能力有关。
[1] 于世博,孔祥耀,陈明翠,等.瘤果黑种草子对小鼠急性酒精性肝损伤的影响[J].贵州医科大学学报,2016,41(11):1288-1291.
[2] 林晓晖,黄玲,王一铮,等.小鼠急性酒精性肝损伤模型的制备及观察[J].北方药学,2014,11(6):67-68.
[3] 李守超.竹节参总皂苷对小鼠急性酒精性肝损伤的保护作用及机理研究[D].宜昌:三峡大学,2012.
[4] 王宪龄,刘仁慧,张影,等.柴胡黄芩配伍抗小鼠急性酒精性肝损伤的实验研究[J].中药材,2004,27(10):756-758.
[5] 赵云霞,陶明煊,陆文娟,等.鸡枞菌多糖对小鼠急性酒精性肝损伤的保护作用[J].食品科学,2014,35(19):260-264.
[6] 杨牧祥,田元祥,姚树坤,等.解酒护肝饮对酒精性肝损伤大鼠血清和肝组织 ALT、AST 的影响[J].河北中医,2000,22(10):793-796.
Effects of Pinus Yunnanensis on Acute Alcoholic Liver Injury in M ice
SHAO Wei-li1, YANG Xian-ying1, CHEN Jin-ru1, LIU Xi1,2(1. College of Pharmacy and Chemistry, Dali University, Dali 671000, China; 2. Yunnan Provincial Key Laboratory of Entomological Biopharmaceutical R&D, Dali 671000, China) WU Dao-xun1, ZHANG Na1,
Objective To study the effect of Pinus yunnanensis on acute alcoholic liver injury in rats and explore its mechanism. Methods A model of acute alcoholic liver injury in m ice was prepared by alcohol. The m ice were random ly divided into normal control group, model group, positive control group, Pinus yunnanensis low-, mediumand high-dose groups. M ice in the medicine group were given the corresponding medicine by gavage once a day for 7 days. After the last three hours of intragastric administration, the liver and spleen index, ALT, AST and GSH in serum, SOD, MDA and NO in liver homogenates were measured. Histopathological changes of liver were observed by HE staining. Results Compared With model group, Pinecone of Pinus unnanensis high-, medium- and low-dose groups could significantly reduce the liver index in m ice (P<0.01), and high dose groups could significantly reduce the number of spleen (P<0.01); The contents of AST in the medium- and high-dose groups significantly decreased (P<0.01) and the GSH activity significantly increased (P<0.05, P<0.01). There was no significant difference in serum ALT level, SOD activity, GSH activity and NO content in the liver tissues of Pinus yunnanensis groups (P>0.05). HE staining results showed that, the damage of liver tissue in m ice of Pinus yunnanensis was significantly improved compared With the model group. Conclusion Pinus yunnanensis has protective effects on acute alcoholic liver injury in mice.
Pinus yunnanensis; acute alcoholic liver injury; oxidation factors; mice
10.3969/j.issn.1005-5304.2017.08.011
R285.5
A
1005-5304(2017)08-0046-04
2016-12-21)
(
2017-01-22;编辑:华强)
国家自然科学基金(81260632)
刘熙,E-mai l:626585322@qq.com
