黄姜皂素提取工艺的研究进展
2017-08-07赵国强王常高林建国杜馨蔡俊
赵国强,王常高,林建国,杜馨,蔡俊
(湖北工业大学发酵工程教育部重点实验室 工业发酵湖北省协同创新中心,武汉 430068)
黄姜皂素提取工艺的研究进展
赵国强,王常高,林建国,杜馨,蔡俊*
(湖北工业大学发酵工程教育部重点实验室 工业发酵湖北省协同创新中心,武汉 430068)
黄姜是我国特有的植物,是生产薯蓣皂素的主要原料。文章就黄姜皂素的不同提取方法做了简单回顾,并对各种方法的工艺、优缺点等进行了概括。重点阐述了以生物转化技术为基础的黄姜皂素提取工艺,为后期黄姜皂素的清洁生产提供了理论依据。
黄姜;黄姜皂素;生物转化技术;提取工艺;优缺点
黄姜,学名盾叶薯蓣(DioscoreazingiberensisC. H.Wright)亦称火头根、枕头根等,多年生缠绕草本植物,为我国特有的野生植物资源[1]。其主要活性物质为薯蓣皂苷,是生产甾体激素类药物的原料, 常用于治疗风湿关节炎、心脑血管疾病等。据资料显示[2],黄姜根茎中除了含有薯蓣皂苷外,还含有30%~40%的淀粉和 40%~50%的纤维素以及其他的植物活性成分, 是世界上薯蓣皂苷元含量最高的物种。在我国,黄姜分布在陕西、湖北、河南、贵州等地,其中黄姜种植面积的70%分布在湖北、陕西两省。
黄姜皂素是薯蓣属植物中黄姜皂苷的配基及水解产物,以黄姜皂苷形式存在于根茎细胞中,主要包括原薯蓣皂苷、薯蓣皂苷、原纤细皂苷、纤细皂苷、延令草次苷等[3]。黄姜皂素具有一定的药用价值,是生产皮质激素、性激素等300多种甾体激素和避孕药物的重要原料,被誉为“激素之母”[4]。有报道称,世界上薯蓣皂素含量较高的植物主要分布在我国和墨西哥[5],而我国又是主要的生产国[6],因此,笔者针对不同的提取方法进行研究,并着重阐述了无污染、条件温和的生物转化法。皂素的结构见图1。
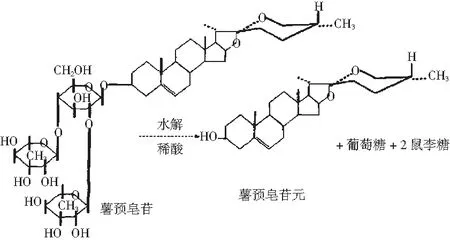
图1 皂素结构
1 黄姜皂素的提取工艺
黄姜皂素为异螺旋甾烷的衍生物。在自然状态下,黄姜皂素主要是以黄姜皂苷的形式存在于植物体内。而皂苷在植物中多以糖苷的形态出现,游离型的苷元甚少,苷键断裂,产生葡萄糖、鼠李糖和皂苷元[7]。皂苷的C3位通过皂苷键与糖链相连,进而与植物的细胞壁紧密连接。植物中大量的淀粉、纤维素和果胶等物质将皂苷包裹和屏蔽,使其结构紧密,机械强度大,难以破坏[8]。提取黄姜皂素,应首先使皂苷游离出来,再在一定的反应条件下断开皂素与糖基之间的苷键,最终使黄姜皂素游离出来。
在黄姜皂素生产过程中,提取皂素的方法主要有分解分离法、直接酸水解法、自然发酵法、酶解法、直接回流萃取法、微波提取萃取法、超声波提取萃取法、超临界CO2萃取法、热分解提取萃取法等,见表1。

表1 黄姜皂素提取工艺Table 1 The extraction process of diosgenin
分离法提取黄姜中的总皂苷实现了黄姜中皂素、淀粉和纤维素的有效分离。但由于3种物质之间结构结合紧密,简单方法难以分离,使得皂素纯度过低;直接酸水解法最早是由Rothrock等[23]提出的,用强酸直接水解黄姜。此方法所产生的废水严重污染环境,阻碍了社会的可持续发展;自然发酵法是利用自身及环境中的微生物于一定的自然环境进行发酵,既提高了皂素收率也缩短了提取时间;酶解法是在自然发酵的基础上进行改进,有针对性地加入一些酶,以此达到提高产率的目的;直接回流萃取法主要是通过易挥发的有机溶剂对原料进行循环浸提。由于该方法加热时间比较持久,不适应于受热易分解的皂苷。微波提取萃取法的本质是利用微波进行加热。微波实际上是一种能量,其在传输过程中会产生大量热能,最终导致细胞破裂,相比于直接酸水解具有提取率高、提取时间短等优点[24];超临界CO2萃取法是近年来发展的一项化工分离技术,由于CO2不具有毒性,因此此法获得的产物更安全可靠;热分解提取萃取法由陈俊英首次提出,且申请了国家专利[25]。在皂素生产过程中不使用强酸、强碱等化学试剂,也没有废水产生,从根本上解决了皂素生产中的污水处理问题,但存在着有机溶剂用量大、残渣多等缺点,有待进一步改善。笔者参考了近几年来国内外有关文献资料对黄姜皂素的提取工艺进行了概述,提出了未来的研究方向,为黄姜皂素的清洁生产提供了理论依据。
综上所述,黄姜皂素的所有提取工艺都是在酸水解的基础上进行的改进,故这些工艺都存在其本身所具有的缺陷,那就是酸水解带来的环境污染问题。近年来,随着基因工程、蛋白质工程等生物技术的不断发展,大大地推动了生物催化与生物转化的基础研究和应用研究,现在有大量的学者研究以生物转化法为基础的提取工艺,以达到高效提取皂素、避免污染的目的。
2 生物转化法
生物转化法是利用微生物直接将黄姜中的皂苷转化成皂素,条件温和,工艺简单,无污染,有利于环境的可持续发展,包括微生物转化法和酶转化法。
2.1 微生物转化法
微生物转化法是利用微生物本身所产生的酶对外源化合物进行酶催化反应的技术,常应用于甾体药物的生物转化中。微生物转化黄姜为薯蓣皂素是个复杂的过程,一般有两种方式即间接转化法和直接转化法。间接转化法即将发酵产生的粗酶液提取出来,再与黄姜进行酶解反应;而直接转化法则省去提取粗酶步骤,直接在体系中发生转化。二者相互比较,直接转化法更加便利,并且反应周期短,但间接转化法的产率较直接转化法有所提高。总的来说,微生物转化法相对于酸水解而言,具有选择性强、反应条件易于控制等优点。
朱余玲等[26]从生长黄姜的土壤和常见的一些霉菌中筛选出了3株可以有效水解皂苷的霉菌,它们分别是产纤维素酶活力较高的T.reesei,产β-糖苷酶活力较高的A.niger和产木聚糖酶活力较高的A.oryzae。对纯种发酵、复合同步发酵、复合顺序发酵进行了比较,确定了最佳的工艺,即A.niger与T.reesei共培养时,当T.reesei发酵第3天时投加A.niger继续发酵6天后皂素得率可达到78.25%。Lei等[27]利用烟曲真菌产生的β-糖苷酶将皂苷转化成皂素,β-糖苷酶能将C3位的糖苷键断裂。Ma等[28]将黑曲霉菌直接接种于原料黄姜培养发酵,经分离后成功提取黄姜皂素。董悦生等[29]利用米曲霉直接转化盾叶薯蓣制备薯蓣皂苷元,并对培养条件进行了优化,产率达到17.06 mg/g。因此,利用生物转化法能大幅度提高黄姜皂素产率,而且成本低、无污染。
2.2 酶转化法
酶转化法是利用商品化酶,实现将黄姜转化为薯蓣皂素的方法。与微生物转化法相比,酶解法省去了培养微生物所需的相关设备,解除了染菌和生产菌变异的后顾之忧。截止目前,能将薯蓣皂苷完全转化为薯蓣皂素的单一酶还未发现。但在薯蓣皂苷转化为薯蓣皂素的过程中,断裂不同糖苷键的酶却层出不穷,为薯蓣皂苷转化薯蓣皂素提供了理论依据,为实现更加环保方便的工艺做了重要铺垫。
徐升运等[30]采用生物酶法对薯蓣皂素进行提取研究,使黄姜淀粉和纤维素充分分解,促进葡萄糖和皂素的分离。通过正交试验确定了复合酶提取皂素的最佳工艺,即最适酶解条件为温度55 ℃,pH值4.0,时间6 h,在该条件下,黄姜皂素得率提高26%。钟桂芳等[31]先后用淀粉酶、糖化酶以及普鲁士酶对黄姜进行预处理,再用复合酶对黄姜皂苷进行水解,研究了酶解时间、温度、pH和搅拌转速对皂素提取率的影响,并通过正交试验确定了复合酶法提取工艺的最优工艺,使薯蓣皂素的得率达到4.88%。Zhu等[32-34]利用淀粉酶、糖化酶先从黄姜根茎中分离出淀粉,然后再用里氏木霉将皂渣中的皂苷转化成薯蓣皂素,最终淀粉回收率达98.0%,废水中的COD下降了99.4%,用酸量减少了100%,既充分利用了黄姜中的其他资源,也提高了皂素产率。
综合以上工艺可知,生物转化法能够有效地解决酸水解过程中提取率低、废水多、污染严重的问题,为黄姜的清洁生产开辟了新的思路和途径。由于发酵反应过程复杂不易控制,商品酶成本高,酶的温和型和专一性引起的产率不足等因素,目前在薯蓣皂素的制备过程中并没有实现全生物法的产业化生产,但是随着薯蓣皂素制备方法的不断深入以及科学技术的发展,为最终实现生物转化法制备薯蓣皂素奠定了基础。
3 展望
我国是黄姜生产大国,研究和开发黄姜皂素,对人类的健康和社会经济效益具有积极的作用。对于如何能够高效提取黄姜皂素,国内外的研究人员做了大量的研究,提出了不同的提取工艺,但均是在酸水解的基础上进行的改进,无法从根本上解决环境污染问题。近年来,随着基因组学、蛋白质组学等生物技术的快速发展,以生物转化技术为前提的提取工艺应运而生,在不久的将来这种条件温和、成本低、操作简单、无污染的生物法提取工艺将是黄姜皂素生产研究的发展方向。
[1]陈俊英.薯蓣皂素提取新工艺及相关基础研究[D].郑州:郑州大学,2007.
[2]Zhang Y,Tang L,An X,et al.Modification of cellulase and its application to extraction of diosgenin fromDioscoreazingiberensisC.H.Wright[J].Biochemical Engineering Journal,2009,47(1):80-86.
[3]Lin J T,Yang D J.Determination of steroidal saponins in different organs of yam (DioscoreapseudojaponicaYamamoto)[J].Food Chemistry,2008,108(3):1068-1074.
[4]李江浩,葛台明,洪岩,等.黄姜皂素生产工艺中的发酵机理与条件优化[J].天然产物研究与开发,2015(3):521-528.
[5]张燕,梅明,董梅.黄姜产业概况及污染防治对策[J].黄石高等专科学校学报,2004(4):58-61.
[6]黄诗铿,张希.中国黄姜生产的现状及对策[J].世界农业,2003(9):49-50.
[7]王悦,晁芳芳.黄姜皂素的清洁生产工艺研究及资源综合利用[J].咸阳师范学院学报,2012,27(2):35-37.
[8]魏蜜.微生物法清洁生产黄姜皂素新技术及工程化研究[D].武汉:华中科技大学,2014.
[9]Wang Y,Liu H,Bao J,et al.The saccharification-membrane retrieval-hydrolysis (SMRH) process: a novel approach for cleaner production of diosgenin derived fromDioscoreazingiberensis[J].Journal of Cleaner Production,2008,16(10):1133-1137.
[10]李江浩,葛台明.黄姜皂素提取工艺研究进展[J].山东农业大学学报:自然科学版,2014(3):476-480.
[11]陈俊英,韩志慧,刘国际,等.黄姜中薯蓣皂素的制取方法[J].农产品加工·学刊,2005(1):22-24.
[12]潘鹤林,陈晨.黄姜资源清洁高效利用研究进展[J].上海化工,2009(6):22-29.
[13]滕文锐,陈俊英.盾叶薯蓣皂素提取及其资源综合利用研究进展[J].科技广场,2014(12):251-256.
[14]Peng Y,Wang Y,Yang Z,et al.Content increase of spirostanol saponins during enzymatic hydrolysis of Dioscoreazingiberensis C.H.Wright[J].Industrial & Engineering Chemistry Research,2010,49(17):8279-8281.
[15]杨转萍.黄姜中薯蓣皂苷的提取纯化及酶解工艺研究[D].咸阳:陕西科技大学,2011.
[16]王新军,韩菊,魏福祥.薯蓣皂甙元提取方法的研究进展[J].河北工业科技,2006,23(5):317-320.
[17]胡娅梅.黄姜中总皂苷的提取方法研究[D].湘潭:湖南科技大学,2012.
[18]Li X,Ma J,Xia J,et al.A study on the ultrasonic-assisted ethanol extraction of dioscin[J].Journal of Medicinal Plants Research,2011,5(14):2945-2951.
[19]Li X,Ma J,Xia J,et al.Study on the extraction of dioscin by the ultrasonic-assisted ethanol[J].African Journal of Biotechnology,2014,13(8):73-97.
[20]Li X,Ma J,Xia J.Study on extraction of dioscin fromD.zingiberensis[J].Advanced Materials Research,2011(193):863-866.
[21]杨光义,魏晋宝,叶方,等.薯蓣皂素洁净生产技术研究进展[J].中国药师,2015(3):467-470.
[22]陈俊英,韩志慧,刘国际,等.无污染提取薯蓣皂素的热分解处理研究[J].中国农业科学,2010,43(18):3824-3830.
[23]Rothrock J W,Stoudt T H,Garber J D.Isolation of diosgenin by microbiological hydrolysis of saponin[J].Archives of Biochemistry & Biophysics,1955,57(1):151-155.
[24]Shu Y Y,Ming Y K,Chang Y S.Microwave-assisted extraction of ginsenosides from ginseng root[J].Microchemical Journal,2003,74(2):131-139.
[25]陈俊英,刘国际.热分解黄姜提取薯蓣皂素的工艺[J].湖北农业科学,2007,46(1):130-132.
[26]朱余玲,黄文,刘葳,等.复合微生物发酵法从黄姜中提取皂素研究[J].南水北调与水利科技,2009(6):442-446.
[27]Jing L,Hai N,Li T,et al.A novel β-glucosidase fromAspergillusfumigatesreleases diosgenin from spirostanosides ofDioscoreazingiberensisC.H.Wright (DZW)[J].World Journal of Microbiology & Biotechnology,2012,28(3):13.
[28]Ma B,Feng B,Huang H,et al.Biotransformation of Chinese herbs and their ingredients[J].World Science & Technology,2010,12(2):150-154.
[29]董悦生,齐珊珊,刘琳,等.米曲霉直接转化盾叶薯蓣生产薯蓣皂苷元[J].过程工程学报,2009,9(5):993-998.
[30]徐升运,赵文娟,陈卫锋.应用生物酶法提取黄姜皂素的清洁工艺研究[J].环境科学与技术,2012,34(2):162-164.
[31]钟桂芳,刘径羽,番攀,等.复合酶法提取薯蓣皂素的研究[J].中国酿造,2014,32(5):62-66.
[32]Zhu Y L,Huang W,Ni J R.A promising clean process for production of diosgenin fromDioscoreazingiberensisC.H.Wright[J].Journal of Cleaner Production,2010,18(3):242-247.
[33]Zhu Y L,Ni J R,Huang W.Process optimization for the production of diosgenin withTrichodermareesei[J].Bioprocess & Biosystems Engineering,2010,33(5):647-655.
[34]Zhu Y L,Huang W,Ni J R,et al.Production of diosgenin fromDioscoreazingiberensis,tubers through enzymatic saccharification and microbial transformation[J].Applied Microbiology & Biotechnology,2010,85(5):9-16.
Research Progress on Extraction Process of Diosgenin
ZHAO Guo-qiang, WANG Chang-gao, LIN Jian-guo, DU Xin, CAI Jun*
(Key Laboratory of Fermentation Engineering,Ministry of Education, Hubei Collaborative Innovation Center for Industrial Fermentation, Hubei University of Technology, Wuhan 430068, China)
Dioscoreazingiberensisis a characteristic plant of our country,and it is the main raw material for producing diosgenin.Introduce various extraction methods and generalize the process,advantages and disadvantages.The process based on bioconversion technology is elaborated emphasically.The study could provide theoretical basis for the cleaner production of diosgenin in future.
Dioscoreazingiberensis;diosgenin;bioconversion technology;extraction process;advantages and disadvantages
2017-01-06 *通讯作者
国家自然科学基金(31401807)
赵国强(1992-),男,硕士,研究方向:发酵工程;
蔡俊(1968-),男,教授,博士生导师,博士,研究方向:发酵工程。
TS201.1
A
10.3969/j.issn.1000-9973.2017.07.036
1000-9973(2017)07-0165-04
